修回日期: 2002-08-01
接受日期: 2002-08-16
在线出版日期: 2003-03-15
目的: 探讨莪术油微球(CAO-MS)释放出莪术油(CAO)对人肝癌SMMC-7721细胞的生长抑制作用及机制.
方法: 用MTT法测定CAO及CAO-MS对体外培养的人肝癌细胞系SMMC-7721的生长抑制作用. 用FCM测定CAO及CAO-MS对人肝癌细胞周期的影响. 用DNA含量测定、AnnexinⅤ标记、电镜观察细胞形态检测CAO及CAO-MS对人肝癌细胞的诱导凋亡作用. 用免疫细胞化学(ICC)及RT-PCR方法分别检测p21WAF1/CIP1蛋白与mRNA表达水平.
结果: CAO与CAO-MS对肝癌细胞的生长抑制作用与药物浓度及作用时间呈一定的依赖关系(P<0.01). 药物作用72 h时, CAO与CAO-MS对SMMC-7721的半数抑制浓度(IC50)分别约为50 mg/L和100 mg/L. 50 mg/L CAO和100 mg/L CAO-MS作用于肝癌细胞72 h后, 使G0+G1比例增加, S期及G2+M期比例相对下降, 细胞周期阻滞于G0+G1期. DNA含量测定、AnnexinⅤ标记、形态学研究结果提示, CAO与CAO-MS均能诱导肝癌细胞的凋亡, CAO的作用优于CAO-MS. ICC 和RT-PCR检测结果表明, 50 mg/L CAO 和100 mg/L CAO-MS作用于肝癌细胞72 h后, 均能提高 CAO-MS p21WAF1/CIP1蛋白及mRNA表达水平, 相同剂量的CAO的作用优于CAO-MS.
结论: CAO及CAO-MS对人肝癌细胞SMMC-7721均有显著的抑制增生作用, 作用呈剂量依赖性; CAO及CAO-MS能诱导对人肝癌细胞SMMC-7721凋亡, 并能使细胞周期阻滞于G0+G1期; CAO及CAO-MS抑制肝癌细胞增生及诱导其凋亡的机制可能与其上调p21WAF1/CIP1基因表达有关.
引文著录: 吴万垠, 郭伟剑, 常钢. 莪术油微球释放莪术油对人肝癌SMMC-7721细胞的作用. 世界华人消化杂志 2003; 11(3): 260-263
Revised: August 1, 2002
Accepted: August 16, 2002
Published online: March 15, 2003
AIM: To explore the inhibitory effects and mechanisms of CAO released from CAO-MS on the growth of human hepatoma cell line SMMC-7721.
METHODS: Inhibitory effects of CAO and CAO-MS on the growth of human hepatoma cell line SMMC-7721 in vitro were determined with MTT assay. The cell cycles of SMMC-7721 treated with CAO and CAO-MS were analyzed with flow cytometry. The apoptosis of human hepatoma cell line was tested with cellular DNA quantitative analysis, AnnexinⅤ labeling and morphological study. The expressions of p21WAF1/CIP1 protein and mRNA were detected, respectively, with immunocytochemistry staining (ICC) and reverse transcriptase polymerase chain reaction (RT-PCR).
RESULTS: The inhibitory effects of CAO and CAO-MS on the growth of human hepatoma cell line were dose- and time- dependent (P < 0.01). The IC50s of CAO and CAO-MS on SMMC-7721 were 50 mg/L and 100 mg/L, respectively. The propoertion of SMMC-7721 in G0/G1 phase increased and that in S and G2+M phase decreased after exposure with 50mg/L CAO and 100mg/L CAO-MS for 72 hours. ICC and RT-PCR analysis showed that both CAO and CAO-MS incresaed the level of p21WAF1/CIP1 protein and mRNA. The effect of CAO was superior to that of CAO-MS with the same dosage of CAO and CAO-MS.
CONCLUSION: Dose-dependent inhibitory effects of CAO and CAO-MS on the growth of human hepatoma cell line are remarkable. Both CAO and CAO-MS could induce apoptosis of human hepatoma cell and keep the cell cycle at G0/G1 phase from up-regulating expression of p21WAF1/CIP1 protein and mRNA.
- Citation: Wu WY, Guo WJ, Chang G. Effect of CAO released from MS-CAO on human hepatoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2003; 11(3): 260-263
- URL: https://www.wjgnet.com/1009-3079/full/v11/i3/260.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i3.260
含药微球用于经导管肝动脉灌注栓塞治疗肝细胞肝癌(HCC), 具有栓塞肿瘤血管和缓释药物达到局部抗癌的双重功效[1-4]. 从活血破瘀中药莪术中提取的挥发油莪术油(CAO), 含有多种抗癌成分. CAO对HepA肝癌有显著的抑制作用并能延长腹水癌小鼠的生存时间, 其作用机制可能与其抑制肿瘤细胞增生活性及诱导细胞凋亡有关[5-8]. 将CAO制成的含药明胶微球(CAO-MS), 经肝动脉灌注治疗大鼠肝脏移植型肿瘤, 在控制瘤体增长及延长荷瘤大鼠生存时间方面均显示了较好的疗效. 本研究中, 我们利用体外培养的人肝癌细胞, 对从莪术油微球中缓释的莪术油在避开栓塞作用后是否能达到对人肝癌细胞生长的抑制作用及其作用机制进行了探讨.
p21WAF1单抗(稀释度为1: 50)为Dako公司产品. 荧光标记Annexin Ⅴ(FIFT-Annexin Ⅴ)试剂盒为德国宝灵曼公司产品. PCR引物为上海中科院植物生理研究所合成: p21WAF1/CIP1基因扩增片段为384bp, p21WAF1/CIP1 5'GCGACTGTGATGCGCTAATG 3'、5'AGAAGATCAGCCGGCGTTTG 3'作为内标的b-actin扩增片段为114 bp, β-actin 5'ACCCCCACTGAAAAAGATGA 3'5'ATCTTCAAACCTCCATGATG 3'可供静脉注射的10 g/L CAO注射液由我院制剂室制备, 批号97112601, 97041601. 空白微球(B-MS)及CAO-MS由沈阳药科大学陈济民教授负责制备, 直径50-150 mm. 含药微球中温莪术油与明胶比例为1: 9. 将CAO-MS及B-MS按4 g/L加入细胞培养液中, 经24 h释放CAO后, 所得的培养液即为CAO-MS及B-MS药液. 再以培养液稀释至各种浓度. 人肝癌细胞珠SMMC-7721引自中国科学院上海细胞生物研究所. 常规培养于DMEM完全培养液中, 于37℃, 50 mL/L CO2充分湿度条件下恒温培养箱中培养, 隔3-4 d传代1次. 取对数生长期的细胞用于实验.
1.2.1 MTT法测定: CAO及CAO-MS药液对肝癌细胞的生长抑制作用. SMMC-7211细胞5×103/孔接种于96孔板中; 预培养24 h后加入含不同浓度的CAO及CAO-MS药液100 μL, 并设立对照组(培养液、溶剂和B-MS药液), 终体积为0.2 mL/孔. 分别于24, 48, 72和96 h进行MTT实验, 每次实验结束前4 h于每实验孔中加入MTT液(2 g/L) 20 μL, 再培养4 h, 离心吸弃上清, 加入DMSO 180 mL/孔显色. 用酶标仪在波长570 nm处测定并记录吸光A, 计算抑制率: 细胞生长抑制率 = (1-加药组A平均值/对照组A平均值)×100%
1.2.2 FCM检测细胞形态凋亡及细胞周期: 细胞接种于24孔板, 预培养24 h后换新培养液, 加药继续培养72 h后收集细胞, 制成细胞悬液(每份约106细胞). 1体积细胞悬液加9体积700 mL/L乙醇于-20℃固定24 h; PI染色, 上FCM分析细胞周期. AnnexinⅤ标记法检测肝癌细胞凋亡. 细胞预培养24 h后换新培养液, 加药继续培养72 h后收集细胞, PBS洗后加入Hepes 缓冲液96 μL, 2 μL FIFT-Annexin Ⅴ, 2 μL PI (50 g/L), 室温避光孵育10-15 min, 再加入400 μL Hepes 缓冲液, 上FCM分析. 激发波长488 nm, 双参数分析绿荧光(Annexin Ⅴ标记的细胞)及红荧光(PI标记的胞膜破损细胞)MODFIT软件分析细胞凋亡结果. 电子显微镜观察肝癌细胞超微结构的变化. 收集加药培养72 h后细胞, 用25 g/L戊二醛和10 g/L四氧化锇前后固定, 梯度乙醇脱水, 渗透包埋, 以常规方法制备超薄切片, 染色, 透射电镜观察.
1.2.3 检测p21WAF1/CIP1蛋白和p21WAF1/CIP1mRNA表达: 细胞预培养24 h后换新培养液, 加药继续培养72 h后收集细胞涂片, 丙酮固定, 加p21WAF1/CIP1单抗, 再依次加二抗、三抗, DAB显色, 苏木素复染; 常规蓝化、脱水、透明、封固. 参照文献标准, 评价p21WAF1/CIP1蛋白表达结果. 细胞接种预培养24 h后换新培养液, 加CAO(50 g/L)、CAO-MS(100 g/L)继续培养作用72 h后收集细胞, 以TRIZOL试剂抽提总RNA, 方法按说明书进行. 以RNA为模板, 合成cDNA, 20 μL反应体系含RNA 1 μg, 5×缓冲液 4.0 μL, Olig (dT) 0.2 μg, dNTP 1 mmol/L; Rnasin 0.5 μg; 逆转录酶AMV 15U. 42℃下孵育1 h, 99℃灭活AMV 5min, 迅速置冰浴中, -20℃保存. PCR反应体系含cDNA 2.0 μL, MgCL21.8 mmol/L, dNTP 0.2 mmol/Lβ-actin引物(25μmol/L)各 0.4μL, p21WAF1/CIP1引物(25 mmmol/L)各 1.0 μL, Taq酶 1U. 反应条件: 94℃预变性2 min, 然后94℃×45 s, 58℃ 1 min, 72℃ 1.5 min, 共30个循环, 72℃延伸7 min. 取20 μL PCR产物, 于15 g/L琼脂糖凝胶(含EB 0.5 g /L) 上电泳; 以TAE作电泳缓冲液, 6 V/cm胶, 电泳完成后于紫外灯下观察结果并摄片, 电泳条带在图像分析仪上分析.
统计学处理 采用华西医科大学卫生统计教研室研制的《中国医学百科全书医学统计学》统计软件包. 主要采用方差分析及c2检验等.
CAO与CAO-MS对肝癌细胞的生长抑制作用与药物浓度及作用时间呈一定的依赖关系. 作用72 h时, CAO与CAO-MS对SMMC-7721的半数抑制浓度(IC50)分别约为50 g/L和100 g/L, 提示CAO的作用强于CAO-MS(其中CAO-MS浓度指其所含CAO的浓度).
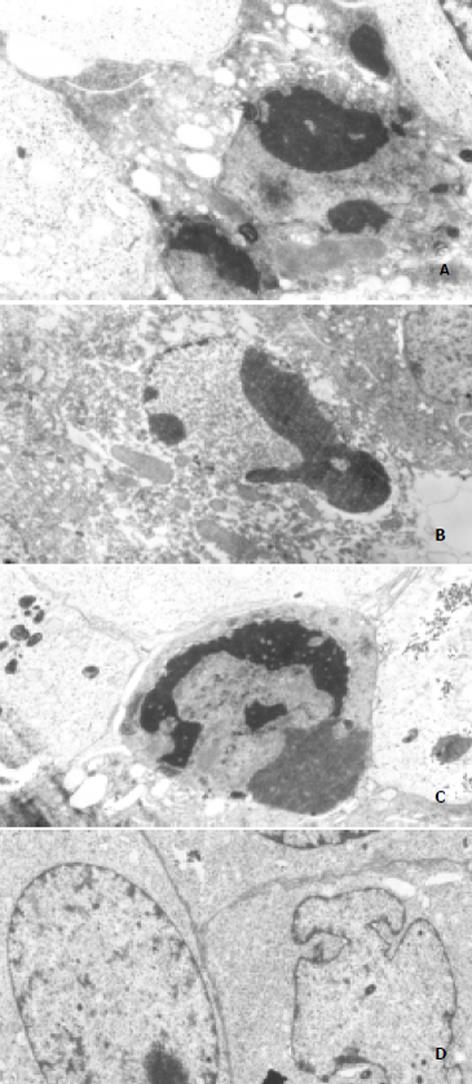
肝癌细胞经CAO及CAO-MS药物作用72 h后, 可见部分细胞膜完整、体积缩小、皱缩、形态不规则, 细胞内出现空泡, 凋亡小体形成(图1A); 部分细胞胞质细胞器完好, 核内染色质凝聚外突, 趋向凋亡小体形成(图1B); 另一类细胞染色质凝集, 胞质基质溶解、出现空泡, 为凋亡小体形成早期(图1C). 未经药物作用的肝癌细胞则多表现为胞质密度高, 细胞器正常, 核常规则或不规则, 核仁大, 凋亡小体少见(图1D). 未经药物作用的对照组肝癌细胞G0+G1, S及G2+M期平均比例分别为0.61, 0.23和0.16.药物作用于肝癌细胞72 h后, 低浓度的CAO (25 g/L)对细胞各期比例无显著影响, 较高浓度(50 g/L)使G0+G1比例增加(0.89), S期(0.03)及G2+M期(0.09)比例相对下降, 细胞周期阻滞于G0+G1期. 较低浓度的CAO-MS (50 g/L)仅使G2+M期比例增加(0.55), 对G0+G1期及S期比例均无显著影响, 加倍剂量的CAO-MS (100 g/L)方显示出类似于CAO的作用, G0+G1、S及G2+M期平均比例分别为0.81, 0.09和0.10.在AnnexinⅤ标记法检测细胞凋亡实验中, 根据细胞凋亡的早期即开始出现磷脂酰丝氨酸(PS)残基的暴露(自胞膜内层转移至外层), AnnexinⅤ能特异而高亲和力地与PS结合, 因而凋亡细胞表现为AnnexinⅤ标记阳性, 而PI染色阴性. 坏死细胞则表现为AnnexinⅤ、PI标记均阳性, 可与凋亡细胞区别. 结果高(50 g/L)、低剂量(25 g/L)的CAO均能增加凋亡肝癌细胞的比例, 高剂量(39.0±1.1%)优于低剂量(17.5±2.0, P<0.01); 相同剂量的CAO-MS作用低于CAO(P<0.01), 100 g/L的CAO-MS (34.4±2.2%)诱导肝癌细胞凋亡作用与50 g/L的CAO (39.0±1.1%)的作用类似(P>0.05). 结果提示, 二药均能诱导肝癌细胞的凋亡, 并有一定的剂量依赖关系, 相同剂量下, CAO的作用优于CAO-MS.
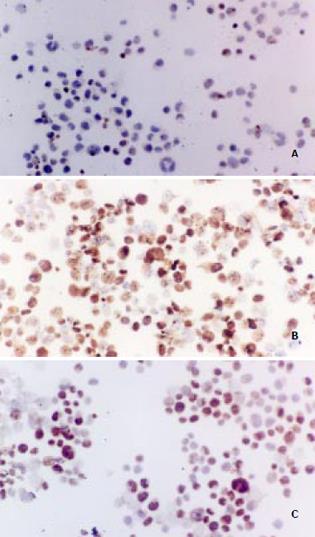
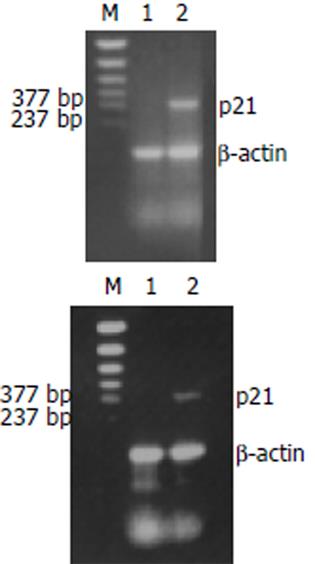
p21WAF1/CIP1蛋白ICC染色阳性定位于细胞核, 呈棕黄色. 未经药物作用的细胞, p21WAF1/CIP1蛋白表达呈弱阳性(图2A); 肝癌细胞经CAO (50 g/L)作用72 h后, p21WAF1/CIP1蛋白表达呈强阳性(图2B); CAO-MS (100 g/L)作用72 h后, p21WAF1/CIP1蛋白表达呈中度阳性(图2C). 该结果提示CAO及CAO-MS能提高p21WAF1/CIP1基因的蛋白表达水平. RT-PCR检测p21WAF1/CIP1mRNA表达的结果详见图3A, 3B. 未经药物作用的人肝癌SMMC-7721细胞未见明显的p21WAF1/CIP1扩增条带. 肝癌细胞经CAO(50 g/L)作用72 h后, 可见明显的p21WAF1/CIP1扩增条带(图3A); CAO-MS (100 g/L)作用72 h后, 亦可见明显的p21WAF1/CIP1扩增条带(图3B), 但与CAO作用后的条带相比较弱.
莪术油(CAO)含有榄香烯、莪术醇、莪术二酮等多种抗癌成分, 对HepA肝癌有显著的抑制作用, 并能延长腹水癌小鼠的生存时间, 其作用机制可能与其抑制肿瘤细胞增生活性及诱导细胞凋亡有关. 将CAO制成的含药明胶微球(CAO-MS), 经肝动脉灌注治疗大鼠肝脏移植型肿瘤, 在控制瘤体增长及延长荷瘤大鼠生存时间方面均显示了较好的疗效. 我们采用电子显微镜、DNA含量FCM分析及Annexin Ⅴ标记FCM分析多种方法相结合检测凋亡. 能检测出早期凋亡细胞并能区分坏死细胞. p53, p21WAF1/CIP1基因为与凋亡、细胞周期相关基因, 在细胞的增生、分化、凋亡过程中发挥重要作用. CAO及CAO-MS对人肝癌细胞SMMC-7721均有一定的抑制生长作用, 抑制效应呈剂量依赖性, 且与作用时间亦有一定的相关性. 药物作用72 h时, CAO与CAO-MS对SMMC-7721的半数抑制浓度(IC50)分别约为50 g/L和100 g/L. FCM细胞周期检测结果表明, CAO主要使细胞周期阻滞于G0+G1期, S期比例降低; 低剂量CAO-MS则使细胞周期阻滞于G2+M期, 较高剂量的作用类似于CAO. 药物诱导肝癌细胞凋亡检测结果提示, 电镜下可见特征性的凋亡小体形成等凋亡证据; AnnexinⅤ标记法及DNA含量测定法均提示一定浓度的CAO或CAO-MS能增加肝癌凋亡细胞的百分比, 在FCM图上可见明显的亚G1峰形成. 以上多种方法检测出的结果提示, CAO及CAO-MS确能诱导人肝癌细胞凋亡.
免疫组化检测结果显示, CAO或CAO-MS作用于肝癌细胞后能上调p21WAF1/CIP1蛋白表达水平; RT-PCR测定结果则进一步提示他们尚能提高p21WAF1/CIP1 mRNA的表达水平. 综合以前的文献研究及以上的实验结果, CAO及CAO-MS抑制人肝癌细胞增生的机制可能如下: (1)CAO中含有多种抗癌成份, 具细胞毒作用, 可能通过直接损伤细胞DNA, 激活p21WAF1/CIP1基因表达, 引起细胞周期阻滞以修复DNA, 无法修复时则激发凋亡发生; (2) CAO中含有的榄香烯等成份能激活自然杀伤细胞(NK)活性及诱导生物体产生白介素-2(IL-2), 而已有人证实NK和IL-2对诱导肿瘤细胞凋亡有重要作用. 总之, CAO以及从CAO-MS中缓释出的CAO对人肝癌细胞SMMC-7721的增生均有显著的抑制作用. 其作用机制是通过调节与细胞增生及凋亡相关的某些基因表达, 一方面引起肝癌细胞增生周期阻滞, 另一方面诱导肝癌细胞发生程序化死亡(凋亡). 本结果为临床上使用CAO或CAO-MS治疗原发性肝癌提供了一定的实验依据, 我们预计经肝动脉灌注CAO-MS至肝癌局部后, 从微球中缓释出的CAO亦能达到以上的效应, 同时配合微球的微动脉栓塞作用有望进一步增强疗效, 其最终疗效目前正在临床试验过程中.
编辑: N/A
| 1. | Liu L, Jiang Z, Teng GJ, Song JZ, Zhang DS, Guo QM, Fang W, He SC, Guo JH. Clinical and experimental study on regional administration of phosphorus 32 glass microspheres in treating hepatic carcinoma. World J Gastroenterol. 1999;5:492-505. [PubMed] [DOI] |
| 2. | Fan J, Ten GJ, He SC, Guo JH, Yang DP, Wang GY. Arterial chemoembolization for hepatocellular carcinoma. World J Gastroenterol. 1998;4:33-37. [PubMed] [DOI] |
| 3. | Ho S, Lau WY, Leung TW, Johnson PJ. Internal radiation therapy for patients with primary or metastatic hepatic cancer: a review. Cancer. 1998;83:1894-1907. [PubMed] [DOI] |
| 4. | Lau WY, Leung WT, Ho S, Leung NW, Chan M, Lin J, Metreweli C, Johnson P, Li AK. Treatment of inoperable hepatocellular carcinoma with intrahepatic arterial yttrium-90 microspheres: a phase I and II study. Br J Cancer. 1994;70:994-999. [PubMed] [DOI] |
| 5. | Sharma RA, McLelland HR, Hill KA, Ireson CR, Euden SA, Manson MM, Pirmohamed M, Marnett LJ, Gescher AJ, Steward WP. Pharmacodynamic and pharmacokinetic study of oral Curcuma extract in patients with colorectal cancer. Clin Cancer Res. 2001;7:1894-1900. [PubMed] |
| 6. | Wu WY, Luo YJ, Chen JH, Chang G, Xu Q, Liu WS, Li RX. Image cytometric DNA analysis of hepatic carcinomas carried by mice treated by Curcuma aromatica oil (CAO). Zhongxiyi Jiehe Ganbing Zazhi. 1999;9:18-20. |
| 7. | Shi LC, Wu WY, Zhang WB, Qu YQ, Tan M, Xiao QM. Effect of Curcuma aromatica oil on proliferating cell nuclear antigen of hepatoma in mice. Shijie Huaren Xiaohua Zazhi. 1999;7:156-157. [DOI] |
| 8. | Wu WY, Xu Q, Shi LC, Zhang WB. Inhibitory effects of Curcuma aromatica oil on proliferation of hepatoma in mice. World J Gastroenterol. 2000;6:216-219. [PubMed] |