修回日期: 2002-10-12
接受日期: 2002-10-29
在线出版日期: 2003-02-15
目的: 探讨环氧化酶-2(COX-2)和p53在胰腺癌组织中的表达与生物学行为之间的关系并探讨二者的相关性及可能机制.
方法: 用免疫组织化学Envision法对51例胰腺导管癌和11例癌旁非肿瘤胰腺组织的COX-2和p53的表达进行检测.
结果: 51例胰腺导管癌中COX-2和p53蛋白的表达率分别为74.5%和60.8%; 二者在11例癌旁非肿瘤胰腺组织中均未发现阳性表达. COX-2的表达与临床分期和淋巴结转移有关(P = 0.022, 0.036), 而与组织学分级关系不大(P = 0.152); p53的表达与淋巴结转移有关(P = 0.035), 而与组织学分级、临床分期关系不大(P = 0.131, 0.078); COX-2的表达与p53的表达密切相关(r = 0.452, P = 0.001). 二者的表达与患者的性别、年龄、肿瘤的大小、部位均无关.
结论: COX-2和p53的协同作用可能在胰腺癌的发生发展过程中起重要作用, 可能为胰腺癌的治疗提供了新的靶点.
引文著录: 刘江伟, 李开宗, 窦科峰. COX-2在胰腺癌组织中的表达及其与p53的相关性研究. 世界华人消化杂志 2003; 11(2): 229-232
Revised: October 12, 2002
Accepted: October 29, 2002
Published online: February 15, 2003
AIM: To investigate the expressions of COX-2 and p53 in human pancreatic cancer and their correlation with biological behaviors of pancreatic cancer.
METHODS: The expressions of COX-2 and p53 in 51 specimens of human pancreatic ductal adenocarcinoma and 11 specimens of normal tissues adjacent human pancreatic ductal adenocarcinoma were detected with immunohistochemistry by Envision.
RESULTS: The detectable rate of COX-2 and p53 in pancreatic ductal adenocarcinoma were 74.5% and 60.8%, respectively; but none in adjacent normal tissues. The expression of COX-2 was significantly associated with the clinical stages and metastasis status of lymph nodes (P = 0.022, 0.036), but not with histological grade (P = 0.152). The expression of p53 was significantly correlated with the lymph node metastasis status (P = 0.035), but not with their histological grades and clinical stages (P = 0.131, 0.078). There was a significant correlation between the expression of COX-2 and p53 (r = 0.452, P = 0.001). Conditions such as age, sex, tumor size and location had no relation with expression of COX-2 or p53.
CONCLUSION: The cooperation of COX-2 and p53 may play a pivotal role in the carcinogenesis and the progression in pancreatic cancer. They may provide new targets for the therapy of pancreatic cancer.
- Citation: Liu JW, Li KZ, Dou KF. Expression of cyclooxygenase-2 in pancreatic cancer and its correlation with p53. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 229-232
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.229
环氧化酶-2(cyclooxygenase-2, COX-2)是炎症过程中催化前列腺素合成的一个关键诱导酶. 近年研究发现, COX-2参与了多种肿瘤特别是消化系统肿瘤的细胞增生、抗凋亡和血管生成, 与肿瘤的发生、发展和预后密切相关[1-12]. p53是迄今发现的最重要的肿瘤抑制基因, 在许多消化系肿瘤组织中均存在基因突变, 参与肿瘤的发生、发展[13-34]. COX-2与p53之间关系的研究目前尚存争议; 而胰腺癌组织中COX-2的表达与突变型p53表达关系的研究, 国内外尚未见文献报道. 本研究旨在探讨COX-2和p53在胰腺癌中的表达和临床病理特征之间的关系, 并探讨二者之间的相互关系及可能的机制.
采用第四军医大学西京医院病理科1995-2000年胰腺癌根治术后存档蜡块51例, 均经组织病理学诊断为导管腺癌, 男30例, 女21例; 年龄39-75岁, 平均59.2岁. 按Klopper组织学分级标准, Ⅰ级19例, Ⅱ级17例, Ⅲ级15例. 按Hemreck临床分期标准, Ⅰ期7例, Ⅱ期11例, Ⅲ期20例, Ⅳ期13例. 有淋巴结转移者32例. 另取11例癌旁非肿瘤胰腺组织标本做对照. COX-2兔抗人多克隆抗体、p53鼠抗人单克隆抗体, 均系Santa Cruz 公司产品. Envision二步法免疫组化试剂盒、DAB显色剂系DAKO公司产品.
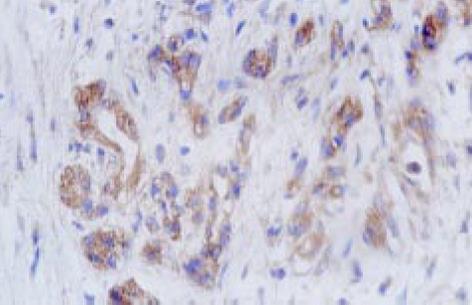
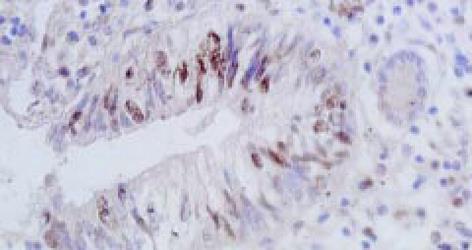
免疫组织化学检测步骤如下: 组织切片常规脱蜡至水, 离子水冲洗5 min; 置枸橼酸盐抗原修复液中用微波炉进行抗原修复15 min, 自然冷却至室温, PBS冲洗; 3%的H2O2浸泡20 min, PBS冲洗; 正常山羊血清37℃封闭30 min, 滴加兔抗人多克隆抗体COX-2(工作浓度 1: 50)和鼠抗人单克隆抗体p53(工作浓度1: 100), 37℃放置2 h; PBS冲洗后加入Envision二抗-酶标多聚物37℃放置30 min, DAB显色, 自来水冲洗, 苏木素复染, 封片. 同时用PBS代替-抗作染色的阴性对照, 用已知的染色阳性切片作阳性对照. COX-2以肿瘤细胞胞质出现棕黄色颗粒为阳性细胞(图1); p53以肿瘤细胞核出现棕黄色颗粒为阳性细胞(图2); 二者采取统-的评价标准. 在400倍光镜下至少观察5个视野, 肿瘤阳性细胞>5%定义为阳性表达, ≤5%为阴性表达[35].
统计学处理 采用SPSS10.0统计学软件, 采用x2检验和Spearman等级相关分析.
胰腺癌组织COX-2蛋白阳性表达率为74.5%, p53蛋白阳性表达率为60.8%. 在11例癌旁胰腺组织中未见COX-2、p53蛋白的阳性表达. COX-2蛋白表达率在临床Ⅰ-Ⅱ期为55.6%(10/18), 在Ⅲ-Ⅳ期为84.8%(28/33), 差异具有显著性(x2 = 5.262, P<0.05); 在淋巴结转移阳性组为84.4%(27/32), 淋巴结转移阴性组为57.9%(11/19), 差异具有显著性(x2 = 4.401, P<0.05); COX-2的表达在组织学分级之间无显著性差异(P>0.05). p53蛋白表达在淋巴结转移阳性组明显高于淋巴结转移阴性组, 差异具有显著性(x2 = 4.432, P<0.05); 在组织学分级、临床分期之间均无显著性差异(P>0.05). COX-2, p53的表达与患者的性别、年龄、肿瘤的大小、部位无明显关系(P>0.05, 表1).
在COX-2阳性表达组中, P53的阳性表达率为73.7%(28/38); 在COX-2阴性表达组中p53阳性表达率为23.1%(3/13), 差异有显著性(x2 = 10.407, P = 0.001). Spearman 等级相关分析表明二者有相关性(r = 0.452, P = 0.001).
流行病学和实验研究发现, 非甾体类抗炎药物(NSAIDs)能够有效地预防肿瘤, NSAIDs主要作用于环氧化酶. 环氧化酶是前列腺素合成过程中的重要限速酶, 已发现有两种同工酶COX-1和COX-2.COX-1被认为是"看家基因", 在大多数正常细胞中都呈稳定表达, 与正常的生理功能有关, 如保护胃黏膜和维持肾脏的正常血流量等. COX-2在大多数正常组织中不表达, 但在细胞受到各种刺激如炎症因子、生长因子、促癌剂等的诱导下迅速合成, 参与炎症过程和肿瘤的发生[36]. COX-2在大多数人类肿瘤中过表达, 其过表达与结肠癌、头颈部肿瘤、肺癌、前列腺癌、胃癌、乳腺癌等肿瘤的浸润、淋巴结转移和预后不良有关[37]. 本研究发现, COX-2在胰腺癌中的表达率为74.5%, 而在癌旁的非肿瘤胰腺组织中未见表达; COX-2的表达与病理学分级、患者的性别、年龄、肿瘤的大小、部位无关(P>0.05), 而与临床分期和淋巴结转移呈密切正相关(P<0.05). 由此可见, COX-2可能在胰腺癌的发生、发展、肿瘤的浸润和转移中起重要作用, COX-2 的过表达可能是反映胰腺癌预后的有用指标. 最近研究表明, COX-2 可能通过以下机制参与肿瘤形成, 如促进前列腺素的合成, 促进血管生成, 抑制机体免疫监视功能, 阻止细胞凋亡等[38]. 至于哪种机制在胰腺癌的形成中起重要作用尚需进一步研究.
野生型p53(wt p53)是细胞生长的负调控基因, 通过调控细胞的生长和凋亡而起抑癌作用. 当细胞在理化因素作用下DNA发生损伤时, 他能使细胞分裂停止在G1/S期, 使细胞修复损伤而恢复正常, 如果损伤不能恢复, wtP53能促使细胞凋亡, 从而保证有癌变倾向的细胞的自我消亡; 其突变或缺失引起的突变型p53则失去此"肿瘤抑制"效应而对细胞的增生和转化起促进作用. p53突变后, 半衰期延长, 因而用免疫组化可检测到突变的p53.在许多肿瘤中都可检测到高水平的突变型p53表达, 而其表达往往与肿瘤的分级、分期、预后密切相关, 常常是肿瘤术后复发、治疗失败的关键[39-44]. 本研究发现, p53在胰腺癌组织中的突变率达60.8%, 在癌旁组织未检测到突变型p53, 其表达与淋巴结转移呈正相关趋势, 表明p53的突变在胰腺癌的肿瘤发生、发展中起重要作用.
关于COX-2和p53之间的关系的研究尚存争议, Ristimaki et al[36,45,46]研究发现, 在有突变型p53的肿瘤组织中比没有p53突变的肿瘤组织中表达更多的COX-2. Costa et al[37,47]研究认为, COX-2的表达与突变型p53的表达无关. 我们对胰腺癌组织中COX-2和突变型p53的表达进行相关性分析发现二者密切相关. 有研究认为野生型p53能够与TATA-结合蛋白竞争COX-2启动子上的结合位点从而抑制COX-2 的表达[48]. 在p53缺陷的鼠胚胎纤维母细胞中重新置入p53可阻止COX-2 的表达, 因而认为在p53和COX-2之间存在着调节环路[49]. 因肿瘤的发生发展是受多基因多步骤调控的, 我们认为, 野生型p53可能是COX-2上游的其中一个调控基因; 野生型p53的突变可能丧失了对COX-2的抑制而使COX-2表达增加, p53的突变和COX-2在肿瘤的发生、发展中可能起协同作用, 其机制尚需进一步阐明.
随着对COX-2参与肿瘤发生、发展机制的进一步研究, 加之选择性COX-2抑制剂的不断开发上市, COX-2在胰腺癌的预防、增加化疗、放疗敏感性, 减少治疗的毒副作用方面存在潜在的实用价值.
编辑: N/A
| 1. | Moran EM. Epidemiological and clinical aspects of nonsteroidal anti-inflammatory drugs and cancer risks. J Environ Pathol Toxicol Oncol. 2002;21:193-201. [PubMed] [DOI] |
| 2. | Tian G, Yu JP, Luo HS, Yu BP, Yue H, Li JY, Mei Q. Effect of nimesulide on proliferation and apoptosis of human hepatoma SMMC-7721 cells. World J Gastroenterol. 2002;8:483-487. [PubMed] [DOI] |
| 3. | 郜 恒骏, 于 连珍, 孙 亮, 缪 琨, 白 剑峰, 张 小勇, 吕 秀珍, 赵 志泉. 胃癌及癌旁组织中COX-2基因蛋白的表达. 世界华人消化杂志. 2000;8:578-579. [DOI] |
| 4. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hCOX-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究. 世界华人消化杂志. 2000;8:1211-1217. [DOI] |
| 5. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions:H.pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 7. | 孙 波, 吴 云林, 张 学军, 王 升年, 贺 恒益, 乔 敏敏, 章 永平, 钟 捷. 舒林酸抑制人胃腺癌细胞增生及诱导凋亡. 世界华人消化杂志. 2001;9:997-1002. [DOI] |
| 10. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 11. | Wang X, Lan M, Wu HP, Shi YQ, Lu J, Ding J, Wu KC, Jin JP, Fan DM. Direct effect of croton oil on intestinal epithelial cells and colonic smooth muscle cells. World J Gastroenterol. 2002;8:103-107. [PubMed] [DOI] |
| 14. | 郭 洁, 沈 志祥, 谭 诗云, 罗 和生, 李 海霞, 冯 志强, 杨 军. MDM2、P53与P14ARF在结肠肿瘤中的表达及意义. 世界华人消化杂志. 2002;10:540-543. [DOI] |
| 15. | 季 代金, 曹 燕, 张 亚历, 姜 泊, 余 宁, 冯 福才, 周 殿元. 大肠癌HT-29, Lovo细胞p53转录表达差异同步研究. 世界华人消化杂志. 2000;8:77-79. [DOI] |
| 21. | 魏 子白, 王 丽冰, 田 步生, 王 金龙, 孙 旭芳, 魏 建平, 刘 娜, 王 敬弘. 内镜下卢戈液染色与P53蛋白检测诊断早期食管癌. 世界华人消化杂志. 2001;9:495-498. [DOI] |
| 23. | Wang DX, Fang DC, Li W, Du QX, Liu WW. A study on relationship between infection of Helicobacter pylori and inactivation of antioncogenes in cancer and pre-cancerous lesion. Shijie Huaren Xiaohua Zazhi. 2001;9:984-987. |
| 24. | Zhang L, Fu HM, Jin SZ, Huang R, Zhou CG. Overexpression of P53 and relationship between extracellular matrix and differentiation, invasion and metastasis of gastric carcinoma. Shijie Huaren Xiaohua Zazhi. 2001;9:992-996. |
| 25. | Zhang ZY, Dou KF, Liu ZC. Relationship between p73 and p53 expression in extrahepatic cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi. 2001;9:1147-1151. |
| 26. | Liu HF, Liu WW, Fang DC, Gao JH, Wang ZH. Apoptosis and proliferation in duced by Helicobacter pylori and its association with p53 protein expression in gastric epithelial cells. Shijie Huaren Xiaohua Zazhi. 2001;9:1265-1268. |
| 27. | Liu H, Wang Y, Zhou Q, Gui SY, Li X. The point mutation of p53 gene exon7 in hepatocellular carcinoma from Anhui Province, a non HCC prevalent area in China. World J Gastroenterol. 2002;8:480-482. [PubMed] [DOI] |
| 28. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 29. | Zhang Z, Yuan Y, Gao H, Dong M, Wang L, Gong YH. Apoptosis, proliferation and p53 gene expression of H. pylori associated gastric epithelial lesions. World J Gastroenterol. 2001;7:779-782. [PubMed] [DOI] |
| 30. | Wang LP, Liang K, Shen Y, Yin WB, Hans G, Zeng YJ. Neutron-induced apoptosis of HR8348 cells in vitro. World J Gastroenterol. 2001;7:435-439. [PubMed] [DOI] |
| 31. | Yin ZZ, Jin HL, Yin XZ, Li TZ, Quan JS, Jin ZN. Effect of Boschniakia rossica on expression of GST-P, p53 and p21(ras)proteins in early stage of chemical hepatocarcinogenesis and its anti-inflammatory activities in rats. World J Gastroenterol. 2000;6:812-818. [PubMed] [DOI] |
| 32. | Wang XJ, Yuan SL, Li CP, Iida N, Oda H, Aiso S, Ishikawa T. Infrequent p53 gene mutation and expression of the cardia adenocarcinomas from a high-incidence area of Southwest China. World J Gastroenterol. 2000;6:750-753. [PubMed] [DOI] |
| 33. | Lin GY, Chen ZL, Lu CM, Li Y, Ping XJ, Huang R. Immunohistochemical study on p53, H-rasp21, c-erbB-2 protein and PCNA expression in HCC tissues of Han and minority ethnic patients. World J Gastroenterol. 2000;6:234-238. [PubMed] |
| 34. | Qin LL, Su JJ, Li Y, Yang C, Ban KC, Yian RQ. Expression of IGF- II, p53, p21 and HBxAg in precancerous events of hepatocarcinogenesis induced by AFB1 and/or HBV in tree shrews. World J Gastroenterol. 2000;6:138-139. [PubMed] [DOI] |
| 35. | Molina MA, Sitja-Arnau M, Lemoine MG, Frazier ML, Sinicrope FA. Increased cyclooxygenase-2 expression in human pancreatic carcinomas and cell lines: growth inhibition by nonsteroidal anti-inflammatory drugs. Cancer Res. 1999;59:4356-4362. [PubMed] |
| 36. | Ristimäki A, Sivula A, Lundin J, Lundin M, Salminen T, Haglund C, Joensuu H, Isola J. Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer. Cancer Res. 2002;62:632-635. [PubMed] |
| 37. | Costa C, Soares R, Reis-Filho JS, Leitão D, Amendoeira I, Schmitt FC. Cyclo-oxygenase 2 expression is associated with angiogenesis and lymph node metastasis in human breast cancer. J Clin Pathol. 2002;55:429-434. [PubMed] [DOI] |
| 38. | Xu XC. COX-2 inhibitors in cancer treatment and prevention, a recent development. Anticancer Drugs. 2002;13:127-137. [PubMed] [DOI] |
| 39. | Mirza A, McGuirk M, Hockenberry TN, Wu Q, Ashar H, Black S, Wen SF, Wang L, Kirschmeier P, Bishop WR. Human survivin is negatively regulated by wild-type p53 and participates in p53-dependent apoptotic pathway. Oncogene. 2002;21:2613-2622. [PubMed] [DOI] |
| 40. | Liu JW, Li KZ. Pancreatic cancer, oncogene and anti-oncogene. Shijie Huaren Xiaohua Zazhi. 2001;9:72-73. |
| 41. | Qin LX, Tang ZY, Ma ZC, Wu ZQ, Zhou XD, Ye QH, Ji Y, Huang LW, Jia HL, Sun HC. P53 immunohistochemical scoring: an independent prognostic marker for patients after hepatocellular carcinoma resection. World J Gastroenterol. 2002;8:459-463. [PubMed] [DOI] |
| 42. | Li HL, Chen DD, Li XH, Zhang HW, Lu YQ, Ye CL, Ren XD. Changes of NF-kB, p53, Bcl-2 and caspase in apoptosis induced by JTE-522 in human gastric adenocarcinoma cell line AGS cells: role of reactive oxygen species. World J Gastroenterol. 2002;8:431-435. [PubMed] [DOI] |
| 43. | Xu M, Jin YL, Fu J, Huang H, Chen SZ, Qu P, Tian HM, Liu ZY, Zhang W. The abnormal expression of retinoic acid receptor-beta, p 53 and Ki67 protein in normal, premalignant and malignant esophageal tissues. World J Gastroenterol. 2002;8:200-202. [PubMed] [DOI] |
| 44. | Xu AG, Li SG, Liu JH, Gan AH. Function of apoptosis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] [DOI] |
| 45. | Kawabe A, Shimada Y, Uchida S, Maeda M, Yamasaki S, Kato M, Hashimoto Y, Ohshio G, Matsumoto M, Imamura M. Expression of cyclooxygenase-2 in primary and remnant gastric carcinoma: comparing it with p53 accumulation, Helicobacter pylori infection, and vascular endothelial growth factor expression. J Surg Oncol. 2002;80:79-88. [PubMed] [DOI] |
| 46. | Niki T, Kohno T, Iba S, Moriya Y, Takahashi Y, Saito M, Maeshima A, Yamada T, Matsuno Y, Fukayama M. Frequent co-localization of Cox-2 and laminin-5 gamma2 chain at the invasive front of early-stage lung adenocarcinomas. Am J Pathol. 2002;160:1129-1141. [PubMed] [DOI] |
| 47. | Sepehr A, Tanière P, Martel-Planche G, Zia'ee AA, Rastgar-Jazii F, Yazdanbod M, Etemad-Moghadam G, Kamangar F, Saidi F, Hainaut P. Distinct pattern of TP53 mutations in squamous cell carcinoma of the esophagus in Iran. Oncogene. 2001;20:7368-7374. [PubMed] [DOI] |
| 48. | Subbaramaiah K, Altorki N, Chung WJ, Mestre JR, Sampat A, Dannenberg AJ. Inhibition of cyclooxygenase-2 gene expression by p53. J Biol Chem. 1999;274:10911-10915. [PubMed] [DOI] |
| 49. | Zahner G, Wolf G, Ayoub M, Reinking R, Panzer U, Shankland SJ, Stahl RA. Cyclooxygenase-2 overexpression inhibits platelet-derived growth factor-induced mesangial cell proliferation through induction of the tumor suppressor gene p53 and the cyclin-dependent kinase inhibitors p21waf-1/cip-1 and p27kip-1. J Biol Chem. 2002;277:9763-9771. [PubMed] [DOI] |