修回日期: 2002-11-02
接受日期: 2002-11-16
在线出版日期: 2003-02-15
目的: 研究在活血化淤基础上辅以软坚散节自制的双甲五灵冲剂对大鼠肝纤维化模型抗纤维化的治疗机制.
方法: 采用免疫诱导型肝纤维化大鼠模型, 80只Wister大鼠, 分为5组, A预防组 造模同时开始喂食双甲五灵冲剂; B治疗组1 在造模结束的同时开始喂食双甲五灵冲剂; C治疗组2 在造模结束3 mo后开始喂食双甲五灵冲剂; D秋水仙碱组 在造模结束的同时开始喂食秋水仙碱; 另设正常对照组10只. 采用HE染色观察肝组织改变及Von-Gieson胶原纤维特殊染色以观察肝纤维化程度, 并采用肝组织原位杂交及免疫组织化学染色观察大鼠肝脏组织中TIMP-1和TIMP-2 mRNA及蛋白的表达强度.
结果: 免疫诱导型肝纤维化大鼠, 在造模结束后肝组织学改变呈进行性加重, 以造膜结束后3 mo为著, 其TIMP-1和TIMP-2 mRNA及蛋白呈强阳性表达, 而经双甲五灵冲剂治疗后的大鼠与模型组大鼠相比, 肝组织结构明显好转, 纤维组织明显减少, TIMP-1和TIMP-2 mRNA及蛋白表达明显降低(P<0.05), 并且其效果为: 预防组效果最好, 治疗1组较治疗2组效果好, 即造模同时开始喂食双甲五灵冲剂最好, 造模结束同时用药好于造模结束3 mo后用药, 三组均明显优于秋水仙碱组.
结论: 中药双甲五灵冲剂治疗肝纤维化的机制可能通过抑制TIMP-1和TIMP-2 mRNA及蛋白的表达而降低对MMPs的抑制, 从而有利于MMPs对细胞外基质的降解.
引文著录: 谢玉梅, 聂青和, 周永兴, 黄长形, 康文臻, 张岩, 郝春秋, 王九平, 朱晓慧. 中药双甲五灵冲剂对免疫性肝纤维化大鼠肝组织中TIMPs蛋白及基因表达的影响. 世界华人消化杂志 2003; 11(2): 199-203
Revised: November 2, 2002
Accepted: November 16, 2002
Published online: February 15, 2003
AIM: To explore the effect of Chinese herb Shuangjiawuling in preventing hepatic fibrosis in rat with liver fibrosis.
METHODS: Rat immunogenic liver fibrosis model was induced by administration human serum albumin (HSA 200 g/L) intravenously, 80 rats were randomly divided into 5 groups. Shuangjiawuling was taken orally simultaneously with (group A), immediately after (group B), or 3 months after (group C) administration of HAS intravenously. Colchine tablets were taken orally with the administration of HAS (group D), normal rats were used as control (Group E). The pathological changes of liver tissue were observed by HE and Von-Gieson staining. The hepatic mRNA and protein of TIMP-1 and TIMP-2 were analyzed by in site hybridization and immunohistochemistry.
RESULTS: Hepatic fibrosis developed gradually and became obviously on the third month after administration of HAS. And strong expressions of TIMP-1 and TIMP-2 were observed, however, its expression and hepatic fibrosis were reduced dramatically following administration of Shuangjiawuling and colchine tablets. The effect of Shuangjiawuling in preventing fibrosis was superior to that of colchine tablets (P<0.05), and its effect in group A, B, and C decreased in order.
CONCLUSION: Chinese herb Shuangjiawuling can inhibit the development of hepatic fibrosis and the expression of TIMPs, and promoted the effect of the degradation of the extracellular matrix.
- Citation: Xie YM, Nie QH, Zhou YX, Huang CX, Kang WZ, Zhang Y, Hao CQ, Wang JP, Zhu XH. Effect of Chinese herb Shuangjiawuling on expression of TIMPs in rat with liver fibrosis. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 199-203
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/199.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.199
病毒性肝炎在我国是常见病, 多发病, 严重影响患者及家属的生活质量. 在肝炎抗病毒治疗尚未取得突破性进展的今天, 防治肝纤维化的发生可以说是治疗慢性肝病的重大决策. 肝纤维化是各种慢性肝病发展为肝硬变的必经阶段和共同病理途径, 现已知肝纤维化是一个可逆性病变, 而肝硬化则是-不可逆性病变[1,2]. 近10年来, 肝纤维化发生机制的研究已取得了长足发展, 许多方面的研究结果得以共识. 肝纤维化的形成主要由于肝星状细胞(HSC)激活, 细胞外基质(extracellular matrix ECM)生成过多, 降解相对不足, 在肝内大量沉积所致[3-5]. 影响细胞外基质降解的主要酶是基质金属蛋白酶(mastrix metalloproteinases, MMPs)及基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinasas, TIMP), MMP是一组能降解ECM的重要蛋白分解酶, 而TIMP是一组具有抑制MMP功能的活性多肽, 通过对MMP的抑制从而阻止ECM的降解[6-10].
国内外许多学者都在积极探索肝纤维化治疗的有效方法. 但至今为止, 尚无治疗肝纤维化高效、低毒、价廉而理想的药物. 有报道秋水仙碱、D-青霉胺、马洛替酯等药物具有抗肝纤维化的作用, 其中秋水仙碱曾-度被认为具有抑制基质生成的作用, 并曾应用于一些病例, 但由于疗效不佳, 毒副作用较大, 临床应用受到极大的限制. 近年研究发现活血化瘀中药在抗纤维化治疗中较有应用前途[11-19]. 我们通过对纯中药制剂"双甲五灵冲剂"对免疫损伤性肝纤维化大鼠的治疗, 同时选用秋水仙碱作为对照, 应用常规病理学及免疫、分子病理学检测技术, 以探讨中药治疗肝纤维化的作用机制, 为临床应用提供可靠的理论依据.
Wister大鼠♀, 80只, 体质量120-150 g(购自第四军医大学实验动物中心). 人血白蛋白, 购自卫生部兰州生物制品研究所; 不完全福氏佐剂(Sigma产品); 中药制剂双甲五灵冲剂系第四军医大学唐都医院感染科研制, 中药制剂科生产(重要方剂由五味子、灵芝、柴胡、丹参、桃仁、黄芪、鳖甲等中药组成); 市售秋水仙碱系昆明制药股份有限公司生产. 链霉素抗生物素蛋白-过氧化酶免疫染色超敏试剂盒(SP-Kit)购自福州迈新生物技术开发公司, 产品编号Kit-9710, 按试剂盒说明书常规进行免疫组织化学操作; 鼠抗TIMP-1和TIMP-2单克隆抗体购自美国Maxim生物技术公司, 产品编号分别为MAB-0 282、MAB-0 283 . TIMP-1和TIMP-2原位杂交试剂盒均购自武汉博士德生物工程有限公司, 试剂编号为MK 1 549.
参照王宝恩et al应用的人血白蛋白免疫攻击方法制备并加以改良, 抗大鼠IgG单克隆抗体购自法国Coulter公司. 具体操作方法: 将人血白蛋白用生理盐水稀释, 与等量的不完全福氏佐剂乳化, 每只大鼠皮下多点注射, 每次注射0.5 mL(内含人血白蛋白4 mg), 共4次, 前2次间隔14 d, 第3, 4次间隔10 d. 末次免疫后10 d取血测抗体, 取抗体阳性大鼠作实验, 尾静脉攻击注射白蛋白, 2次/wk, 第1周2. 5 mg/只, 以后每次攻击增加0.5 mg/只直至4.5 mg/只. 维持此剂量2-2.5 mo.
A组10只为预防组 造模同时开始喂食双甲五灵冲剂, 共3 mo, 造膜结束后存活8只; 60只造模组共存活43只, 随机分为4组, B组10只为治疗组1 在造模结束的同时开始喂食双甲五灵冲剂, 共3 mo; C组10只为治疗组2 在造模结束3 mo后开始喂食双甲五灵冲剂, 共3 mo; D组10只为秋水仙碱组 在造模结束的同时开始喂食秋水仙碱, 共3 mo; E组模型组13只, 以观察肝纤维化自然恢复情况, 另设10只为正常对照组. 常规HE染色观察肝组织学改变; Von Gieson胶原纤维特殊颜色.
1.3.1 免疫组织化学染色: 石蜡包埋4 mm连续切片, 采用SP法作免疫组织化学染色. 主要步骤; 脱腊至水; 抗原修复; 加10%正常血清封闭20 min; 加TIMP-1或TIMP-2 McAb (-抗)或Ⅰ Ⅲ型胶原单克隆抗体4℃过夜; 加生物素二抗37℃, 恒温30-40 min; 加亲和素-过氧化酶溶液37℃, 20 min; 加DAB显色10 min; 苏木素复染, 酒精脱水, 二甲苯透明, 树胶封片, 镜检, 并照像记录. 免疫组织化学法对照实验: 为保证实验结果的可靠性, 特别是免疫组织化学的特异性, 本实验采用省略-抗和二抗, 分别用兔血清和磷酸盐缓冲液代替-抗; 另设10例正常肝组织做对照.
1.3.2 肝组织原位杂交: 按试剂盒说明书常规进行操作, 基本步骤为石蜡包埋4 mm连续切片, 80℃烤片后, 二甲苯脱蜡, 酒精逐级水化, 加蛋白酶K消化30 min, 酒精逐级脱水固定, 37℃-40℃水浴箱内预杂交2 h, 将TIMP-1和TIMP-2 cDNA探针 95℃ 10 min变性后迅速放入-20℃的冰箱内10 min, 滴加在经过预杂交处理的肝组织切片上, 置37℃水浴箱内过夜, 依次用2×SSC, 1×SSC, 0.2×SSC等洗片, 滴加BuffⅠ缓冲液, 滴加封闭液, 室温20 min, 滴加兔抗地高辛, 37℃、60 min, 滴加生物素化羊抗兔, 37℃, 30 min, 滴加SABC, 37℃, 30 min, DAB显色, 苏木素复染, 酒精脱水, 二甲苯透明, 封片, 镜检. 原位杂交特异性确证实验: 空白对照以预杂交液替代TIMP-1和TIMP-2cDNA探针对阳性肝组织切片进行原位杂交. 阴性对照用TIMP-1和TIMP-2 cDNA探针对10例正常肝组织进行原位杂交试验.
1.3.3 免疫组织化学法和原位杂交法半定量判断指标: 未见阳性细胞(-); 阳性细胞占肝小叶全部肝细胞的1/3以下(+); 1/3-2/3为(++); 2/3以上为(+++).
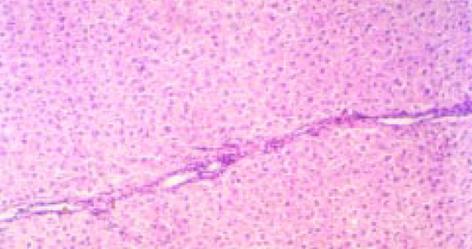
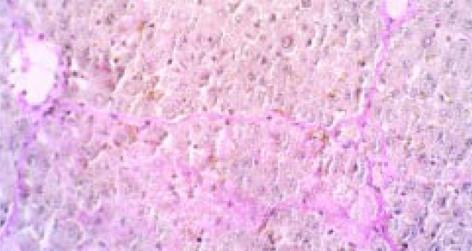
免疫反应休克致死的大鼠肝细胞呈明显空泡样变, 肝细胞变性、坏死明显, 造膜结束后大鼠的肝组织汇管区中可见纤维组织增生且向肝小叶内延伸, 同时, 纤维组织于中央静脉周围增生并与汇管区纤维相连包绕形成假小叶, 但纤维间隔较纤细, 汇管区及中央静脉周围可见炎细胞浸润, 沿界板及其他部位有肝细胞浓染、溶解及小双核细胞(图1). V-G染色 免疫反应致大鼠肝纤维化模型胶原纤维沿汇管区及中央静脉周围向肝小叶内延伸交联成网状结构(图2).
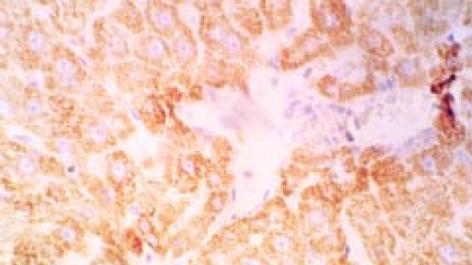
原位杂交检测的阳性信号呈现为棕黄色颗粒状, 分布在肝细胞质内, 未见细胞核着色, 呈散在或弥漫性分布(图3). 8只预防组经治疗3 mo后, TIMP-1 mRNA的表达强度: 弱阳性5/8, 中等阳性2/8, 阴性1/8, TIMP-2mRNA的表达强度弱阳性4/8, 中等阳性1/8, 阴性3/8; 治疗组1经治疗3mo后, TIMP-1 mRNA的表达强度: 弱阳性3/10, 中等阳性6/10, 阴性1/10, TIMP-2mRNA的表达强度弱阳性3/10, 中等阳性5/10, 阴性2/10; 治疗组2经治疗3 mo后, TIMP-1 mRNA的表达强度: 弱阳性2/10, 中等阳性7/10, 阴性1/10, TIMP-2 mRNA的表达强度为弱阳性4/10, 中等阳性4/10, 阴性2/10; 秋水仙碱组经治疗3 mo后, TIMP-1 mRNA的表达强度: 弱阳性1/10 , 中等阳性4/10, 强阳性5/10, TIMP-2mRNA的表达强度: 弱阳性2/10, 中等阳性4/10, 强阳性4/10; 观察组, TIMP-1 mRNA的表达强度中等阳性者5/13 , 强阳性者8/13, TIMP-2mRNA的表达强度中等阳性者6/13, 强阳性者7/13.用预杂交液替代TIMP-1和TIMP-2 cDNA探针杂交后, 结果为阴性; 10例正常肝组织经过TIMP-1和TIMP-2 cDNA探针原位杂交后, 结果为阴性; 上述结果表明, TIMP-1和TIMP-2 cDNA探针原位杂交结果是特异性的.
免疫组化检测的阳性信号呈现为棕黄色颗粒状, 分布在肝细胞质内, 未见细胞核着色, 呈散在或弥漫性分布. 8只预防组经治疗3 mo后, 肝组织中TIMP-1和TIMP-2蛋白表达的阳性率分别为37.5%和62.5%; 治疗组1经治疗3 mo后, 肝组织中TIMP-1和TIMP-2蛋白表达的阳性率分别为90%和80%; 治疗组2经治疗3 mo后, 肝组织中TIMP-1和TIMP-2蛋白表达的阳性率分别为70%和80%; 秋水仙碱组经治疗3 mo后, 肝组织中TIMP-1和TIMP-2蛋白表达的阳性率分别为100%和100%; 观察组, 肝组织中TIMP-1和TIMP-2蛋白表达的阳性率分别为100%和100% . 省略-抗和二抗后阳性信号消失, 分别用兔血清和磷酸盐缓冲液代替第-抗体, 结果是阴性. 实验证实此免疫组织化学检测结果是特异性的
统计学处理 采用秩和检验的Willcoxon法, 各指标之间的相关性采用两因素的相关分析, 当P<0.05时认为有统计学意义.
我们采用人血白蛋白注射所致免疫诱导性大鼠肝纤维化模型, 其病理学显示: 肝脏纤维组织增生向肝小叶内延伸, 形成纤维间隔分隔包绕, 肝纤维化程度多数在Ⅲ-Ⅴ级. 据文献报道此方法所造的免疫诱导性肝纤维化模型持续时间长, 自然恢复时间可达280 d, 我们在此基础上加以改良, 观察肝纤维化病理改变可维持363 d, 仍可见肝组织中少量结缔组织的存在, 免疫诱导性肝纤维化模型持续时间明显长于肝毒性(如CCl4所制模型)诱导所致的肝纤维化模型[20]. 由于人类的慢性乙、丙型肝炎所致的肝纤维化多为免疫性损伤, 因此, 此种方法所造模型更接近于慢性病毒性肝炎所致的肝纤维化, 可以作为评估药物疗效较好的动物模型.
肝纤维化是各种慢性肝病的共同病理基础, 是肝硬化的必经阶段. 肝纤维化是肝细胞损伤后的修复机制, 是可逆转性病变[21,22], -般认为, 肝纤维化的形成过程主要取决于胶原的合成、沉积与降解和吸收的动态平衡, 当胶原合成与沉积大于降解与吸收时则肝内胶原纤维增加, 逐渐形成肝纤维化[23-29]. ECM的降解受-系列酶的催化, 即MMPs, MMPs可特异性地分解ECM, 对胶原的沉积和组织结构的改建起着重要作用, MMP家族至今已有20个成员被克隆和测序, 而肝内发现了8种, 肝纤维化早期, MMPs轻度增高, 而肝纤维化中晚期MMPs活性则明显降低, 以致ECM合成超过降解, 引起ECM大量沉积. 通过调节MMPs活性, 有助于增加基质的降解, 促进肝纤维化的逆转[3], MMP1称为间质胶原酶, 主要降解Ⅰ、Ⅲ、Ⅹ型胶原; MMP-2(即Ⅳ型胶原酶)主要降解Ⅳ, Ⅴ, Ⅶ, Ⅹ型胶原和弹性硬蛋白、纤维连接蛋白以及变性的Ⅰ型胶原, Ⅳ型胶原是构成基底膜的主要成分[30-34]. TIMPs目前发现有4种亚型即TIMP-1、TIMP-2、TIMP-3、TIMP-4, 而肝脏中仅有TIMP-1和TIMP-2二种亚型的存在, 其中TIMP-1主要抑制间质胶原酶即MMP1.近年研究表明, 肝纤维化过程中间质胶原酶活性明显下降, 而TIMP-1持续超常表达则可能是间质胶原酶下降的主要原因[35-40].
我们观察到: 免疫损伤性肝纤维化大鼠在造膜结束后肝组织纤维化程度呈进行性加重之趋势, HE染色、V-G胶原染色均可见纤维组织自汇管区向肝小叶内延伸, 交织成网状, TIMP-1和TIMP-2 mRNA及蛋白呈强阳性表达, 以造膜结束后3 mo为著[20], 这可能是通过TIMP抑制了MMP的活性从而阻止ECM降解导致大鼠肝纤维化的一个诱因, 而经双甲五灵冲剂治疗3 mo后, TIMP-1和TIMP-2 mRNA及蛋白表达与模型组相比均明显降低, 提示双甲五灵冲剂抗肝纤维化作用机制可能是通过抑制TIMPs的表达, 使其对MMP的抑制作用减弱, 有利于MMP对ECM的降解, 从而使得肝纤维化发生逆转, 为中药在基因水平上抑制实验性肝纤维化大鼠提供了有利的科学依据.
祖国医学应用活血化瘀的原理治疗肝硬变取得了较好的效果, 提示某些中药具有抗纤维化作用. 许多中药, 如黄芪、丹参、冬虫夏草、桃仁等, 已在实验性肝纤维化显示具有阻抑或抗纤维化作用, 临床研究证明, 长期应用活血化瘀药物, 可阻抑肝纤维化发展, 甚至使已形成的早期肝硬变逆转[41]. 双甲五灵冲剂是在五灵丸活血化瘀基础上辅以软肝散结之中药而成, 经我科实验室及临床多年研究证实, 五灵丸是-保肝、降酶安全有效之良药, 在此基础上配以软肝散结之中药, 在促进肝细胞恢复的同时, 抗肝纤维化可能通过抑制TIMP-1和TIMP-2 mRNA和蛋白的表达而降低对MMP的抑制, 促进胶原降解从而有利于ECM的降解; 其疗效是预防作用最好, 治疗效果是用药越早越好.
编辑: N/A
| 2. | Okazaki I, Watanabe T, Hozawa S, Niioka M, Arai M, Maruyama K. Reversibility of hepatic fibrosis: from the first report of collagenase in the liver to the possibility of gene therapy for recovery. Keio J Med. 2001;50:58-65. [PubMed] [DOI] |
| 3. | Okazaki I, Watanabe T, Hozawa S, Arai M, Maruyama K. Molecular mechanism of the reversibility of hepatic fibrosis: with special reference to the role of matrix metalloproteinases. J Gastroenterol Hepatol. 2000;15 Suppl:D26-D32. [PubMed] [DOI] |
| 4. | Garcia-Bañuelos J, Siller-Lopez F, Miranda A, Aguilar LK, Aguilar-Cordova E, Armendariz-Borunda J. Cirrhotic rat livers with extensive fibrosis can be safely transduced with clinical-grade adenoviral vectors. Evidence of cirrhosis reversion. Gene Ther. 2002;9:127-134. [PubMed] [DOI] |
| 5. | Murphy FR, Issa R, Zhou X, Ratnarajah S, Nagase H, Arthur MJ, Benyon C, Iredale JP. Inhibition of apoptosis of activated hepatic stellate cells by tissue inhibitor of metalloproteinase-1 is mediated via effects on matrix metalloproteinase inhibition: implications for reversibility of liver fibrosis. J Biol Chem. 2002;277:11069-11076. [PubMed] [DOI] |
| 6. | Murawaki Y, Kawasaki H. [Pathophysiology of hepatic fibrosis]. Nihon Shokakibyo Gakkai Zasshi. 1999;96:1143-1152. [PubMed] |
| 7. | Okazaki I, Watanabe T, Inagaki Y. [Recent advance in understanding mechanisms of fibrogenesis and fibrolysis in hepatic fibrosis]. Nihon Shokakibyo Gakkai Zasshi. 2002;99:353-364. [PubMed] |
| 8. | Valkova M. Hepatic fibrogenesis. Bratisl Lek Listy. 2002;103:76-85. |
| 9. | Gagliano N, Arosio B, Grizzi F, Masson S, Tagliabue J, Dioguardi N, Vergani C, Annoni G. Reduced collagenolytic activity of matrix metalloproteinases and development of liver fibrosis in the aging rat. Mech Ageing Dev. 2002;123:413-425. [PubMed] [DOI] |
| 10. | Schuppan D, Ruehl M, Somasundaram R, Hahn EG. Matrix as a modulator of hepatic fibrogenesis. Semin Liver Dis. 2001;21:351-372. [PubMed] [DOI] |
| 11. | Yang H, Chen Y, Xu R, Shen W, Chen G. Clinical observation on the long-term therapeutic effects of traditional Chinese medicine for treatment of liver fibrosis. J Tradit Chin Med. 2000;20:247-250. [PubMed] |
| 12. | Liu C, Chen W, Liu P, Wang Z, Hu Y, Liu C. [Changes of lipid peroxidation in liver fibrogenesis induced by dimethylnitrosamine and drugs' intervention]. Zhonghua Gan Zang Bing Za Zhi. 2001;9 Suppl:18-20. [PubMed] |
| 13. | Liu P, Hu YY, Liu C, Zhu DY, Xue HM, Xu ZQ, Xu LM, Liu CH, Gu HT, Zhang ZQ. Clinical observation of salvianolic acid B in treatment of liver fibrosis in chronic hepatitis B. World J Gastroenterol. 2002;8:679-685. [PubMed] [DOI] |
| 14. | Chen JC, Tsai CC, Chen LD, Chen HH, Wang WC. Therapeutic effect of gypenoside on chronic liver injury and fibrosis induced by CCl4 in rats. Am J Chin Med. 2000;28:175-185. [PubMed] [DOI] |
| 15. | Huang ZG, Zhai WR, Zhang YE, Zhang XR. Study of heteroserum induced rat liver fibrosis model and its mechanism. World J Gastroenterol. 1998;4:206-209. [DOI] |
| 16. | Yang Q, Yan YC, Gao YX. Inhibitory effect of Quxianruangan Capsulae on l iver fibrosis in rats and chronic hepatitis atients. Shijie Huaren Xiaohua Zazhi. 2001;9:1246-1249. [DOI] |
| 17. | Yao X, Yao XX, Xiu HM, Gao JP, Zhang YZ. Blood-activating and stasis-eliminating Chinese herb concentrated Yigan decoction on hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi. 2002;10:544-548. [DOI] |
| 18. | Xu RY, Ling YB, Wang ZL, Qiu WS, Yang HZ. Therapeutic effect of gan xian fang on liver cirrhosis by hepatitis B. Shijie Huaren Xiaohua Zazhi. 1999;7:866. [DOI] |
| 19. | Sun YF, Tao XX, Jiang SL. Treatment of Chinese medicine in liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:686-687. [DOI] |
| 20. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Cao YZ. Inhibiting effect of antisense oligonucleotides phosphorthioate on gene expression of TIMP-1 in rat liver fibrosis. World J Gastroenterol. 2001;7:363-369. [PubMed] [DOI] |
| 21. | Jiang HQ, Zhang XL. Pathogenesis of liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:687-689. [DOI] |
| 22. | Bai WY, Yao XX, Feng LY. The advance of liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:1267-1268. [DOI] |
| 23. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Bai XG, Cao YZ. Methodologic research on TIMP-1, TIMP-2 detection as a new diagnostic index for hepatic fibrosis and its significance. World J Gastroenterol. 2002;8:282-287. [PubMed] [DOI] |
| 24. | Nie Q, Zhou Y, Xie Y. [Expression and significance of tissue inhibitors of metallproteinases-1 and -2 in serum and liver tissue of patients with liver cirrhosis]. Zhonghua Yi Xue Za Zhi. 2001;81:805-807. [PubMed] |
| 25. | Lamireau T, Desmoulière A, Bioulac-Sage P, Rosenbaum J. [Mechanisms of hepatic fibrogenesis]. Arch Pediatr. 2002;9:392-405. [PubMed] [DOI] |
| 26. | Housset C, Guéchot J. [Hepatic fibrosis: physiopathology and biological diagnosis]. Pathol Biol (Paris). 1999;47:886-894. [PubMed] |
| 27. | Szántová M, Kupcová V. [Biochemical markers of fibrogenesis in liver diseases]. Bratisl Lek Listy. 1999;100:28-35. [PubMed] |
| 28. | Valkova M. Hepatic fibrogenesis. Bratisl Lek Listy. 2002;103:76-85. [PubMed] |
| 29. | Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis. 2001;5:315-334, v-vi. [PubMed] [DOI] |
| 30. | Schuppan D, Ruehl M, Somasundaram R, Hahn EG. Matrix as a modulator of hepatic fibrogenesis. Semin Liver Dis. 2001;21:351-372. |
| 31. | Benyon RC, Arthur MJ. Extracellular matrix degradation and the role of hepatic stellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] [DOI] |
| 32. | Kossakowska AE, Edwards DR, Lee SS, Urbanski LS, Stabbler AL, Zhang CL, Phillips BW, Zhang Y, Urbanski SJ. Altered balance between matrix metalloproteinases and their inhibitors in experimental biliary fibrosis. Am J Pathol. 1998;153:1895-1902. [PubMed] [DOI] |
| 33. | Wang Y, Gao Y, Yang JZ. Expression of interstitial collagenase in rats with experimental liver fibrosis. Shijie Huaren Xiaohua Zazhi. 1999;7:1004-1006. [DOI] |
| 34. | Gao Y, Wang Y, Yang JZ, Huang YQ. Dynamic expression of matrix metalloproteinases-2 in rats with experimental liver fibrosis. Shijie Huaren Xiaohua Zazhi. 1999;7:1003-1004. [DOI] |
| 35. | Yoshiji H, Kuriyama S, Miyamoto Y, Thorgeirsson UP, Gomez DE, Kawata M, Yoshii J, Ikenaka Y, Noguchi R, Tsujinoue H. Tissue inhibitor of metalloproteinases-1 promotes liver fibrosis development in a transgenic mouse model. Hepatology. 2000;32:1248-1254. |
| 36. | Knittel T, Mehde M, Grundmann A, Saile B, Scharf JG, Ramadori G. Expression of matrix metalloproteinases and their inhibitors during hepatic tissue repair in the rat. Histochem Cell Biol. 2000;113:443-453. [PubMed] |
| 37. | Xie YM, Nie QH, Zhou YX, Cheng YQ, Kang WZ. Detection of TIMP-1 and TIMP-2 RNA expressions in cirrhotic liver tissue of patients using digoxigenin labelled probe by in situ hybridization. Shijie Huaren Xiaohua Zazhi. 2001;9:251-254. [DOI] |
| 38. | Wang A, Yang X, Wang W, Zuo F, Wang Q, He F. [Effect of recombinant human augmenter of liver regeneration on gene expression of tissue inhibitor of metalloproteinase-1 in rat with experimental liver fibrosis]. Zhonghua Yi Xue Za Zhi. 2002;82:610-612. [PubMed] |
| 39. | Yoshiji H, Kuriyama S, Miyamoto Y, Thorgeirsson UP, Gomez DE, Kawata M, Yoshii J, Ikenaka Y, Noguchi R, Tsujinoue H. Tissue inhibitor of metalloproteinases-1 promotes liver fibrosis development in a transgenic mouse model. Hepatology. 2000;32:1248-1254. [PubMed] [DOI] |
| 40. | McCrudden R, Iredale JP. Liver fibrosis, the hepatic stellate cell and tissue inhibitors of metalloproteinases. Histol Histopathol. 2000;15:1159-1168. [PubMed] |
| 41. | Huang YQ, Gao Y, Yang JZ, Fang SG, Wang Y. Expression of matrix metalloproteinase and its tissue inhibitor. Shijie Huaren Xiaohua Zazhi. 1999;7:795-796. [DOI] |