修回日期: 2002-11-02
接受日期: 2002-11-19
在线出版日期: 2003-02-15
目的: 探讨肝靶向十六酸拉咪呋啶酯固体脂质纳米粒抗HBV的作用.
方法: 以半乳糖苷为载体, 构建十六酸拉咪呋啶酯固体脂质纳米粒(PLN-LAGS), 将其靶向导入2.2.15细胞, 共同温育10 d 后, 观察对细胞的毒性作用; 同时将LAP-GSLN尾静脉注入小鼠体内, RP-HPLC测定拉米呋定(lamivudine, LA)在血清、肝、肾、肺及脾中的分布, 用ELISA和荧光定量PCR检测多个时期培养上清中HBsAg, HBeAg和HBV DNA.
结果: LAP-GSLN在肝脏中具有靶向性, LAP-GSLN组肝脏的含药量为LA组的3.3倍; 导向后4 d出现对HBV-DNA的抑制, 在药物浓度10.0 mg/L时 LAP-GSLN组 HBV DNA <1.11×107拷贝/L, 而单纯LA组则为5.06×109拷贝/L; 6 d出现对HBsAg, HBeAg抑制, 在药物浓度0.01mg/L时, LAP-GSLN, LA组对HBsAg, HBeAg抑制率分别为52.9%, 53.9%; 32.2%, 31.1%; 在药物浓度10.0 mg/L时, LAP-GSLN, LA组对HBsAg, HBeAg抑制率分别为67.2%, 69.0%; 45.1%, 41.0%. 未发现对2.2.15细胞的毒性作用.
结论: 小剂量半乳糖介导十六酸拉米呋定脂质纳米粒能快速有效的抑制HBV抗原表达和DNA复制.
引文著录: 王九平, 白雪帆, 张三奇, 李谨革, 张颖, 张岩, 薛克昌, 顾宜, 王平忠, 骆抗先. 肝靶向十六酸拉咪呋啶酯固体脂质纳米粒抗乙肝病毒的研究. 世界华人消化杂志 2003; 11(2): 191-194
Revised: November 2, 2002
Accepted: November 19, 2002
Published online: February 15, 2003
AIM: To investigate the anti-HBV effect of targeted lamivudy palmitate solid lipid Nano-particles (LAP-SLN).
METHODS: The nano-particles modified by galactosides (LAP-GSLN) were prepared and delivered into 2.2.15 cells. HBsAg, HBeAg and HBVDNA of 2.2.15 cells were detected by ELISA and hepatitis B virus fluorescence polymerase chain reaction (PCR). The cytotoxicity of targeted LAP-GSLN on 2.2.15 cells were observed. Fifteen male mice (2 months old) were randomly divided into 3 groups: LAP-SLN group, LAP-GSLN group and LA group. Levels of lamivudine in serum, liver, kidney, lung and spleen tissue were detected by reversed-phase high performance liquid chromatography (RP-HPLC).
RESULTS: LAP-GSLN could be targeted to the liver. Liver LAP-GSLN content in LAP-GSLN group was 3.3 times of that in the LA group. HBV DNA was inhibited on the 4th day. HBV DNA in LAP-GSLN group and LA group with concentration of lamivudine at 10 mg/L was less than 1.11×107 /L and 5.06×109/L, respectively. Inhibition of HBsAg and HBeAg showed on the 6th day, the inhibition rate of LAP-GSLN on HBsAg and HBeAg with concentration of lamivudine at 0.01 mg/L was 52.9%, 53.9%, respectively; while the inhibition rate of LA on HBsAg and HBeAg was 32.2%, 31.1%, respectively. When the concentration of lamivudine was 10 mg/L, the inhibition rate of LAP-GSLN on HBsAg and HBeAg was 67.2%, 69.0%, respectively; while the inhibition rate of LA on HBsAg and HBeAg was 45.1%, 41.0%, respectively. No cytotoxic effect on 2.2.15 cells was found.
CONCLUSION: LAP-GSLN can target liver effectively in vivo and inhibit HBV expression and DNA replication.
- Citation: Wang JP, Bai XF, Zhang SQ, Li JG, Zhang Y, Zhang Y, Xue KC, Gu Y, Wang PZ, Luo KX. Anti-HBV effect of targeted lamivudy palmitate solid lipid nano-particles. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 191-194
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/191.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.191
近年来国内外有关使用核苷类药物治疗乙型肝炎业已取得了初步疗效, 特别是近来拉咪呋啶(lamivudine, LA)的临床应用[1-6], 证实其对乙肝病毒有效, 但疗效尚不理想[5]. 主要是由于乙肝病毒核心抗原存在于肝细胞内, 核苷类药物须进入肝细胞, 并经胸腺嘧啶核苷激酶催化三磷酸后方显效. 而核苷类药物不易透过肝细胞, 且乙肝病毒感染的细胞缺少胸腺嘧啶核苷激酶, 宿主细胞磷酸化作用缓慢, 达不到抑制病毒复制的有效浓度. 许多研究表明[13,14], 靶向给药不仅可使给药量约80%的药物浓集于肝脏, 而且可迅速进入肝细胞, 为了提高拉米夫啶的疗效, 我们研制半乳糖苷介导的十六酸拉咪呋啶脂质纳米粒, 并证实了肝靶向性和对乙肝病毒抗原(HBV)表达和HBV-DNA复制的抑制作用.
拉咪呋啶(英国葛兰素); 十六酸(分析纯、天津市化学试剂二厂); 卵磷脂(美国Sigma公司); D-半乳糖(上海试剂二厂); (2-C2-C2-羟基乙基)-r-十二烷基醚(MOA)(江苏海安石油化工厂, 经柱层析纯化); 其他药品和试剂均为分析纯. HepG22.2.15细胞为Hep G2肝癌细胞转染HBV后能表达HBsAg, HBeAg, HBV DNA及Dane颗粒等的细胞, 购于北京医科大学. DMEM粉、胎牛血清为美国Gibco, G418(Geneticin)为美国Sigma公司. MTT为德国Boehringer公司产品. 昆明种小鼠, 体质量19-21 g, 雌雄各半(第四军医大学实验动物中心).
合成十六酸拉咪呋啶酯(lamivudinyl palmitate, LAP): 用拉咪呋啶1.29 g, 十六酸1.55 g, 二环已基碳二亚胺(DCC)1.50 g, 4-二甲氨基吡啶(DMAP)置于100 mL干燥的二氯甲烷中, 室温反应12 h, 抽滤浓缩, 硅胶柱层分析(氯仿40: 1), 得白色粉末. 合成半乳糖苷Galβ1-(CH2CH2O)3-C12H25(GMOA): 用四乙酰溴代半乳糖2.17 g, MOA1.25 g, AgCO3 1.05 g, 置于30 mL氯仿中, 室温避光搅拌16 h, 过滤浓缩, 加入200 moL/L CH3ONa的甲醇溶液20 mL, 搅拌0.5 h. 加入浓盐酸1滴. 浓缩, 硅酸柱层析纯化(氯仿-甲醇30: 1)得无色膏状物1.35 g. 制备半乳糖脂质纳米粒十六酸拉咪呋啶lamivudiny palmitate-solid lipid nanoparticles modified by galactoside, LAP-GSLN). LAP-SLN处方: LAP 11.3 mg, 卵磷脂100 mg; LAP-GSLN处方: LAP 11.3 mg, 卵磷脂95 mg, GMOA5 mg. 精密称取处方量物质于100 mL园底烧瓶中, 加入氯仿15 mL溶解. 旋转蒸发除去氯仿, 在烧瓶壁上形成-层薄膜, 加入60 g/L甘露醇水溶液10 mL, 水溶液超声2次, 1 min/次, 无菌过滤装于安瓿中放入冰箱待用. HepG22.2.15细胞培养按文献[7]等方法进行. 在HepG22.2.15 细胞长满培养瓶后转种于24孔板, 每孔1 mL, 密度1×108个细胞/L, 第2天加入不同浓度的药物, 留-不加药为对照孔, 每2 d换液1次, 仍加入原浓度的药物, 10 d终止试验. 收集各孔培养上清液测定HBsAg, HBeAg和HBV DNA. 每种药物浓度均加3孔, 取3孔之平均值.
1.2.1 十六酸拉咪呋啶酯固体脂质纳米粒对细胞内HBV的抑制: ELSIA检测 HBsAg, HBeAg: 按试剂盒说明书操作, 测定每孔吸光度(A)值, 换算成P/N值(X), 计算抑制率. 抑制率计算公式为抑制率 = (对照组X-实验组X)÷(对照组X-2.1)×100%. 无效: 抑制率<30%, 轻度抑制 = 30%-50%, 明显抑制>50%. HBV-DNA检测: 采用Hepatitis B virus fluorescence polymerase chain reaction(PCR)定量方法. 试剂由广州中山大学达安基因诊断公司提供. 不对称引物P1 5'ATCCTGCTGCTATGCCTCATCTT 23'3 bp; P2 5'ACAGTGGGGGAAAGCCCTACGAA3'23 bp; 信号引物为: 5'TGGCTAGTTTACTAGTGCCATTTTG3'25 bp. 按操作说明常规碱基解法从血清中提取HBV-DNA, 不对称扩增, 取提上清液5 μL, 加不对称扩增反应混合液10 μL(含不对称扩增引物P1, P2, dNTP, Taq酶及PCR缓冲液), 先预变性93℃ 120 s, 然后93℃ 45 s, 55℃ 60 s 10个循环, 再按93℃ 30 s, 55℃ 45 s做30循环; 使用PE 5 700荧光DNA检测仪(美国Perkin Elmer公司), 并依据纯化HBV-DNA建立直线回归方程, ASAP专用软件自动分析, 读出HBV-DNA模板数.
1.2.2 细胞毒性及肝脏靶向性观察: 按上述HepG22.2.15 细胞方法培养, 也加入不同浓度的靶向药物, 每个浓度设3孔, 设空孔对照, 继续培养6 d后观察结果. 取健康昆明种♂幼鼠15只, 体质4 g±1 g, 随机分3组, 分别于LAP-SLN组, LAP-GSLN组和LA组, 小鼠禁食12 h后尾静脉给药. 给药后30 min时小鼠眼眶取血, 处死后取出肝、肾、肺、脾加二倍水制自匀浆. 取血清或匀浆0.1 mL, 加入甲醇0.5 mL, 离心10 min(14 000 g), 上清液20 mL进样, 用反相高效液相色谱(reversed-phase high performance liquid chromatography, RP-HPLC)测定LA含量.
2.2.15细胞分泌HBsAg和HBeAg LAP、LAP-SLN及LAP-GSLN对2.2.15细胞分泌HBsAg和HBeAg均有抑制作用, 抑制作用的大小随着药物作用延长而增大, LAP-SLN、LAP-GSLN组在 6 d时对HBsAg, HBeAg呈现明显抑制作用, 而LA组在 8 d后, 1.0mg/L以上的浓度才有明显的抑制作用表1.
| 药名 | 浓度mg/L | 1 d | 2 d | 4 d | 6 d | 8 d | 10 d |
| LAP-SLN | 0.01 | 12.2(17.4) | 20.1(25.8) | 29.8(30.3) | 45.9(43.2) | 55.1(52.1) | 64.2(60.3) |
| 0.10 | 20.6(21.2) | 28.4(30.2) | 31.9(32.5) | 54.2(52.4) | 59.8(50.3) | 66.3(59.3) | |
| 1.00 | 23.4(23.6) | 32.0(32.5) | 39.9(40.3) | 53.3(51.4) | 64.9(55.2) | 70.2(55.2) | |
| 10.00 | 28.9(27.4) | 19.9(21.1) | 30.9(33.0) | 60.1(51.9) | 62.8(67.7) | 65.5(59.0) | |
| LAP-GSLN | 0.01 | 15.2(17.0) | 19.9(21.2) | 30.9(33.0) | 52.5(53.9) | 62.8(67.7) | 65.5(59.0) |
| 0.10 | 21.9(22.3) | 30.3(33.4) | 37.2(38.2) | 60.2(59.1) | 71.4(77.5) | 70.2(70.9) | |
| 1.00 | 28.7(29.0) | 36.9(40.3) | 44.7(45.3) | 60.4(54.3) | 71.3(69.2) | 71.9(68.4) | |
| 10.00 | 30.1(32.3) | 35.3(41.2) | 60.5(61.2) | 67.2(69.0) | 72.4(51.9) | 74.2(67.7) | |
| LA | 0.01 | 10.2(15.4) | 15.8(11.5) | 26.2(27.3) | 30.2(31.1) | 45.2(44.3) | 60.9(61.2) |
| 0.10 | 17.2(19.3) | 20.9(21.0) | 33.3(35.4) | 33.5(36.6) | 49.8(55.5) | 61.8(59.2) | |
| 1.00 | 20.3(21.6) | 29.8(29.6) | 40.1(39.2) | 42.7(41.2) | 56.2(40.2) | 59.6(60.3) | |
| 10.00 | 25.1(26.9) | 27.9(30.2) | 40.9(40.3) | 45.1(41.0) | 53.4(49.8) | 60.3(64.0) |
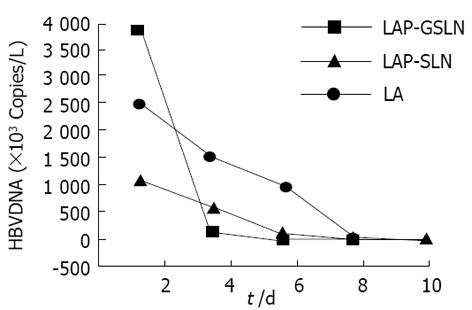
LA、LAP-SLN及LAP-GSLN对HepG22.2.15细胞HBV DNA的抑制作用(图1), 在HepG22.2.15细胞培养中, LA组细胞外HBV DNA(培养上清液中)随着培养时间的延长, HBV DNA含量缓慢的下降, 到第8 天时, HBV DNA含量降至正常. LAP-SLN组在第6天 HBV DNA含量接近正常, LAP-GSLN组的HBV DNA含量下降很快, 在第4天 HBV DNA含量达到正常. 结果表明: LA、LAP-SLN及LAP-GSLN 对HepG22.2.15细胞HBV DNA有抑制作用, 但LAP-SLN及LAP-GSLN较LA作用迅速, 尤以LAP-GSLN组明显.
实验组与对照组比较均未见细胞生长、形态和活细胞计数有明显改变. 各脏器含量分布及各脏器药物含量占总药量的百分比见表2, 利用SPSS软件对3次肝脏药物含量数据进行方差分析, 证明LAP-SLN和LAP-GSLN在肝脏中都有靶向性, 且LAP-GSLN强于LAP-SLN(P<0.01). LAP-GSLN组肝脏的含药量为LA组的3.3倍, 是LAP-SLN组的2.0倍. LAP-SLN组肝脏的含量为LA组的1.7倍, 进一步证明LAP-SLN和LAP-GSLN在肝脏中有靶向性, 且LAP-GLSN LAP-SLN.
| 药物 | 血清 | 肝脏 | 肾脏 | 肺脏 | 脾脏 |
| LA | 40.0 | 39.4 | 12.8 | 6.4 | 1.4 |
| LAP-SLN | 25.2 | 52.1 | 12.7 | 7.3 | 2.7 |
| LAP-GLSN | 11.4 | 77.4 | 5.2 | 3.6 | 2.4 |
拉咪呋啶作为一种新的抗HBV药物[8-11], 其疗效已取得到公认, 且无毒性, 不良反应轻微, 可口服, 有望成为干扰素以外新的另一治疗选择. 然而, 拉咪呋啶的作用只能阻断HBV复制过程中的中间环节, 但不能清除肝细胞内及肝外组织细胞中HBV的复制源cccDNA, 同时对整合入宿主细胞基因的HBV-DNA亦无能为力. 对肝细胞内病毒状态似无影响, 停药后易复发[2,14-15]. 因此寻找一条小剂量, 快速持续在肝细胞内HBV-DNA势在必然. 固体脂质纳米粒(solid lipid nanoparticles, SLN)是近年正在发展的一种新型毫微粒类给药系统[12,13,16-25], 以类脂为载体, 将药物包裹于类脂核中制成酸态给药体. 进入机体后, 很快被网状内皮系统吞噬而被动进入肝脾, 达到肝靶向作用. SLN主要适用于包封亲脂性药物, LA的脂溶性, 故将其酶化制成十六酸拉咪呋啶酯(LAP), 增加脂溶性. 肝细胞膜上有半乳糖受体(ASGP-R), [23]交联物与受体结合后, 通过细胞的吞噬作用进入肝细胞, 随后到达溶酶体. 由于溶酶体PH较低, 交联物与载体分离, 在肝细胞中发挥药效.
HepG22.2.15细胞是转染了 HBV-DNA序列的肝癌细胞, 能长期稳定地产生HBV-DNA颗粒, 其表面存在ASGP-R[7]. LA对 HepG22.2.15细胞HBV-DNA具有抑制作用. 本文以HepG22.2.15细胞为靶细胞, 以半乳糖苷修饰十六酸拉咪呋啶酯固体质纳米粒治疗手段, 将LA直接运载至肝脏, 观察肝细胞内抗乙型肝炎病毒作用. 结果观察到 LAP-GSLN 4d对HBV-DNA复制有明显抑制, 6 d对HBeAg, HBsAg有明显抑制作用, 而单纯LA需8 d后只有> 1.0 mg/L才对HBV-DNA和HBV抗原表达有明显抑制作用. 且LAP-SLN, LAP-GSLN和单用LA无论是对HBV的HBsAg、HBeAg和HBV-DNA的抑制还是对HepG22.2.15细胞的存活率的影响均相似. 本结果显示, 靶向的LA只需短暂作用于细胞, 即可对病毒抗原分泌和DNA复制产生有效的抑制作用. 半乳糖修饰的LAP-SLN可以迅速、完全地进入HepG22.2.15细胞, 使细胞内的LA增多发挥更高的抗病毒效应. 这-结果与多位学者采用半乳糖修饰后的抗乙肝病毒药物疗效提高作用相似[22-25].
研究结果还表明, LAP-SLN和LAP-GSLN对小鼠肝组织有明显的选择亲和力, 这种靶向能将LA定向的转入肝细胞, 且LAP-GSLN与肝细胞膜上的ASGP-R迅速结合, 故LAP-GSLN靶向性作用强于LAP-SLN, 这对提高药物疗效, 减少用量, 有-定意义.
编辑: N/A
| 1. | Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, Brown N, Condreay LD. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Lamivudine Clinical Investigation Group. Hepatology. 1998;27:1670-1677. [PubMed] [DOI] |
| 2. | Lai CL, Ching CK, Tung AK, Li E, Young J, Hill A, Wong BC, Dent J, Wu PC. Lamivudine is effective in suppressing hepatitis B virus DNA in Chinese hepatitis B surface antigen carriers: a placebo-controlled trial. Hepatology. 1997;25:241-244. [PubMed] [DOI] |
| 3. | Nevens F, Main J, Honkoop P, Tyrrell DL, Barber J, Sullivan MT, Fevery J, De Man RA, Thomas HC. Lamivudine therapy for chronic hepatitis B: a six-month randomized dose-ranging study. Gastroenterology. 1997;113:1258-1263. [PubMed] [DOI] |
| 4. | Mutimer D, Naoumov N, Honkoop P, Marinos G, Ahmed M, de Man R, McPhillips P, Johnson M, Williams R, Elias E. Combination alpha-interferon and lamivudine therapy for alpha-interferon-resistant chronic hepatitis B infection: results of a pilot study. J Hepatol. 1998;28:923-929. [PubMed] [DOI] |
| 5. | Mason WS, Cullen J, Moraleda G, Saputelli J, Aldrich CE, Miller DS, Tennant B, Frick L, Averett D, Condreay LD. Lamivudine therapy of WHV-infected woodchucks. Virology. 1998;245:18-32. [PubMed] [DOI] |
| 6. | Wu GY, Wu CH. Specific inhibition of hepatitis B viral gene expression in vitro by targeted antisense oligonucleotides. J Biol Chem. 1992;267:12436-12439. [PubMed] |
| 7. | Wu GY, Wu CH. Receptor-mediated in vitro gene transformation by a soluble DNA carrier system. J Biol Chem. 1987;262:4429-4432. [PubMed] |
| 8. | Lai CL, Chien RN, Leung NW, Chang TT, Guan R, Tai DI, Ng KY, Wu PC, Dent JC, Barber J. A one-year trial of lamivudine for chronic hepatitis B. Asia Hepatitis Lamivudine Study Group. N Engl J Med. 1998;339:61-68. [PubMed] [DOI] |
| 10. | Tassopoulos NC, Volpes R, Pastore G, Heathcote J, Buti M, Goldin RD, Hawley S, Barber J, Condreay L, Gray DF. Efficacy of lamivudine in patients with hepatitis B e antigen-negative/hepatitis B virus DNA-positive (precore mutant) chronic hepatitis B. Lamivudine Precore Mutant Study Group. Hepatology. 1999;29:889-896. [PubMed] [DOI] |
| 11. | Buti M, Cotrina M, Cruz de Castro E, Jardí R, Rodríguez F, Esteban R, Guardia J. [One year treatment with lamivudine in different hepatitis B virus related hepatic diseases]. Gastroenterol Hepatol. 1999;22:117-121. [PubMed] |
| 14. | Sokal EM, Roberts EA, Mieli-Vergani G, McPhillips P, Johnson M, Barber J, Dallow N, Boxall E, Kelly D. A dose ranging study of the pharmacokinetics, safety, and preliminary efficacy of lamivudine in children and adolescents with chronic hepatitis B. Antimicrob Agents Chemother. 2000;44:590-597. [PubMed] [DOI] |
| 15. | Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z, Crowther L, Condreay LD, Woessner M, Rubin M. Lamivudine as initial treatment for chronic hepatitis B in the United States. N Engl J Med. 1999;341:1256-1263. [PubMed] [DOI] |
| 16. | Moynihan JS, Jones DH, Farrar GH, Howard CR. A novel microencapsulated peptide vaccine against hepatitis B. Vaccine. 2001;19:3292-3300. [PubMed] [DOI] |
| 17. | Moynihan JS, D'Mello FI, Howard CR. 48-mer synthetic peptide analogue of the hepatitis B virus "a" determinant induces an anti-HBs antibody response after a single injection. J Med Virol. 2000;62:159-166. [PubMed] [DOI] |
| 18. | Aguado MT. Future approaches to vaccine development: single-dose vaccines using controlled-release delivery systems. Vaccine. 1993;11:596-597. [PubMed] [DOI] |
| 19. | 柳 钟勋. 新型免疫佐剂在疫苗中的应用. 中华微生物学和免疫学杂志. 1997;17:337-341. |
| 21. | Hashida M, Nishedawa M, Tadakura Y. Hepatic targeting of drugs and proteins by chemical modification. J Controll Rel. 1995;36:99-107. [DOI] |
| 22. | Nishikawa M, Kamijo A, Fujita T, Takakura Y, Sezaki H, Hashida M. Synthesis and pharmacokinetics of a new liver-specific carrier, glycosylated carboxymethyl-dextran, and its application to drug targeting. Pharm Res. 1993;10:1253-1261. [PubMed] [DOI] |
| 24. | Torrani Cerenzia M, Fiume L, De Bernardi Venon W, Lavezzo B, Brunetto MR, Ponzetto A, Di Stefano G, Busi C, Mattioli A, Gervasi GB. Adenine arabinoside monophosphate coupled to lactosaminated human albumin administered for 4 weeks in patients with chronic type B hepatitis decreased viremia without producing significant side effects. Hepatology. 1996;23:657-661. [PubMed] [DOI] |