修回日期: 2002-12-30
接受日期: 2003-01-08
在线出版日期: 2003-11-15
探讨胆管癌组织中P53与血管内皮生长因子(VEGF)表达和血管生成的关系.
应用免疫组织化学技术对48例胆管癌组织P53、VEGF表达和肿瘤组织微血管密度(MVD)检测.
MVD和VEGF的表达与胆管癌分化程度(73±12, 87%; 44±17, 39%; P<0.01), 有无淋巴或远处转移(89%, 70±11; 16%, 39±15; P<0.01)和TNM分期(29%, 44±17; 82%, 78±19; P<0.05)密切相关. P53和VEGF均阳性的胆管癌组织MVD明显高于二者均阴性者(72±12, 34±17; P<0.01).
胆管癌组织突变的P53上调VEGF的表达, 促进血管生成, 进而影响胆管癌的进展.
引文著录: 陈勇军, 俞亚红, 丁志强. 胆管癌组织P53和血管内皮生长因子表达与血管生成的相关性研究. 世界华人消化杂志 2003; 11(11): 1827-1830
Revised: December 30, 2002
Accepted: January 8, 2003
Published online: November 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1827-1830
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1827
恶性实体肿瘤的生长需要新的微血管生成[1], 新生的血管不仅提供肿瘤循环, 并增加了转移概率, 故微血管密度(microvaslular density, MVD)在许多原发肿瘤中已被作为判定生物学侵袭性和转移潜能的指标, 是独立的临床预后性指标[2]; 血管内皮生长因子(vascular endothelial growth factor, VEGF)是肿瘤血管形成最重要的调控因子, 其自身又受到P53的调控[3]; 最近的研究表明, 突变型P53的表达与恶性肿瘤的生物学行为密切相关[4]. 我们应用免疫组织化学染色法研究胆管癌组织MVD、VEGF和P53的表达对胆管癌预后和进展的影响, 以及P53和VEGF与血管生成的关系.
同济医院1998-01/2001-12手术切除胆管癌标本48例, 全部标本均经病理证实. 男28例, 女20例, 年龄21-78岁, 平均56岁; 上段胆管癌30例, 中段10例, 下段8例; 高分化23例, 中分化10例, 低分化15例; 管样腺癌36例, 乳头状腺癌8例, 黏液腺癌和鳞癌各2例; TNM分期, I-II期20例, III- IV期28例; 发生淋巴或远处转移者29例, 未发生转移者19例.
选择肿瘤边缘的肿瘤组织石蜡块, 进行5 μm的连续切片, 按SP试剂盒说明进行免疫组织化学染色, 特异性一抗是鼠抗人P53单克隆抗体(DO-7 DaKo, 工作浓度为1: 50), 兔抗人VEGF多克隆抗体(147. Santa Crux, 工作浓度的1:50)和鼠抗人VII因子单克隆抗体(DaKo公司, 工作浓度为1:40)(均购自北京中山生物技术公司), 10例胆总管囊肿标本作对照组.
MVD计数按照Weidner et al [5]的方法: 计数时在放大100倍视野下, 随机选择3个新生血管最密切区, 再在200倍视野下计数, 取其均数, 即为新生血管数; VEGF结果按Miyake et al [6]的判定标准, 每张切片中看到有大于5%的肿瘤细胞胞质或胞膜染色阳性, 即判定为VEGF阳性; P53结果按Silvestrini et al [7]的判定标准: 以阳性细胞超过全部细胞的10%为阳性.
统计学处理 MVD, VEGF和P53相互之间以及他们与临床病理因素的关系根据不同情况采用方差分析, t检验和X2检验. P<0.05为差异有显著意义.
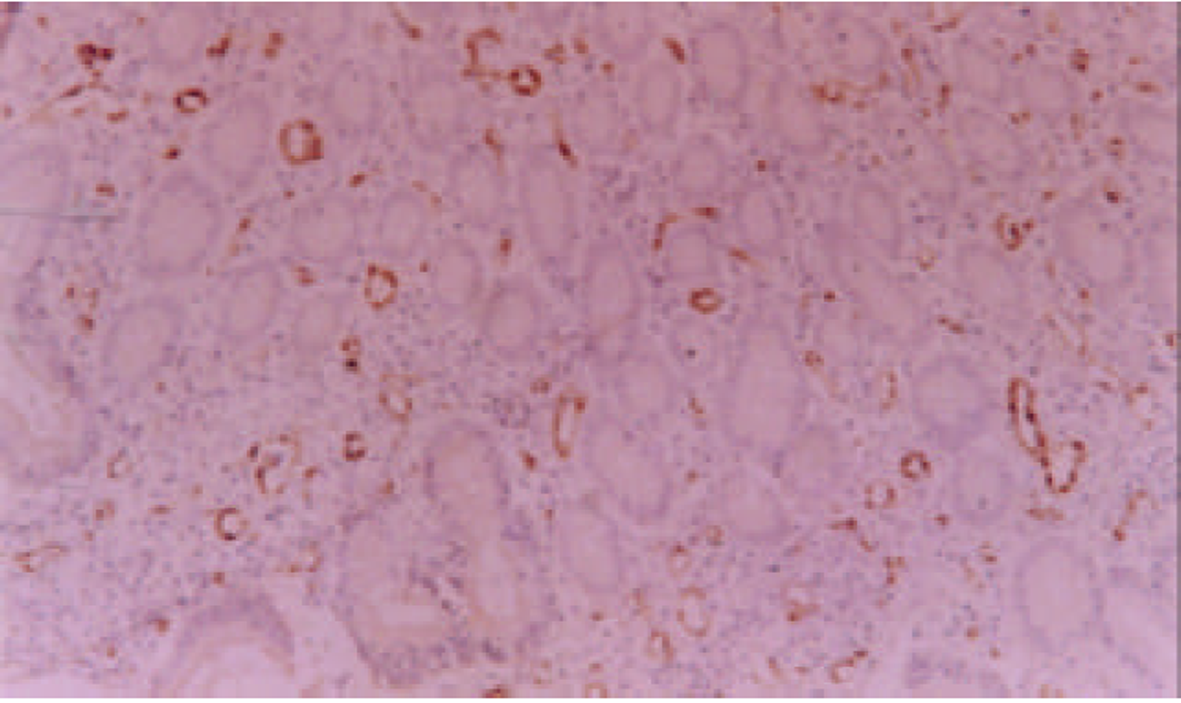
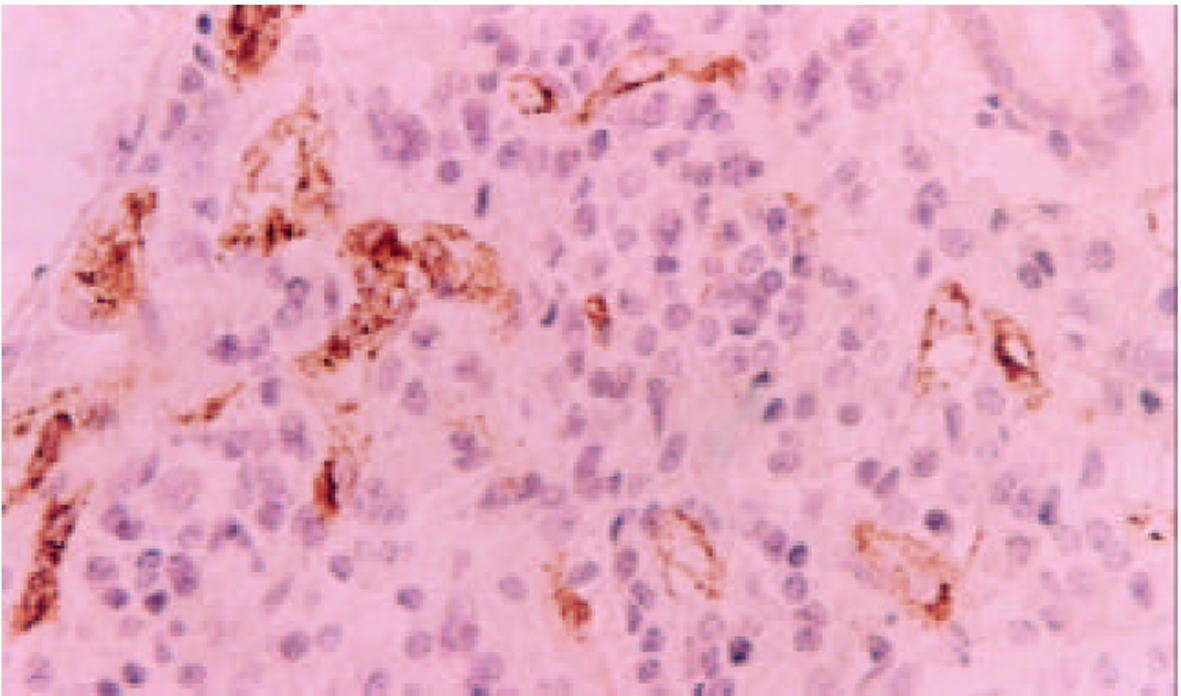
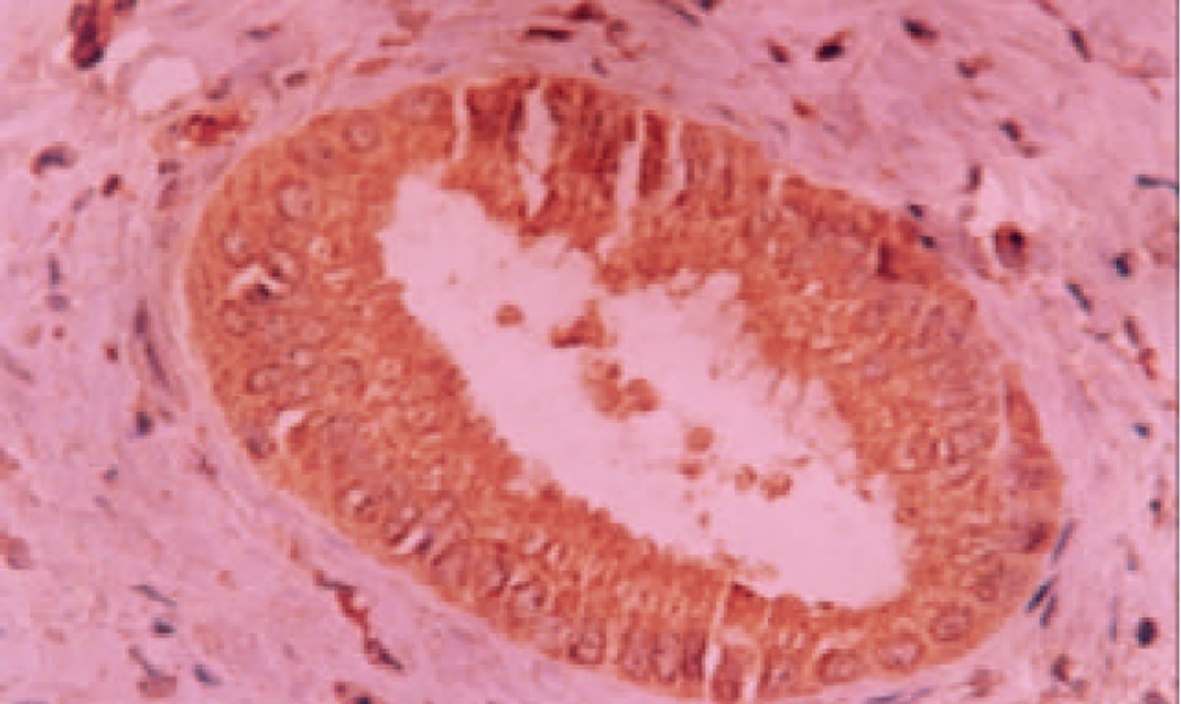
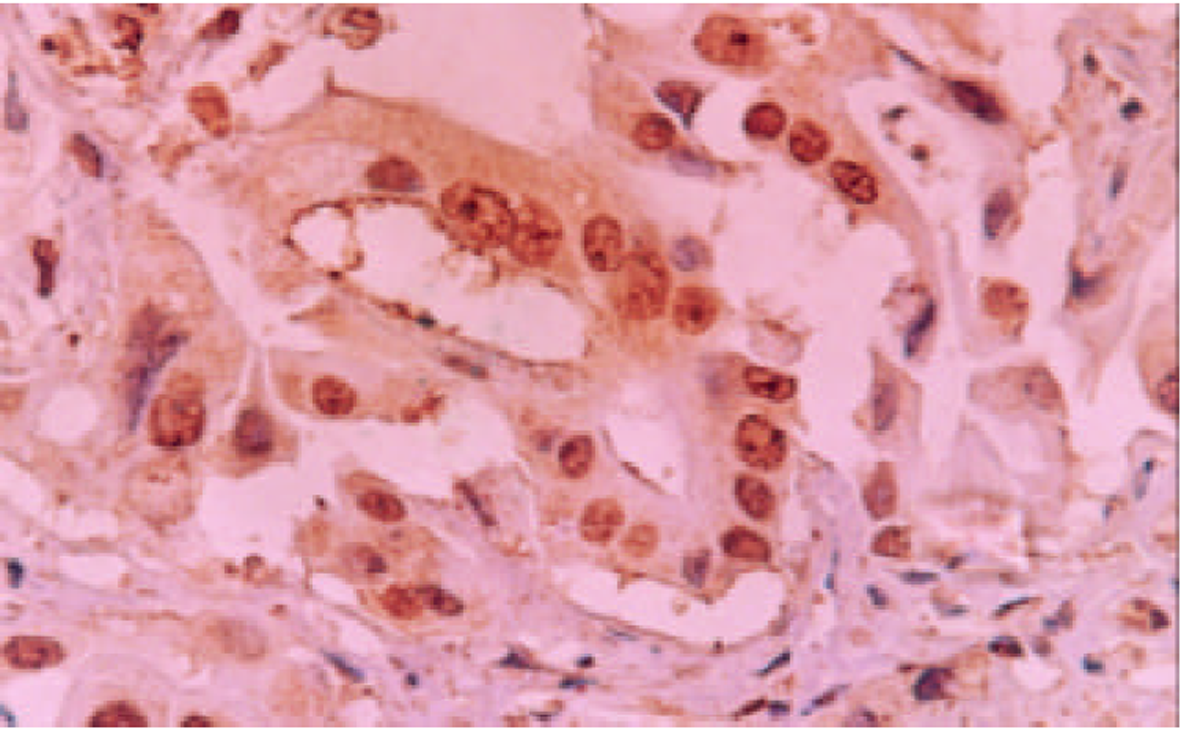
VIII因子单克隆抗体染色, 见新生的微血管在癌组织中分布呈异质性, 不同区域MVD不同, 高密度区主要在肿瘤组织与周围组织交界的浸润缘, 低倍镜下可见血管外形, 高倍镜下主要为染成棕黄色或棕褐色的内皮细胞或内皮细胞簇因(图1, 图2). 计数时只计分布在癌组织中的MV, 本组病例MVD的范围在21-87, 平均为58; VEGF主要定位于胆管癌细胞的胞质和胞膜, 呈棕黄色或棕褐色, 强阳性者为褐黑色颗粒(图3), 本组胆管癌病例中, 有29例阳性, 阳性表达为60.43%. P53表达于部分胆管癌细胞的胞核中, 亦表现为棕黄色或棕褐色颗粒(图4), 有31例表达阳性, 阳性表达率为64.58%.
表达与临床病理因素的关系 MVD与胆管癌的分化程度, 淋巴或远处转移和TNM分期密切相关(F =18.50, P<0.01; t =-7.9 452, P<0.01; t =2.9 654, P<0.05), 将全部病例的MVD以58分界值分为高MVD组和低MVD组, 结果显示出MVD与以上临床病理因素有密切相关性, 而与性别, 年龄, 肿瘤的部位, 病理类型无明显相关性(t =0.9 738, 0.4837, P >0.05; F = 0.11, 0.13, P>0.05); VEGF的表达与临床病理因素的相关性同MVD(x2=14.232, P = 0.001; x2= 10.18, 4.479, P<0.05); P53的表明与胆管癌的分化程度, 淋巴结或远处转移以及TNM分期不同的病例中差异不显著(x2 = 4.794, 0.113, 0.2 142, P>0.05)(表1).
| 临床预后性指标 | n | P53阳性 | P | VEGF阳性 | P | MVD | P | ||
| n | 百分比(%) | n | 百分比(%) | ||||||
| 性别 | |||||||||
| 男 | 28 | 20 | 71 | x2=0.056 | 15 | 53 | x2=3.128 | 55±20 | t =0.9 738 |
| 女 | 20 | 11 | 55 | P =0.813 | 14 | 70 | P =0.073 | 61±19 | P =0.3 353 |
| 年龄(岁) | |||||||||
| <50 | 27 | 19 | 70 | x2=0.018 | 13 | 49 | x2=3.192 | 59±20 | t =0.4 837 |
| ≥50 | 21 | 12 | 57 | P =0.893 | 16 | 76 | P =0.074 | 57±20 | P =0.6 309 |
| 肿瘤部位 | |||||||||
| 胆总管上段 | 30 | 19 | 63 | 17 | 56 | 58±20 | |||
| 胆总管中段 | 10 | 6 | 60 | x2=0.102 | 6 | 60 | x2=0.206 | 59±19 | F =0.11 |
| 胆总管下段 | 8 | 6 | 75 | P =0.950 | 6 | 75 | P =0.902 | 55±20 | P =0.8 966 |
| 组织学类型 | |||||||||
| 管样腺癌 | 36 | 22 | 61 | 20 | 56 | 5920 | |||
| 乳头状腺癌 | 8 | 6 | 75 | x2=0.157 | 6 | 75 | x2=0.332 | 54±20 | F =0.1 3 |
| 黏液腺癌和腺磷癌 | 4 | 3 | 75 | P =0.925 | 3 | 75 | P =0.847 | 72±7 | P =0.7 167 |
| 分化程度 | |||||||||
| 高 | 23 | 14 | 61 | 9 | 39 | 44±17 | |||
| 中 | 10 | 6 | 60 | x2=4.794 | 6 | 60 | x2=14.232 | 67±11 | F =18.50 |
| 低 | 14 | 11 | 73 | P =0.091 | 13 | 87 | P =0.001 | 73±12 | P =0.0 001 |
| 淋巴或远处转移 | |||||||||
| 有 | 29 | 21 | 72 | x2=0.113 | 26 | 89 | x2=10.018 | 70±11 | t =-7.9 452 |
| 无 | 19 | 10 | 52 | P =0.776 | 3 | 16 | P =0.002 | 39±15 | P<0.001 |
| TNM分期 | |||||||||
| I-II | 21 | 10 | 48 | x2=0.2 142 | 6 | 29 | x2=4.479 | 44±17 | t =2.9654 |
| III-IV | 18 | 12 | 75 | P =0.643 | 23 | 82 | P =0.035 | 78±9 | P =0.048 |
在全部48例胆管癌病例中, VEGF阳性表达的有29例, 其平均MVD为72, VEGF表达阴性的平均MVD为36 (t = -12.5896 , P<0.01), 且VEGF表达阳性的29例均属高MVD组, 不表达VEGF的19例, 说明VEGF的阳性表达与MVD计数密切相关. 31例P53阳性表达的胆管癌, 其中28例VEGF表达阳性, 3例VEGF不表达, 在P53表达阴性的17例病例中, 只有1例VEGF表达阳性, 表明VEGF表达与P53表达密切相关(x2 = 37.734, P<0.05); P53和VEGF均阳性表达的病例有27例, 其MVD平均数为72, 明显高于P53和VEGF均表达阴性的16例(MVD平均数为34)(t = -14.1 517, P<0.01).
增生期肿瘤的一个显著特征是能从宿主组织中诱生出新的毛细血管[8]. 实体肿瘤增生到一定阶段必须依靠新生血管形成才能与肿瘤宿主的脉管系统保持一定的延续性, 以获得氧分或营养的供应, 否则"休眠"于2-3 cm. MV形成与肿瘤本身生物学形为密切相关, 多因素相关分析显示MVD是一个独立的预后指标.
VEGF是血管生成过程中最重要的调控因子. 肿瘤细胞自分泌的VEGF与其特异受体结合, 促进内皮细胞的增生、分裂, 促进肿瘤血管增生和维持血管功能, 因而VEGF不仅与血管形成的数量有关, 而且与新生血管的质量有关[9]. 本组研究表明, 在高分化和未转移的胆管癌中VEGF阳性表达率和MVD均值明显低于低分化或伴转移的胆管癌, 且VEGF表达阳性胆管癌标本中MVD平均值明显高于VEGF表达阴性的MVD平均值, 说明胆管癌细胞分泌的VEGF具有明显的促肿瘤血管生成作用, 也说明肿瘤微血管生成与肿瘤细胞本身具有密切的关系.
野生型P53是一种抑癌基因, 其机制之一是野生型P53通过作用于VEGF基因的启动子, 以呈剂量依赖方式反向调节VEGF启动子的活性而抑制VEGF的转录, 当P53发生突变, 可增强蛋白激酶C的活性, VEGF的表达增加, 诱导肿瘤血管生成, 诱发多种实体恶性肿瘤的发生和发展[10]. 野生型P53蛋白几乎存在于所有的体细胞中, 但由于其半衰期短, 常呈低水平表达或检测不到. P53基因突变使蛋白构型发生改变, 用免疫组织化学方法能在许多人恶性肿瘤中检测到突变型P53蛋白过表达[11]. 本组研究表明, 胆管癌组织P53阳性表达率(64%)显著高于慢性炎症的胆管壁组织; 尽管P53蛋白表达与肿瘤分化程度, 淋巴或远处转移以及TNM分期无显著相关性, 不能作为单独的预后指标, 但P53的表达与VEGF的表达和MVD计数显著相关. P53阳性表达的31例胆管癌组织中VEGF的表达(28/31)显著高于P53阴性者(1/12), 相应的VEGF阳性胆管癌组织MVD明显高于VEGF阴性者, 证实突变的P53通过诱导VEGF的表达, 促进血管生成是肿瘤生物学形为的恶性进展的机制之一.
| 1. | Liotta LA, Steeg PS, Steeler-Stewenson WG. Cancer metastasis and angiogenesis : an imblance of positive ang negative regulation. Cell. 1991;64:327-336. [DOI] |
| 2. | Macchiarini P, Fontanini O, Hardlin MJ, Squartini F, Ang CA. Relation of neovascularisation to metastasis of non-small-cell lung cancer. Lancet. 1992;340:145-146. [DOI] |
| 3. | Volpert OV, Dameron KM, Bouck N. Sequential development of an angiogenic phenotype by human fibroblasts progressing to tumorigenicity. Oncogene. 1997;14:1495-1502. [DOI] |
| 4. | Campomenosi P, Fronza G, Ottaggio L, Roncella S, Inga A, Bogliolo M, Monti P, Assereto P, Moro F, Boz Chiorazzi N, Cutrona G, Abbondandolo A, Ferrarini M. Heterogeneous p53 mutations in Burkitt lymphoma from an AIDS patient with monoclonal c-myc and VDJ rearrangements. Int J Cancer. 1997;73:816-821. [DOI] |
| 5. | Weidner N, Semple JP, Welch WR, Folkman J. Tumorl angiogenesis and metastasis-correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [DOI] |
| 6. | Miyake M, Taki T, Hitomi S, Hakomori S. Correlation of expression of H/Ley/Le(b) antigen with survival in patients with carcinoma of the lung. N Engl J Med. 1992;327:14-18. [DOI] |
| 7. | Silvestrini R, Benini E, Daidone MG, Veneroni S, Boracc J, Cappelletti V, Di Fronzo G, Veronessi U. p53 as an indepen-dentprognostic marker in lymph node negative breast cancer patients. J Natl Cancer Inst. 1993;85:965-970. [DOI] |
| 8. | Folkman J. Seminars in medicine of the beth Israel hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med. 1995;333:1757-1763. [DOI] |
| 9. | Maehare Y, Kabashima A, Koga T, Tokunaga E, Takeuchi H, Sugimachi K. Vascular invasion and potential for tumor angiogenesis and metastasis in gastric carcinoma. Surgery. 2000;128:408-416. [DOI] |