修回日期: 2003-01-20
接受日期: 2003-03-21
在线出版日期: 2003-11-15
明确血管紧张素II (AngII)对大鼠肝星形细胞(HSC)细胞外基质降解的影响以及一氧化氮(NO)对其的干预作用.
采用原位酶灌注法分离培养HSC, 发色底物法测定纤溶酶原激活物抑制物-I (PAI-I)活性, 硝酸还原酶法测定NO浓度; 采用半定量RT-PCR法检测PAI-I mRNA的表达.
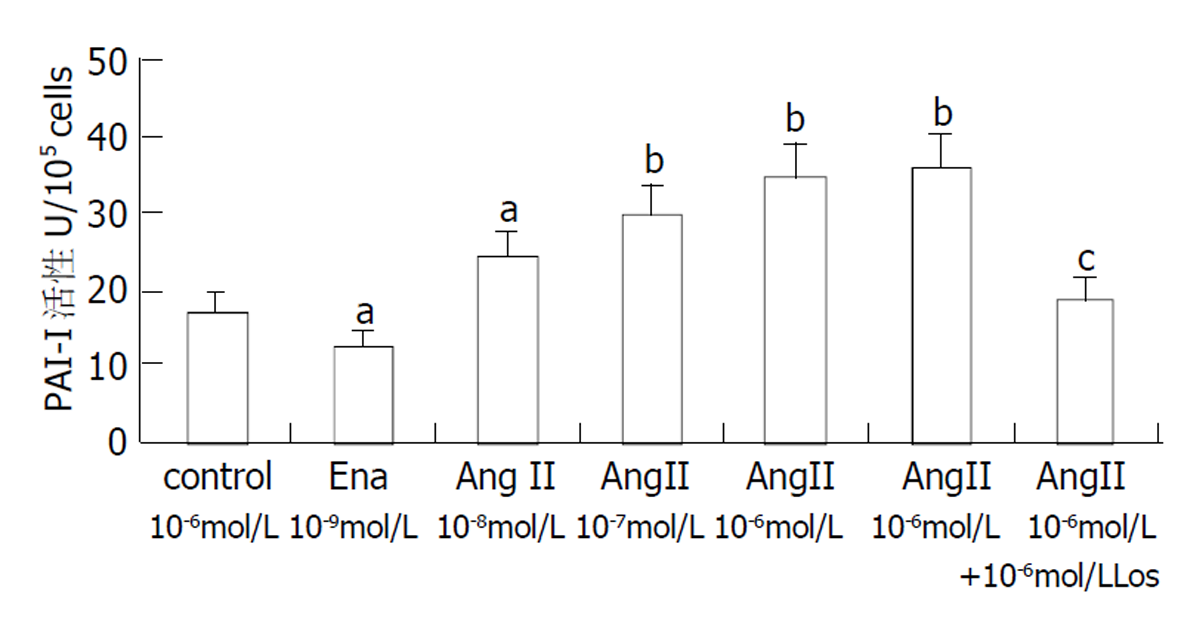
AngII能剂量依赖性地促进HSC合成和释放PAI-I, NO、依那普利和氯沙坦均能减弱这种作用.
AngII能通过I型受体抑制细胞外基质降解, NO可以拮抗这种作用. 促进细胞外基质代谢是依那普利和氯沙坦抑制肝纤维化的机制之一.
引文著录: 张晶, 李定国, 尤汉宁, 刘清华, 宗春华, 陆汉明. 血管紧张素II对大鼠HSC合成PAI-I的影响及NO的干预作用. 世界华人消化杂志 2003; 11(11): 1807-1808
Revised: January 20, 2003
Accepted: March 21, 2003
Published online: November 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1807-1808
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1807.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1807
近年来研究证实, 肝纤维化的关键细胞-肝星形细胞(hepatic stellate cell, HSC)能表达血管紧张素II(angiotensin II, Ang II)的I型受体(AngII receptor type I, AT1R), 并且外源性AngII能促进其分裂增生和合成细胞外基质(extracellular matrix, ECM) [1]. 为进一步明确AngII与ECM代谢的关系, 本实验对Ang II与纤溶酶原激活物抑制物-1 (plasminogen activator inhibitor-1, PAI-I, 为肝纤维化过程中抑制ECM代谢的主要物质之一)之间的关系进行了初步研究, 并观察了依那普利(enalapril, Ena, 为血管紧张素转换酶抑制剂)和氯沙坦(losartan, Los, 为AT1R拮抗剂)及一氧化氮(nitric oxide, NO)对AngII功能的影响.
从成年SD大鼠肝脏中采用原位酶灌注法分离HSC, 以2×105/cm2接种于培养瓶中, 于5% CO2 37 °C恒温孵育箱中培养.
将传代的HSC以2×105/ml接种于24孔培养板, 待细胞接近长满时, 换用无血清培养基. 24 h后分别加入不同浓度的药物进行干预(详见结果部分), 孵育24 h后采集上清液冻存备用. 每个条件设3复孔, 取平均值. 采用发色底物法测定PAI-I活性, 采用硝酸还原酶法测定NO含量. 采用RT-PCR法检测PAI-I mRNA表达.
统计学处理 采用SAS软件包进行统计学分析, 多组间均数比较采用方差分析.
AngII以剂量依赖的方式促进PAI-I合成和分泌, 这种作用可被Ena减弱, 也可被10-6mol/L Los完全阻断, 说明AngII通过AT1R影响PAI-I合成(图1).
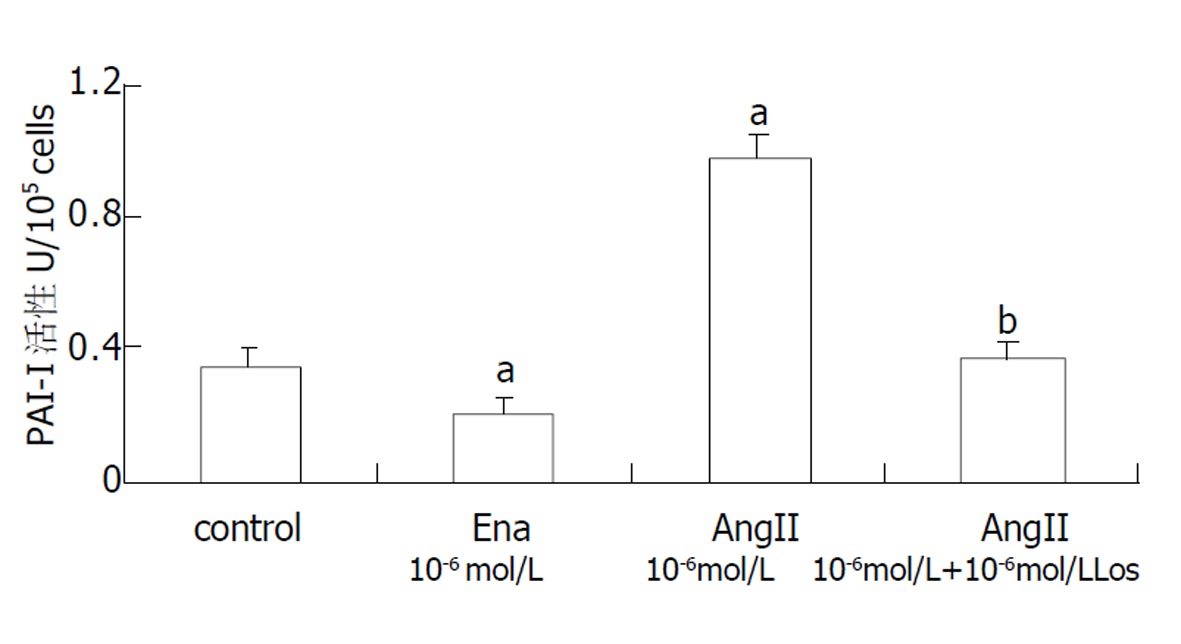
在正常HSC中可检测到PAI-I mRNA表达.10-6mol/L AngII可显著增加PAI-I mRNA表达(P<0.01), Ena和Los可减弱或阻断这种作用(图2).
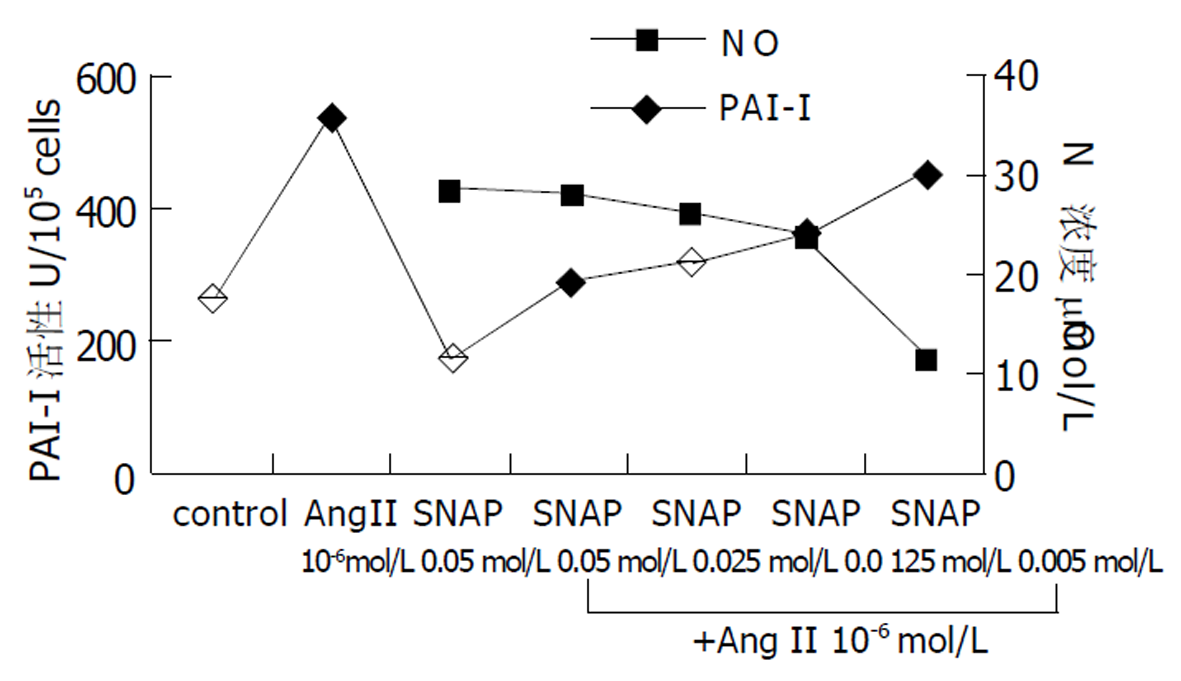
对照孔上清液中未检测到NO. SNAP能剂量依赖性地诱导上清液中NO生成. NO能剂量依赖性地减弱AngII促进PAI-I合成的作用(图3).
由组织和细胞合成的肾素-血管紧张素-醛固酮系统(renin- angiotensin-aldosterone system, RAAS), 称为局部RAAS[2] , 参与多种组织纤维化过程, 应用RAAS抑制剂能延缓纤维化发生[3]. 已经证实, 肝纤维化的关键细胞HSC能表达AT1R, 外源性AngII能促进HSC分裂增生和合成ECM[1]. 肝纤维化时肝内AngII升高[4]. 多种RAAS抑制剂如依那普利、氯沙坦等具有预防或逆转肝纤维化的作用[5], 说明肝纤维化与局部RAAS密切相关.
PAI-I在HSC表达很强[6], 具有抑制ECM降解, 促进肝纤维化发生的作用. 本实验结果显示, HSC可合成PAI-I并释放至上清液中, AngII能剂量依赖性地上调PAI-I活性, 10-6 mol/L AngII 使PAI-I活性上调2.06倍、PAI-I mRNA上调2.8倍. 由于PAI-I具有抑制ECM降解的作用, 肝纤维化时AngII升高势必增强这种作用, 从而使ECM沉积多于降解, 加速纤维化发生. Ena能够抑制血管紧张素转换酶活性, 抑制HSC合成AngII; Los阻断AngII与AT1R结合, 从而促进ECM降解, 起到抑制肝纤维化的作用.
NO是强烈的抗肝纤维化因子[7] , 并且总是与AngII作用相反.因此, 我们观察了在HSC中, NO对AngII作用的影响.由于诱生型NO合成酶在HSC表达极低, 因此我们采用NO供体-SNAP诱导NO合成. 从图3可以看出, 10-6 mol/L AngII能显著增加PAI-I活性(P <0.01), NO使这种促进作用被明显抑制, SNAP浓度越高, NO越多, 则抑制作用越强. 这说明, 在肝纤维化进展中, AngII与NO仍然是作用相反的一对, 促进NO合成有助于延缓AngII引起的肝纤维化, 而抑制NO则促进肝纤维化发展.这与在自发性高血压大鼠心肌的研究结果相同[8].
总之, 本实验结果表明, AngII能通过I型受体, 以剂量依赖的方式促进HSC合成和分泌PAI-I, 抑制ECM降解, 促进肝纤维化进展, NO能剂量依赖地抑制AngII对PAI-I合成和分泌的促进作用. 促进ECM降解是Ena和Los抗肝纤维化的机制之一.
| 1. | Bataller R, Gines P, Nicolas JM, Gorbig MN, Garcia-Ramallo E, Gasull X, Bosch J, Arroyo V, Rodes J. Angiotensin II induces contraction and proliferation of human hepatic stellate cells. Gastroenterology. 2000;118:1149-1156. [DOI] |
| 3. | Brilla CG. Renin-angiotesin-aldosterone system and myocardial fibrosis. Cardiovasc Res. 2000;47:1-3. [DOI] |
| 4. | 张 晶, 宗 春华, 李 定国, 周 仁建, 杜 学亮, 周 馨, 徐 芹芳, 陆 汉明. 肝内肾素-血管紧张素-醛固酮系统与大鼠肝纤维化的关系. 世界华人消化杂志. 2002;10:397-400. |
| 5. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Fukui H. Angiotensin-II type 1 receptor interaction is a major regulator for liver fibrosis development in rats. Hepatology. 2001;34:745-750. [PubMed] [DOI] |
| 6. | Knittel T, Fellmer P, Ramadori G. Gene expression and regulation of plasminogen activator inhibitor type I in hepatic stellate cells of rat liver. Gastroenterology. 1996;111:745-754. [DOI] |
| 7. | Rockey DC, Chung JJ. Inducible nitric oxide synthase in rat hepatic lipocyte and the effect on lipocyte contractility. J Clin Invest. 1995;95:1199-1206. [DOI] |
| 8. | Hou J, Kato H, Cohen RA, Chobanian AV, Brecher P. Angiotensin II-induced cardiac fibrosis in the rat is increased by chronic inhibition of nitric oxide synthase. J Clin Invest. 1995;96:2469-2477. [DOI] |