修回日期: 2003-06-20
接受日期: 2003-07-15
在线出版日期: 2003-11-15
观测大黄素对Wistar大鼠结肠环行平滑肌细胞胞质游离钙水平([Ca2+]i)的影响, 并探讨机制.
酶解法分离结肠环行平滑肌细胞, 分别采用图像分析系统和激光扫描共聚焦显微镜观测细胞长度和[Ca2+]i的变化.
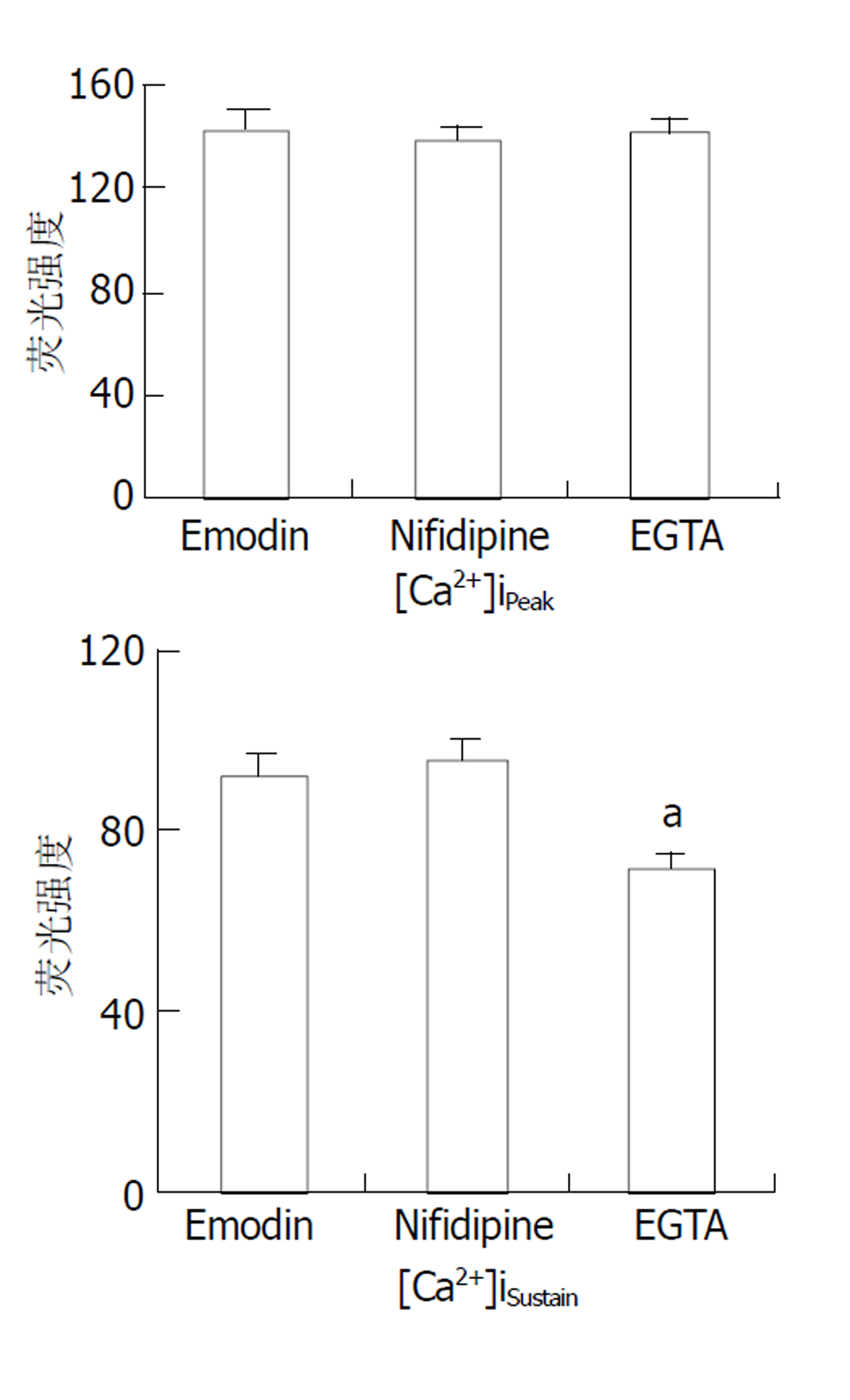
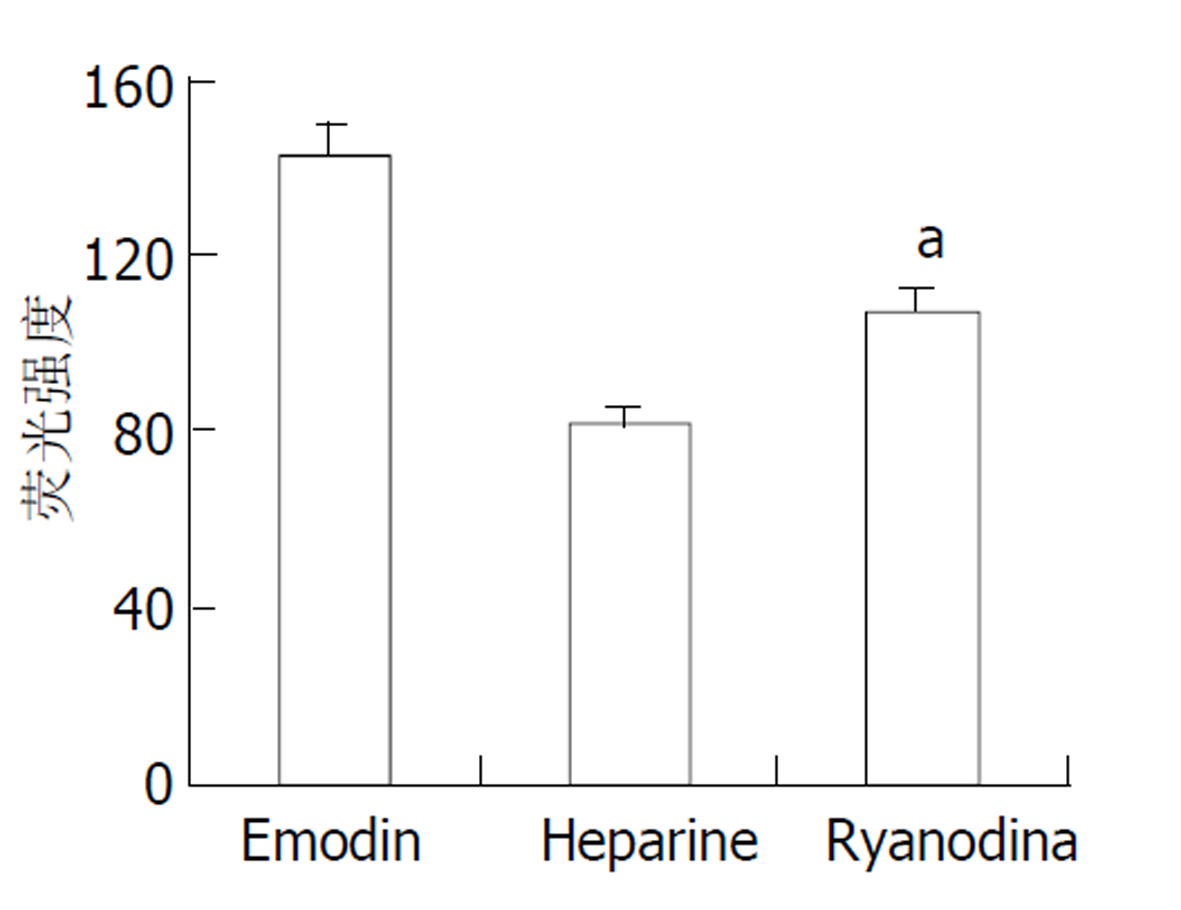
大黄素可收缩大鼠结肠环行平滑肌细胞, 也可浓度依赖性升高[Ca2+]i; 大黄素作用后, [Ca2+]i迅速升高达到峰值([Ca2+]iPeak), 而后下降至平台期([Ca2+]iSustain, 仍高于静息值). Nifedipine对大黄素的钙动员作用没有明显影响, EGTA明显降低[Ca2+]iSustain. Heparine 几乎完全抑制[Ca2+]iPeak, Ryanodine 明显抑制[Ca2+]iPeak.
大黄素通过升高[Ca2+]i收缩结肠环行平滑肌细胞. 大黄素升高[Ca2+]i的机制为: 活化IP3受体释放细胞内钙, 进一步以CICR方式促进RYR受体开放, 共同作用升高[Ca2+]i, 细胞外钙内流参与平台期[Ca2+]i的升高.
引文著录: 马涛, 齐清会, 简序, 费乃昕. 大黄素对大鼠结肠环行平滑肌细胞[Ca2+]i的影响. 世界华人消化杂志 2003; 11(11): 1699-1702
Revised: June 20, 2003
Accepted: July 15, 2003
Published online: November 15, 2003
To investigate whether emodin has any effects on circular smooth muscle cells of rat colon and to examine the underlying mechanisms.
Smooth muscle cells were isolated from the circular muscle layers of Wistar rat colon and cell length was measured by computerized image micrometry. Intracellular Ca2+ ([Ca2+]i) signaling was studied in smooth muscle cells using Ca2+ indicator Fluo-3 AM by laser-scanning confocal microscopy.
Emodin dose-dependently induced smooth muscle cells contraction, caused a large, transient increase in [Ca2+]i followed by a Sustained elevation in [Ca2+]i. Emodin-induced increase in [Ca2+]i was unaffected by nifedipine, a votage-gated Ca2+-channel antagonist, and the Sustained phase of rising of [Ca2+]i was attenuated by extracellular Ca2+ removal with EGTA solution. Inhibiting Ca2+ release from ryanodine-sensitive intracellular stores by ryanodine reduced the Peak increase in [Ca2+]i. However, the application of heparine, an antagonist of IP3R, nearly abolished the Peak increase in [Ca2+]i induced by emodin.
Emodin has direct excitatory effect on circular smooth muscle cells from rat colon and its effect is mediated through Ca2+-dependent pathways. Furthermore, emodin-induced Peak [Ca2+]i increase may be attributable to the Ca2+ release from IP3 sensitive stores, which promotes Ca2+ release from ryanodine-sensitive stores through CICR mechanism. Additionally, Ca2+ influx from extracellular medium contributes to the Sustained increase in [Ca2+]i.
- Citation: Ma T, Qi QH, Jian X, Fei NX. Effects of emodin on intracellular Ca2+ signaling in the circular smooth muscle cells of rat colon. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1699-1702
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1699.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1699
大黄素属于蒽醌类化合物, 广泛存在于大黄、番泻叶等中药的根、皮等部位[1-3]. 靳珠华et al [4]证实大黄素可促进离体肠道平滑肌条收缩, 杨文修et al [5,6]发现大黄素可升高豚鼠结肠带平滑肌细胞[Ca2+]i. 但大黄素对胃肠道平滑肌细胞是否有直接收缩作用及其发挥作用的机制尚有待于研究. 因此, 我们观测大黄素对大鼠结肠环行平滑肌细胞长度及[Ca2+]i的影响, 探讨大黄素的作用机制.
大黄素(emodin)、HEPES、DMEM、II型胶原酶、大豆胰蛋白酶抑制剂、saponin、heparine、ryanodine、nifedipine等购自Sigma, Fluo-3 AM 购自Molecular probes, 余试剂均为国产分析纯购自天津市翰洋生物公司. 称取适量大黄素, 先用0.01 mol/L NaOH溶解, 然后用DMEM培养基稀释至1 μmol/L, 调整pH值为7.4, 无菌过滤分装, 4 °C冰箱保存, 使用前稀释至相应浓度.
(1)结肠环行平滑肌细胞分离: 取Wistar大鼠远端结肠约5 cm, 刮去黏膜, 解剖显微镜下剥离环行肌, 将肌组织剪成约1-2 mm3, 置于10 mL 含1 g/L II型胶原酶、0.1 g/L大豆胰蛋白酶抑制剂的消化液中37 °C连续孵育1 h, 30 min时更换消化液1次, 50目筛网过筛, 收集部分消化的组织用不含酶的HEPES缓冲液冲洗, 然后振荡20 min, 30次/min, 收集自由脱落的细胞供实验用. 台盼蓝染色确定细胞活力达90 %以上符合实验要求. 将细胞浓度调整为5×108/L. (2)平滑肌细胞收缩的测定: 取0.25 ml细胞悬液, 加入相应浓度的实验试剂. 1 min后加入25 g/L戊二醛终止反应. 应用Cmais2000图像分析系统随机测定50个细胞的长度. 收缩反应的计算公式为: 收缩变化百分数=(用药组平均长度-对照组平均长度)/对照组平均长度×100%. (3)平滑肌细胞[Ca2+]i测定: 将平滑肌细胞接种于预包被L-多聚赖氨酸的盖玻片, 离心促进细胞贴壁, 37 °C温箱孵育60 min后, 加入终浓度7.5 μmol/L Fluo-3 AM和0.2 g/L F-127的HEPES缓冲液. 37 °C孵育30 min, HEPES缓冲液冲洗3次, 37 °C继续孵育20 min. 装入Chamber Slide上机检测. 间隔10 s收集荧光强度图像, 观测200 s, 于60 s末加入大黄素. [Ca2+]i变化以荧光强度相对值表示. 其中峰值 [Ca2+]i([Ca2+]iPeak)由包括峰值在内3时间点的测定值确定, 平台期[Ca2+]i([Ca2+]iSustain)由平台期3个时间点的测定值确定.
统计学处理 数据均以mean±SD表示, 采用Student t test方法进行统计处理. P<0.05提示差别存在显著性.
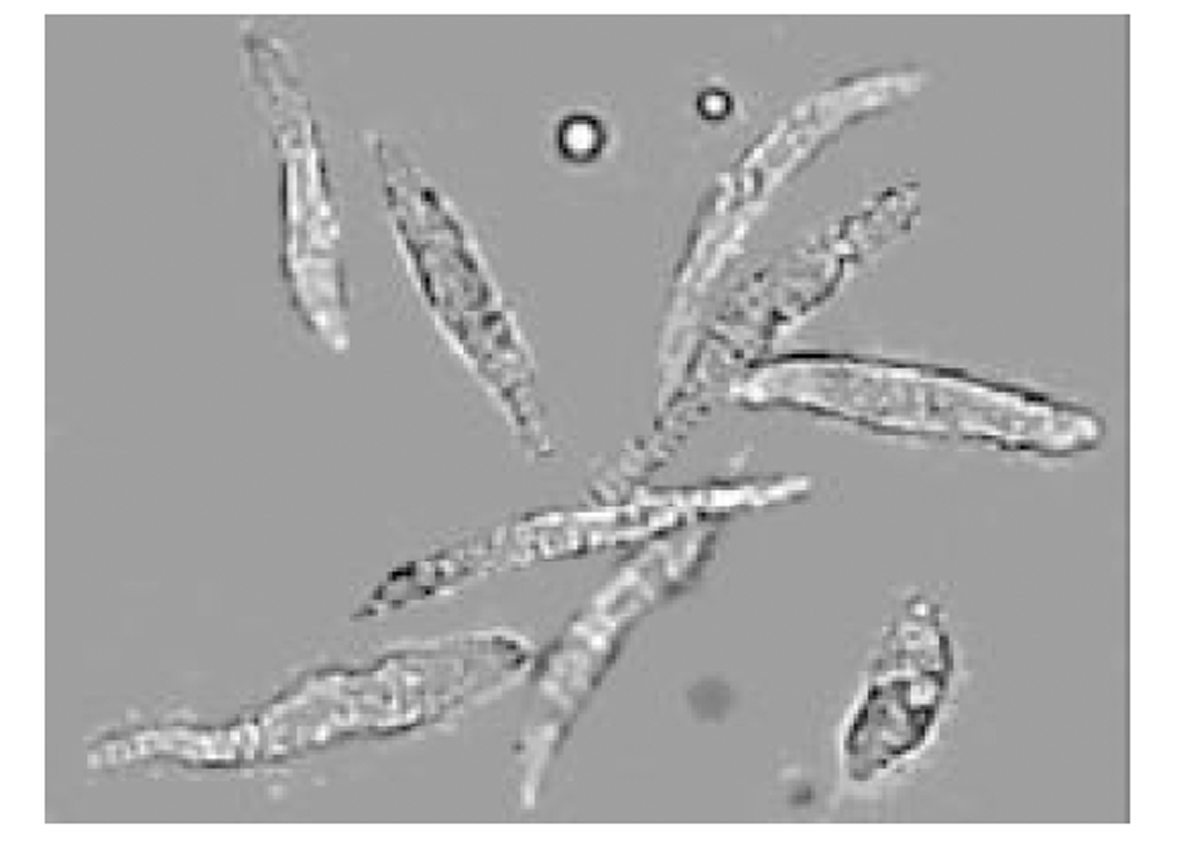
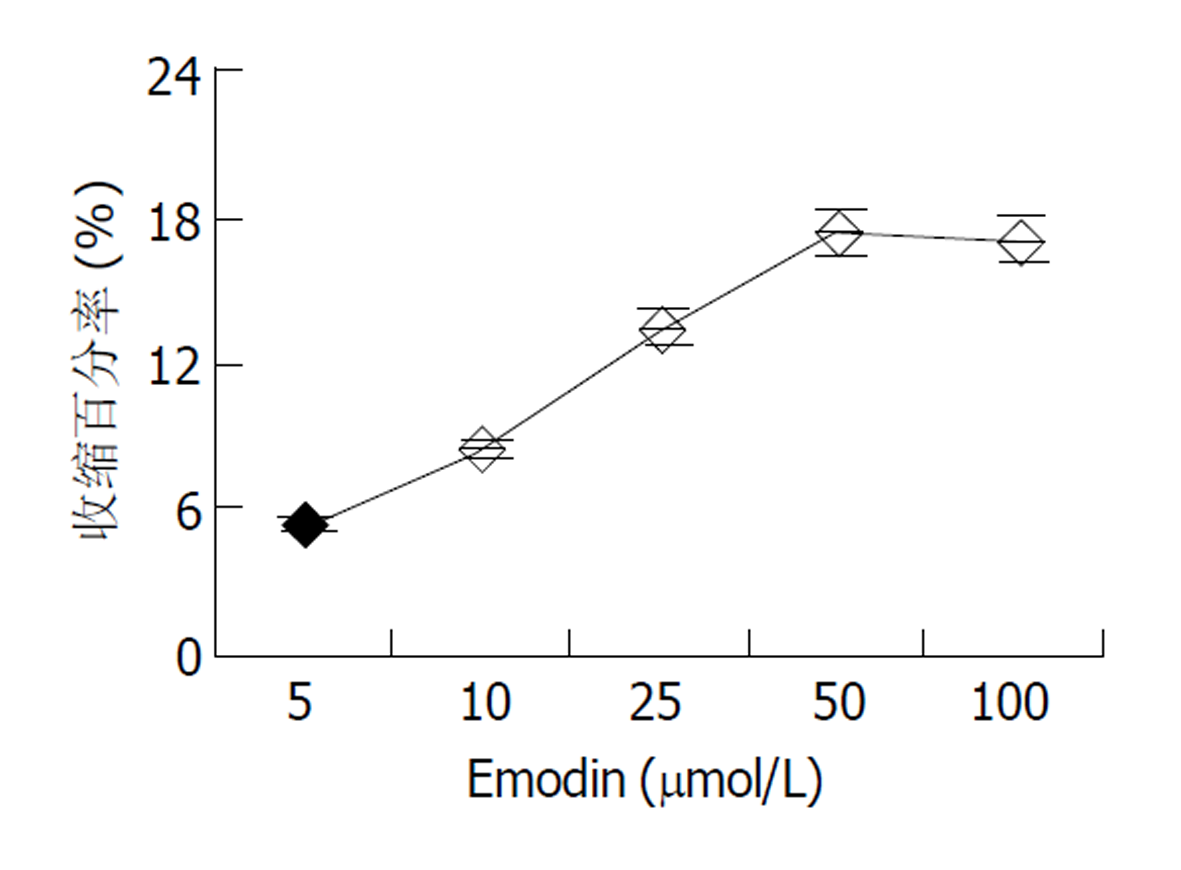
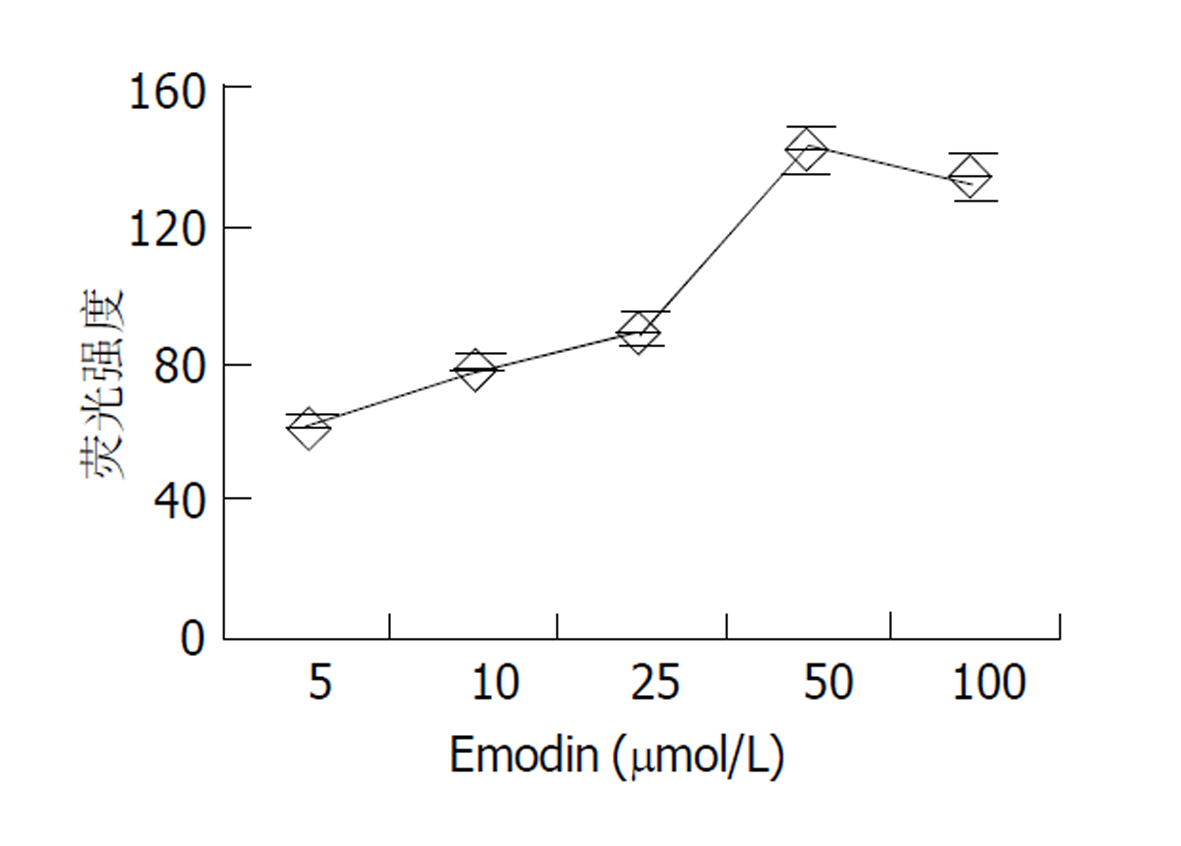
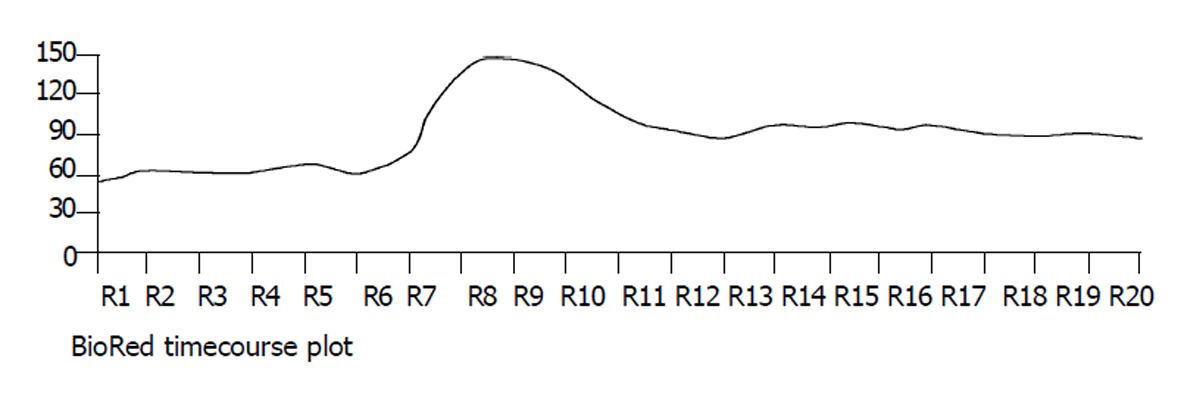
倒置显微镜下, 分离的结肠环行平滑肌细胞呈梭形, 长度各异, 有的处于舒张状态, 有的则处于不同的收缩状态下. 细胞的长度54-129 μm, 平均81.3 μm (图1). 使用5, 10, 25, 50, 100 μmol/L大黄素作用后, 分别测定50个平滑肌细胞长度, 并计算收缩百分数, 结果表明大黄素可收缩平滑肌细胞, 并表现为浓度依赖关系, 50 μmol/L浓度时收缩反应达峰值(17.3±3.5 %) (图2). 静息状态下, 平滑肌细胞胞质的平均荧光强度值(FI)为54.2±6.2. 5, 10, 25, 50, 100 μmol/L大黄素均可升高胞质[Ca2+]i, 峰值平均荧光强度值分别为62.5±5.6, 79.3±6.3, 89.6±5.5, 142.3±8.6, 133.5±4.8 (图3). 动态观测50 μmol/L大黄素对[Ca2+]i的影响, 可发现大黄素作用后[Ca2+]i短时间内迅速升高达到峰值, 后下降至平台期(图4).
Nifidipine (L型钙通道抑制剂, 1 μmol/L)作用10 min后, 加入50 μmol/L大黄素, 观测[Ca2+]i的动态变化. 结果表明Nifedipine对大黄素引起的[Ca2+]iPeak和[Ca2+]iSustain均无明显影响. EGTA(钙螯合剂, 2 mmol/L)对大黄素作用的[Ca2+]iPeak也没有明显影响, 但降低了[Ca2+]iSustain 71.2±6.5)(P<0.05, 图5).
因为heparin无法穿透细胞膜, 因此在加用heparin前, 用saponin处理细胞, 使heparin可进入细胞内. Heparin (IP3受体拮抗剂, 10 mg/L)和ryanodine (RYR受体拮抗剂, 0.1 μmol/L)与平滑肌细胞孵育30 min后, 加入50 μmol/L大黄素, 观测[Ca2+]i的动态变化. 结果表明heparine作用后[Ca2+]iPeak(81.3±6.5)明显降低, 下降达42.9% (P<0.05), ryanodine作用后[Ca2+]iPeak (107.5±7.7)也明显降低, 下降达24.4% (P<0.05, 图6).
研究证实, 大黄素具有促进胃肠运动的作用[3-6]. 我们首次从细胞水平证实大黄素可直接作用于结肠环行平滑肌细胞, 引起收缩. 表明大黄素的促动力作用可通过肌原性作用实现. [Ca2+]i是决定平滑肌细胞收缩或舒张的关键性因素, [Ca2+]i升高后与CaM结合, 活化Ca2+/CaM依赖性MLCK收缩平滑肌细胞[7-11]. 靳珠华et al [4]通过肌条收缩试验证实大黄素的促动力作用与钙离子有关. 杨文修et al [3,5,6]发现大黄素可升高豚鼠结肠带平滑肌细胞[Ca2+]i. 我们的实验也证实大黄素可剂量依赖性升高大鼠结肠环行平滑肌细胞的[Ca2+]i. 进一步观测50 μmol/L的大黄素对[Ca2+]i的动态影响, 发现大黄素作用后, [Ca2+]i迅速升高达到峰值, 并持续维持于较高的水平(图4).
[Ca2+]i的调节是一个复杂的调节体系, [Ca2+]i的升高可源于细胞外钙内流和/或细胞内钙释放[7-11]. 细胞外钙通过细胞膜上的钙通道进入细胞内, 其中L-钙通道是细胞外钙内流的主要通道[12-15]. Nifedipine是细胞膜L-钙通道的特异性抑制剂, 可抑制经由L-钙通道的细胞外钙内流. 在我们的实验中, 使用nifedipine抑制L-钙通道的活性对大黄素的钙动员作用没有影响, 表明L-钙通道不参与大黄素的钙动员作用; EGTA是一种钙螯合剂, 可结合游离的钙离子. 使用EGTA螯合细胞外钙后, 使[Ca2+]iSustain明显降低, 表明在[Ca2+]i升高的平台期有细胞外钙内流, 但钙内流的通道还有待于进一步研究.
肌质网是平滑肌细胞的细胞内钙贮存库, 已证实肌质网上存在着两种钙释放通道: IP3受体和RYR受体[16-19]. 研究表明IP3受体开放依赖于IP3产生并与之结合[16-18], 而RYR受体的激动剂尚不清楚, 但已证实RYR受体可通过钙诱导钙释放(CICR)的方式参与[Ca2+]i的调节[19,20-25], 所谓CICR是指细胞外钙内流或IP3受体开放释放钙可激活RYR受体开放进一步释放细胞内钙[26-30]. 我们使用的ryanodine和heparine分别是RYR受体和IP3受体的特异性拮抗剂, 可特异性抑制RYR受体和IP3受体的活性. 我们的结果表明, 使用ryanodine抑制RYR受体活性, IP3受体功能正常时, [Ca2+]iPeak明显降低; 而抑制IP3受体活性, RYR受体功能正常时, [Ca2+]iPeak几乎被完全抑制, 与ryanodine作用时[Ca2+]i相比, [Ca2+]iPeak也明显降低(P<0.05). 表明IP3受体介导的钙释放可能是大黄素钙动员作用的关键, 而RYR受体的激活依赖于IP3受体的开放. 因此我们推测大黄素作用后首先通过IP3受体开放释放细胞内钙, 进一步以CICR方式激活RYR受体, 共同作用升高[Ca2+]i.
总之, 我们的实验证实大黄素通过钙依赖性机制收缩大鼠结肠环行平滑肌细胞. 大黄素升高[Ca2+]i的机制为: 活化IP3受体释放细胞内钙, 进一步以CICR方式促进RYR受体活化, 共同作用升高[Ca2+]i, 在[Ca2+]i升高的平台期有细胞外钙内流, 但钙内流的通道有待于进一步研究.
| 1. | Lee HZ. Effects and mechanisms of emodin on cell death in human lung squamous cell carcinoma. Br J Pharmacol. 2001;134:11-20. [PubMed] [DOI] |
| 7. | Sanders KM, Invited review. Mechanisms of calcium handling in smooth muscles. J Appl Physiol. 2001;91:1438-1449. [DOI] |
| 8. | Jacques D, Sader S, El-Bizri N, Chouffani S, Hassan G, Shbaklo H. Neuropeptide Y induced increase of cytosolic and nuclear Ca2+ in heart and vascular smooth muscle cells. Can J Physiol Pharmacol. 2000;78:162-172. [DOI] |
| 9. | Bolton TB, Prestwich SA, Zholos AV, Gordienko DV. Excitation-contraction coupling in gastrointestinal and other mooth muscles. Annu Rev Physiol. 1999;61:85-115. [DOI] |
| 10. | Makhlouf GM, Murthy KS. Signal transduction in gastrointestinal smooth muscle. Cell Signal. 1997;9:269-276. [DOI] |
| 11. | Fan J, Byron KL. Ca2+ signalling in rat vascular smooth muscle cells: a role for protein kinase C at physiological vasoconstrictor concentrations of vasopressin. J Physiol. 2000;524:821-831. [DOI] |
| 12. | Poteser M, Wakabayashi I, Rosker C, Teubl M, Schindl R, Soldatov NM, Romanin C, Groschner K. Crosstalk between voltage-independent Ca2+ channels and L-type Ca2+ channels in A7r5 vascular smooth muscle cells at elevated intracellular pH: evidence for functional coupling between L-type Ca2+ channels and a 2-APB-sensitive cation channel. Circ Res. 2003;92:888-896. [DOI] |
| 13. | Furutani H, Zhang XF, Iwamuro Y, Lee K, Okamoto Y, Takikawa O, Fukao M, Masaki T, Miwa S. Ca2+ entry channels involved in contractions of rat aorta induced by endothelin-1, noradrenaline, and vasopressin. J Cardiovasc Pharmacol. 2002;40:265-276. [DOI] |
| 14. | Elble RC, Ji G, Nehrke K, DeBiasio J, Kingsley PD, Kotlikoff MI, Pauli BU. Molecular and functional characterization of a murine calcium-activated chloride channel expressed in smooth muscle. J Biol Chem. 2002;277:18586-18591. [DOI] |
| 15. | Amberg GC, Koh SD, Perrino BA, Hatton WJ, Sanders KM. Regulation of A-type potassium channels in murine colonic myocytes by Phosphatase activity. Am J Physiol Cell Physiol. 2001;281:2020-2028. [DOI] |
| 16. | White C, McGeown JG. Regulation of basal intracellular calcium concentration by the sarcoplasmic reticulum in myocytes from the rat gastric antrum. J Physiol. 2000;529:395-404. [PubMed] [DOI] |
| 17. | Carl A, Lee HK, Sanders KM. Regulation of ion channels in smooth muscles by calcium. Am J Physiol. 1996;271:C9-34. [DOI] |
| 18. | McCarron JG, Flynn ER, Bradley KN, Muir TC. Two Ca2+ entry pathways mediate InsP3-sensitive store refilling in guinea-pig colonic smooth muscle. J Physiol. 2000;525:113-124. [DOI] |
| 19. | Takeuchi M, Watanabe J, Horiguchi S, Karibe A, Katoh H, Baba S, Shinozaki T, Miura M, Fukuchi M, Kagaya Y, Shirato K. Interaction between L-type Ca2+ channels and sarcoplasmic reticulum in the regulation of vascular tone in isolated rat small arteries. J Cardiovasc Pharmacol. 2000;36:548-554. [DOI] |
| 20. | van Helden DF, Imtiaz MS, Nurgaliyeva K, Von der Weid P, Dosen PJ. Role of calcium stores and membrane voltage in the generation of slow wave action potentials in guinea-pig gastric pylorus. J Physiol. 2000;524:245-265. [DOI] |
| 21. | Flynn ER, Bradley KN, Muir TC, McCarron JG. Functionally separate intracellular Ca2+ stores in smooth muscle. J Biol Chem. 2001;276:36411-36418. [PubMed] [DOI] |
| 22. | Kotlikoff ML, Wang YX, Xin HB, Ji G. Calcium release by ryanodine receptors in smooth muscle. Novartis Found Symp. 2002;246:108-119. [DOI] |
| 23. | Ji G, Barsotti RJ, Feldman ME, Kotlikoff MI. Stretch-induced calcium release in smooth muscle. J Gen Physiol. 2002;119:533-544. [DOI] |
| 24. | Collier ML, Ji G, Wang Y, Kotlikoff MI. Calcium-induced calcium release in smooth muscle: loose coupling between the action potential and calcium release. J Gen Physiol. 2000;115:653-662. [DOI] |
| 25. | Henkel CC, Asbun J, Ceballos G, del Carmen Castillo M, Castillo EF. Relationship between extra and intracellular sources of calcium and the contractile effect of thiopental in rat aorta. Can J Physiol Pharmacol. 2001;79:407-414. [DOI] |
| 26. | Somlyo AP, Somlyo AV. The sarcoplasmic reticulum: then and now. Novartis Found Symp. 2002;246:258-268. [DOI] |
| 27. | Chambers P, Neal DE, Gillespie JI. Ryanodine receptors in human bladder smooth muscle. Exp Physiol. 1999;84:41-46. [DOI] |
| 28. | Hisamitsu T, Ohata H, Kawanishi T, Iwamoto T, Shigekawa M, Amano H, Yamada S, Momose K. A mechanism of Ca2+ release from Ca2+ stores coupling to the Na+/Ca2+ exchanger in cultured smooth muscle cells. Life Sci. 2001;69:2775-2787. [DOI] |
| 29. | Mohanty MJ, Li X. Stretch-induced Ca(2+) release via an IP(3)-insensitive Ca(2+) channel. Am J Physiol Cell Physiol. 2002;283:456-462. [DOI] |
| 30. | Zhang Y, Paterson WG. Role of Ca2+-activated Cl- channels and MLCK in slow IJP in opossum esophageal smooth muscle. Am J Physiol Gastrointest Liver Physiol. 2002;283:104-114. [DOI] |