修回日期: 2003-03-20
接受日期: 2003-03-29
在线出版日期: 2003-11-15
探讨肝细胞癌变过程中cyclin D1的异常表达与端粒酶活性之间的关系及其意义.
用0.5 g/L的2-AAF诱导Wistar大鼠建立肝癌动物模型, 应用原位杂交法和PCR-TRAP-ELISA法检测大鼠肝脏在癌变过程中cyclin D1的异常表达和端粒酶的活性.
正常组8例中cyclin D1表达均正常, 端粒酶均阴性. 肝硬化组16例中有12例cyclin D1过表达, 有4例cyclin D1表达正常; 有9例端粒酶阳性, 有7例端粒酶阴性. 肝癌组11例中有4例cyclin D1过表达, 有7例cyclin D1表达正常; 有10例端粒酶阳性, 有1例端粒酶阴性.
肝硬化组和肝癌组的cyclin D1异常表达、端粒酶活性均高于正常组, 而且肝硬化组的cyclin D1异常表达与端粒酶活性呈正相关, 肝癌组的cyclin D1异常表达与端粒酶活性呈负相关.
引文著录: 李宝杰, 王新红, 曲波. 肝细胞癌变过程中cyclin D1的异常表达与端粒酶活性的相关分析及意义. 世界华人消化杂志 2003; 11(11): 1682-1685
Revised: March 20, 2003
Accepted: March 29, 2003
Published online: November 15, 2003
To explore the relationship between cyclin D1 aberrant expression and telomerase activity during hepatocellular canceration and its significance.
0.5 g/L 2-AAF was used to induce rat (Wistar) hepatocellular carcinoma. Cyclin D1 and telomerase were examined respectively by in situ hybridization techniques and PCR-TRAP-ELISA.
Eight rats in control group showed normal expression of cyclin D1 and negative telomerase activity. In 16 rats with liver cirrhosis, 12 showed overexpression of cyclin D1 and 9 showed positive telomerase activity. In 11 rats with hepatocellular carcinoma, 4 showed overexpression of cyclin D1 and 10 showed positive telomerase activity.
Expression of cyclin D1 and telomerase activity in liver cirrhosis and hepatocellular carcinoma were higher than those in control group. Cyclin D1 overexpression was associated with a high telomerase activity in liver cirrhosis. There was a negative correlation between cyclin D1 expression and telomerase activity in hepatocellular carcinoma.
- Citation: Li BJ, Wang XH, Qu B. Correlation analysis of cyclin D1 aberrant expression and telomerase activity during hepatocellular canceration and its significance. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1682-1685
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1682.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1682
肝细胞癌是人类常见的一种恶性肿瘤, 研究其发病机制以便于更好的治疗则是目前人们研究的重点之一. 因为肝细胞癌的形成与端粒酶的活性及cyclin D1异常表达均有密切关系, 而且cyclin D1作为细胞周期调节因子, 是调节细胞周期的关键[1], 所以本实验通过研究大鼠肝脏在癌变的动态过程中端粒酶与cyclin D1之间的关系, 来探讨端粒酶的活性与细胞周期的关系, 从而为肿瘤的预防、诊断、治疗提供依据.
Wistar大鼠及饲料购自哈尔滨医科大学附属第二医院动物中心, 2-乙酰氨基芴(2-AAF)和DEPC购自美国Sigma公司, PCR-TRAP-ELISA试剂盒购自瑞士Roche公司, cyclin D1原位杂交试剂盒购自天津T.B.D生物制品有限公司, DAB购自武汉博士德生物公司.
选取♂Wistar大鼠39只, 质量140±20 g. 随机选取9只大鼠为正常对照组, 给予标准颗粒饲料喂养; 其余为实验组, 以含0.5 g/L 2-AAF的颗粒饲料喂养. 分别于8, 12, 16 wk随机取鼠13只处死(正常组3只和实验组10只). 取部分肝组织放于40 g/L多聚甲醛中固定, 做成蜡块留做病理学检查及原位杂交; 取部分肝组织放入液氮中速冻, 再移入-80 °C冰箱, 留做端粒酶活性检测.
1.2.1 原位杂交法检测cyclin D1的mRNA含量 石蜡切片经脱蜡、脱水后, 用30 mL/L H2O2室温孵育10 min以消除内源性过氧化物酶的活性. 把组织放入细胞打孔液中浸泡40 min, PBS冲洗, 再放入抗原修复液中修复组织, PBS冲洗, 滤纸吸干. 滴加3%柠檬酸新鲜稀释液, PBS冲洗, 滤纸吸干. 滴加预杂交液37 °C过夜, SSC冲洗, 滤纸吸干. 滴加含探针的杂交液37 °C 5 h, SSC冲洗, 滤纸吸干. 滴加封闭液、生物素化兔/小鼠抗地高辛、SABC-POD、DAB显色剂等, 苏木素复染, 脱水、透明、封片. Cyclin D1原位杂交以细胞质出现棕黄色颗粒为阳性. 计数10个高倍镜视野, 根据阳性细胞在同类细胞中所占比例的多少将染色结果分为4个等级: 阴性(-)为无阳性细胞或<5%的细胞呈阳性反应; 弱阳性(+)为5-24%的细胞呈阳性反应; 中度阳性(++)为25-50%的细胞呈阳性反应; 强阳性反应(+++)为>50%的细胞呈阳性反应. -~+为表达正常, ++~+++为过表达.
1.2.2 PCR-TRAP-ELISA法检测端粒酶的活性 取4 mm3的肝组织放入加有200 μL裂解液的研磨器中, 研碎后倒入eppendorf管中, 冰浴30 min. 然后4 °C 16 000 g离心20 min, 取上清液. 部分用于检测蛋白含量, 部分放入液氮中速冻, 然后-80 °C保存. 将反应混合物、无菌蒸馏水、组织提取物加入PCR扩增管中, 然后按下述PCR循环进行扩增. 循环1: 25 °C 10 min. 循环2: 94 °C 5 min. 循环3-32: 94 °C 30 s; 50 °C 30 s; 72 °C 90 s. 循环33: 72 °C 10 min. 将变性液与扩增产物常温孵育10 min, 再加入杂交液涡旋混匀. 取100 μL混合物放入MTP板, 依次加入抗DIG-POD工作液、底物显色液、终止液, 30 min内用酶标仪测定450 nm处的吸光度(用630 nm波长作对照). 端粒酶的结果按吸光度(A)的值分级. 阳性对照: A阳450-A阳630 >1.5为阳性合格. 阴性对照: A阴450-A阴630 <0.25为阴性合格. 样本: A450-A630-A阴 >0.2为阳性, 否则为阴性. A >0.2为+, 1 <A <1.5为++, A >1.5为+++.
统计学处理 采用秩和检验和相关分析的统计学方法.
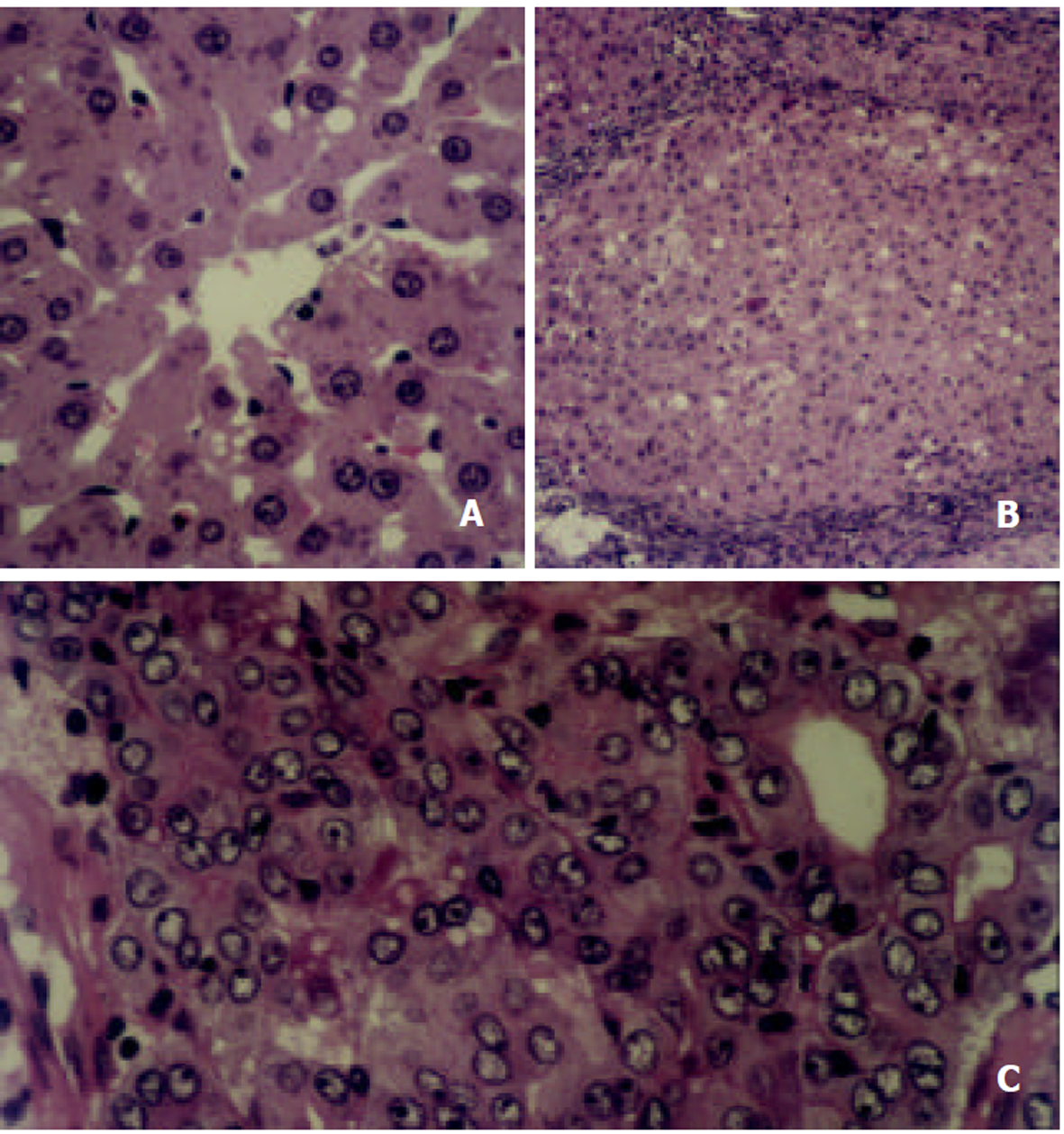
正常对照组9只大鼠中, 有1只大鼠在16 wk处死时肝脏有部分发生轻度脂肪变性而排除, 其余8只大鼠均正常. 实验组在8 wk处死时, 10只大鼠均为肝硬化, 轻重略有不同. 在12 wk处死时, 有1只大鼠死亡而排除, 有5只大鼠为肝硬化, 有4只大鼠为肝癌. 在16 wk处死时, 有2只大鼠死亡而排除, 有1只大鼠为肝硬化, 有7只大鼠为肝癌. 即正常对照组8只大鼠, 肝硬化组16只大鼠, 肝癌组11只大鼠. 正常对照组可见肝细胞大小形态均匀一致. 肝硬化组可见肝细胞的变性坏死, 假小叶的形成, 但纤维化的程度不同, 为轻至重度纤维化, 结节处的核分裂像增多, 但异型性不明显. 肝癌组可见肝细胞大小不等, 核分裂像增多, 异型性明显(图1).
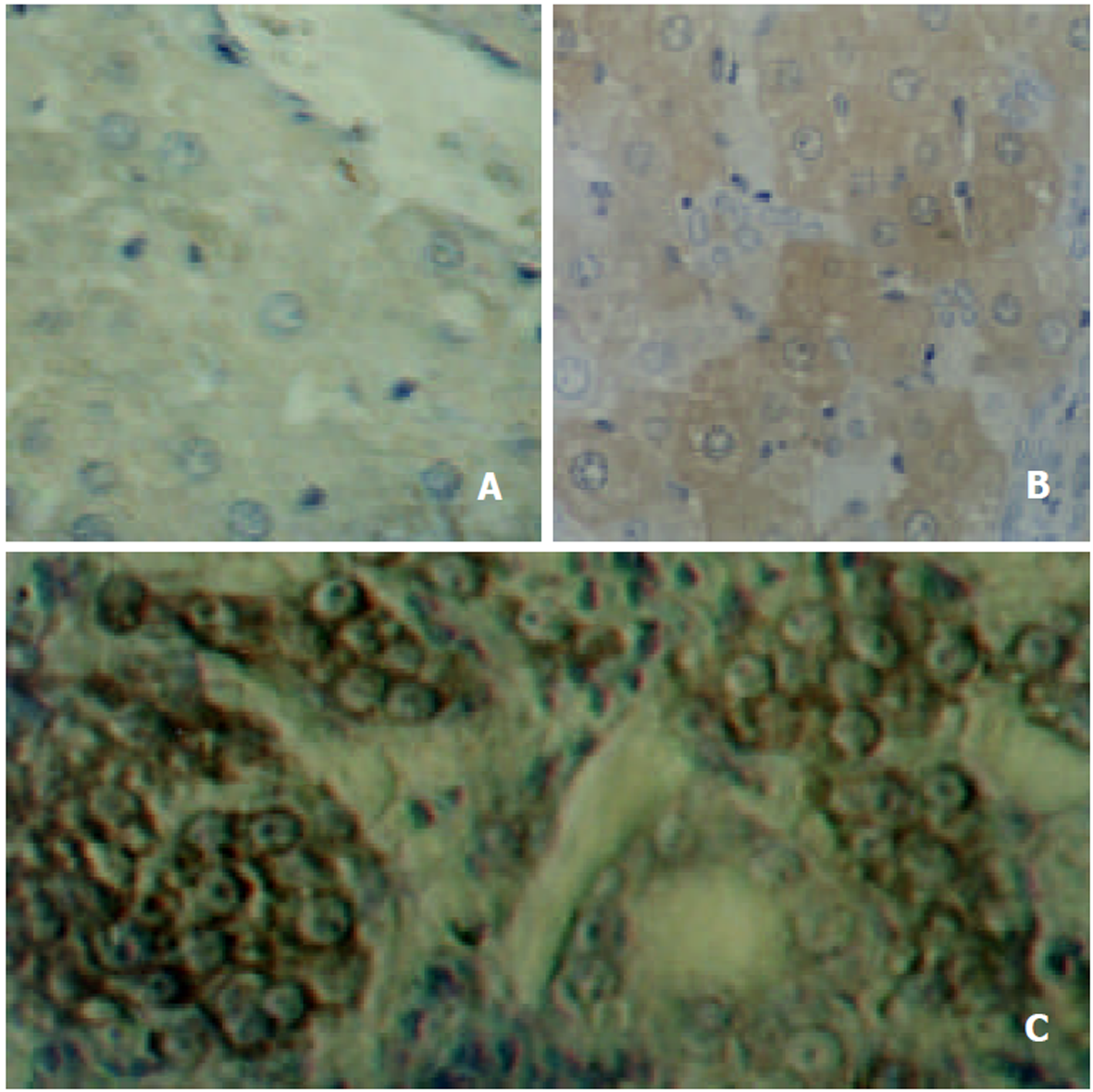
正常组8例cyclin D1表达均正常. 肝硬化组16例中有12例cyclin D1过表达, 阳性率为75.0%. 肝癌组11例中有4例cyclin D1过表达, 阳性率为36.4%. 肝硬化组和肝癌组的cyclin D1异常表达均高于正常组, 而且肝硬化组的cyclin D1异常表达又高于肝癌组(图2).
正常组8例端粒酶活性均为阴性. 肝硬化组16例中有9例端粒酶活性阳性, 阳性率为56.3%. 肝癌组11例中有10例端粒酶活性阳性, 阳性率为90.9%. 肝硬化组和肝癌组的端粒酶活性均高于正常组, 而且肝硬化组的端粒酶活性又低于肝癌组.
正常组8例cyclin D1表达均正常, 而且端粒酶活性均为阴性. 肝硬化组12例cyclin D1过表达中有8例端粒酶活性阳性, 4例cyclin D1表达正常中有1例端粒酶活性阳性. 肝癌组4例cyclin D1过表达中有3例端粒酶活性阳性, 7例cyclin D1表达正常中端粒酶活性均阳性. 肝硬化组的cyclin D1异常表达与端粒酶活性呈正相关, 肝癌组的cyclin D1异常表达与端粒酶活性呈负相关(表1).
| 分组 | cyclin D1表达 | 端粒酶活性 | 合计 | |||
| - | + | ++ | +++ | |||
| 肝硬化 | - | 0 | 0 | 0 | 0 | 0 |
| + | 3 | 1 | 0 | 0 | 4 | |
| ++ | 4 | 1 | 1 | 1 | 7 | |
| +++ | 0 | 1 | 3 | 1 | 5 | |
| 合计 | 7 | 3 | 4 | 2 | 16 | |
| 肝癌 | - | 0 | 0 | 1 | 2 | 3 |
| + | 0 | 0 | 2 | 2 | 4 | |
| ++ | 0 | 2 | 1 | 0 | 3 | |
| +++ | 1 | 0 | 0 | 0 | 1 | |
| 合计 | 1 | 2 | 4 | 4 | 11 | |
因为肿瘤细胞的永生化与端粒酶的活化和细胞周期的调控失常均有密切关系[1-10], 而且端粒酶与细胞周期的异常变化常同时出现在人类肿瘤中, 如: 在头颈癌[11]和皮肤黑色素瘤[12]等的研究中, 常发现端粒酶的活性增加和细胞周期调节因子cyclin D1等的异常改变, 所以二者的关系引起人们的广泛关注.
本实验的结果表明在肝细胞癌变过程中, 肝硬化组与肝癌组均有cyclin D1过表达和端粒酶活性增加, 而且高于正常组, 这与文献[13-29]报导一致. 另外, 肝细胞癌变过程中端粒酶活性越来越强, 肝癌组高于肝硬化组. 这可能是因为肝硬化时细胞逐渐增生, 端粒逐渐缩短, 部分激活端粒酶, 至肝癌时端粒酶活性更高. 肝细胞癌变过程中cyclin D1的表达先升高后下降, 肝硬化组高于肝癌组, 这可能与癌变程度有关. 一些研究认为cyclin D1过表达是肝癌发生的早期事件[20], 另一些研究发现肝癌中cyclin D1下调与大肝癌、低分化(III~IV级)有关, 在微小肝癌中未见, cyclin D1下调发生在肝癌的晚期. 本实验的结果表明, 随着肝硬化的逐渐加重, cyclin D1的过表达逐渐增多, 至肝癌早期达到高峰, 然后逐渐下降, 至肝癌晚期下调, 这似乎与他们的研究一致. 没有看到肝癌早期的高峰, 可能与肝癌组例数较少有关.
肝硬化组的cyclin D1异常表达与端粒酶活性呈正相关, 肝癌组的cyclin D1异常表达与端粒酶活性呈负相关, 这可能是因为cyclin D1在G1期开始积累, 在G1晚期达到高峰, 进入S期后迅速分解, 而端粒酶活性在G1/S期进行性增加并于S期达到最大, 在G2/M期活性极低, 所以cyclin D1的过表达促进了细胞周期的进程, 加速细胞周期进入S期, 然后cyclin D1迅速分解, 从而促进了端粒酶的活性达高峰.
肝细胞癌中细胞周期的调控失常与端粒酶的活性有关, 与乳腺癌、卵巢癌[30]、子宫内膜癌[31]等多种肿瘤的研究结果相似, 这为人们进一步研究肿瘤的发病机制、端粒酶抑制剂及细胞周期阻断剂在肿瘤治疗中的作用提供了理论依据.
| 1. | Yamanishi Y, Hiyama K, Ishioka S, Maeda H, Yamanaka T, Kurose Y, Yamakido M. Telomerase activity in the synovial tissues of chronic inflammatory and non-inflammatory rheumatic diseases. Int J Mol Med. 1999;4:513-517. [DOI] |
| 2. | Li Z, Kong C, Wang P, Liu X, Liu T. Telomerase activity in urine in diagnosis and recurrence surveillance of urothelial carcinoma. Chin Med J. 2002;115:1650-1652. |
| 3. | Segawa N, Gohji K, Azuma H, Iwamoto Y, Ohnishi K, Katsuoka Y. Telomerase activity in renal cell carcinoma by modified telomeric repeat amplification protocol assay. Int J Urol. 2003;10:153-159. [PubMed] |
| 4. | Shao JC, Wu JF, Wang DB, Qin R, Zhang H. Relationship between the expression of human telomerase reverse transcriptase gene and cell cycle regulators in gastric cancer and its significance. World J Gastroenterol. 2003;9:427-431. [DOI] |
| 5. | Masuda M, Suzui M, Yasumatu R, Nakashima T, Kuratomi Y, Azuma K, Tomita K, Komiyama S, Weinstein IB. Constitutive activation of signal transducers and activators of transcription 3 correlates with cyclin D1 overexpression and may provide a novel prognostic marker in head and neck squamous cell carcinoma. Cancer Res. 2002;62:3351-3355. [PubMed] |
| 6. | Gugger M, Kappeler A, Vonlanthen S, Altermatt HJ, Ris HB, Lardinois D, Borner MM, Heighway J, Betticher DC. Alterations of cell cycle regulators are less frequent in advanced non-small cell lung cancer than in resectable tumours. Lung Cancer. 2001;33:229-239. [DOI] |
| 7. | Umekita Y, Ohi Y, Sagara Y, Yoshida H. Overexpression of cyclinD1 predicts for poor prognosis in estrogen receptor-negative breast cancer patients. Int J Cancer. 2002;98:415-418. [DOI] |
| 8. | Zhang YJ, Chen SY, Chen CJ, Santella RM. Polymorphisms in cyclin D1 gene and hepatocellular carcinoma. Mol Carcinog. 2002;33:125-129. [DOI] |
| 9. | Itami A, Shimada Y, Watanabe G, Imamura M. Prognostic value of p27(Kip1) and CyclinD1 expression in esophageal cancer. Oncology. 1999;57:311-317. [DOI] |
| 10. | Sundarrajan M, Gupta S, Rao KV. Overexpression of cyclin D1 is associated with the decondensation of chromatin during den-induced sequential hepatocarcinogenesis. Cell Biol Int. 2002;26:699-706. [DOI] |
| 11. | Soria JC, Morat L, Commo F, Dabit D, Perie S, Sabatier L, Fouret P. Telomerase activation cooperates with inactivation of p16 in early head and neck tumorigenesis. Br J Cancer. 2001;84:504-511. [DOI] |
| 12. | Miracco C, Pacenti L, Santopietro R, Biagioli M, Fimiani M, Perotti R, Rubegni P, Pirtoli L, Luzi P. Detection of telomerase activity and correlation with mitotic and apoptotic indices, Ki-67 and expression of cyclins D1 and A in cutaneous melanoma. Int J Cancer. 2000;88:411-416. [DOI] |
| 13. | Pascale RM, Simile MM, De Miglio MR, Muroni MR, Calvisi DF, Asara G, Casabona D, Frau M, Seddaiu MA, Feo F. Cell cycle deregulation in liver lesions of rats with and without genetic predisposition to hepatocarcinogenesis. Hepatology. 2002;35:1341-1350. [DOI] |
| 14. | Sun BH, Wang T, Wu ZB, Ruan YB, Yang ML. Expression of cyclinD1 gene in primary hepatocellular carcinoma and its relationship with P16 and CDK4 expression. Shijie Huaren Xiaohua Zazhi. 2000;8:307-309. |
| 15. | Jung YJ, Lee KH, Choi DW, Han CJ, Jeong SH, Kim KC, Oh JW, Park TK, Kim CM. Reciprocal expressions of cyclin E and cyclin D1 in hepatocellular carcinoma. Cancer Lett. 2001;168:57-63. [DOI] |
| 16. | Ueta T, Ikeguchi M, Hirooka Y, Kaibara N, Terada T. Beta-catenin and cyclin D1 expression in human hepatocellular carcinoma. Oncol Rep. 2002;9:1197-1203. [PubMed] |
| 17. | Choi YL, Park SH, Jang JJ, Park CK. Expression of the G1-S modulators in hepatitis B virus-related hepatocellular carcinoma and dysplastic nodule: association of cyclin D1 and p53 proteins with the progression of hepatocellular carcinoma. J Korean Med Sci. 2001;16:424-432. [DOI] |
| 18. | Azechi H, Nishida N, Fukuda Y, Nishimura T, Minata M, Katsuma H, Kuno M, Ito T, Komeda T, Kita R, Takahashi R, Nakao K. Disruption of the p16/cyclin D1/retinoblastoma protein pathway in the majority of human hepatocellular carcinomas. Oncology. 2001;60:346-354. [DOI] |
| 19. | Joo M, Kang YK, Kim MR, Lee HK, Jang JJ. Cyclin D1 overexpression in hepatocellular carcinoma. Liver. 2001;21:89-95. [DOI] |
| 20. | Ito Y, Matsuura N, Sakon M, Miyoshi E, Noda K, Takeda T, Umeshita K, Nagano H, Nakamori S, Dono K, Tsujimoto M, Nakahara M, Nakao K, Taniguchi N, Monden M. Expression and prognostic roles of the G1-S modulators in hepatocellular carcinoma: p27 independently predicts the recurrence. Hepatology. 1999;30:90-99. [DOI] |
| 21. | Deane NG, Parker MA, Aramandla R, Diehl L, Lee WJ, Washington MK, Nanney LB, Shyr Y, Beauchamp RD. Hepatocellular carcinoma results from chronic cyclin D1 overexpression in transgenic mice. Cancer Res. 2001;61:5389-5395. [PubMed] |
| 22. | Jong HS, Lee HS, Kim TY, Im YH, Park JW, Kim NK, Bang YJ. Attenuation of transforming growth factor beta-induced growth inhibition in human hepatocellular carcinoma cell lines by cyclin D1 overexpression. Biochem Biophys Res Commun. 2002;292:383-389. [PubMed] [DOI] |
| 23. | Shimada M, Hasegawa H, Gion T, Utsunomiya T, Shirabe K, Takenaka K, Otsuka T, Maehara Y, Sugimachi K. The role of telomerase activity in hepatocellular carcinoma. Am J Gastroenterol. 2000;95:748-752. [DOI] |
| 26. | Wang HY, Yan RQ, Long JB, Wu QL. CyclinD1 amplification is associated with HBV DNA integration and pathology in human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi. 1999;7:98-100. |
| 30. | Terasawa K, Sagae S, Takeda T, Ishioka S, Kobayashi K, Kudo R. Telomerase activity in malignant ovarian tumors with deregulation of cell cycle regulatory proteins. Cancer Lett. 1999;142:207-217. [DOI] |
| 31. | Bonatz G, Frahm SO, Klapper W, Helfenstein A, Heidorn K, Jonat W, Krupp G, Parwaresch R, Rudolph P. High telomerase activity is associated with cell cycle deregulation and rapid progression in endometrioid adenocarcinoma of the uterus. Hum Pathol. 2001;32:605-614. [PubMed] [DOI] |