修回日期: 2003-01-20
接受日期: 2003-02-19
在线出版日期: 2003-10-15
探讨黄连素对人结肠癌细胞系HT-29的作用及与Ca2+有关的机制, 为黄连素作为一种新的结肠癌化学治疗药物进行理论上的准备和提供相关实验结果.
0.1 μmol/L, 0.3 μmol/L , 3.0 μmol/L, 30.0 μmol/L 的黄连素加入到HT-29结肠癌细胞系培养液中. 分别在第1 d, 第2 d, 第3 d测量各有关值. 以bapta-AM(33 μmol/L)为细胞内Ca2+螯合剂, verapamil (50 mmol/L)为细胞膜Ca2+通道拮抗剂, 分别抑制细胞内Ca2+和细胞膜Ca2+通道, 对比观察黄连素对细胞内Ca2+的影响及结肠癌细胞在不同Ca2+浓度条件下各有关值. 细胞记数检测细胞的生长和增生, 用免疫荧光分光光度法检测细胞内Ca2+浓度.
黄连素在浓度大于0.3 μmol/L时则有明显的量效关系抑制结肠癌细胞的生长. 黄连素在浓度大于0.3 μmol/L时对细胞内Ca2+的释放有抑制作用.
黄连素能够抑制Ca2+的释放可能为黄连素抑制HT-29细胞生长和增生的一个机制.
引文著录: 台卫平, 罗和生. 黄连素对HT-29人结肠癌细胞系 Ca2+的抑制作用. 世界华人消化杂志 2003; 11(10): 1642-1644
Revised: January 20, 2003
Accepted: February 19, 2003
Published online: October 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1642-1644
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1642
结肠癌是常见的恶性肿瘤之一, 他严重地危害着人们的身体健康. 目前临床上结肠癌常用的化疗药物毒副作用大, 寻找新的化疗效果好、毒副作用小的药物, 可以提高结肠癌患者的治疗效果, 提高患者的生存期及生存质量. 已有研究证实黄连素(berberine, ber)对平滑肌细胞内Ca2+有作用[1]. Ca2+作为第二信使可能以某种形式参与肿瘤生长和繁殖的调节[2]. 本题采用细胞培养的方法, 将黄连素加入到结肠癌细胞培养环境中, 观察培养上清中细胞内Ca2+的改变, 同时观察ber对结肠癌细胞生长、增生的影响, 为ber作为一种新的结肠癌化疗药物进行理论上的研究.
细胞系: HT-29细胞系购自中南大学湘雅医学院肿瘤研究所, 该细胞系由该所引自ATCC. 主要试剂和仪器: berberine (Sigma), Fura-2/AM (Sigma), bapta-AM(Sigma), verapamil(Sigma), 日本产岛津RF-5000荧光分光光度计.
1.2.1 细胞培养 HT-29以RPMI-1640为培养液, 加入100 mL/L热灭活的FBS及青霉素和链霉素, HT-29细胞置于37 °C, 50 mL/L CO2培养箱中培养, 以1×106/mL细胞接种24 h后, 分组加药: 终浓度为0.1 μmol/L, 0.3 μmol/L, 3.0 μmol/L, 30.0 μmol/L 的ber加入到HT-29结肠癌细胞系培养液中. 以bapta-AM (33 μmol/L)为细胞内Ca2+螯合剂, verapamil (30 mmol/L)为细胞膜Ca2+通道拮抗剂, 分别抑制胞内Ca2+及胞膜钙通道, 对比观察黄连素对细胞内Ca2+的影响. 24 h后测量钙离子浓度.
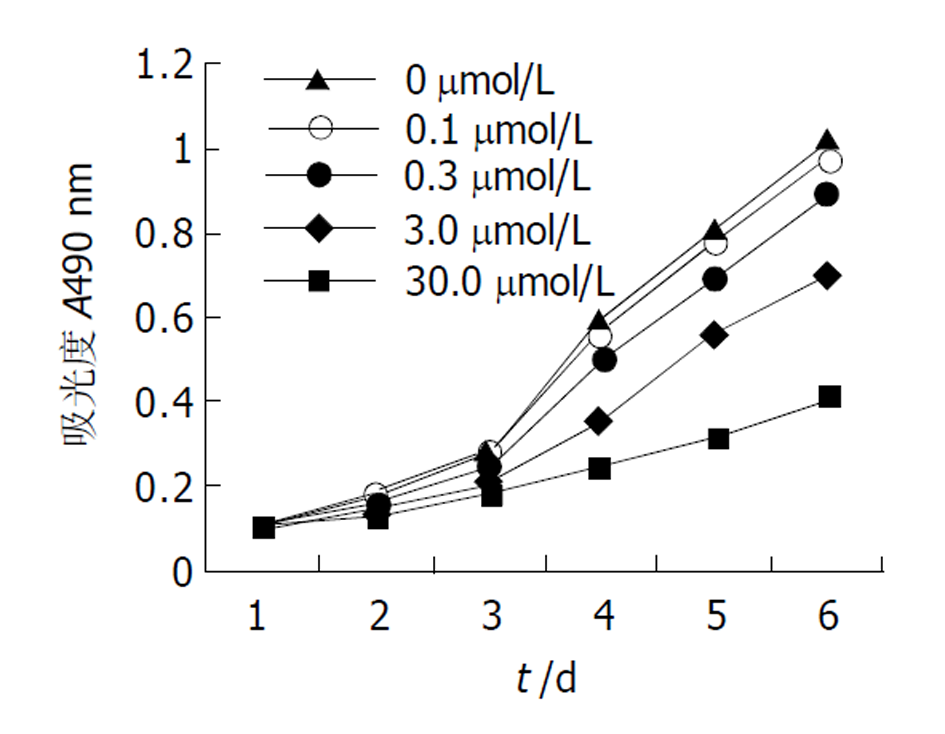
1.2.2 生长曲线的绘制 采用氮兰四唑盐实验(MTT)法, 取对数生长期的HT-29细胞按传代方式制成单细胞悬液, 以每孔4×103个细胞接种于96孔培养板中, 培养24 h后, 弃去原细胞培养液, 实验组每孔加入ber母液, 使其浓度为0.1 μmol/L、0.3 μmol/L、3.0 μmol/L、30.0 μmol/L, 对照组不加药, 换成与实验组相同体积的培养液. 每组每个时间点设6个平行孔, 继续培养箱内培养, 培养6 d, 每组各取6孔加入MTT溶液(5 mg/mL)20 μL, 37 °C孵育4 h后弃去孔内培养液, 每孔加入15 μLDMSO震荡10 min. 以空白孔调零, 在酶联免疫检测仪上测490nm波长处的每孔吸光度值(aborbance, A值), 求其平均值.
1.2.3 免疫荧光分光光度法检测钙离子浓度 经典的Fura-2/AM负载测钙[2]方法: 用无血清的培养液洗涤细胞, 将106细胞悬浮于1 mL含2.5 mmol/L Fura-2/AM和2 g/L BSA的BSS液中, 37 °C温浴80 min, 并不断振荡. 用冷BSS洗涤细胞2次, 去除胞外游离的Fura-2/AM. 将细胞悬浮在冷BSS中. 连续测定340 nm、380 nm波长激发光交替激发时, 490 nm发射新的荧光强度F, 同时记录荧光强度比值R (R = F340/F380). 扫描结果由Super Ion Probe Software软件自动分析, 依据公式[Ca2+]I = Kd(Rmin-R)/(R-Rmax)×(Ff2/Fb2), 其中Kd为Fura-2/AM与钙离子结合反应的解离平衡常数. Ff2/Fb2分别为钙离子游离与饱和时380 nm的荧光强度. 自发荧光以未负载Fura-2/AM的细胞同样方法测得, 计算时减去.
统计学处理 采用统计软件SPSS10.0分析. 根据资料性质, 实验数据均以mean±SD表示, 用t检验处理, P<0.05为有统计学差异.
不同浓度的ber对HT-29细胞干预后的生长曲线如图1. 细胞接种后, 对照组细胞几乎呈线性生长, 72 h后细胞数量大约增加8倍. ber干预后呈剂量依赖性抑制细胞增生, 生长曲线向右移, 3.0 μmol/L及30.0 μmol/L浓度抑制细胞增生较明显.
不同浓度的ber及verapamil、Bapta-AM对HT-29 [Ca2+]I的影响见表1. 结果显示当ber浓度在0.3-30 μmol/L之间时, 对[Ca2+]I有抑制作用, 但作用强度比胞膜Ca2+拮抗剂verapamil弱, 比胞内Ca2+螯合剂Bapta-AM更弱.
黄连素是从毛莨科黄连素(Coptis chinensi)根状茎中提取的一种季胺类化合物, 属于异喹啉生物碱, 主要用于肠道炎症伴发热, 其毒副作用很小. 近年来有研究证实ber对肿瘤细胞系也有作用[3]. 关于ber对肿瘤细胞的作用机制, 以前侧重于ber与细胞凋亡的关系[4]. Ca2+作为一种第二信使, 在细胞信号传导中起着重要作用[5].
细胞钙以结合钙(如与带负电的脂质及蛋白质结合)和游离钙两种形式存在. 在通常情况下, 细胞外液约50-60%是结合钙, 游离钙浓度约0.1-10 mmol/L, 细胞内钙则99.9%以上为结合钙, 主要分布于细胞核、线粒体、内质网/肌浆网和质膜, 而胞内游离钙极少. 细胞在非激活状态时, 胞内游离钙浓度仅为0.1μmol/L左右, 但胞内游离钙浓度的改变却是细胞生理功能的关键环节. 钙库如内质网、线粒体中的Ca2+缓冲能力很大, 在调节细胞质内Ca2+浓度中起着重要作用. 当一种刺激使胞外即使少量的Ca2+进入胞内溶质或钙库释放稍有增加时, 均可以导致胞质内Ca2+浓度大幅度增加, 继而引起一系列生理生化反应, 而起到传递细胞外信号的作用[6]. 由此可见, 胞内游离钙浓度的变化是细胞生理功能的重要物质基础, 胞内游离钙浓度的调节也就成为信息传递过程中的关键环节[7,8].
细胞游离钙浓度的变化是Ca2+跨膜转运的结果. 胞外Ca2+内流: 钙在细胞内外的电化学梯度大于其他许多离子, 细胞外Ca2+可通过被动扩散进入细胞内, 但控制胞外Ca2+内流最主要的途径还是通过细胞膜上的钙通道. 钙通道的种类很多, 但对其确切的分子结构大多还不完全清楚, 目前认为有五大钙通道: (1)电压操纵的钙通道(voltage-operated calcium channels, VOCs): 常见于应激细胞, 其活动受膜电压变化的影响, 存在于心肌、骨骼肌、神经元及内分泌等不同细胞中[9]. (1)受体操纵的钙通道(receptor-operated calcium channels, RCCs): 见于神经元与其靶细胞之间的突触传递[10]. (3) 第二信使操纵的钙通道(second messenger operated calcium channels, SMOCs): 受控于细胞的第二信使, 其电导很小[11]. (4)机械操纵的钙通道(mechanically operated calcium channels, MOCs): 内皮细胞上有牵张刺激的钙通道, 这一通道也存在于平滑肌与骨骼肌中[12]. (5)漏流钙通道(leak calcium channels, LCCs): 也称为静息钙通道或背景钙通道, 存在于平滑肌与心肌细胞膜中, 在无电化学或机械刺激时, 参与静息钙电流, 协助调节静息细胞内Ca2+浓度[13].
细胞内钙主要储存于内质网(endoplasmic reticulum, ER)/肌浆网(sarcoplasmic reticulum, SR)内. 目前已知ER/SR有两类钙库, 即IP3敏感(IP3-sensitive calcium pools, IsCaP)和IP3不敏感钙库(IisCaP), 分别通过上面的IP3受体通道和ryanodine受体通道释放Ca2+[14].
本研究发现浓度大于0.3 μmol/L时黄连素可以降低胞内Ca2+浓度, 结果如表所示. 在正常培养环境中, 胞内Ca2+浓度为145.5±10.7 nmol/L, verapamil 50 μmol/L可以使胞内Ca2+浓度降至110.3±8.7 nmol/L. 而verapamil的作用位点为VOCs, 这说明在HT-29细胞胞膜上存在VOCs, 这一点与Jamie et al [14]的研究结果相一致; 由于RCCs仅见于神经元与其靶细胞之间的突触传递; SMOCs由于受控于细胞的第二信使; MOCs仅见于血管内皮细胞、平滑肌和骨骼肌; LCCs仅存于心肌和平滑肌细胞膜, 参与静息钙电流. 故在HT-29细胞中黄连素降低[Ca2+]I胞外钙离子内流环节可能涉及到的通道为VOCs和SMOCs. 而在细胞内钙离子动员方面, Bischof et al [15]已经证实HT-29细胞胞内钙可以通过ER/SR钙库动员. 故本实验推测黄连素降低细胞内钙离子浓度其机制可能是通过VOCs或SMOCs或抑制ER、SR胞内钙离子的释放进而降低胞内钙离子浓度; 在观察的0.1-10.0 μmol/L浓度范围内, 其抑制用的强度弱于50 μmol/L的细胞膜L-通道拮抗剂verapamil (30 μmol/L黄连素组 vs 50 μmol/L verapamil组, P>0.05, 无显著性差异), 更不如33 μmol/L的胞内钙离子螯合剂bapta-AM (30 μmol/L黄连素组 vs 33 μmol/L bapta-AM组, P<0.05, 差异有显著性).
| 1. | Cao JW, Luo HS, Yu BP, Huang XD, Sheng ZX, Yu JP. Effects of berberine on intracellular free calcium in smooth muscle cells of Guinea pig colon. Digestion. 2001;64:179-183. [DOI] |
| 2. | Scott DA, de Souza W, Benchimol M, Zhong L, Lu HG, Moreno SN, Docampo R. Presence of a plant-like proton-pumping pyrophosphatase in acidocalcisomes of Trypanosoma cruzi. J Biol Chem. 1998;273:22151-22158. [DOI] |
| 3. | Li XK, Motwani M, Tong W, Bornmann W, Schwartz GK. Huanglian, A Chinese herbal extract inhibits cell growth by suppressing the expressing of cyclinB1 and inhibiting CDC2 kinase activity in human cancer cells. Mol Pharmacol. 2000;58:1287-1293. [DOI] |
| 4. | Lin HL, Liu TY, Wu CW, Chi CW. Berberine modulates expression of mdr1 gene product and the responses of digestive track cancer cells to Paclitaxel. Br J Cancer. 1999;81:416-422. [PubMed] [DOI] |
| 5. | Shen MR, Chou CY, Browning JA, Wilkins RJ, Ellory JC. Human cervical cancer cells use Ca2+ signalling, protein tyrosine phosphorylation and MAP kinase in regulatory volume decrease. J Physiol. 2001;537:347-362. [PubMed] [DOI] |
| 7. | Gomez-Lagunas F, Melishchuk A, Armstrong CM. Block of Shaker potassium channels by external calcium ions. Proc Natl Acad Sci USA. 2003;100:347-351. [PubMed] [DOI] |
| 8. | Kindzelskii AL, Petty HR. Intracellular calcium waves accompany neutrophil polarization, formylmethionylleucylp henylalanine stimulation, and phagocytosis: a high speed microscopy study. J Immunol. 2003;170:64-72. [PubMed] [DOI] |
| 9. | Yoshida M, Ishikawa M, Izumi H, De Santis R, Morisawa M. Store-operated calcium channel regulates the chemotactic behavior of ascidian sperm. Proc Natl Acad Sci USA. 2003;100:149-154. [PubMed] [DOI] |
| 10. | Mao L, Wang JQ. Group I metabotropic glutamate receptor-mediated calcium signalling and immediate early gene expression in cultured rat striatal neurons. Eur J Neurosci. 2003;17:741-750. [PubMed] [DOI] |
| 11. | Mitra P, Slaughter MM. Calcium-induced transitions between the spontaneous miniature outward and the transient outward currents in retinal amacrine cells. J Gen Physiol. 2002;119:373-388. [DOI] |
| 12. | Jorgensen NR, Teilmann SC, Henriksen Z, Civitelli R, Sorensen OH, Steinberg TH. Activation of L-type calcium channels is required for gap junction-mediated intercellular calcium signaling in osteoblastic cells. J Biol Chem. 2003;278:4082-4086. [DOI] |
| 13. | Subramani S, Vijayanand C, Tharion E. Differential effects of organic calcium-channel blockers on diastolic SR calcium-handling in the frog heart. Br J Pharmacol. 2002;137:756-760. [DOI] |
| 14. | Jamie H, Dyason K, Milne PJ, Grant G, Graz CJ. The influence of acetoacetate and butyrate on calcium influx and ATP concentrations in HT-29 cells. Pharmazie. 2001;56:332-336. [PubMed] |
| 15. | Bischof G, Brenman J, Bredt DS, Machen TE. Possible regulation of capacitative Ca2+ entry into colonic epithelial cells by NO and cGMP. Cell Calcium. 1995;17:250-262. [DOI] |