修回日期: 2003-03-20
接受日期: 2003-04-01
在线出版日期: 2003-10-15
建立检测SEN病毒(SENV)D和H基因型的聚合酶链反应(PCR)方法, 并将其应用到流行调查.
从GeneBank下载SENV序列, 在SENV开放读码框I的高度保守序列内自行设计外引物, 参考文献报道合成SENV D型和H型的型特异性引物作为内引物, 建立检测SENV D型和H型的巢式PCR方法, 并对深圳地区192名健康体检人群、48例急性甲肝患者、176例慢性乙肝患者、98例慢性丙肝患者和38例非甲-戊型肝炎患者的血清进行检测. 部分阳性PCR产物进行克隆和DNA序列分析.
巢式PCR方法的敏感性及特异性均好. SENV D和/或H型在健康成人、急性甲肝、慢性乙肝、慢性丙肝和非甲-戊型肝炎患者中的总感染率分别为30.7%、37.5%、64.8%、57.1%和44.7%. SENV D和/或H型在健康人群中的感染率低于慢性乙肝患者和慢性丙肝患者(P<0.001). 非甲-戊型肝炎及急性甲肝患者中的感染率略高于健康人群, 但无显著性差异(P>0.05).
巢式PCR方法可用于检测SENV感染. 深圳地区健康人群和急、慢性肝炎患者中存在SENV感染. SENV可能与HBV和HCV有相似的传播途径, 其致病性有待进一步研究阐明.
引文著录: 唐蔚, 彭晓谋, 张瑛, 王辉, 蒋晓玲, 周伯平. 聚合酶链反应检测SEN病毒D型和H型方法的建立及初步应用. 世界华人消化杂志 2003; 11(10): 1540-1543
Revised: March 20, 2003
Accepted: April 1, 2003
Published online: October 15, 2003
To establish a polymerase chain reaction (PCR) method to detect 2 SENV subtypes (SENV-D and SENV-H) in sera from patients with hepatitis and healthy adults.
The outer primers were designed based on the data of SENV D and H subtypes from geneBank, while sequences of the inner pair of primers were obtained from newly published medical literature, both of which were used to establish a nested-PCR. SENV-D and H in sera from 192 healthy adults and 48 patients with acute hepatitis A, 176 with chronic hepatitis B, 98 with chronic hepatitis C, and 38 with non A-E hepatitis were detected by this method.
The specificity and sensitivity of the nested-PCR test were perfect. The prevalence of SENV-D and/or SENV-H (SENV-D/H) infections in healthy adults and patients with acute hepatitis A, chronic hepatitis B, chronic hepatitis C and non A-E hepatitis were 30.7%, 37.5%, 64.8%, 57.1% and 44.7%, respectively. SENV D/H infection were more frequent in patients with chronic hepatitis B and chronic hepatitis C than in healthy adults (P<0.001), but showed no significant difference between patients with non A-E and healthy adults (P>0.05).
This nested PCR can be used to detect SEN virus. SENV infections do occur in Shenzhen. SENV may share similar modes of transmission to that of HBV and HCV, but whether it plays a causal role in non A-E hepatitis remains to be elucidated.
- Citation: Tang W, Peng XM, Zhang Y, Wang H, Jiang XL, Zhou BP. Establishment and application of polymerase chain reaction for detecting D and H subtypes of SEN virus. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1540-1543
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1540.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1540
迄今仍有10%的输血相关肝炎、20%的社区获得性肝炎和30%的慢性肝病肝硬化没有明确的病因, 提示存在着不明致病原[1-3]. HGV/GBV-C[4,5]和TTV[6]相继被用来解释非甲-戊型肝炎, 但是这一结论在后来的研究中没有得到证实[7-9]. SEN病毒(SEN virus, SENV)最早是由意大利学者Primi et al [10]于1999年从1例有静脉药瘾的HIV-1型携带者的血清中发现的, 虽然与TTV结构相似, 但与TTV原型(TTV prototype)核苷酸同源性55%, 而氨基酸同源性只有37%[11]. SENV属于TTV相关病毒超家族(super family of TTV-related viruses), 是一组无包膜的单链环状DNA病毒, 共分8个型别. 一般认为致病性较弱或无致病性[12,13] 但不能排除部分基因型致病的可能性. 有研究显示SENV D型和H型与输血相关的非甲-戊型肝炎的联系最为密切[14]. 为此, 我们参照文献[10]报道的SENV D型和H型的型特异性引物序列, 建立了巢式PCR方法, 并对深圳地区的部分人群中SENV两亚型的感染状况进行了初步研究.
健康成人192例的血清于1999-08某社区健康体检时收集, 急性甲肝 48例、慢性乙型肝炎176例、慢性丙型肝炎96例及非甲-戊型肝炎38例为我院2000-09/2001-12住院及门诊病例, 诊断参照2001年《病毒性肝炎防治方案》[15]. 10×Taq酶聚合酶缓冲液、Taq DNA聚合酶、pMD 18 T载体、DL 2000 DNA Marker购自TaKaRa (大连)公司, dNTPs和大肠杆菌DH5α为美国Promega公司产品. PCR产物纯化试剂盒为QiaGen公司产品, 质粒抽提纯化试剂盒购自美国Omega公司, 测序试剂盒BigDye Terminator Reaction Kit V 2.0和ABI Prisms 3100遗传分析仪均出自美国应用生物系统公司.ICycler DNA扩增仪为Bio-Rad公司产品.
从GeneBank下载SENV的基因序列, 采用Primer Premier 5.0软件辅助分析, 在开放读码框I(ORF1)的高度保守序列内设计SENV D和H型的通用外引物SENV1和SENV2, 其产物的理论大小为588 bp. SENV1 (sense primer, 正义引物)序列: 5'-CCSAAACTRTTTGAAGAC-3', SENV2(antisense primer, 反义引物)序列: 5'-TRTTTGAGTACCAGCCT-3'; 以文献[10]公布的SENV-D型和H型的型特异性引物作为内引物.SENV-D的正义引物(D10S)序列为: 5'-GTAACTTTGCGGTCAACTGCC-3'; SENV-H的正义引物(C5S)序列为: 5'-GGTGCCCCTWGTYAGTTGGCGGTT-3'; SENV-D和H型的共用反义引物(L2AS)序列为: 5'-CCTCGGTTKSAAAKGTYTGATAGT-3'. SENV-D产物的理论大小为224 bp. SENV-H产物的理论大小为230 bp. 引物由大连宝生物工程技术有限公司合成. 在血清50 μL中加入裂解液120 μL, 混匀后61.8 °C水浴30 min, 加入重蒸酚150 μL及仿醇50 μL混匀10 000 r/min离心10 min, 吸上清160 μL, 经醋酸钠乙醇溶液250 μL -30 °C冷冻沉淀30 min后, 以15 000 r/min×10 min离心, 除上清, 700 mL/L乙醇洗涤1次, 室温风干, 去离子水5 μL重悬浮, 作为PCR模板. 第1次PCR反应体系含DNA提取液5 μL、dNTP 200 μmol/L, Taq DNA聚合酶2U、外引物各为0.5 μmol/L及1.5 mmol/L MgCL2. 扩增条件为94 °C 3 min预变性, 然后94 °C 45 s变性, 55 °C 30 s退火, 72 °C 45 s延伸, 共35个循环, 再72 °C延伸7 min. 取扩增产物2 μL作为摸板, 改换内引物, 同条件进行第2次PCR. 取扩增产物10 μL进行琼脂糖凝胶电泳, 透射紫外灯下与DNA Marker比对, 观察结果. 取阳性第2次PCR片段切胶纯化, 分装2个0.5 mL离心管, 一管直接测序用, 另一管按T载体产品说明书操作进行连接反应, 反应液转化大肠杆菌DH5α感受态细胞. 经蓝白斑试验, 挑选白色菌落, 用PCR方法鉴定阳性克隆, 按试剂盒要求小剂量制备质粒DNA作为模板. 采用M13 (-47) 通用引物, 按PE公司BigDye Terminator Reaction Kit V2.0测序试剂盒说明书, 在ABI Prism 3100 Genetic Analyzer上进行测序. 将阳性血清各1份逐级对倍稀释检验本方法的敏感性. 选择阳性及阴性标本各15份, 设立3个平行管进行PCR反应来评价其特异性和重复性. 采用优化后的巢式PCR方法分别对健康成人192例、急性甲肝患者48例、慢性乙肝患者176例、慢性丙肝患者98例和非甲-戊型肝炎患者38例的血清进行SENV D型和H型DNA的检测. 每批设空白对照1份、阳性对照(3次PCR反应均为阳性的血清标本)1份、阴性对照(3次PCR反应均为阴性的血清标本)2份. 随机选择5例SENV D型和5例SENV H型阳性PCR产物直接测序进行DNA序列分析.
统计学处理 组间数据比较用x2检验.
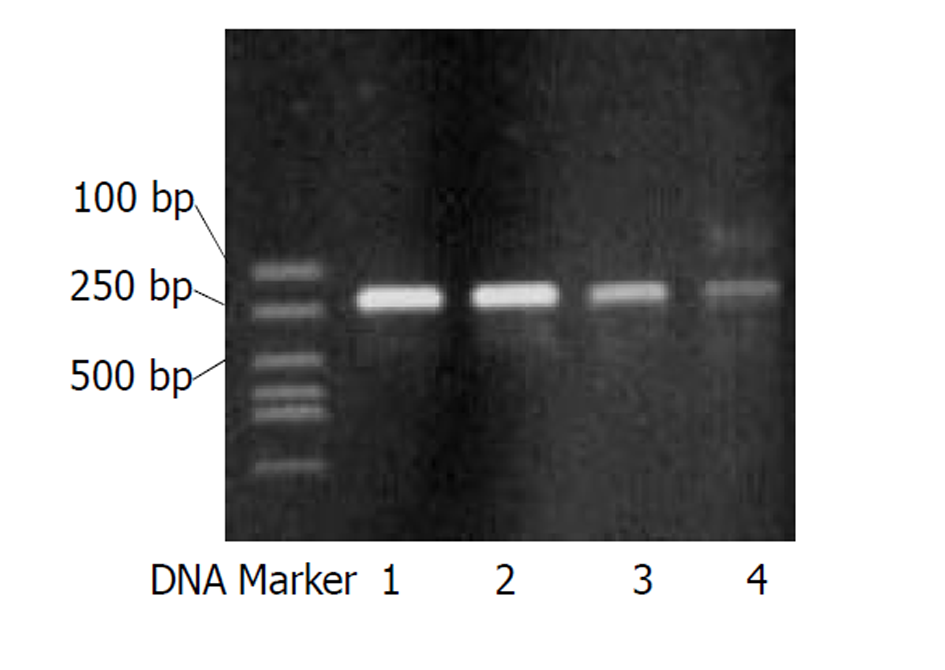
SENV D和H型阳性产物分子大小与设计相符, SENV D型约为224 bp, SENV H型约为230 bp(图1).
阳性血清1例经24倍稀释, 另1例经25倍稀释仍可见清晰的扩增条带(图1). 30份血清3个平行管重复实验的结果: SENV D型及H型DNA PCR重复实验的符合率阳性标本均为100% (15/15), 阴性标本均为93.3% (14/15).
SENV D型和H型深圳株分别与GeneBank主要分离株DNA序列比较的排序图见图2, 图3. 核苷酸序列同源性比较见表1, 表2.
| SZ-6 | AB059352 | AX025730 | AB075263 | AY072045 | |
| AY072045 | 88.9 | 82.3 | 84.3 | 90.9 | *** |
| AB075263 | 88.4 | 82.8 | 85.4 | *** | |
| AX025730 | 82.8 | 98.0 | *** | ||
| AB059352 | 80.3 | *** | |||
| SZ-6 | *** |
| SZ-41 | AB059353 | AX025838 | AB075283 | AY153769 | |
| AY153769 | 95.0 | 80.7 | 84.0 | 93.9 | *** |
| AB075283 | 90.1 | 85.6 | 89.0 | *** | |
| AX025838 | 80.1 | 95.0 | *** | ||
| AB059353 | 77.3 | *** | |||
| SZ-41 | *** |
健康人群和肝炎患者血清中SENV D型及H型检测结果见表3. SENV的总感染率为47.8%. D和H型的总检出率分别为39.3%和38.6%. 混合感染约占总感染病例的62.9%. 不同人群中均以混合感染为主, 混合感染率为18.2-44.9%. 各组之间D或H型单独感染、混合感染和D或H型总感染率均无统计学差异.
10份SENV D型和H型PCR扩增产物的序列分析的结果与直接判断的结果符合率为100%.
10份SENV D型和H型PCR扩增产物的序列分析的结果与直接判断的结果符合率为100%.
自SEN病毒被发现以来, 各国学者[16-20]展开了有关其流行情况和致病性的研究. 国外的大部分研究是在Primi博士的领导下进行的, 由Diasorin公司申请了专利. 我们摘录了SENV D和H型特异性引物的序列, 并自行设计了巢式PCR方法, 以期获得与国际同行有可比性的资料. 经DNA序列分析, 等比稀释等证实建立的巢式PCR技术有极高的敏感性、特异性和重复性.
意大利和美国的志愿献血员中SENV-D/H的感染率为2% [10,14], 而日本同样的人群中为10%[16]. 台湾健康成人的感染率为15%[16]. 本研究显示, 健康成人的SENV-D/H的感染率为30.7%. 该结果似乎较其他学者报道的高, 可能与本研究使用了敏感的巢式PCR技术有关. 但SENV感染可能是全球性的, 其感染率也可能存在显著的地区差异.慢性乙肝患者和慢性丙肝患者中SENV D和(或)H的感染率分别为64.8%和57.1%, 比健康人群中的30.7%高(P<0.001), 表明SENV可能与HBV和HCV有相似的传播途径[16]. 而在非甲非戊患者和急性甲肝患者中的感染率分别为44.5%和37.5%, 与健康体检人群之间无显著性差异(P>0.05), 进一步证实SENV D和H型虽然与非甲-戊型肝炎联系有一定关系, 但其意义有待进行一步研究阐明.
本研究中D型与H型混合感染的比例较高, 与国外报道的结果有较大差异[16], 其原因可能与该地区SENV感染率高, 合并感染和重叠感染机会较大有关.也不排除是由于单链环型DNA病毒的聚合酶缺乏效对功能而引起的准种现象. 如果是这样的话, SENV的基因分型方法有待进一步改良.
| 1. | Alter HJ, Bradley DW. Non-A, non-B hepatitis unrelated to the hepatitis C virus (non-ABC). Semin Liver Dis. 1995;15:110-120. [PubMed] [DOI] |
| 2. | Alter MJ, Margolis HS, Krawczynski K, Judson FN, Mares A, Alexander WJ, Hu PY, Miller JK, Gerber MA, Sampliner RE. The natural history of community-acquired hepatitis C in the United States. The sentinel counties chronic non-A, non-B hepatitis study team. N Engl J Med. 1992;327:1899-1905. [PubMed] [DOI] |
| 3. | Kodali VP, Gordon SC, Silverman AL, McCray DG. Cryptogenic liver disease in the United States: further evidence for non-A, non-B, and non-C hepatitis. Am J Gastroenterol. 1994;89:1836-1839. [PubMed] |
| 4. | Linnen J, Wages J Jr, Zhang-Keck ZY, Fry KE, Krawczynski KZ, Alter H, Koonin E, Gallagher M, Alter M, Hadziyannis S, Karayiannis P, Fung K, Nakatsuji Y, Shih JW, Young L, Piatak M Jr, Hoover C, Fernandez J, Chen S, Zou JC, Morris T, Hyams KC, Ismay S, Lifson JD, Kim JP. Molecular cloning and disease association of hepatitis G virus: a transfusion-transmissible agent. Science. 1996;271:505-508. [DOI] |
| 5. | Simons JN, Leary TP, Dawson GJ, Pilot-Matias TJ, Muerhoff AS, Schlauder GG, Desai SM, Mushahwar IK. Isolation of novel virus-like sequences associated with human hepatitis. Nat Med. 1995;1:564-569. [DOI] |
| 6. | Nishizawa T, Okamoto H, Konishi K, Yoshizawa H, Miyakawa Y, Mayumi M. A novel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology. Biochem Biophys Res Commun. 1997;241:92-97. [PubMed] [DOI] |
| 7. | Alter HJ, Nakatsuji Y, Melpolder J, Wages J, Wesley R, Shih JW, Kim JP. The incidence of transfusion-associated hepatitis G virus infection and its relation to liver disease. N Engl J Med. 1997;336:747-754. [PubMed] [DOI] |
| 8. | Naoumov NV, Petrova EP, Thomas MG, Williams R. Presence of a newly described human DNA virus (TTV) in patients with liver disease. Lancet. 1998;352:195-197. [DOI] |
| 9. | Matsumoto A, Yeo AE, Shih JW, Tanaka E, Kiyosawa K, Alter HJ. Transfusion-associated TT virus infection and its relationship to liver disease. Hepatology. 1999;30:283-288. [PubMed] [DOI] |
| 10. | Primi D, Fiordalisi G. Identification of SENV genotypes. International patent number WO0028039. 2000;//ep.espacenet.com/). |
| 11. | Tanaka Y, Primi D, Wang RY, Umemura T, Yeo AE, Mizokami M, Alter HJ, Shih JW. Genomic and molecular evolutionary analysis of a newly identified infectious agent (SEN virus) and its relationship to the TT virus family. J Infect Dis. 2001;183:359-367. [PubMed] [DOI] |
| 12. | Bowden S. New hepatitis viruses: contenders and pretenders. J Gastroenterol Hepatol. 2001;16:124-131. [DOI] |
| 13. | Umemura T, Tanaka Y, Kiyosawa K, Alter HJ, Shih JW. Observation of positive selection within hypervariable regions of a newly identified DNA virus (SEN virus)(1). FEBS Lett. 2002;510:171-174. [DOI] |
| 14. | Umemura T, Yeo AE, Sottini A, Moratto D, Tanaka Y, Wang RY, Shih JW, Donahue P, Primi D, Alter HJ. SEN virus infection and its relationship to transfusion-associated hepatitis. Hepatology. 2001;33:1303-1311. [PubMed] [DOI] |
| 16. | Kao JH, Chen W, Chen PJ, Lai MY, Chen DS. Prevalence and implication of a newly identified infectious agent (SEN virus) in Taiwan. J Infect Dis. 2002;185:389-392. [PubMed] [DOI] |
| 17. | Shibata M, Wang RY, Yoshiba M, Shih JW, Alter HJ, Mitamura K. The presence of a newly identified infectious agent (SEN virus) in patients with liver diseases and in blood donors in Japan. J Infect Dis. 2001;184:400-404. [PubMed] [DOI] |
| 18. | Schroter M, Laufs R, Zollner B, Knodler B, Schafer P, Sterneck M, Fischer L, Feucht HH. Prevalence of SENV-H viraemia among healthy subjects and individuals at risk for parenterally transmitted diseases in Germany. J Viral Hepat. 2002;9:455-459. [DOI] |
| 19. | Umemura T, Alter HJ, Tanaka E, Yeo AE, Shih JW, Orii K, Matsumoto A, Yoshizawa K, Kiyosawa K. Association between SEN virus infection and hepatitis C in Japan. J Infect Dis. 2001;184:1246-1251. [PubMed] [DOI] |
| 20. | Wilson LE, Umemura T, Astemborski J, Ray SC, Alter HJ, Strathdee SA, Vlahov D, Thomas DL. Dynamics of SEN virus infection among injection drug users. Infect Dis. 2001;184:1315-1319. [PubMed] [DOI] |