修回日期: 2002-03-20
接受日期: 2003-03-25
在线出版日期: 2003-10-15
观察丁酸钠对结肠癌细胞株HT-29的组织蛋白酶D(Cath-D)表达水平的影响.
运用细胞增生抑制实验(MTT法), 光镜观察, 免疫细胞化学技术观察丁酸钠对HT-29细胞株的生长, 凋亡和对Cath-D表达水平的影响.
丁酸钠能抑制HT-29细胞株增生, 诱导凋亡, 并促进Cath-D表达.
丁酸钠能够影响Cath-D的表达水平, 这暗示了Cath-D在丁酸钠诱导的凋亡中可能伴有重要角色.
引文著录: 李曦, 罗和生, 李凡. 丁酸钠对结肠癌细胞株HT-29组织蛋白酶D表达水平的影响. 世界华人消化杂志 2003; 11(10): 1508-1510
Revised: March 20, 2002
Accepted: March 25, 2003
Published online: October 15, 2003
To detect the effect of sodium butyrate on the expression of cathepsins D(Cath-D) in HT-29 colon carcinoma cell.
MTT assay, light microscopy and immunocytochemistry were used to observe the growth, apoptosis and expression of Cath-D in HT-29 cell line after treated by sodium butyrate
Sodium butyrate inhibited the growth of HT-29 cell lines, induced apoptosis and increased the expression of Cath-D in HT-29 cell line.
Sodium butyrate can affect the expressoon of Cath-D and may play an important role in apoptosis of HT-29 cell line.
- Citation: Li X, Luo HS, Li F. Effect of sodium butyrate on the expression of cathepsins D. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1508-1510
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1508
丁酸钠是由结肠共生细菌通过发酵肠道内食物纤维所产生的一种四碳短链脂肪酸, 他对体外培养细胞的基因表达调节, 细胞生长及蛋白质和酶的产生均有重要影响, 能够抑制多种肿瘤细胞的生长, 诱导细胞分化, 同时丁酸钠还能通过许多途径诱导肿瘤细胞发生凋亡[1-5]. 组织蛋白质酶D (Cath-D)则是一种普遍存在的天冬氨酸蛋白质, 主要分布于溶酶体中, 有研究表明Cath-D可能参与肿瘤细胞的凋亡过程, 其在细胞质内的含量上升可能诱导细胞的凋亡. 他也可以促进某些肿瘤细胞如乳腺癌细胞的侵袭生长[6,7]. 结肠HT-29细胞保留了肠腺多能干细胞的特点, 能被诱导分化成杯状细胞样或肠吸收上皮样细胞, 是用于研究的一种重要的结肠癌细胞株. 我们运用MTT法, 光镜观察, 免疫细胞化学技术探讨丁酸钠对结肠癌细胞株HT-29抑制作用和对Cath-D表达水平影响.
HT-29细胞系来自湘雅医院肿瘤研究所, 丁酸钠, 四甲基偶氮唑盐(MTT), 二甲基桠枫为Sigma产品, 小牛血清为国产三利公司产品, RPMI1640培养基为Hyclone公司产品, Cath-DmAb (1: 50)为ADI公司产品, SP试剂盒为北京中山生物有限公司产品.
HT-29细胞株于含100 ml/L的小牛血清, 100 KU/L青霉素, 100 mg/L链霉素的RPMI 1640培养基中, 在37 °C, 50 ml/L CO2, 饱和湿度条件下培养, 增生, 传代, 扩增以备用. HT-29细胞在丁酸钠处理后, 在倒置显微镜下观察细胞变化. 将对数生长期HT-29细胞配成2.0 107/L的单细胞悬液, 接种于96 孔培养板中, 每孔200 μL, 于37 °C, 50 ml/L CO2的培养箱中培养48 h后, 分别加入1.0 mol/L, 3.0 mol/L. 5.0 mol/L丁酸钠, 对照组为不含丁酸钠的培养液, 每种剂量的药物设4个复孔, 继续培养到12 h, 24 h, 36 h, 48 h时, 每组往一孔中加入5 g/LM TT 20 μL, 孵育4 h, 再加入二甲基亚砜100 μL微振荡, 使紫兰色沉淀完全溶解, 用酶标仪测490 nm处的吸光度. 细胞抑制率 = (1-试验孔A/对照孔A)×100%. 将15×15 mm盖玻片裁成6×6 mm大小放置于24孔培养板中, 将3.0 ×108 /L单细胞悬液接种于24孔培养板中, 上述条件下培养48 h, 待细胞长成单层后, 更换培养液, 分别加入不同溶度的丁酸钠, 使丁酸钠溶度为1.0 mol/L, 3.0 mol/L, 5.0 mol/L.对照组为不含丁酸钠的培养液, 每组设4个复孔, 继续培养到24 h, 48 h, 72 h时, 分别从各组中取出一块盖玻片, 固定后, 对细胞切片进行组织蛋白酶D免疫细胞化学染色, 染色结果用计算机图像分析系统处理, 自动记录吸光度值(A值), 每张切片取5个视野, 取A均值.
统计学处理 采用SPSS9.0 统计软件包进行分析. 计量资料用均数±标准差表示, 组间比较用方差分析.
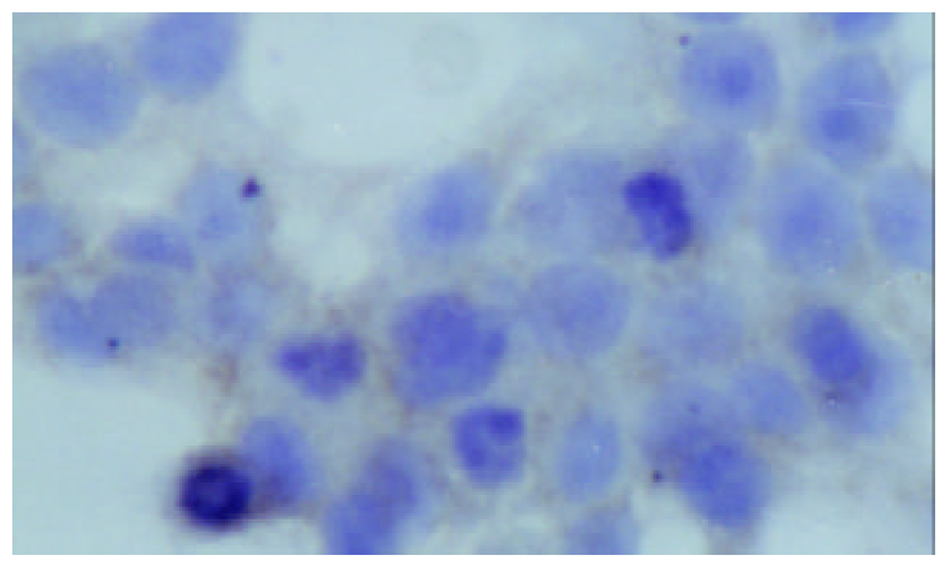
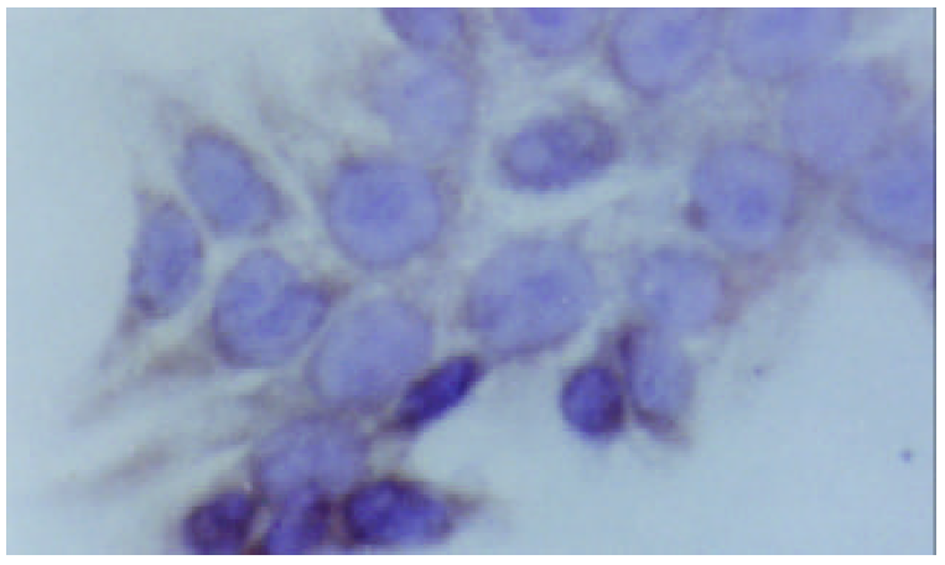
对照组细胞增生旺盛, 加入1 mmoL /L丁酸钠作用12 h, 24 h, 36 h, 48 h后, 细胞生长抑制率由7.4%上升至51.9%, 2 mmoL/L使HT-29细胞生长抑制率由18.3%上升至63.3%, 5 mmol/L丁酸钠则使细胞生长抑制率由27.6%上升至72.8%, 表明丁酸钠对人结肠癌HT-29细胞生长抑制作用随浓度时间延长而增加, 呈时间、剂量依赖性. 低分化的人结肠癌HT-29细胞呈多边形, 部分细胞为圆形, 不规则, 丁酸钠处理的细胞24 h后, 凋亡细胞已明显增多, 每高倍视野下凋亡细胞为平均为10.4个, 对照组只有2.0个. 总之, 丁酸钠处理的细胞与未加干预相比, 可见漂浮凋亡细胞明显增多, 以及细胞固缩变小等凋亡变化. 免疫细胞化学染色表明丁酸钠可以促进组织蛋白酶D表达, 组织蛋白酶D在未分化的HT-29细胞株中染色较浅, 在经过丁酸钠干预后, Cath-D在细胞内含量上升(图1, 图2), 但无明显时间剂量依赖(表1).
丁酸钠是可抑制癌细胞株的生长, 促进癌细胞的分化、成熟. 通过多种途径诱导肿瘤细胞发生凋亡, 如通过Fas, H2O2诱导凋亡[8-10]. Cath-D在限制性蛋白水解中伴有最重要角色[11-13]. 剔除Cath-D基因的实验证明, Cath-D又是小肠发育的关键酶.乳腺癌中 Cath-D表达上升, 并参与溶解基底膜, 细胞外基质及结缔组织, 促进肿瘤细胞侵袭[6,7]. Cath-D的表达水平是否与大肠癌Dakes分期有关存在争议, 而Cath-D在大肠癌细胞中的分布方式特点更能够反映出大肠肿瘤的潜在侵袭性[14,15]. Cath-D与肿瘤细胞凋亡的关系也十分密切, 可参与线粒体介导的凋亡. 本实验表明丁酸钠能够抑制结肠癌细胞株HT-29的生长和诱导细胞凋亡. 同时还能够促进Cath-D在HT-29细胞内的表达. 此结果与Tan et al [16]用Western blot分析测得丁酸钠作用HT-29细胞后Cath-D的表达明显上升的结论相一致. 从细胞增生抑制实验结果可以看出, 丁酸钠明显抑制HT-29的生长, 且这种生长抑制作用随时间, 浓度的增加而加强, 呈时间, 剂量依赖性.丁酸钠抑制肿瘤细胞生长的机制非常复杂, 至今仍不明确, 研究表明可能是丁酸钠通过组蛋白的超乙酰化激活一些转录因子, 并通过这些转录因子激活某些特定基因, 最终抑制细胞生长, 同时还有可能通过DNA甲基化, 组蛋白磷酸化等许多其他途径来发挥抑制作用[1,17-22].
我们还通过光镜观察和免疫细胞化学技术表明丁酸钠处理的细胞与对照相比凋亡细胞明显增多, 而且同时伴随着Cath-D的表达上升, 提示Cath-D的表达增高可能与凋亡有关. 丁酸钠促进细胞凋亡的机制研究有很多, 可通过多种途径发挥其诱导凋亡的作用, 如丁酸钠可能通过产生H2O2来诱导凋亡. Giardina et al [10]发现丁酸钠处理HT-29细胞后, H2O2在细胞内含量明显上升, 且这种上升是持续的, 超过24 h. Roberg et al [23]的 研究表明H2O2则可以诱导溶酶体失稳定, 从而促使Cath-D 从溶酶体中释放到细胞质中. 而Cath-D与细胞凋亡密切相关, Cath-D能够调节干扰素γ和肿瘤坏死因子介导的细胞程序性死亡, 如PepstatinA (Cath-D抑制剂), 可以抑制某些细胞株的细胞凋亡, 干扰肿瘤坏死因子γ诱导的程序性细胞死亡, Cath-D 在P53介导的凋亡中也伴有重要角色[24-26]. 此外, 一些诱导凋亡物质也可以通过Cath-D来诱导溶酶体介导的凋亡, 如CD437, α-TOS等. 这些物质能促使Cath-D从溶酶体中释放到细胞质中, 这一事件伴随着细胞色素C的释放和线粒体膜的潜在性破坏, 最终引起凋亡[26,27]. 通过以往研究和本实验结果可以推测丁酸钠可能存在着一种诱导凋亡的新机制, 即丁酸钠通过H2O2诱导Cath-D表达上升和从溶酶体中释放到细胞质中来诱导凋亡.
| 1. | Domon-Dell C, Wang Q, Kim S, Kedinger M, Evers BM, Freund JN. Stimulation of the intestinal Cdx2 homeobox gene by butyrate in colon cancer cells. Gut. 2002;50:525-529. [DOI] |
| 2. | Santini V, Gozzini A, Scappini B, Grossi A, Rossi-Ferrini P. Searching for the magic bullet against cancer: the butyrate saga. Leuk Lymphoma. 2001;42:275-289. [PubMed] [DOI] |
| 3. | Gaschott T, Werz O, Steinmeyer A, Steinhilber D, Stein J. Butyrate-induced differentiation of Caco-2 cells is mediated by vitamin D receptor. Biochem Biophys Res Common. 2001;288:690-696. [PubMed] [DOI] |
| 4. | Witt O, Schulze S, Kanbach K, Roth C, Pekrun A. Tumor cell differentiation by butyrate and environmental stress. Cancer Lett. 2001;171:173-182. [DOI] |
| 6. | Glondu M, Liaudet-Coopman E, Derocq D, Platet N, Rochefort H, Garcia M. Down-regulation of cathepsin-D expression by antisense gene transfer inhibits tumor growth and experimental lung metastasis of human breast cancer cells. Oncogene. 2002;21:5127-5134. [PubMed] [DOI] |
| 7. | Heylen N, Vincent LM, Devos V, Dubois V, Remacle C, Trouet A. Fibroblasts capture cathepsin D secreted by breast cancer cells: possible role in the regulation of the invasive process. Int J Oncol. 2002;20:761-767. [DOI] |
| 8. | Gaschott T, Maassen CU, Stein J. Tributyrin, a butyrate precursor, impairs growth and induces apoptosis and differentiation in pancreatic cancer cells. Anticancer Res. 2001;21:2815-2819. [PubMed] |
| 9. | Chopin V, Toillon RA, Jouy N, Le-Bourhis X. Sodium butyrate induces P53-independent, Fas-mediated apoptosis in MCF-7 human breast cancer cells. Br J Pharmacol. 2002;135:79-86. [PubMed] [DOI] |
| 10. | Giardina C, Inan MS. Nonsteriodal anti-inflammatory drugs, short-chain fatty acids and reactive oxygen metabolism in human colorectal cancer cells. Biochem Biophy Acta. 1998;1401:277-288. [DOI] |
| 11. | Berg T, Gjoen T, Bakke O. Physiological functions of endosomal proteolysis. Biochem J. 1995;307:313-326. [PubMed] |
| 12. | Berchem G, Glondu M, Gleizes M, Brouillet JP, Vignon F, Garcia M, Liaudet-Coopman E. Cathepsin-D affects multiple tumor progression steps in vivo: proliferation, angiogenesis and apoptosis. Oncogene. 2002;21:5951-5955. [PubMed] [DOI] |
| 13. | Authier F, Metioui M, Fabrega S, Kouach M, Briand G. Endosomal proteolysis of internalized insulin at the C-terminal region of the B chain by cathepsin D. J Bio Chem. 2002;277:9437-9446. [PubMed] [DOI] |
| 14. | Valentini AM, Pirrelli M, Armentano R, Caruso ML. The immunohistochemmical expression of cathepsin D in colorectal cancer. Anticancer Res. 1996;16:77-80. [PubMed] |
| 15. | Arao J, Fukui H, Ono T, Ueda Y, Chiba T, Fujimori T. Immunohis-tocheical localization of cathepsin D in colorectal tumors. Dis Colon Rectum. 2000;43:396-401. [DOI] |
| 16. | Tan S, Seow TK, Liang MY, Koh S, Lee PC, Chung MC, Hooi SC. Proteome analysis of butyrate-treated human colon cancer cells(HT-29). Int J Cancer. 2002;98:523-531. [PubMed] [DOI] |
| 17. | Grunstein M. Histone acetylation in chromatin structure and transcription. Nature. 1997;389:349-352. [PubMed] [DOI] |
| 18. | Della-Ragione F, Criniti V, Della-Pietra V, Borriello A, Oliva A, Indaco S, Yamamoto T, Zappia V. Genes modulated by histone acetylation as new effectors of butyrate activity. FEBS Lett. 2001;499:199-204. [DOI] |
| 19. | Demary K, Wong L, Spanjaard RA. Effects of retinoic acid and sodium butyrate on gene expression, histone acetylation and inhibition of proliferation of melanoma cells. Cancer Lett. 2001;163:103-107. [DOI] |
| 20. | Suenaga M, Soda H, Oka M, Yamaguchi A, Nakatomi K, Shiozawa K, Kawabata S, Kasai T, Yamada Y, Kamihira S. Histone deacetylase inhibitors suppress telomerase reverse transcriptase mRNA expression in prostate cancer cells. Int J Cancer. 2002;97:621-625. [PubMed] [DOI] |
| 21. | Tsubaki J, Hwa V, Twigg SM, Rosenfeld RG. Differential activation of the IGF binding protein-3 promoter by butyrate in prostate cancer cells. Endocrindogy. 2002;143:1778-1778. [PubMed] [DOI] |
| 22. | Sasahara Y, Mutoh M, Takahashi M, Fukuda K, Tanaka N, Sugimura T, Wakabayashi K. Suppression of promoter-dependent transcriptional activity of inducible nitric oxide synthase by sodium butyrate in colon cancer cells. Cancer Lett. 2002;177:155-161. [DOI] |
| 23. | Roberg K, Johansson U, Ollinger K. Lysosomal release of cathepsin D precedes relocation of cytochrome C and loss of mitochoadrial transmembrane potential during apoptosis induced by oxidative stress. Free Radic Biol Med. 1999;27:1228-1237. [DOI] |
| 24. | Isahara K, Ohsawa Y, Kanamori S, Shibata M, Waguri S, Sato N, Gotow T, Watanabe T, Momoi T, Urase K. Regulation of a novel pathway for cell death by lysosomal aspartic and cysteine proteinases. Neuroscience. 1999;91:233-249. [DOI] |
| 25. | Wu GS, Saftig P, Peters C, Ei-Deiry WS. Potential role for cathepsin D in p53-dependent tumor suppression and chemosensitivety. Oncogene. 1998;16:2177-2183. [PubMed] [DOI] |
| 26. | Zang Y, Beard RL, Chandraratna RA, Kang JX. Evidence of a lysosomal pathway for apoptosis induced by the synthetic retinoid CD437 in human leukemia HL-60 cells. Cell Death Differ. 2001;8:447-485. [DOI] |