修回日期: 2003-03-20
接受日期: 2003-03-28
在线出版日期: 2003-10-15
研究乙型肝炎病毒(HBV)S基因高频突变位点(T126S, M133L, T144A)变异对HBV生物学活性的影响, 开发新的检测HBsAg试剂盒, 混合HBV多价疫苗及多效价的乙型肝炎免疫球蛋白(HBIG).
利用人工定点突变技术, 基因重组, 建立系列HBV S基因'a'决定簇真核细胞表达的质粒.
测序和计算机软件分析, 克隆的质粒基因突变序列完全正确, 并且能在真核细胞中表达, 被HBsAg单克隆抗体识别.
所构建的乙型肝炎病毒S基因单突变克隆能够在真核细胞表达蛋白, 所表达的蛋白可以正确折叠, 维持天然二级构象, 具有良好的抗原性, 为开发新的检测试剂盒, HBV疫苗及高效价的乙型肝炎免疫球蛋白奠定物质基础.
引文著录: 余祖江, 杨东亮, 张俊, 郝友华, 王宝菊, 郝连杰. 乙型肝炎病毒S基因系列单突变克隆人工构建. 世界华人消化杂志 2003; 11(10): 1500-1504
Revised: March 20, 2003
Accepted: March 28, 2003
Published online: October 15, 2003
To study the mutation in a determinant of HBV S gene, to explore how it influenced the biologic characteristics of S gene.
Through site-mutation PCR, we constructed series variant clones (T126S, M133L, T144A) of HBV S gene 'a' determinant according to epidemiologic data.
After analysis of sequence and expression of cells, sequences of mutation clone were correct and the mutation of different positions in 'a' determinant could influence antigenicity of expressed HBsAg.
The successful construction and expression of variant clone provide the theoretical basis for developing new detection kit, HBV vaccine and HBIG.
- Citation: Yu ZJ, Yang DL, Zhang J, Hao YH, Wang BJ, Hao LJ. Construction and analysis of HBV S gene clones with artificial mutation sites. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1500-1504
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1500.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1500
我国是乙型肝炎病毒(hepatitis B virus, HBV)感染的高流行区, 有报道全国血清学调查, HBsAg 携带率达9.75%, 约1.2亿人, 慢性乙型肝炎患者约为3000万, 其中10-20%可以发展为肝硬化和肝癌. HBV在如此众多的人群中相互传播, 经受着巨大的宿主主动和被动免疫抵抗, 必须以变异等多种形式逃避宿主的免疫清除. 由于病毒外膜蛋白在宿主保护性免疫起着重要作用, 因此外膜蛋白的变异是HBV变异最为常见的方式之一[1-6]. 我们根据流行病学的调查结果[7-9], 通过PCR定点突变技术(基因拼接重叠扩增PCR, gene SOEing PCR, gene splice of overlap extending PCR), 对患病人群中HBV S基因'a'决定簇高突变频率位点进行人工定点突变, 得到真核细胞内表达克隆, 即T126S, M133L, T144A. 最后采用真核细胞表达系统, 探讨HBV S基因'a'决定簇突变对其表达蛋白(HBsAg)的抗原性和免疫原性的影响.
pcDNA3质粒购自Invitrogen公司, pCR3.1/SHBV质粒(含野生株HBVS基因). BHK-21(叙利亚仓鼠肾细胞)系本室保存. DNA/RNA定量分析仪, Pharmacia Biotech 公司产; PTC-200PCR扩增仪, 美国MJ Research 公司产; 凝胶成像分析系统, 美国UVP公司. Pfu聚合酶, EcoR I内切酶, Smal I内切酶, Xhol-I内切酶购自武汉中科建公司. 小牛碱性磷酸酶(CIAP), 123bp分子大小标准, 羊抗鼠免疫荧光抗体购自Gibco BRL公司. 凝胶回收试剂盒, 德国Qiagen公司. HBsAg鼠单克隆抗体由北京生物公司提供.
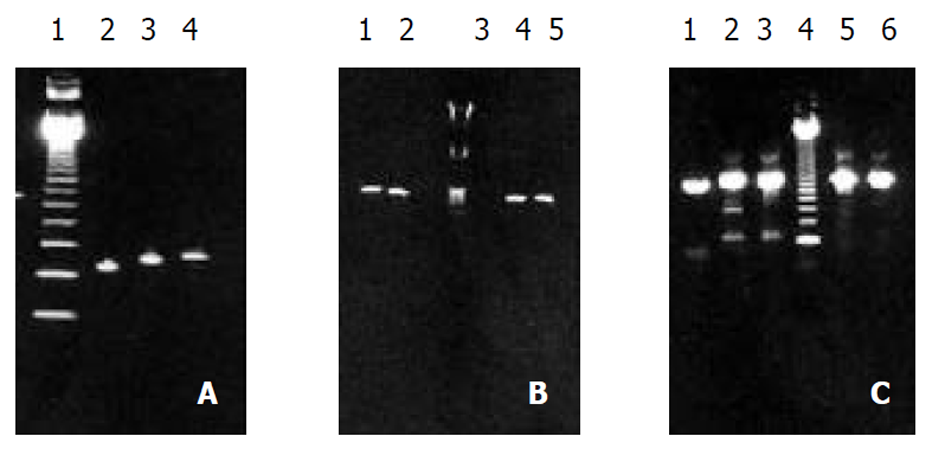
1.2.1 变异克隆的构建 PCR3.1/SHBV和pcDNA3同时被ECOR I 37 °C 酶切5h(其中pcDNA3酶切后线装载体作以后连接用), 前者酶切后混合产物, CIAP 5'去磷酸化, 与pcDNA3 EcoR I酶切后线状载体连接. 提供下一步Gene SOEing PCR反应所需的模板. Gene SOEing PCR 引物(武汉金贝生物科技有限公司合成)HBV S基因上, 下游引物ZL、ZR和pcDNA3载体对应引物SP6R: ZL: (5'位于HBV 157, 5'- GCGCTGAACATGGAGAACATCAC-3', ZR: (5'位于HBV 860, 5'- CCATCTTTTTGTTTTGTTAAGG-3'; 引物SP6R, 位于pcDNA3载体上SP6 启动子序列区: SP6R: 5'-AGCATTTAAGTGACACTATAQAATAAG-3'. 定点突变HBV S基因126, 133, 144位的互补突变引物: 126位突变互补引物126L: 5'-CTGCATGACTAATGCTCAAGGAAC-3'(439-415), 126R: 5'-TTCTTGAGCACTAGTCATGCAGGTCC-3'(460-434); 133位突变互补引物133L: 5'-CCAGGAACCTCTCTGTATCCCTCC-3'(455-431), 133R: 5'-AGGGATACAGAGAGG TTCCTTGAGCA-3'(476-450); 144位突变互补引物 144L: 5'-AACCTTCGGCCGGAAA TTGC-3'(492-472), 144R: 5'-GTGCAATTTCCGGCCGAAGGTTTG-3'(513-489). 按照Horton et al (Gene, 1989; 77: 61-68)方法进行, Pfu酶保守扩增. 简单的说, 第1次PCR: ZL与126R扩增126位突变S基因的上半段; ZL和133R扩增133位突变S基因的上半段; ZL与144R扩增144位突变S基因的上半段(见图1A). 126L与SP6R扩增126位突变的S基因的下半段; 133L与SP6R扩增133位突变的S基因的下半段; 144L与SP6R扩增144位突变的S基因的下半段(见图1B). 第2次PCR扩增利用引物ZL和SP6R进行(见图1C). 最后提取T126S, M133L, D144A突变的S基因全长的PCR扩增产物(含有pcDNA3载体的多克隆酶切位点). XHOl 和ECOR V 双向酶切pcDNA3, 提纯. 同时用XHOl 酶切 HBV S基因定点突变产物, 提纯后与线状pcDNA3载体连接. 连接产物按常规方法进行转化感受态细胞后, 涂板, 37 °C培养, 挑取单菌落, 常规培养转化后的菌株. 转化培养细菌2 μl, ZL和ZL为引物, 以PCR3.1/SHBV质粒作阳性对照, 进行鉴定和筛选. PCR阳性克隆, 常规小提制备质粒, 分别ECOR I和XHOL 双酶切鉴定. 小量提纯后质粒, 送大连宝生物工程公司, 采用双脱氧终止法进行全自动序列测定. 测序的结果利用计算机软件进行分析(见结果2.2).
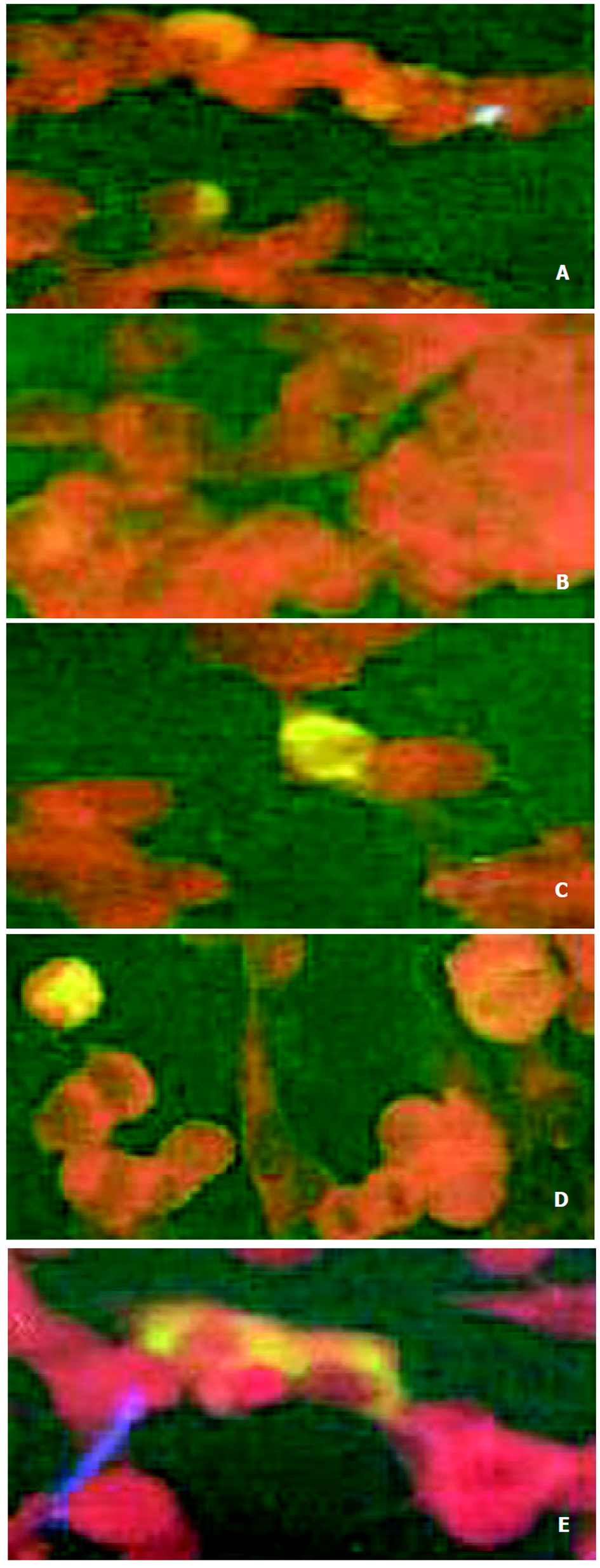
1.2.2 变异克隆在真核细胞表达 常规培养细胞, 转染前1 d将BHK细胞接种到8孔槽中, 加入含10% FCS的DMEM培养基, 在37 ℃和5%的CO2中培养至细胞的融合率为50-80%. 用QIAGENE小量提取质粒试剂盒提取质粒SHBV、T126S、M133L和D144A, 测定浓度后稀释到1 g/L. 按lipofectamine试剂盒(boehringer mannheim biochemicals Co.USA)说明转染细胞, ELISA检测细胞培养上清. PBS洗涤细胞2次后用4 °C的甲醇和丙酮各半混合液低温固定15 min, 间接免疫荧光检测. 固定后的细胞加鼠抗HBsAg mAb(1:100稀释), 37 °C 1 h孵育. PBS洗涤后加羊抗鼠IgG-FITC (1:100稀释, 含1 g/L的伊文氏蓝) 37 °C, 50 min. PBS再洗涤后, 甘油封片后在荧光显微镜下观察照相.
S基因上半段第1次PCR扩增产物结果电泳图(图A); S基因下半段产物第1次PCR扩增结果电泳图(图B); 第2次PCR扩增的结果(图C).
Wshbvaa代表野生株HBsAg的氨基酸序列, T126Saa, M133Laa和D144Aaa分别位点突变后HBsAg的氨基酸序列. 黑体方框部分为'a'决定簇氨基酸序列一级结构和同源性序列比较结果如下.
各突变质粒经脂质体包裹后, 转染BHK细胞3 d后, 收获细胞, HBsAg单克隆抗体免疫荧光检测各突变质粒表达产物, 细胞内或膜表面出现特异性荧光颗粒为阳性(荧光图片下标题表明相应的质粒转染细胞结果, Wild S表示未发生变异的S基因克隆, 空载体转染细胞的结果为阴性对照, 图2).
体外实验已经证实, S蛋白是形成HBV亚病毒颗粒的主要组成部分, 和其他蛋白一样由粗面内质网的膜结合核糖体合成的, 由226个氨基酸构成, N端信号I引导蛋白进行跨膜转运, 其下游的信号II在第80-90位氨基酸之间有一个疏水结构, 在信号II和S蛋白疏水性C末端形成一个环状结构, 其上携带主要的HBsAg抗原决定簇'a'(Howard CR. J Viral Hepatology. 1995; 2: 165-170). HBsAg 'a'决定簇是HBsAg诱导保护性抗体最主要的抗原决定簇, 其氨基酸表位上共有28个氨基酸, 含有构象依赖性B细胞表位和TH细胞表位, 他们与HBsAg抗原性及抗HBS的产生密切相关[7]. 通常基因组合的HBV疫苗包含S或者M蛋白, 'a'决定簇的氨基酸任何变异, 在空间构象都会对疫苗产生的抗体有决定性影响[10-12].
HBsAg是HBV感染的最重要标志, 一般认为抗-HBS出现表示宿主已将病毒清除并具备中和外来HBsAg的能力. 目前研究显示, HBsAg阴性或抗HBS阳性并不能排除HBV病毒血症. 提取这些病毒核酸, 序列分析的结果显示HBV S基因往往出现变异.
Carman et al最早发现在一意大利无症状携带者体内的G145R突变株可以稳定存在5 a. Ogata et al [13]从意大利患儿获得的G145R突变株血清感染黑猩猩, 证明该突变株可以在体内完整复制, 具有感染性和致病性.Colemanet al [14]对乙型肝炎病毒S基因'a'决定簇在患者人群中高突变频率位点G145R, M133A突变质粒等分析表明, 不同的商业试剂盒对这些产生突变质粒所表达的HBsAg识别能力下降或根本不具备识别能力. 在被动免疫预防的儿童, 国内也发现了'a'决定簇的变异: 在评估这些基因突变及其可能影响中发现, 逃避被动免疫的儿童重新感染的HBV基因组中, 有93.4%的样品的HBV基因组发生突变, 其中对HBV S基因'a'决定簇的点突变占30%以上, 他们可以水平或垂直传播, 并且不易被现有HBsAg检测试剂盒检测[15].
在慢性感染患者人群中, S基因突变十分常见, 突变位点多集中于'a'决定簇第一个环上面. 另外在乙型肝炎疫苗主动预防失败和高效价HBIG预防器官移植患者再感染HBV的人群中, 'a'决定簇也常常发生突变, 但突变的位点多集中于a决定簇第2个环上面[16,17]. HBV'a'决定簇的基因突变可以导致HBsAg明显抗原性和免疫原性变化, 导致现有的试剂盒诊断的漏诊、误诊和疫苗预防和HBIG被动免疫的失败, 因此早期检测和预防显得十分必要. 解决上述问题关键在于对这些突变株所表达的蛋白在体内和体外的生物学活性进行细致的研究.
Coleman et al用HBsAg的单克隆抗体, 可以检测标准试剂盒无法检测的'a'决定簇129位氨基酸和145氨基酸突变[14,18]. Van Deursen et al [19]用PCR检测了HBsAg试剂盒检测阴性的慢性HBV感染者, Ma et al [20]用突变PCR检测了HBV基因组第551位核甘酸突变. 闻玉梅et al 用单克隆抗体识别129位氨基酸突变, 并构建了相应的突变基因克隆. 他们在分析该克隆所表达的抗原的抗原性和免疫原性时发现: 相应突变的HBsAg的抗原性和免疫原性发生了很大的变化[21], 后来他们又通过基因免疫的方式进一步阐述前述的结果[22]. 为了在整体上分析突变位点对HBV生物活性的作用, 最近Liu et al一次克隆了HBV全基因组, 分析HBV基因突变与病毒免疫清除之间的关系, 位点突变对HBV生物学特性的影响[23].
在不同的患者人群中, HBV S基因'a'决定簇上每一个氨基酸都可以发生点突变或和其他位点突变一起产生复合突变[24-26], 不同的位点突变对HBsAg的抗原性都会存在着或多或少的影响. 因此对不同人群中高突变频率的位点研究显得更具有意义.
我们根据流行病学调查结果, 以HBV S基因野生株为基础, 利用Gene SOEing PCR技术, 获得系列HBV S基因突变克隆. 经过序列测定和氨基酸同源性分析表明: 与野生株HBV S基因克隆相比, 除目的位点突变外, 除目的位点氨基酸突变外, 其余位点氨基酸与野生株HBsAg的氨基酸同源性比较为100% (见结果2.2). 以上结果表明我们对野生株S基因'a'决定簇高突变频率位点实行了定点突变, 获得了3株在不同患者人群中具有高突变频率的S基因'a'决定簇突变克隆.
HBsAg体外表达具有其特殊性: 由于HBsAg对大肠杆菌有一定的毒性, 他不能完整的在原核细胞内表达, 必须通过一定基因修饰才能在大肠杆菌中表达[27,28], 这势必会影响到HBsAg的抗原性和免疫原性的变化; 另外基因工程乙型肝炎疫苗大多在酵母和昆虫等真核表达系统中生产, 但在酵母等系统表达的HBsAg不能分泌到细胞外, 且表达水平也不高, 因此也具有一定的局限性[29-31]. 我们将HBV S基因不同位点突变的基因克隆入真核表达载体pcDNA3中, 转染BHK中表达, 转染细胞上清用ELISA检测, 细胞用间接免疫荧光法进行检测. 结果表明, HBV S基因系列突变(T126S, M133L, T144A)克隆能在真核细胞中表达, 正确折叠, 维持天然二级构象, 能够被HBsAg单克隆抗体识别(见结果2.3), 具有良好的抗原性. 可以用作开发新型乙型肝炎混合多价疫苗, 高效价HBIG及HBsAg检测试剂盒, 同时也为分析不同位点突变的HBV S基因克隆在体内表达HBsAg生物学活性, 特别对其抗原性和免疫原性的分析奠定基础.
| 1. | Chen HB, Fang DX, Li FQ, Jing HY, Tan WG, Li SQ. A novel hepatitis B virus mutant with A-to-G at nt551 in the surface antigen gene. World J Gastroenterol. 2003;9:304-308. [DOI] |
| 2. | Weinberger KM, Zoulek G, Bauer T, Bohm S, Jilg W. A novel deletion mutant of hepatitis B virus surface antigen. J Med Virol. 1999;58:105-110. [DOI] |
| 3. | Rodriguez-Frias F, Buti M, Jardi R, Vargas V, Quer J, Cotrina M, Martell M, Esteban R, Guardia J. Genetic alterations in the S gene of hepatitis B virus in patients with acute hepatitis B, chronic hepatitis B and hepatitis B liver cirrhosis before and after liver transplantation. Liver. 1999;19:177-182. [PubMed] |
| 4. | Cabrerizo M, Bartolom inverted question marke J, Caramelo C, Barril G, Carreno V. Molecular analysis of hepatitis B virus DNA in serum and peripheral blood mononuclear cells from hepatitis B surface antigen-negative cases. Hepatology. 2000;32:116-23. [PubMed] [DOI] |
| 5. | Koyanagi T, Nakamuta M, Sakai H, Sugimoto R, Enjoji M, Koto K, Iwamoto H, Kumazawa T, Mukaide M, Nawata H. Analysis of HBs antigen negative variant of hepatitis B virus: unique substitutions, Glu129 to Asp and Gly145 to Ala in the surface antigen gene. Med Sci Monit. 2000;6:1165-1169. [PubMed] |
| 6. | Lee KM, Kim YS, Ko YY, Yoo BM, Lee KJ, Kim JH, Hahm KB, Cho SW. Emergence of vaccine-induced escape mutant of hepatitis B virus with multiple surface gene mutations in a Korean child. J Korean Med Sci. 2001;16; 359-362. [PubMed] [DOI] |
| 7. | Karthigesu VD, Allison LM, Ferguson M, Howard CR. A hepatitis B virus variant found in the sera of immunised children induces a conformational change in the HBsAg 'a' determinant. J Med Virol. 1999;58:346-352. [DOI] |
| 8. | Theamboonlers A, Chongsrisawat V, Jantaradsamee P, Poovorawan Y. Variants within the 'a' determinant of HBs gene in children and adolescents with and without hepatitis B vaccination as part of Thailand's expanded program on immunization (EPI). Tohoku J Exp Med. 2001;193:197-205. [PubMed] [DOI] |
| 9. | Wu L, Yuan ZH, Liu F, Waters JA, Wen YM. Comparing the immunogenicity of hepatitis B virus S gene variants by DNA immunization. Viral Immunol. 2001;14:359-367. [PubMed] [DOI] |
| 10. | Karthigesu VD, Allison LM, Ferguson M, Howard CR. A hepatitis B virus variant found in the sera of immunised children induces a conformational change in the HBsAg 'a' determinant. J Med Virol. 1999;58:346-352. [DOI] |
| 11. | Preikschat P, Meisel H, Will H, Gunther S. Hepatitis B virus genomes from long-term immunosuppressed virus carriers are modified by specific mutations in several regions. J Gen Virol. 1999;80:2685-2691. [PubMed] [DOI] |
| 12. | Shinji T, Koide N, Hanafusa T, Hada H, Oka T, Takayama N, Shiraha H, Nakamura M, Ujike K, Yumoto Y. Point mutations in the S and pre-S2 genes observed in two hepatitis B virus carriers positive for antibody to hepatitis B surface antigen. Hepatogastroenterology. 1998;45:500-502. [PubMed] |
| 13. | Ogata N, Zanetti AR, Yu M, Miller RH, Purcell RH. Infectivity and pathogenicity in chimpanzees of a surface gene mutant of hepatitis B virus that emerged in a vaccinated infant. J Infect Dis. 1997;175:511-523. [DOI] |
| 14. | Coleman PF, Chen YC, Mushahwar IK. Immunoassay detection of hepatitis B virus surface antigen mutants. J Med Virol. 1999;59:19-24. [DOI] |
| 15. | Zhu Q, Lu Q, Xiong S, Yu H, Duan S. Hepatitis B virus S gene mutants in infants infected despite immunoprophylaxis. Chin Med J. 2001;114:352-354. |
| 16. | Mesenas SJ, Chow WC, Zhao Y, Lim GK, Oon CJ, Ng HS. Wild-type and "a" epitope variants in chronic hepatitis B virus carriers positive for hepatitis B surface antigen and antibody. J Gastroenterol Hepatol. 2002;17:148-152. [DOI] |
| 17. | Schories M, Peters T, Rasenack J. Isolation, characterization and biological significance of hepatitis B virus mutants from serum of a patient with immunologically negative HBV infection. J Hepatol. 2000;33:799-811. [DOI] |
| 18. | Yukimasa N, Ohkushi H, Fukasawa K, Fukuchi K, Takagi Y, Gomi K. Hepatitis B virus gene mutations in the sera of three patients with coexisting hepatitis B surface antigen and anti-surface antibody. Rinsho Byori. 2000;48:184-188. [PubMed] |
| 19. | Van Deursen FJ, Hino K, Wyatt D, Molyneaux P, Yates P, Wallace LA, Dow BC, Carman WF. Use of PCR in resolving diagnostic difficulties potentially caused by genetic variation of hepatitis B virus. J Clin Pathol. 1998;51:149-153. [DOI] |
| 20. | Ma CL, Fang DX, Chen HB, Li FQ, Jin HY, Li SQ, Tan WG. A mutation specific polymerase chain reaction for detecting hepatitis B virus genome mutations at nt551. World J Gastroenterol. 2003;9:509-512. [DOI] |
| 21. | Wu L, He JW, Yao X, Li HM, Wen YM. A novel hepatitis B virus variant S 129 (Gln-->Leu): lack of correlation between antigenicity and immunogenicity. J Med Virol. 1999;59:424-430. [DOI] |
| 22. | Liu CJ, Chen PJ, Lai MY, Kao JH, Chang CF, Wu HL, Shau WY, Chen DS. A prospective study characterizing full-length hepatitis B virus genomes during acute exacerbation. Gastroenterology. 2003;124:80-90. [PubMed] [DOI] |
| 23. | Bahn A, Gerner P, Martine U, Bortolotti F, Wirth S. Detection of different viral strains of hepatitis B virus in chronically infected children after seroconversion from HBsAg to anti-HBs indicating viral persistence. J Hepatol. 1997;27:973-978. [DOI] |
| 24. | Hsu HY, Chang MH, Ni YH, Lin HH, Wang SM, Chen DS. Surface gene mutants of hepatitis B virus in infants who develop acute or chronic infections despite immunoprophylaxis. Hepatology. 1997;26:786-791. [PubMed] [DOI] |
| 25. | Kalinina T, Riu A, Fischer L, Will H, Sterneck M. A dominant hepatitis B virus population defective in virus secretion because of several S-gene mutations from a patient with fulminant hepatitis. Hepatology. 2001;34:385-394. [PubMed] [DOI] |
| 26. | Gu B, Ren H, Zhang D. Expression of recombinant inserting mutants of HBsAg in vitro and its antigenic analysis. Zhonghua Yixue Zazhi. 1999;79:139-142. [PubMed] |
| 27. | Lee YH, Tung YT, Lo SJ. Expression and secretion of hepatitis B viral surface antigen in E.coli. Biochem Biophys Res Commun. 1986;135:1042-1049. [DOI] |
| 28. | Gu B, Ren H. Expression of HBsAg by using various eukaryotic expression vectors. Zhonghua Ganzangbing Zazhi. 1999;7:98-100. [PubMed] |
| 29. | Kalinina T, Riu A, Fischer L, Will H, Sterneck M. A dominant hepatitis B virus population defective in virus secretion because of several S-gene mutations from a patient with fulminant hepatitis. Hepatology. 2001;34:385-394. [PubMed] [DOI] |
| 30. | Qin S, Tang H, Zhao LS, He F, Lin Y, Liu L, He XM. Cloning of HBsAg-encoded genes in different vectors and their expression in eukaryotic cells. World J Gastroenterol. 2003;9:1111-1113. [DOI] |