修回日期: 2002-08-20
接受日期: 2002-09-05
在线出版日期: 2003-10-15
观察并比较粉防已碱(tetrandrine, tet)、大黄与潘生丁对实验性肝纤维化的影响, 探讨其可能的作用机制.
四氯化碳皮下注射法制备大鼠肝纤维化模型, 分别给予不同剂量的药物灌胃, 酶动力法测定肝功能指标, 放免法测定细胞外基质(extracellular matrix, ECM)水平, HE、VG染色和电镜检测病理形态学改变.
三种药物可不同程度地改善肝纤维化时的肝功能状态, 降低ECM含量, 降低肝纤维化程度, 以小剂量Tet、大剂量大黄和小剂量潘生丁效果最显著. 药物间比较无显著差异.
Tet、大黄和潘生丁均可保护肝细胞, 抑制ECM合成, 具有防治实验性肝纤维化和肝硬化的作用.
引文著录: 王如涛, 陈颖伟, 卫新革, 徐芹芳, 李定国. 粉防己碱、大黄与潘生丁抗肝纤维化作用比较. 世界华人消化杂志 2003; 11(10): 1492-1496
Revised: August 20, 2002
Accepted: September 5, 2002
Published online: October 15, 2003
To study the antihepatofibrotic mechanism of tetrandrine, rhubarb and dipyridamole.
The experimental hepatic fibrosis was induced by subcutaneous injection of CCl4. The three drugs were administered to male Sprague-Dawley rats by intragastric infusion respectively. Liver function test was performed by enzyme kinetics and the extracellular matrix (ECM) contents were determined by radioimmunoassay. Pathological changes of liver tissues were detected by HE and VG staining, meanwhile, ultra micro-structure changes were observed by electron microscope in randomly selected samples.
All of the three drugs could improve the liver function in liver fibrosis, reduce the contents of ECM and the degree of liver fibrosis. There was no significant difference among the three drugs.
Tetrandrine, rhubarb and dipyridamole could protect hepatocytes, inhibit the synthesis of ECM, and thereby could prevent the development of liver fibrosis and cirrhosis in the experimental animal models.
- Citation: Wang RT, Chen YW, Wei XG, Xu QF, Li DG. Comparative study of anti-hepatofibr-otic effect of tetrandrine, rhubarb and dipyridamole. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1492-1496
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1492.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1492
肝纤维化与肝硬化的治疗一直是医学界的难题. 近年来, 我们曾就粉防已碱(tetrandrine, tet)对肝纤维化的防治作用进行了一系列的研究. 研究表明: Tet能保护肝细胞及各种细胞器, 降低血清透明质酸(hyluronic acid, HA)、III型前胶原(procollagen, PCIII)水平, 阻遏肝脏贮脂细胞的增生转化, 并能在转录水平上抑制胶原合成, 减少胶原沉积, 从而具有良好的抗肝纤维化作用[1]. 然而, 大剂量的Tet毒性较强, 且其中毒剂量与治疗剂量相当接近, 因而限制了Tet在临床的推广应用. 因此, 寻找更安全有效的抗肝纤维化药物是现今治疗肝纤维化的当务之急. 文献报道, 大黄和潘生丁均能保护肝细胞, 并具有明显的抗脂质过氧化作用[2,3]. 本研究中, 我们分别观察和比较Tet、大黄与潘生丁对实验性肝纤维化的影响, 并探讨其可能的作用机制.
动物: ♂SD大鼠, 体重250 g左右, 购自中国科学院上海实验动物中心. 药物和试剂: Tet、潘生丁: 浙江金华第三制药厂产品; 生大黄粉: 上海童涵春堂国药号; 羟脯氨酸(hydroxyproline, HYP): 中国科学院上海生物化学研究所产品; HA、层粘连蛋白(laminin, LN)和PCIII放免测定试剂盒: 海军上海医学研究所产品. 主要仪器: 自动生化分析仪: 日本岛津公司产品; MJ-182型放射免疫计数仪: 中国科学院上海原子核研究所四环仪器厂产品; UV-Vis7530型分光光度计: 上海分析仪器厂产品; 普通光学显微镜: 日本OLYMPULS公司产品; H-500透射电镜: 日本HITACHI公司产品.
实验分组及处理: 110只♂SD大鼠, 随机分为 I组: 正常对照组; II组: 模型对照组; III组: Tet治疗组(大剂量组: 40 mg/kg; 中剂量组: 20 mg/kg; 小剂量组: 10 mg/kg); IV组: 大黄治疗组(大剂量组: 1 000 mg/kg; 中剂量组: 500 mg/kg; 小剂量组: 250 mg/kg); V组: 潘生丁治疗组(大剂量组: 12 mg/kg; 中剂量组: 6 mg/kg; 小剂量组: 3 mg/kg). 共11个实验组, 每组10只大鼠. 模型建立采用经SD大鼠的皮下注射40%CCl4, 剂量为0.3 ml/kg (首剂加倍), 3d/次, 共15次; 正常对照组则以同样方法注射等量的精制橄榄油. 造模结束后第2 d起, 给予模型治疗组不同剂量的Tet、大黄或潘生丁混悬剂分别灌胃, 1次/d, 共42次; 模型对照组则予以等量的0.5%羧甲基纤维素混悬剂按同样要求灌胃. 治疗结束后, 处死动物, 分别取血清和肝组织进行各项测定. 肝功能系列测定采用酶试剂法, 自动生化分析仪检测. 细胞外基质(extracellular matrix, ECM)的检测: (1)肝组织HYP含量测定: 参照郑少雄法[4]; (2)血清HA、LN及PCIII含量测定: 采用放免法, 按HA、LN及PCIII放免分析测定试剂盒说明书操作. 病理形态学检测采用HE常规染色、VG胶原染色, 并进行肝纤维化分级[5,6]; 透射电镜下观察比较各组大鼠超微结构变化.
统计学处理 计量资料采用方差分析; 计数资料采用Ridit检验.
与正常对照组相比, 模型对照组大鼠血清ALT、AST及ALP水平都明显升高(P<0.01); 血清ALB及TBIL水平则无明显变化(P>0.05). 三种药物各剂量治疗组的血清ALT、ALP水平均显著下降(P<0.01-0.05); 大黄各剂量组间比较无统计学差异, Tet和潘生丁则均以小剂量效果最优; 血清AST水平在Tet大、小剂量组及潘生丁各剂量组中亦明显降低. 三种药物比较, 血清ALT下降程度以小剂量Tet和小剂量潘生丁为优, 而血清ALP下降程度在三种药物九个剂量组均无统计学差异, 表1-3.
与正常对照组相比, 肝纤维化模型组肝组织HYP含量及血清HA、LN及PCIII含量均显著升高(P<0.01); Tet、大黄与潘生丁各剂量组能不同程度地降低这四种指标水平, 分别以Tet小剂量、大黄大剂量和潘生丁小剂量最为有效(P<0.05-0.01). 此三者相比, HYP下降以小剂量潘生丁最明显, 而对血清HA、LN及PCIII的影响则以小剂量Tet最有效, 表4-9.
| n | 0 | I | II | III | IV | U值 | |
| 正常对照组 | 10 | 10 | 0 | 0 | 0 | 0 | - |
| 模型对照组 | 10 | 0 | 1 | 1 | 3 | 5 | - |
| 模型治疗组 | |||||||
| 大剂量 | 10 | 0 | 1 | 1 | 5 | 3 | 0.62 |
| 中剂量 | 10 | 0 | 4 | 3 | 1 | 1.70 | |
| 小剂量 | 10 | 0 | 5 | 3 | 1 | 1 | 2.48a |
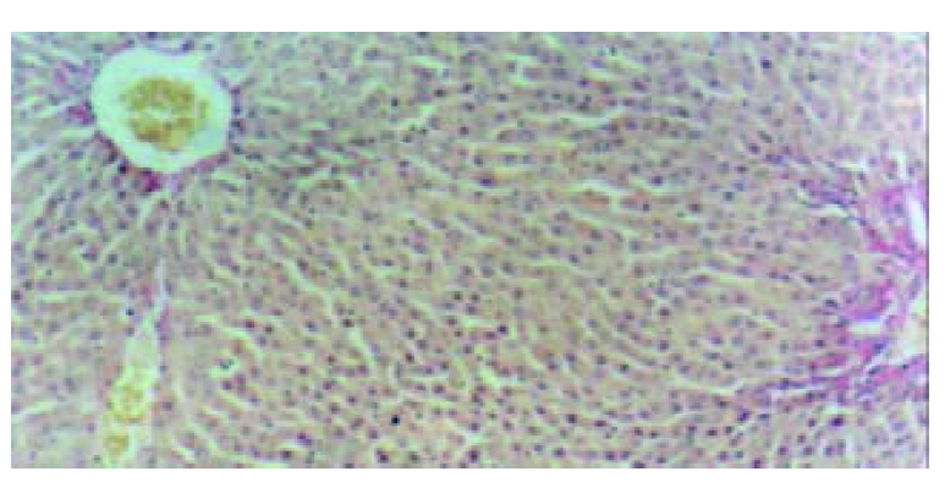
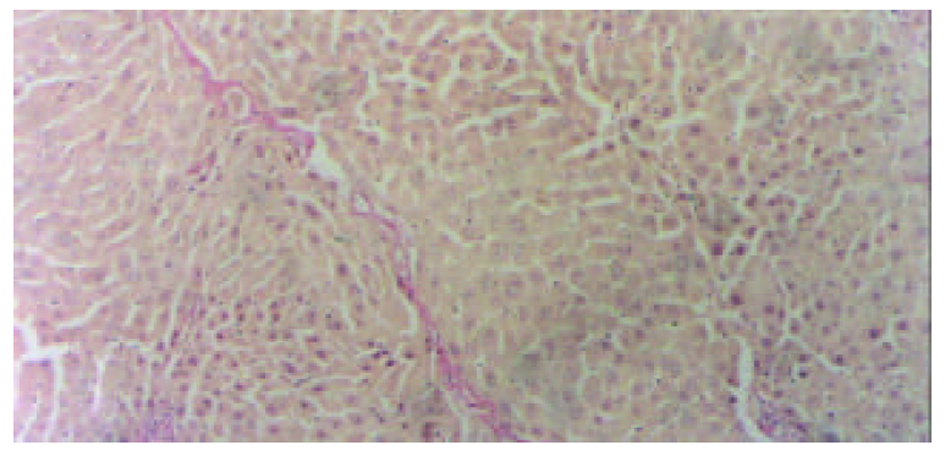
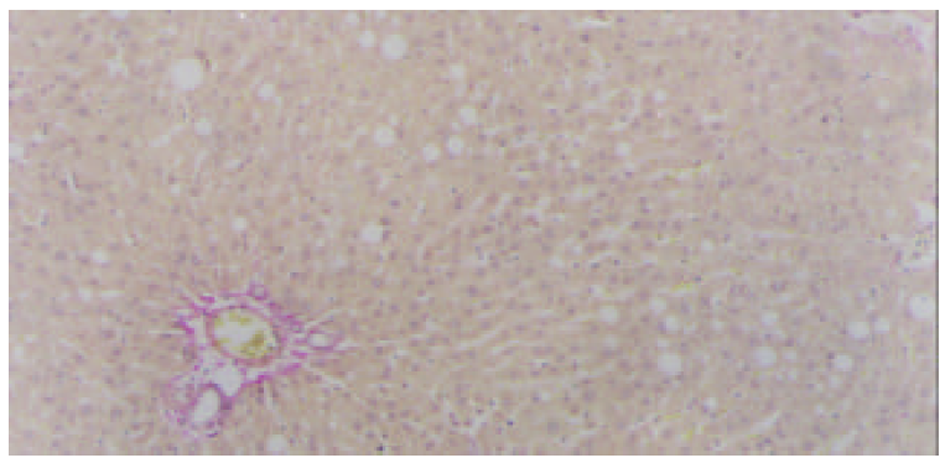
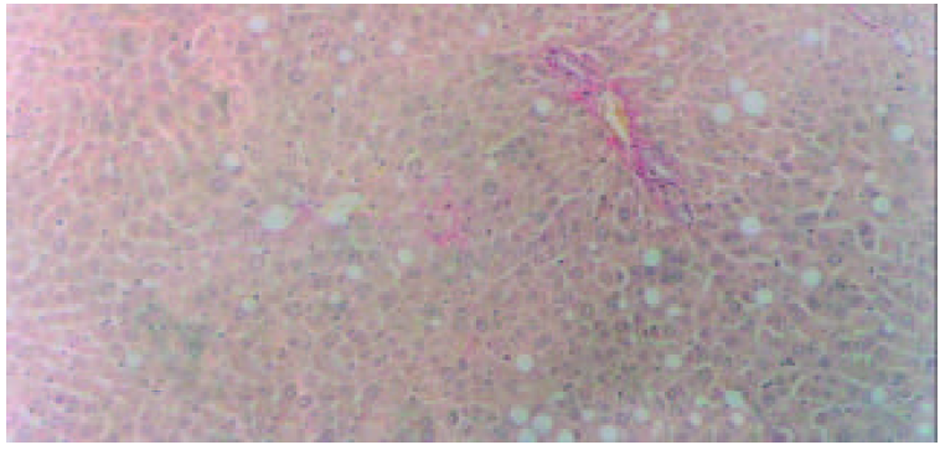
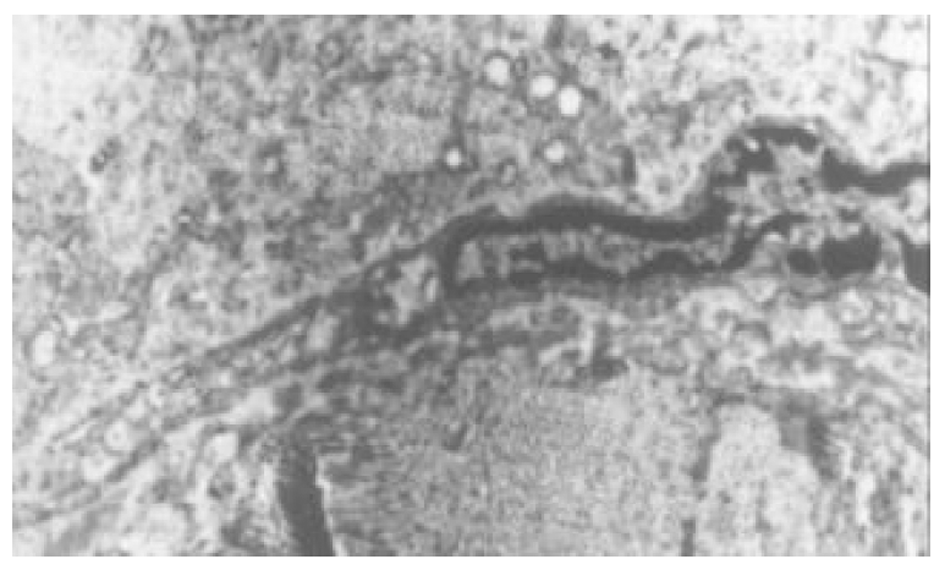
2.3.1 光镜观察(图1-4) 肝组织切片HE常规染色和VG胶原染色显示, 肝纤维化模型对照组大鼠肝组织中可见肝细胞脂肪变性, 坏死, 炎细胞浸润; 汇管区内胶原纤维沉积, Henny's管增生; 纤维结缔组织明显增生, 纤维间隔增粗, 并有典型假小叶形成. 模型治疗组大鼠肝组织纤维结缔组织增生程度减轻, 纤维间隔变细, 假小叶形成不明显, 尤以小剂量Tet、大、中剂量的大黄和小剂量潘生丁为明显, 与模型对照组比较有显著性差异(P<0.05).
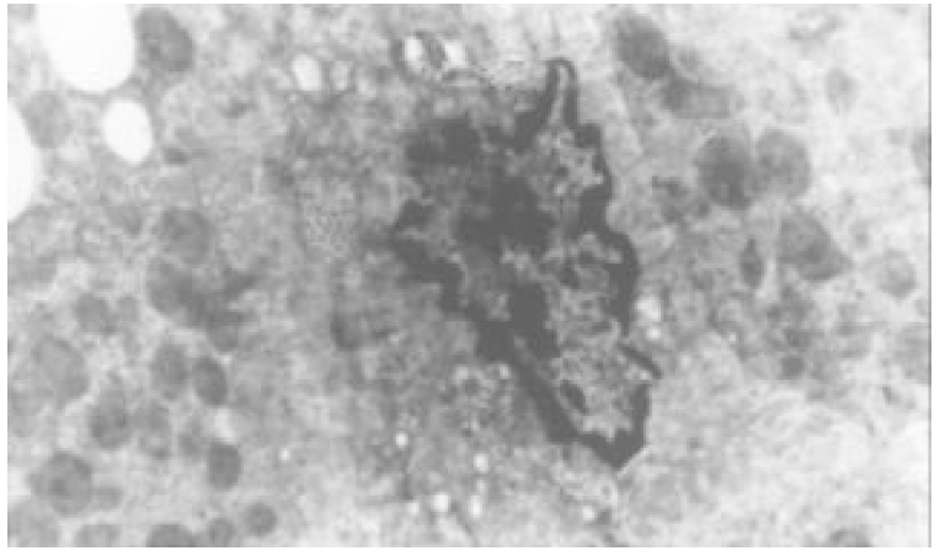
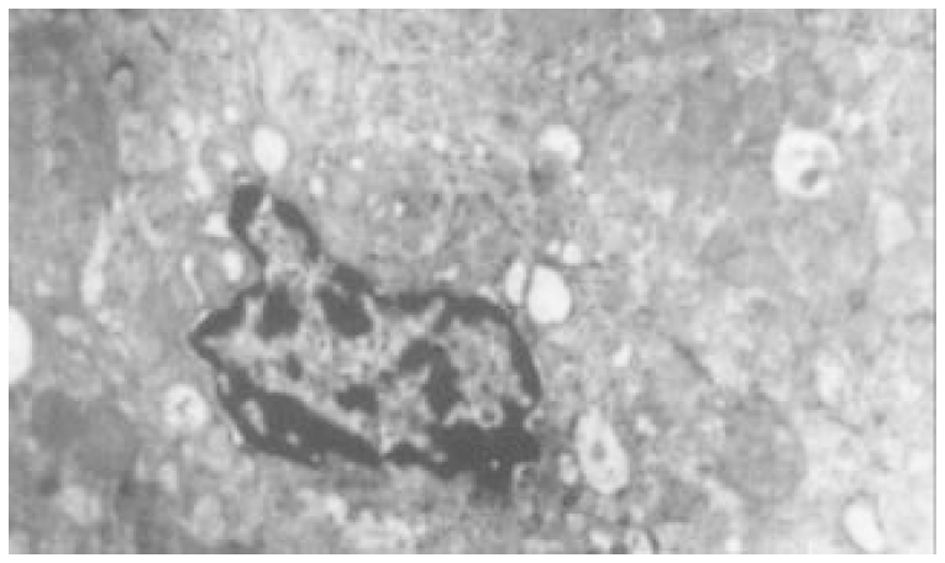
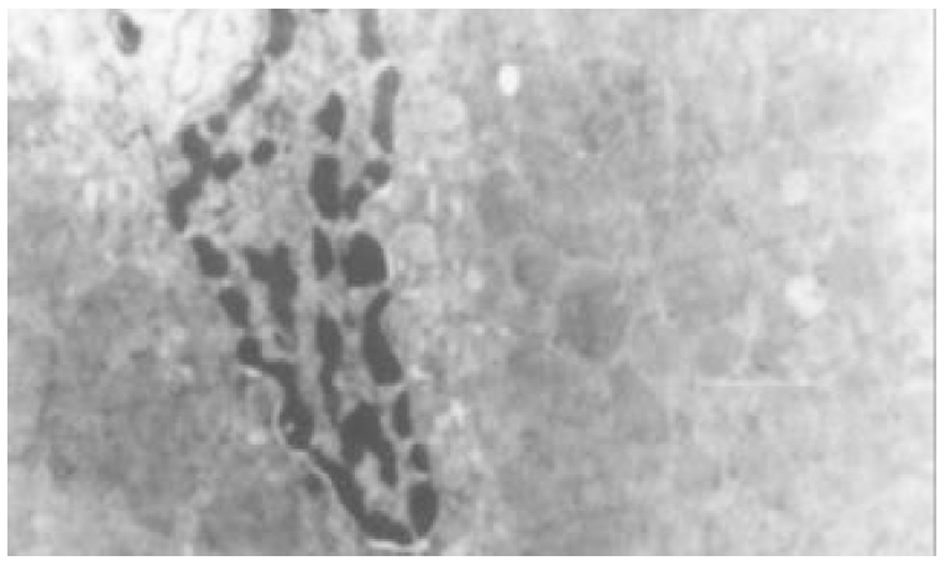
2.3.2 电镜观察(图5-8) 正常对照组大鼠肝细胞间紧密相连, 细胞内各种细胞器分布规律, 结构典型. 血窦排列整齐, Disse腔内可见肝贮脂细胞, 胞质内有脂滴. 模型对照组大鼠肝组织中则出现典型的肝细胞损伤结构, 相邻肝细胞间隙增宽, 肝细胞变性坏死, 核固缩, 胞质内出现大小不等、分布不规则的脂滴. 线粒体增生、肿胀及肥大, 内质网扩张, 出现脂褐素体和髓鞘样结构; 此外, 肝组织中还存在轻重不等的纤维化病变. 内质网明显扩张, 内质网池有絮状和丝状蛋白样结构, 内皮细胞窗孔明显减少, 内皮侧有基底膜形成, 形成"裙边"样切面. 肝窦毛细血管化, Disse腔内可见较多成纤维细胞(活化的肝贮脂细胞), 且周围有大量胶原纤维沉积. 汇管区内可出现大量的胶原纤维.
Tet、大黄和潘生丁治疗组中, 肝细胞的损伤程度有不同程度的减轻, 肝细胞间隙较紧密, 胞质内脂肪小滴减少, 细胞内结构趋向正常. 肝纤维化病变不明显, 肝血窦和Disse腔内胶原纤维沉积及成纤维样细胞数量减少.
肝纤维化系多种慢性肝损伤的异常修复过程, 主要为细胞外胶原和其他基质成分的合成和降解失衡, 造成ECM在肝内过量生成和沉积. 由于肝脏过度或异常的纤维结缔组织增生, 故使小叶结构发生紊乱, 肝内微循环障碍, 造成肝细胞功能进一步降低. 因此, 抗肝纤维化的主要任务是减少慢性肝损伤过程中ECM在肝内的沉积量[7].
ECM包括胶原、非胶原性糖蛋白及蛋白多糖三种主要成分. HYP是胶原蛋白的主要成分, 约占胶原氨基酸总量的13%. 肝组织内HYP含量的测定是衡量肝脏胶原组织代谢和判定抗肝纤维化疗效的重要指标[8]. PCIII是III型胶原的前体, 其在血清中的水平可反映III型胶原的合成状态, 并与肝纤维化程度呈密切正相关[9]. HA是ECM中重要的蛋白多糖, 主要由肝贮脂细胞合成, 在窦状隙内皮细胞内降解. 血清HA水平与肝纤维化的病理改变之间存在着良好的一致性[10,11], 对反映肝纤维化程度和肝内皮细胞功能具有较高的敏感性和准确性[12]. LN是ECM中的糖蛋白, 在肝纤维化时沉积于Disse腔, 参与肝窦毛细血管的形成[13], 其血清含量变化在肝纤维化诊断和预后评估中均具有重要价值[14]. 本实验中发现, 三种药物各剂量治疗组中不仅有各项肝功能指标的改善, 而且肝组织HYP含量和血清HA、LN及PCIII含量均有不同程度的降低, 以小剂量Tet、大剂量大黄和小剂量潘生丁最为有效. 结果提示, 这三种药物能对抗CCl4所致的肝细胞损伤, 减少肝纤维化时ECM的沉积, 从而具有抗肝纤维化的作用.
本研究中HE常规染色显示, 模型对照组大鼠肝组织中可见肝细胞脂肪变性坏死, 炎细胞浸润, 汇管区扩大, Henny's管增生; VG胶原染色则显示, 汇管区内红色的胶原纤维明显增生, 纤维间隔增粗, 并有典型假小叶形成. 模型治疗组大鼠肝组织纤维结缔组织增生程度减轻, 纤维间隔变细, 假小叶形成不明显, 尤以小剂量Tet、大、中剂量大黄和小剂量潘生丁模型治疗组为明显, 与模型对照组比较有显著性差异(P<0.05), 但这四者之间的变化则无统计学意义(P>0.05). 实验结果进一步证实了Tet、大黄和潘生丁的抗大鼠肝纤维化作用.
业已证实, 肝脏贮脂细胞是肝脏发生纤维化的关键细胞. 在正常状态下, 其主要功能为储存和代谢维生素A, 仅合成与分泌少量的ECM及有一定的产生胶原酶的能力. 在肝损伤时, 贮脂细胞大量增生并发生表型改变, 转化为肌成纤维母细胞, 产生除V型胶原以外几乎所有的ECM成分[15]. 贮脂细胞的增生转化受多种因素调节, 其中, 血小板源生长因子(platelet-derived growth factor, PDGF)是最重要的细胞因子之一[16,17]. 体外研究发现, Tet能明显抑制肝贮脂细胞的增生与转化; 阻断PDGF对肝贮脂细胞的激活作用; 可呈浓度和时间依赖性地抑制成纤维细胞地生长和增生[18-21]. 有文献报道, 肝脏Kupper's细胞的活化可刺激肝贮脂细胞的增生和转化, 而大黄可剂量依赖性地抑制肝脏Kupper's细胞的活化[22]; 近年来国外研究认为, 潘生丁在肝损伤时能抑制血小板的聚集, 减少PDGF的释放, 从而影响PDGF对贮脂细胞的激活. 因此, 我们推测, 这三种药物抗肝纤维化作用可能与他们在不同环节抑制肝贮脂细胞增生转化有关.
本实验中, 三种药物之间的疗效无显著差异. 我们设想, 药物的联合应用是否可以提高疗效?而联合应用时各种药物的剂量又该如何设定?这些问题均有待于进一步研究.
| 3. | Perez-Alvarez V, Bobadilla-Lugo RA, Muriel P, Favari L, Villanueve-Lopez C. Effects of leukotriene synthesis inhibition on acute liver damage induced by carbon tetrachloride. Pharmacology. 1993;47:330-336. [PubMed] [DOI] |
| 5. | Schvarcz R, Glaumann H, Weiland O. Survival and his tologica-lresolution of fibrosis in patients with autoimmune chronic active hepatitis. J Hepatol. 1993;18:15-23. [DOI] |
| 11. | Nyberg A, Engstrom-Laurent A, Loof L. Serum hyaluronate in primary billiary cirrhosis-a biochemical marker for progressive liver damage. Hepatology. 1988;8:142-146. [DOI] |
| 12. | Wu J, Danielsson A. Detection of hepatic fibrogenesis: a review of avaiable techniques. Scand J Gastroenterol. 1995;30:817-825. [DOI] |
| 14. | Schuppan D, Stolzel U, Oesterling C, Somasundaram R. Serum assays for liver fibrosis. J Hepatol. 1995;22:82-88. [PubMed] |
| 15. | Ramadori G. The stellate cell (Ito-cell, fat-storing cell, lipocyte, perisinusoidal cell of the liver: new insights into pathophysiololgy of an intriguing cell. Virchows Archiv B Cell Pathol. 1991;61:147-158. [DOI] |
| 16. | Peterson TC. Pentoxifylline prevents fibrosis in an animal model and inhibits platelet-derived growth factor driven proliferation of fibroblasts. Hepatology. 1993;17:486-493. [PubMed] [DOI] |
| 17. | Marra F, Chouhury GG, Pinzani M, Abboud HE. Regulation of platelet-derived growth factor secretion and gene expression in human liver fat-storing cells. Gastroenterology. 1994;107:1110-1117. [DOI] |
| 22. | 许 锋, 陆 伯刚, 姚 智, 鲁 焕章, 吴 咸中. 大黄、大黄素对内毒素刺激下大鼠肝巨噬细胞分泌细胞因子影响的动态观察. 中国实验临床免疫学杂志. 1996;8:41-43. |