修回日期: 2002-07-15
接受日期: 2002-07-22
在线出版日期: 2003-01-15
目的: 应用热盐水灌胃方法制作大鼠慢性萎缩性胃炎(CAG)模型, 并检测热盐水所致大鼠慢性萎缩性胃炎(CAG)胃黏膜组织细胞中与CAG癌变有关的基因蛋白(HSP60, 70, 90α, p53)表达情况, 以探讨长期热咸饮食与CAG及胃癌发生的关系.
方法: (1)采用55 ℃, 15%的盐水对大鼠连续灌胃12 wk, 制作成大鼠CAG模型, 在灌胃期间每隔4 wk处死一批大鼠.(2)应用免疫组化方法检测对照组(蒸馏水灌胃12 wk)及模型组灌胃4 wk、8 wk、12 wk的大鼠胃黏膜组织细胞HSP60, 70, 90 α及p53蛋白表达情况.
结果: 模型组大鼠4 wk、8 wk时胃黏膜组织细胞HSP60, 70, 90α仅有少量表达, 与对照无明显差异(P>0.05). 至第12周出现萎缩时表达量较对照组明显增加, 差异有显著意义(P<0.01), 其中HSP70表达率最高(33%), HSP60最低(6%), HSP90居中(24%). 对照组大鼠胃黏膜组织细胞p53蛋白未见表达, 模型组大鼠4 wk、8 wk时p53蛋白未见表达, 至第12周时呈现一定水平的表达(15.5%), 并与HSP70、HSP90α的表达呈相关性, 以前者相关性最强; 与HSP60没有相关性.
结论: 这些结果说明长期过热过咸饮食可以导致萎缩性胃炎, 并有可能诱发癌变. HSP70、HSP90α与p53在CAG癌变的演变过程中可能起相关作用.
引文著录: 贾长河, 张沥, 张玲霞, 徐俊荣, 江梅, 张宁霞, 曹广周. 热盐水所致大鼠萎缩性胃炎胃黏膜HSP及p53蛋白的表达. 世界华人消化杂志 2003; 11(1): 29-32
Revised: July 15, 2002
Accepted: July 22, 2002
Published online: January 15, 2003
AIM: To study the relationship between hot high-salt diet and chronic atrophic gastritis (CAG) and gastric cancer, and detect the expression of HSP60, HSP 70 and HSP 90 a and p53 protein in the rat gastric mucosa of atrophic gastritis induced by high-salt hot water.
METHODS: Rat CAG models were firstly established by intragastrical feeding with 15% 55 ℃ salt water for 12 wk. Some rats were killed to detect HSP60, HSP 70, HSP 90 a and p53 protein every 4 wk by immunohistochemical method in the control group(intragastrically fed with 25 ℃ distilled water for 12 wk) and the experimental group.
RERULTS: The expression of HSP60, HSP70 and HSP90 a was low in gastric mucosal tissue cells of rats at 4 wk and 8 wk. There was no significant difference between the experimental and the control group (P > 0.05). The expression rates were significantly higher in the rats of experimental group at 12 weeks when CAG had formed than those in the control group (P < 0.01). The expression rates of HSP 70 were the highest (33%) among these proteins, the expression rates of HSP90 a were moderate (24%), and the expression rates of HSP60 were the lowest (6%). The p53 protein was not detected in normal group rats as well as in rats of the model group at 4 wk and 8 wk, but it was detected at 12 wk in the CAG rats of the model group with an expression rate of 15.5%, which was significantly associated with the expression of HSP70 and HSP90 a, especially, the former which had no association with the expression of HSP60.
CONCLUSION: Long time high-salt hot diet can induce CAG, and may even promote the development of gastric cancer. HSP70/HSP90 a and p53 proteins might have combined effect in the development from CAG to gastric cancer.
- Citation: Jia CH, Zhang L, Zhang LX, Xu JR, Jiang M, Zhang NX, Cao GZ. Expressions of HSP and p53 protein in gastric mucosa of atrophic gastritis induced by high-salt hot water in rats. Shijie Huaren Xiaohua Zazhi 2003; 11(1): 29-32
- URL: https://www.wjgnet.com/1009-3079/full/v11/i1/29.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i1.29
慢性萎缩性胃炎属癌前状态, 与胃癌的发生有十分密切的关系. 流行病学研究发现胃癌多发于高纬度地区, 这些地区多为高原和中温带气候, 受寒冷因素的影响这里的居民常年喜食高盐热烫食物, 我国胃癌高发区居民绝大多数有进食高盐食品的习惯. 我们以人类饮食中不可缺少的两大因素-食物的热度与咸度, 创建了快速建立慢性萎缩性胃炎动物模型的方法, 并从分子水平证实应用热盐水造出的大鼠CAG模型已存在癌变倾向.
100只7周龄健康、性成熟的二级♂SD大鼠, 体质量200-250 g由第四军医大学动物实验中心提供; SABC即用型试剂盒, HSP60、HSP70、HSP90α及p53一抗, 生物素化的二抗均购自武汉博士德公司; 余化学试剂均购自第四军医大学.
大鼠萎缩性胃炎模型采用55 ℃, 150 g/L的盐水连续灌胃12 wk[1], 对照组采用等量的蒸馏水灌胃12 wk, 在灌胃期间每隔4 wk处死一批大鼠, 至12 wk时全部处死. 收集制模阶段的大鼠胃黏膜石蜡包埋标本(其中包括热盐水灌胃4 wk的大鼠胃黏膜标本16例, 8 wk的标本18例, 12 wk的标本34例及对照组标本32例)进行免疫组织化学检测. 采用SABC即用型试剂盒, 切片常规脱蜡水化, 经30 ml/L过氧化氢-90 ml/L甲醇封闭内源性过氧化物酶20 min, 微波修复抗原10 min, 山羊血清孵育25 min后加一抗(HSP60, HSP70, HSP90α, p53), 4 ℃
冰箱过夜, 次日加对应的生物素化二抗, 37℃, 30 min; ABC复合物, 37 ℃, 30 min. 之后用DAB显色. 以上各步骤除血清孵育后甩干血清直接加一抗外, 均间以PBS洗涤3次, 每次3-5 min. 阴性对照以PBS代替一抗, 阳性对照分别为已知HSP60, HSP70, HSP90α及p53阳性的胃癌标本. 显微镜下观察DAB显色满意后自来水冲洗5 min; 苏木素复染5 s, 自来水冲洗5 min; 最后脱水, 透明, 中性树胶封片. 细胞质出现棕黄染色, 或伴有胞核棕黄色颗粒者为阳性细胞, p53仅为胞核染色. 高倍镜下选取5个有代表性的视野计数, 每个视野观察100个细胞, 计算阳性细胞的平均表达率. 未被染色或阳性细胞数<5%的视野视为阴性.
统计学处理 样本均数的比较采用t检验, 两样本相关的分析采用直线相关分析, 相关性用r表示.
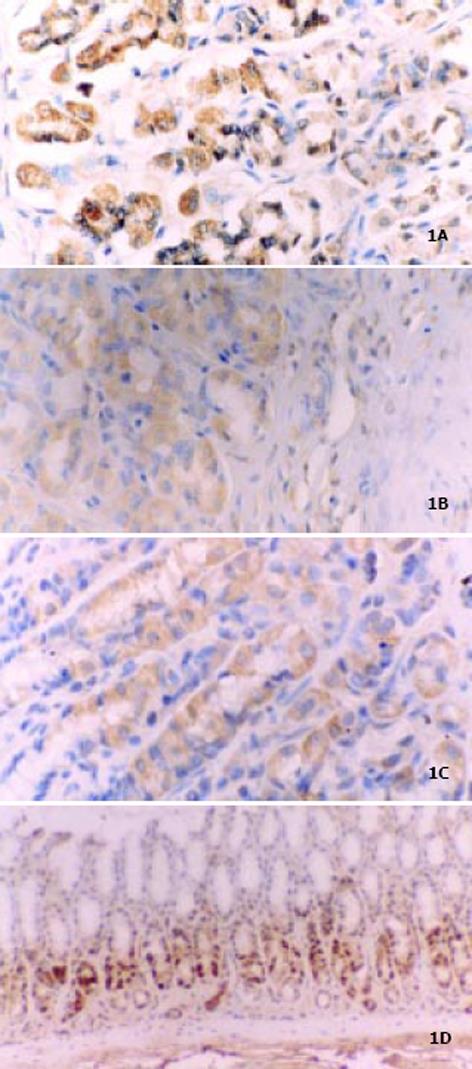
热盐水灌胃4 wk, 8 wk时大鼠胃黏膜组织切片无萎缩性胃炎的表现, 灌胃至12 wk时即出现胃黏膜腺体明显缩小, 腺上皮萎缩, 腺管腔变大等CAG表现, 而对照组无此表现. 模型组大鼠灌胃4 wk, 8 wk时胃黏膜组织细胞HSP60, 70, 90α有少量表达, 与对照组比较无显著差异(P>0.05), 灌胃至12 wk出现CAG时表达量较对照组明显增加, 差异有显著性(P<0.01). 对照组细胞p53蛋白未见表达, 模型组大鼠灌胃4 wk, 8 wk p53蛋白未见表达, 灌胃至12 wk呈现一定量的表达(15.5%). 同一CAG标本中, 可见HSP与p53共同表达, 经相关性检验发现HSP70, HSP90α与p53具有相关性. 其中HSP70与p53相关性最强, r = 0.81; HSP90α与p53相关性次之, r = 0.62; HSP60和p53无相关性. 以上几种蛋白阳性表达主要见于主细胞, 壁细胞(图1, 表1).
CAG常见与胃癌的发生有十分密切的关系[2-22], WHO将之定为胃癌前状态. 近年来流行病学研究表明[23], 长期高盐饮食可以导致CAG, 甚至诱发癌变. 本研究先以热盐水诱导大鼠产生CAG, 然后通过观察CAG大鼠所发生的分子水平变化, 进一步探讨热咸饮食-CAG-胃癌之间的关系. 热休克蛋白(heat shock protein, HSP)是细胞受到各种理化因素刺激后诱导产生的一组保护性蛋白, 具有维持细胞蛋白自身稳定及结合受体调节细胞周期等许多重要功能. HSP的这些功能主要是通过其分子伴侣作用实现的, 分子伴侣是细胞内一类能介导其他蛋白正确装配, 本身却不具功能的最终装配产物的组成成分. HSP通过这一作用影响细胞内多种蛋白质的构象, 参与细胞生长繁殖等重要生命过程. 一些癌基因蛋白如c-myc, Ras, p60v-src等; 细胞周期G1/S转换相关蛋白p38和p30; 类固醇激素受体等均需依赖HSPs形成活性. 目前发现的HSPs有40多种, 一般根据其同源性及分子量大小分为HSP90, HSP70, HSP60及小分子量HSP 4个家族[24]. 在结构上, 他们均具有C-端的ATP酶活性区和N-端的肽结合区; 在功能上, 具有相同、相似或协同作用.
近年来的研究发现, HSP与细胞的转化和恶变过程密切相关, 癌基因转化的细胞和人类恶性肿瘤细胞系中, HSP表达增高[25-27], 提示HSP与肿瘤的发生发展、生物学行为及其预后有较密切的关系[28,29]. 不同分子量的HSP与肿瘤的关系不尽相同. 低分子量的HSP在人类肿瘤组织中的表达差异较大, 有报道认为他主要与子宫及乳腺等部位的肿瘤发生有关. HSP60、HSP70和HSP90则广泛见于各种肿瘤组织. 根据是否含谷氨酰胺的片段, HSP90又分为HSP90α和HSP90 β二种, 二者同源性高达84%. 在病毒转化和化学诱导的肿瘤细胞中, HSP90α表达水平明显升高, 而HSP90 β基本不变, 所以二者中以HSP90α与肿瘤发生的关系最密切.
p53基因是迄今发现的与人类肿瘤相关性最高的基因, 定位于17号染色体短臂上, 是一个重要的细胞增生周期调节因子. 其中野生型p53基因在细胞损伤修复过程中, 监视着基因组DNA的完整性. 当细胞受到射线或某些药物作用而发生DNA损伤时, p53基因所编码的蛋白能使细胞分裂停止在G1/S期, 使细胞充分修复DNA的损伤, 使之恢复正常. 倘不能恢复, 野生型p53基因还能启动细胞的凋亡过程从而引导细胞的程序性死亡, 阻止具有癌变倾向的突变细胞出现. 但野生型p53基因很容易发生突变, 转变成突变型p53基因. 当p53基因突变或功能丧失时, p53介导的细胞周期调节失控, DNA分子程序紊乱, 发生遗传不稳定性及多倍体, 导致肿瘤发生. 野生型p53基因表达的蛋白半衰期甚短, 一般检测方法难以检出, 而当基因发生突变时, 其表达的蛋白质构型发生改变, 半衰期延长, 因此免疫组化测得的p53蛋白为突变型蛋白. 正常胃黏膜、慢性胃炎中无突变型p53表达, 一旦癌变, 其表达率明显增高.
HSP能与多种癌基因产物结合形成异源蛋白复合体, 介导癌蛋白构象成熟及转运, 从而参与细胞转化过程[30]. 大量文献报道肿瘤中常有HSP和p53的共同表达, HSP与突变或野生型p53结合在调控p53功能方面起着重要作用[31-33]. 在HSP中以HSP70与p53的关系最密切, HSP70与突变型p53能选择性结合形成稳定的复合物, 使核内p53蛋白转运到细胞质中, 丧失控制细胞增生的能力. 血清p53抗体阳性的肿瘤患者, 其肿瘤组织中存在突变p53/HSP70复合物, 提示此复合物可能是肿瘤发生、细胞恶变的机制之一, 并可作为判断预后不良的指标.
本研究对两组实验标本进行检测后发现, 模型组大鼠灌胃4 wk, 8 wk时胃黏膜组织细胞HSP60, HSP70, HSP90α蛋白有少量表达, p53蛋白没有表达, 与对照组比较无显著差异(P>0.05), 灌胃至12 wk出现CAG时表达量较对照组明显增加, 差异有显著性(P<0.01). 这说明热盐水灌胃对大鼠CAG的形成及胃黏膜癌变相关基因表达的影响是个逐渐发展的过程. 慢性萎缩性胃炎是胃癌的癌前病变, 现已公认胃黏膜细胞癌变常需经历萎缩性胃炎/伴肠化-不典型增生-胃癌的过程, 在此过程中常常存在一些基因的异常表达. 已有文献[34]报道HSP70、p53在正常胃黏膜、慢性浅表性胃炎、慢性萎缩性胃炎/肠上皮化生、不典型增生及胃癌组织中的表达呈递增形式, 依此推论, 若长期应用热盐水灌胃, 随着大鼠胃黏膜上述基因表达的变化, 很有可能出现肠化、不典型增生甚至胃癌的病理改变. 这表明热盐水所致的动物CAG模型已存在癌变的倾向. HSP60, HSP70, HSP90α三者进行比较以HSP70表达最高, HSP90α次之, HSP60最低, 统计学差异显著, 说明HSP70、HSP90α是主要的细胞周期调节蛋白, 二者在胃黏膜组织细胞中的高表达可能起着与多种癌基因产物结合形成异源蛋白复合体, 介导癌蛋白构象成熟及转运, 从而参与细胞转化过程的作用; HSP60表达较低, 可能在胃黏膜癌变过程中所起作用较弱. HSP60, HSP70, HSP90α 三者分别与p53进行相关性检验, 以HSP70相关性最强, r = 0.81; HSP90α相关性次之, r = 0.62; HSP60和p53之间无相关性. 提示HSP70/HSP90α与p53在CAG的癌变过程中起协同作用. 以上几种蛋白表达主要见于主细胞和壁细胞. 主细胞及壁细胞主要分泌消化酶和盐酸, CAG时由于主、壁细胞减少及其内质网、线粒体的变性改变, 分泌功能受损, 为了促进损伤修复, 细胞合成HSP及p53增加, 如果刺激因素持续存在, 细胞调节就有可能失控, 导致HSP过分表达及p53突变, 故可见主细胞及壁细胞中以上蛋白表达较多. 这些细胞功能异常, 导致胃黏膜泌酸及消化酶的产生发生障碍, 表现出一系列消化吸收功能减弱等CAG症状.
编辑: N/A
| 1. | Zhang L, Zhang LX, Xu JR, Cao GZ, Jiang M, Zhang NX, Jia CH. Rat model of atrophic gastritis induced by high-salt hot water. Shijie Huaren Xiaohua Zazhi. 2002;10:571-574. [DOI] |
| 2. | Asaka M, Sugiyama T, Nobuta A, Kato M, Takeda H, Graham DY. Atrophic gastritis and intestinal metaplasia in Japan: results of a large multicenter study. Helicobacter. 2001;6:294-299. [PubMed] [DOI] |
| 3. | Zhong FM, Song J, Yao P, Yin CC. Expression of p53 and Fas in H. pylori positive gastic cancer. Shijie Huaren Xiaohua Zazhi. 2001;9:456-457. [DOI] |
| 4. | Yao XX, Yin L, Zhang JY, Bai WY, Li YM, Sun ZC. Htert expression and cellular immunity in gastric cancer and precancerosis. Shijie Huaren Xiaohua Zazhi. 2001;9:508-512. [DOI] |
| 5. | Kong XD, Zhang SZ, Hu JK, Xiao CY, Sun Y, Xia QJ. Abnormalities of p15 gene and protein expression in gastric cancers. Shijie Huaren Xiaohua Zazhi. 2001;9:513-516. [DOI] |
| 6. | Cheng SD, Wu YL, Zhang YP, Qiao MM, Guo QS. Abnormal drug accumulation in multidrug resistant gastric carcinoma cells. Shijie Huaren Xiaohua Zazhi. 2001;9:131-134. [DOI] |
| 7. | Chen SY, Wang JY, Ji Y, Zhang XD, Zhu CW. Effects of Helicobacter pylori and protein kinase C on gene mutation in gastric cancer and precancer lesions. Shijie Huaren Xiaohua Zazhi. 2001;9:302-307. [DOI] |
| 8. | Wang B, Shi LC, Zhang WB, Xiao CM, Wu JF, Dong YM. Expression and significance of p16 gene in gastric cancer and its precancerous lesions. Shijie Huaren Xiaohua Zazhi. 2001;9:39-42. [DOI] |
| 9. | Gao MX, Zhang NZ, Ji CX. Estrogen receptor and PCNA in gastric carcinomas. Shijie Huaren Xiaohua Zazhi. 2000;8:1117-1120. [DOI] |
| 10. | Xia JZ, Zhu ZG, Liu BY, Yan M, Yin HR. Significance of immunohistochemically demonstrated micrometastases to lymph nodes in gastric carcinomas. Shijie Huaren Xiaohua Zazhi. 2000;8:1113-1116. [DOI] |
| 11. | Feng RH, Li JF, Liu BY, Zhu ZG, Yin HR. Htr gene cloning from human gastric cancer cells and the construction of its sense and antisense eukaryotic expression vector. Shijie Huaren Xiaohua Zazhi. 2001;9:1409-1414. [DOI] |
| 12. | Yang SM, Fang DC, Yang JL, Luo YH, Lu R, Liu WW. Effect of antisense gene to human telomerase reverse transcriptase on telomerase activity and expression of apoptosis-associated gene. Shijie Huaren Xiaohua Zazhi. 2002;10:149-152. [DOI] |
| 13. | Yu LF, Wu YL, Zhang YP. Reversal of drug resistance in the vincristine-resistant human gastric cancer cell lines MKN28/VCR by emuision of seminal oil of Brucea Javanica. Shijie Huaren Xiaohua Zazhi. 2001;9:376-378. [DOI] |
| 14. | Yin F, Shi YQ, Zhao WP, Xiao B, Miao JY, Fan DM. Suppression of P-gp induced multiple drug resistance in a drug resistant gastric cancer cell line by overexpression of Fas. World J Gastroenterol. 2000;6:664-670. [PubMed] [DOI] |
| 15. | Liu ZM, Shou NH, Jiang XH. Expression of lung resistance protein in patients with gastric carcinoma and its clinical significance. World J Gastroenterol. 2000;6:433-434. [PubMed] [DOI] |
| 16. | El-Zimaity HM, Ota H, Graham DY, Akamatsu T, Katsuyama T. Patterns of gastric atrophy in intestinal type gastric carcinoma. Cancer. 2002;94:1428-1436. [PubMed] [DOI] |
| 17. | Zheng ZH, Sun XJ, Qiu GR, Liu YH, Wang MX, Sun KL. E-cadherin gene mutation in precancerous condition early and advanced stages of gastric cancer. Shijie Huaren Xiaohua Zazhi. 2002;10:153-156. [DOI] |
| 18. | Ren J, Dong L, Pan BR, Xu CB, Li MZ. Interactions between human gastric carcinoma cells and vascular endothelial cells. Shijie Huaren Xiaohua Zazhi. 2001;9:1254-1260. [DOI] |
| 19. | Luo F, Sun JL, Ren DM, Cai D, Shen M. Effect of hyperthermia on telomerase activity and genes expression in human gastric cancer cell line. Shijie Huaren Xiaohua Zazhi. 2001;9:1261-1264. [DOI] |
| 20. | Liu HF, Liu WW, Fang DC, Gao JH, Wang ZH. Apoptosis and proliferation induced by Helicobacter pylori and its association with p53 protein expression in gastric epithelial cells. Shijie Huaren Xiaohua Zazhi. 2001;9:1265-1268. [DOI] |
| 21. | Wan SM, Sun SH, Deng MD, Ge QL, Yang YJ. TGF-a1 and PDGF-A expression in gastric cancer tissue and prognosis. Shijie Huaren Xiaohua Zazhi. 2002;10:36-39. [DOI] |
| 22. | Wang XB, Wang X, Zhang NZ. Inhibition of somatostatin analog Octreotide on human gastric cancer cell MKN45 growth in vitro. Shijie Huaren Xiaohua Zazhi. 2002;10:40-42. [DOI] |
| 23. | Fox JG, Dangler CA, Taylor NS, King A, Koh TJ, Wang TC. High-salt diet induces gastric epithelial hyperplasia and parietal cell loss, and enhances Helicobacter pylori colonization in C57BL/6 mice. Cancer Res. 1999;59:4823-4828. [PubMed] |
| 24. | Takeno S, Noguchi T, Kikuchi R, Sato T, Uchida Y, Yokoyama S. Analysis of the survival period in resectable stage IV gastric cancer. Ann Surg Oncol. 2001;8:215-221. [PubMed] [DOI] |
| 25. | Iaquinto G, Todisco A, Giardullo N, D'Onofrio V, Pasquale L, De Luca A, Andriulli A, Perri F, Rega C, De Chiara G. Antibody response to Helicobacter pylori CagA and heat-shock proteins in determining the risk of gastric cancer development. Dig Liver Dis. 2000;32:378-383. |
| 26. | Ren HY, Yi CQ, Zhang JK. Expression of PCNA and HSP70 in patients with H. pylori infected gastric mucosa. Tongji Yikedaxue Xuebao. 1999;28:135-137. |
| 27. | Guo JC, Li JC, Fan DM, Qiao TD, Zhang XY. Regulation of HSP70 expression in human gastric cancer cell line SGC7901 by gene transfection. Shijie Huaren Xiaohua Zazhi. 1999;7:773-776. [DOI] |
| 28. | Qiao H, Zhao M, Yuan X. [Expression of heat shock protein 90 alpha and its effect on the growth of tumor in mice]. Zhonghua Zhong Liu Za Zhi. 1999;21:19-21. [PubMed] |
| 29. | Iaquinto G, Todisco A, Giardullo N, D'Onofrio V, Pasquale L, De Luca A, Andriulli A, Perri F, Rega C, De Chiara G. Antibody response to Helicobacter pylori CagA and heat-shock proteins in determining the risk of gastric cancer development. Dig Liver Dis. 2000;32:378-383. [PubMed] [DOI] |
| 30. | Zylicz M, King FW, Wawrzynow A. Hsp70 interactions with the p53 tumour suppressor protein. EMBO J. 2001;20:4634-4638. [PubMed] [DOI] |
| 31. | Quenneville LA, Trotter MJ, Maeda T, Tron VA. p53-dependent regulation of heat shock protein 72. Br J Dermatol. 2002;146:786-791. [DOI] |
| 32. | Fan Y, Zhao M, Huang C. [Preliminary study of effect of antisense hsc70 effect on the stability of mutant p53 protein]. Zhonghua Zhong Liu Za Zhi. 2001;23:376-378. [PubMed] |
| 33. | Gaiddon C, Lokshin M, Ahn J, Zhang T, Prives C. A subset of tumor-derived mutant forms of p53 down-regulate p63 and p73 through a direct interaction with the p53 core domain. Mol Cell Biol. 2001;21:1874-1887. [PubMed] [DOI] |
| 34. | Cheng SB, Hong JQ, Wang YH. Expression and significance of heat shock protein 70 and p53 protein in gastric carcinoma. Shiyong Aizheng Zazhi. 2000;15:241-242. |