修回日期: 2002-07-25
接受日期: 2002-08-03
在线出版日期: 2003-01-15
目的: 探讨选择性COX-2抑制剂尼美舒利对胃癌细胞株SGC7901细胞增生及端粒酶活性的影响, 为选择性COX-2抑制剂应用于胃癌的防治提供新的理论依据.
方法: 用不同浓度的尼美舒利(0, 50, 100, 200及400 μmol/L)处理SGC7901胃癌细胞株后, 采用MTT比色试验和PCR-ELSIA半定量法检测细胞的增生和端粒酶活性, 同时用相差显微镜动态观察细胞形态及生长方式上的改变.
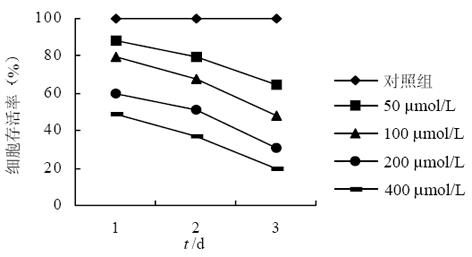
结果: 尼美舒利呈时间剂量依赖性抑制SGC7901细胞的生长, 同时他也能显著抑制SGC7901细胞的端粒酶的活性, 50, 100, 200及400 μmol/L浓度的尼美舒利实验组的吸光度值分别为2.12±0.11, 1.54±0.08, 1.13±0.09, 0.79±0.12 vs 2.76±0.06(P<0.01), 并呈剂量依赖关系.
结论: 选择性COX-2抑制剂尼美舒利能抑制胃癌细胞株SGC7901的端粒酶活性, 进而抑制其细胞生长, 这也可能是选择性COX-2抑制剂抗肿瘤作用的又一新的机制.
引文著录: 胡国勇, 于皆平, 冉宗学, 余保平, 罗和生. 选择性COX-2抑制剂尼美舒利抑制胃癌细胞株SGC7901端粒酶的活性. 世界华人消化杂志 2003; 11(1): 25-28
Revised: July 25, 2002
Accepted: August 3, 2002
Published online: January 15, 2003
AIM: To investigate whether nimsulide, a COX-2-specific inhibitor, could inhibit the proliferation viability and the telomerase activity of SGC7901 gastric cancer cell line.
METHODS: After SGC7901 was treated with different concentrations of nimsulide(0, 50, 100, 200 and 400 μmol/L, respectively), the cellular proliferation was evaluated by MTT assay and the telomerase activity was detected by PCR-ELISA assay. And the cell morphology and growth manner were observed under phase contrast microscope.
RESULTS: Nimsulide could inhibit the growth of SGC7901 gastric cancer cell line in the time and dose-dependent manner; and the telomerase activity of SGC7901 was significantly lower in the 50, 100, 200 and 400 μmol/L groups than that in the control group, their absorbance values were 2.12±0.11, 1.54±0.08, 1.13±0.09, 0.79±0.12 vs 2.76±0.06(P < 0.01), respectively.
CONCLUSION: COX-2-specific inhibitor could inhibit the telomerase activity of gastric cancer cell line, which provides a new pathway of COX-2-specific inhibitor in inhibiting the growth of gastric cancer.
- Citation: Hu GY, Yu JP, Ran ZX, Yu BP, Luo HS. Nimsulide suppresses the telomerase activity of SGC7901 gastric cancer cell line. Shijie Huaren Xiaohua Zazhi 2003; 11(1): 25-28
- URL: https://www.wjgnet.com/1009-3079/full/v11/i1/25.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i1.25
胃癌在我国最常见[1-4], 临床上就诊的患者多属中晚期、治疗效果差[5-7]. 因此提供一条有效的胃癌防治措施显得尤为迫切. 环氧化酶-2(cyclooxygenase-2, COX2)参与了多种肿瘤的发生发展过程. COX-2抑制剂-非甾体消炎药(NSAID)对大肠癌有预防作用 [8-10], 能明显降低患胃癌的危险度 [11], 阿司匹林在体外可诱导胃癌细胞凋亡[12]. 胃癌组织也有COX-2高表达现象[13,14], 同时胃癌组织中端粒酶阳性率高达90%, 且与肿瘤的恶性程度和预后密切相关[15-18]. 我们应用选择性COX-2抑制剂尼美舒利作用于胃癌细胞株SGC7901, 观察其对胃癌细胞增生和端粒酶活性的影响, 并探讨其可能的分子机制, 进一步阐明选择性COX-2抑制剂的抗肿瘤机制, 为胃癌的防治提供新的方法和理论依据.
人胃腺癌细胞株SGC7901购自中国科学院上海细胞生物研究所细胞库, RPMI1640培养基和胎牛血清(FBS)购自GIBCO公司, MTT、DMSO和尼美舒利购自Sigma公司, Telomerase PCR-ELISA试剂盒由Roche公司提供, 恒温CO2培养箱(Sheldon公司), 倒置显微镜(重庆光学仪器厂), 酶联免疫检测分析仪为Digiscan. 胃癌细胞株SGC7901细胞培养于含100 ml/L灭活的胎牛血清(FBS)、100 mg/L链霉素、100 U/ml青霉素的RPMI1640培养液中, 培养条件为37 ℃、50 ml/L CO2、饱和湿度, 每隔2-3 d用2.5 g/L胰酶/0.2 g/LEDTA消化, 以1: 3-1: 5传代1次.
相差显微镜下动态地观察SGC7901细胞和不同浓度(50, 100, 200, 400 mmol/L)的尼美舒利处理后的SGC7901细胞在大小、形态及生长方式上的改变. 细胞增生活性的检测用MTT比色试验. 用0.25%胰蛋白酶消化单层培养细胞SGC7901, 制备成单细胞悬液. 以每孔5×103个细胞接种于96孔培养板(每孔200 mL), 37 ℃、50 μl/L CO2及饱和湿度的CO2孵箱中培养24h后, 加入不同浓度的尼美舒利(50, 100, 200, 400 μmol/L). 并设不接种细胞的空白对照和只加等体积溶剂DMSO的对照组, 每一浓度每个时间点重复6孔. 然后于培养24、48、72 h后各组取6孔, 每孔加入MTT液(5 g/L)20 μL, 37 ℃孵育4 h后弃去上清液, 每孔加入DMSO150 mL, 轻轻振荡10 min, 使结晶物充分溶解, 在490 nm波长酶联免疫检测仪上测定各孔吸光度值, 并计算细胞存活率(%) = 实验组平均吸光度值/对照组平均吸光度值×100%. 将细胞悬液接种到25 cm2的培养瓶中, 待细胞生长到对数生长期(细胞密度约占2×108/L)时, 将不同浓度的尼美舒利(50, 100, 200及400 μmol/L)加入到SGC7901细胞中, 并设只加等体积溶剂DMSO为对照组, 每一浓度重复4瓶, 培养72 h后, 采用Telomerase PCR-ELISA试剂盒检测其端粒酶的活性, 具体操作按说明书标准程序进行, 在450 nm/690 nm波长下检测各组的吸光度值, 以均数±标准差(mean±SD)表示, 并计算端粒酶抑制率(%) =(1-实验组平均吸光度值/对照组平均吸光度值)×100%
统计学处理 以上实验数据采用SPSS10.0统计分析软件进行t检验分析, 所有数值以均数±标准差(mean±SD)表示, P<0.05为有统计学意义.
尼美舒利处理组SGC7901细胞体积略有增大, 呈圆形或多边形, 核浆比例减少, 异性性降低, 且细胞只能呈单层生长, 在长至100%汇合后恢复接触抑制和密度抑制, 在用药第3天后400 μmol/L组大部分细胞已脱壁、老化及死亡; 而对照组SGC7901细胞大小形态不一, 能叠加成堆生长, 丧失接触抑制和密度抑制的特性.
尼美舒利处理组(0, 50, 100, 200及400 μmol/L)SGC7901细胞的端粒酶活性呈剂量依赖性降低, 吸光度值分别为2.76±0.06, 2.12±0.11, 1.54±0.08, 1.13±0.09, 0.79±0.12(P<0.01), 其抑制率分别为23.2%, 44.3%, 59.1%和71.4%.
环氧合酶(cyclooxygenase, COX)是前列腺素合成的关键酶, 至今发现他至少有两种同工酶 : COX-1和COX-2. COX-1为结构型酶, 广泛分布于多种细胞和组织中, 正常情况下保持稳定水平, 以保证细胞的正常生理活动; COX-2为诱导型酶, 静息时不表达, 当细胞受到各种刺激时迅速合成, 表达增加. 近年来, COX-2在消化道肿瘤中所起的作用日益受到重视. 越来越多的证据表明, COX-2在消化道肿瘤的发生机制中扮演了重要的角色[13,14,19-26]. 传统NSAIDs因抑制COX-1活性而引起胃肠道黏膜损害, 而选择性COX-2抑制剂副作用小, 临床应用广阔. 因此选择性COX-2抑制剂有望成为胃癌防治的一条新的途径. 尽管选择性或非选择性COX-2抑制剂能够抑制多种肿瘤包括胃癌细胞的生长和增生 [24-32], 然而这些抗肿瘤效应的分子基础还未完全阐清. 一些COX-2抑制剂能诱导细胞凋亡, 而有些COX-2抑制剂却能诱导细胞周期的停滞. 此外, 不同COX-2抑制剂可能在不同类型的肿瘤细胞中发挥着不同的作用. 因此, 每一种COX-2抑制剂在不同类型的肿瘤中的作用可能具有特异性, 探讨每种COX-2抑制剂在不同类型的肿瘤中的作用机制, 对COX-2抑制剂在临床上应用于肿瘤的防治有重要的意义.
端粒酶是一种核蛋白酶, 由人端粒酶RNA(hTR)、端粒酶相关蛋白(hTP1)和端粒酶催化亚单位(hTERT)三部分组成. 近年来大量研究表明, 人类 85%以上的恶性肿瘤都有端粒酶活性表达, 而正常体细胞及良性肿瘤中端粒酶活性表达极低或无表达[33,34]. 在胃癌细胞中端粒酶活性普遍呈高表达, 提示端粒酶激活可能是肿瘤细胞增生的决定性因素 [15-18], 端粒酶的激活可能是细胞癌变的一条共同通路. 因此, 许多研究以抑制端粒酶的活性作为肿瘤基因治疗的切入点. 目前对端粒酶调节的分子机制尚未完全明了, 认为端粒酶活性的调节可在基因表达与转录、翻译后修饰和蛋白-蛋白相互作用等多个水平进行. 选择性COX-2抑制剂尼美舒利是否也能直接或间接地调节端粒酶的活性, 目前国内外相关研究较少. Lonnroth et al[35]发现消炎痛和磺化舒林酸能降低结肠癌细胞系中的端粒酶活性. 然而, 选择性COX-2抑制剂能否也降低所有高COX-2表达的肿瘤细胞(如胃癌)的端粒酶活性, 目前还未完全证实. 我们应用选择性COX-2抑制剂尼美舒利作用于胃癌细胞株SGC7901后发现, SGC7901细胞的增生能力明显受到抑制, 从形态学和生长方式上, SGC7901细胞的恶性表型有所逆转, 这一结果与文献[24,25,32]报道和我们以前的研究是一致的. 同时我们还首先发现尼美舒利能抑制胃癌细胞系SGC7901端粒酶的活性, 并且呈剂量依赖关系. 尼美舒利抑制SGC790细胞的生长与降低端粒酶活性有关, 这提示选择性COX-2抑制剂除通过诱导肿瘤细胞的凋亡、抑制细胞的增生、影响生长因子的表达和减少肿瘤血管的生成外, 降低端粒酶活性可能也是其抗肿瘤作用的又一新的机制. 然而选择性COX-2抑制剂是如何抑制肿瘤细胞端粒酶活性的具体机制仍旧不清楚. Counter et al[36]研究表明, 端粒酶的活性受端粒酶催化亚单位(hTERT)调节, hTERT磷酸化是端粒酶活性的必要条件. 新近研究表明, 蛋白激酶B(PKB)可通过磷酸化hTERT来增加端粒酶的活性 [37], 而选择性COX-2抑制剂又能抑制蛋白激酶B的磷酸化[38]. 因此, 从我们的实验结果中可推测, 选择性COX-2抑制剂抑制胃癌细胞株SGC7901端粒酶的活性可能与阻碍蛋白激酶B通路有关, 这有待于进一步的研究.
编辑: N/A
| 1. | Chen B, Zhang XY, Zhang YJ, Zhou P, Gu Y, Fan DM. Antisense to cyclin D1 reverses the transformed phenotype of human gastric cancer cells. World J Gastroenterol. 1999;5:18-21. [PubMed] [DOI] |
| 2. | Zou SC, Qiu HS, Zhang CW, Tao HQ. A clinical and long-term follow-up study of peri-operative sequential triple therapy for gastric cancer. World J Gastroenterol. 2000;6:284-286. [PubMed] |
| 3. | He XX, Wang JL, Wu JL, Yuan SY, Ai L. Telomerase expression, H. pylori infection and gastric mucosal carcinogenesis. Shijie Huaren Xiaohua Zazhi. 2000;8:505-508. [DOI] |
| 4. | Zhou XW. Current status and prospect of clinical studies on TCM treatment of precancerous lesions of stomach. Shijie Huaren Xiaohua Zazhi. 1999;7:277-279. [DOI] |
| 5. | Wu K, Liu BH, Zhao DY, Zhao Y. Effect of vitamin E succinate on expression of TGF-beta1, c-Jun and JNK1 in human gastric cancer SGC-7901 cells. World J Gastroenterol. 2001;7:83-87. [PubMed] [DOI] |
| 6. | Pan X, Ke CW, Pan W, He X, Gao GW, Qi ZT. Killing effect of DT/VEGF system on gastric carcinoma cell. Shijie Huaren Xiaohua Zazhi. 2000;8:393-396. [DOI] |
| 7. | Wang GT, Zhu JS, Xu WY, Wang Y, Zhou AG. Clinical and experimental studies on fuzheng anti-cancer granula combined with chemotherapy in advanced gastric cancer. Huaren Xiaohua Zazhi. 1998;6:214-218. [DOI] |
| 8. | Giovannucci E, Egan KM, Hunter DJ, Stampfer MJ, Colditz GA, Willett WC, Speizer FE. Aspirin and the risk of colorectal cancer in women. N Engl J Med. 1995;333:609-614. [PubMed] [DOI] |
| 9. | Jacoby RF, Seibert K, Cole CE, Kelloff G, Lubet RA. The cyclooxygenase-2 inhibitor celecoxib is a potent preventive and therapeutic agent in the min mouse model of adenomatous polyposis. Cancer Res. 2000;60:5040-5044. [PubMed] |
| 10. | Steinbach G, Lynch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB, Wakabayashi N, Saunders B, Shen Y, Fujimura T. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med. 2000;342:1946-1952. [PubMed] [DOI] |
| 11. | Akre K, Ekström AM, Signorello LB, Hansson LE, Nyrén O. Aspirin and risk for gastric cancer: a population-based case-control study in Sweden. Br J Cancer. 2001;84:965-968. [PubMed] [DOI] |
| 12. | Wong BC, Zhu GH, Lam SK. Aspirin induced apoptosis in gastric cancer cells. Biomed Pharmacother. 1999;53:315-318. [PubMed] [DOI] |
| 13. | Ristimäki A, Honkanen N, Jänkälä H, Sipponen P, Härkönen M. Expression of cyclooxygenase-2 in human gastric carcinoma. Cancer Res. 1997;57:1276-1280. [PubMed] |
| 14. | Gao HJ, Yu LZ, Sun L, Miao K, Bai JF, Zhang XY, Lu XZ, Zhao ZQ. The expression of Cox-2 Proteins in gastric cancer tissue and accompanying tissue. Shijie Huaren Xiaohua Zazhi. 2000;8:578-579. |
| 15. | Hiyama E, Yokoyama T, Tatsumoto N, Hiyama K, Imamura Y, Murakami Y, Kodama T, Piatyszek MA, Shay JW, Matsuura Y. Telomerase activity in gastric cancer. Cancer Res. 1995;55:3258-3262. [PubMed] |
| 16. | Zhu ZH, Xia ZS, He SG. The effects of ATRA and 5Fu on telomerase activity and cell growth of gastric cancer cells in vitro. Shijie Huaren Xiaohua Zazhi. 2000;8:669-673. [DOI] |
| 17. | Guan JL, Zhang JP, Zhou TH. Relationship between telomerase Helicobacter pylori and stomach cacner. Shijie Huaren Xiaohua Zazhi. 2000;8:910-911. [DOI] |
| 18. | Zhan WH, Ma JP, Peng JS, Gao JS, Cai SR, Wang JP, Zheng ZQ, Wang L. Telomerase activity in gastric cancer and its clinical implications. World J Gastroenterol. 1999;5:316-319. [PubMed] [DOI] |
| 19. | Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Up-regulation of cyclooxygenase 2 gene expression in human colorectal adenomas and adenocarcinomas. Gastroenterology. 1994;107:1183-1188. [PubMed] [DOI] |
| 20. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions:H.pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 21. | Zimmermann KC, Sarbia M, Weber AA, Borchard F, Gabbert HE, Schrör K. Cyclooxygenase-2 expression in human esophageal carcinoma. Cancer Res. 1999;59:198-204. [PubMed] |
| 22. | Shen ZX, Cao G, Sun J. The clinical and pathology effect of COX-2 mRNA expression in colorectal cancers. Shijie Huaren Xiaohua Zazhi. 2001;9:1082-1084. |
| 23. | Weaver SA, Russo MP, Wright KL, Kolios G, Jobin C, Robertson DA, Ward SG. Regulatory role of phosphatidylinositol 3-kinase on TNF-alpha-induced cyclooxygenase 2 expression in colonic epithelial cells. Gastroenterology. 2001;120:1117-1127. [PubMed] [DOI] |
| 24. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 25. | Li JY, Yu JP, Luo HS, Yu BP, Huang JA. Effects of nonsteroidal anti-inflammatory drugs on the proliferation and cyclooxygenase activity of gastric cancer cell line SGC7901. Shijie Huaren Xiaohua Zazhi. 2002;10:262-265. [DOI] |
| 26. | Buttar NS, Wang KK, Leontovich O, Westcott JY, Pacifico RJ, Anderson MA, Krishnadath KK, Lutzke LS, Burgart LJ. Chemoprevention of esophageal adenocarcinoma by COX-2 inhibitors in an animal model of Barrett's esophagus. Gastroenterology. 2002;122:1101-1112. [PubMed] [DOI] |
| 27. | Mann M, Sheng H, Shao J, Williams CS, Pisacane PI, Sliwkowski MX, DuBois RN. Targeting cyclooxygenase 2 and HER-2/neu pathways inhibits colorectal carcinoma growth. Gastroenterology. 2001;120:1713-1719. [PubMed] [DOI] |
| 28. | Wight NJ, Gottesdiener K, Garlick NM, Atherton CT, Novak S, Gertz BJ, Calder NA, Cote J, Wong P, Dallob A. Rofecoxib, a COX-2 inhibitor, does not inhibit human gastric mucosal prostaglandin production. Gastroenterology. 2001;120:867-873. [PubMed] [DOI] |
| 29. | Wallace JL, McKnight W, Reuter BK, Vergnolle N. NSAID-induced gastric damage in rats: requirement for inhibition of both cyclooxygenase 1 and 2. Gastroenterology. 2000;119:706-714. [PubMed] [DOI] |
| 30. | Zhang Z, DuBois RN. Par-4, a proapoptotic gene, is regulated by NSAIDs in human colon carcinoma cells. Gastroenterology. 2000;118:1012-1017. [PubMed] [DOI] |
| 31. | Shirvani VN, Ouatu-Lascar R, Kaur BS, Omary MB, Triadafilopoulos G. Cyclooxygenase 2 expression in Barrett's esophagus and adenocarcinoma: Ex vivo induction by bile salts and acid exposure. Gastroenterology. 2000;118:487-496. [PubMed] [DOI] |
| 32. | Uefuji K, Ichikura T, Shinomiya N, Mochizuki H. Induction of apoptosis by JTE-522, a specific cyclooxygenase-2 inhibitor, in human gastric cancer cell lines. Anticancer Res. 2000;20:4279-4284. [PubMed] |
| 33. | Kim NW, Piatyszek MA, Prowse KR, Harley CB, West MD, Ho PL, Coviello GM, Wright WE, Weinrich SL, Shay JW. Specific association of human telomerase activity with immortal cells and cancer. Science. 1994;266:2011-2015. [PubMed] [DOI] |
| 34. | Fu JM, Yu XF, Shao YF. Telomerase and primary liver cancer. Shijie Huaren Xiaohua Zazhi. 2000;8:461-463. |
| 35. | Lönnroth C, Andersson M, Lundholm K. Indomethacin and telomerase activity in tumor growth retardation. Int J Oncol. 2001;18:929-937. [PubMed] [DOI] |
| 36. | Counter CM, Meyerson M, Eaton EN, Ellisen LW, Caddle SD, Haber DA, Weinberg RA. Telomerase activity is restored in human cells by ectopic expression of hTERT (hEST2), the catalytic subunit of telomerase. Oncogene. 1998;16:1217-1222. [PubMed] [DOI] |
| 37. | Kang SS, Kwon T, Kwon DY, Do SI. Akt protein kinase enhances human telomerase activity through phosphorylation of telomerase reverse transcriptase subunit. J Biol Chem. 1999;274:13085-13090. [PubMed] [DOI] |
| 38. | Hsu AL, Ching TT, Wang DS, Song X, Rangnekar VM, Chen CS. The cyclooxygenase-2 inhibitor celecoxib induces apoptosis by blocking Akt activation in human prostate cancer cells independently of Bcl-2. J Biol Chem. 2000;275:11397-11403. [PubMed] [DOI] |