Copyright
©The Author(s) 2013.
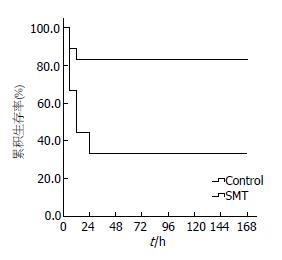
图1 辛伐他汀治疗组和D-GalN/LPS急性肝衰竭对照组小鼠1 wk生存曲线.
Balb/c小鼠腹腔注射D-GalN/LPS(600 mg/kg, 10 μg/kg)诱导急性肝衰竭, 腹腔注射前3 d, 1次/d给予辛伐他汀(25 mg/kg)灌胃. Kaplan-Meier生存率分析, P<0.01 (Log rank test, F = 8.661, P = 0.003). SMT: 辛伐他汀; Control: 急性肝衰竭对照组.
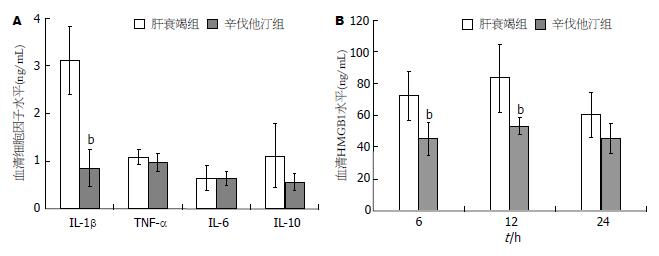
图2 辛伐他汀对肝衰竭小鼠血清炎症因子和抗炎因子水平的影响.
辛伐他汀治疗组(n = 18)和肝衰竭组(n = 18)血清细胞因子水平. A: 血清细胞因子水平, 辛伐他汀治疗组12 h的TNF-α、IL-6和抗炎因子IL-10水平与肝衰竭组无差异, 两组IL-1β水平差异有显著性, bP<0.01 vs 肝衰竭素; B: 血清HMGB1水平, 辛伐他汀治疗组12和24 h血清HMGB1水平显著低于肝衰竭组, bP<0.01 vs 肝衰竭素, 而血清6 h的HMGB1水平无差异. IL: 白介素; TNF: 肿瘤坏死因子.
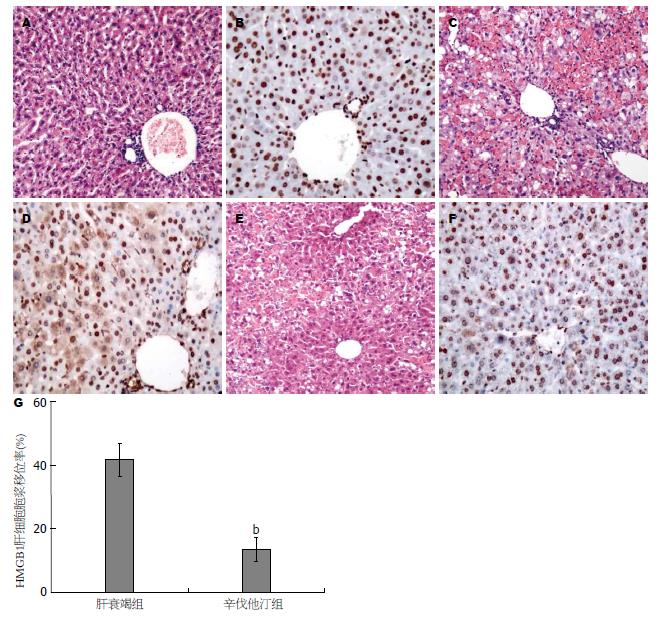
图3 辛伐他汀减轻肝衰竭小鼠肝组织炎症坏死(×200).
A: 正常小鼠肝组织HE染色; B: 正常小鼠肝脏细胞HMGB1表达在胞核; C: 急性肝衰竭组小鼠肝细胞片状坏死, 坏死区大量炎症细胞浸润; D: 急性肝衰竭组小鼠大量肝细胞胞浆表达HMGB1, 发生HMGB1胞浆移位; E: 辛伐他汀治疗组仅出现局灶性肝细胞坏死; F: 辛伐他汀治疗组仅发生少量HMGB1胞浆移位; G: 肝细胞HMGB1胞浆移位率. 辛伐他汀治疗组肝细胞HMGB1胞浆移位率显著低于肝衰竭组, bP<0.01 vs 肝衰竭组.
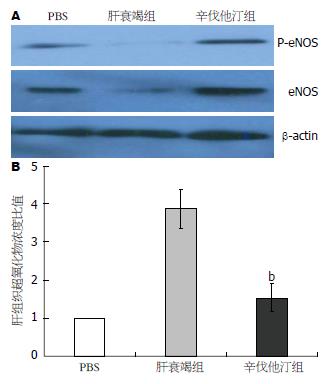
图4 辛伐他汀对内皮细胞氧化亚氮合成酶和肝脏过氧化物水平的影响.
A: 免疫印迹检测不同处理组肝脏eNOS和P-eNOS表达; B: 各处理组肝脏过氧化物水平. bP<0.01, t = 9.1 vs 肝衰竭组. eNOS: 内皮型一氧化氮合酶; P-eNOS: 磷酸化内皮型一氧化氮合酶.
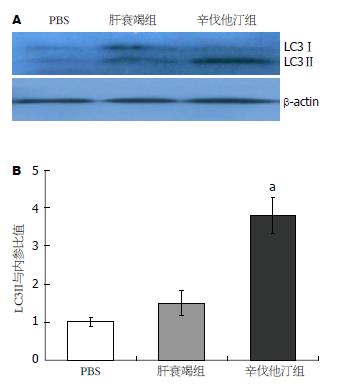
图5 辛伐他汀促进急性肝衰竭肝细胞自噬.
A: 免疫印迹检测肝脏LC3Ⅱ表达; B: 以PBS组为1.0比较不同处理组肝脏LC3Ⅱ表达, 辛伐他汀治疗组LC3Ⅱ表达较肝衰竭组增高, aP<0.05, t = 3.11 vs 肝衰竭组.
引文著录: 雷延昌, 罗盼, 李雯. 辛伐他汀保护小鼠急性肝衰竭肝损伤. 世界华人消化杂志 2013; 21(35): 3940-3946