修回日期: 2017-11-24
接受日期: 2017-12-03
在线出版日期: 2017-12-28
采用高通量测序技术检测溃疡性结肠炎(ulcerative colitis, UC)和正常人群的肠道菌群分布, 挖掘与UC形成和发展显著相关的菌属结构, 促进UC的研究和新药开发.
提取各研究样本染色体DNA, 并进行DNA片段长度检测和定量. 对提取的DNA样本进行16S rRNA V3区基因扩增及焦磷酸测序.
UC患者的肠道菌群整体结构与健康对照人群具有显著的差异, 主要表现为拟杆菌门、变形菌门和厚壁菌门丰度降低. 其中在11个代谢通路中二组平均丰度存在显著差异(P<0.05).
肠道菌群结构的异常改变与UC的发生发展存在较强相关性. 多个代谢通路参与了UC的形成发展. 通过分析疾病相关的关键菌群结构, 有助于了解疾病的分子病理基础, 并为新药设计提供可借鉴的理论依据.
核心提要: 本文主要通过对正常人群和溃疡性结肠炎(ulcerative colitis, UC)患者肠道菌群的检测, 发现二者之间肠道菌群的菌群结构差异. 并结合KEGG数据库挖掘和UC显著相关的信号通路, 为UC药物靶标的设计提供可借鉴的思路.
引文著录: 姜洋, 赵秋枫, 王实, 罗灵和, 徐平珍. 基于16S rRNA序列分析肠道菌群失调与溃疡性结肠炎的相关性. 世界华人消化杂志 2017; 25(36): 3191-3202
Revised: November 24, 2017
Accepted: December 3, 2017
Published online: December 28, 2017
To detect the distribution of intestinal flora between ulcerative colitis (UC) patients and normal controls by high-throughput sequencing to discover the genus structures related to the formation and development of UC.
Chromosomal DNA was extracted from each sample, and the length of DNA fragment was detected and quantified. Gene amplification and sequencing of the V3 region of 16S rRNA were then performed.
The structure of intestinal flora in UC patients exhibited a significant decrease in the numbers of Bacteroidetes, Proteobacteria, and Firmicute, compared with that of healthy controls. There were significant differences (P < 0.05) in the mean abundance of 11 metabolic pathways between the two groups.
There is a strong correlation between the abnormal changes of the intestinal flora structure and the occurrence and development of UC. Multiple metabolic pathways are involved in the formation and development of UC. It is helpful to understand the molecular pathological basis of UC by analyzing the key structures of bacterial flora, which will provide a theoretical basis for the reasonable design of new drugs.
- Citation: Jiang Y, Zhao QF, Wang S, Luo LH, Xu PZ. Analysis of relationship between intestinal flora imbalance and ulcerative colitis based on 16S rRNA sequences. Shijie Huaren Xiaohua Zazhi 2017; 25(36): 3191-3202
- URL: https://www.wjgnet.com/1009-3079/full/v25/i36/3191.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i36.3191
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分清楚的结肠和直肠慢性非特异性炎症性疾病, 炎症反应及病理的改变主要累及结肠及直肠[1]. 近几年研究发现肠道微生物群落可能与UC的发生发展具有很大的相关性. 目前, UC在我国的发病率呈现逐年升高的趋势, 虽然UC的病因尚不清楚, 但研究者普遍认为UC的发病与宿主共生的肠道菌群紊乱, 免疫功能失调, 氧化应激以及炎症介质的参与等有关[2]. 在本研究中, 我们共选取了16例样本, 其中包含8例患者和8例健康对照者的粪便样品作为研究对象, 采用Illumina公司的MiSeq测序仪检测16S rRNA 基因V3区的多样性, 从而研究UC患者肠道菌群的结构, 并与健康人肠道菌群的结构进行比较以期发现肠道菌群的改变与UC的相关性.
1.1.1 一般资料: 本研究共包括16名志愿者. 其中8例UC患者为浙江省立同德医院2015-07/2015-12诊断为UC的患者, 随机选择同期健康查体8例作为对照组. 病例组男性5例, 女性3例, 平均年龄38.6岁±5.4岁, 对照组男性4例, 女性4例, 平均年龄36.5岁±4.2岁. 由于抗生素对肠道菌群影响较大, 要求所有病例在采样前均未接受过任何抗生素治疗, 正常对照者3 mo内未发生过消化系统疾病, 也未使用过抗生素, 根据纳入标准进行筛选. 所有参与实验者均已签署实验知情同意书. 且该项目通过浙江省立同德医院伦理委员会的批准.
1.1.2 入选标准: (1)入选病例均符合"炎症性肠病诊断和治疗共识意见(2012年, 广州)"制订的UC诊断标准; (2)年龄在16至70岁之间; (3)采集粪便标本前4 wk未使用微生态制剂或抗生素.
1.1.3 排除标准: (1)细菌性痢疾、阿米巴痢疾、慢性血吸虫病、肠结核、缺血性结肠炎、放射性结肠炎、结肠癌等; (2)未定型结肠炎者; (3)儿童炎症性肠病患者; (4)妊娠期或哺乳期妇女; (5)合并大肠肿瘤者; (6)合并全身其他部位肿瘤及恶性血液病者; (7)合并肝硬化、糖尿病、肾功能衰竭、重度脂肪肝、肥胖患者; (8)病理发现有结节病样肉牙肿者.
1.2.1 粪便样本DNA提取、文库构建及测序: DNA提取: 高通量测序对DNA的完整性有较高要求. 采用天根粪便DNA提取试剂盒抽提粪便组织中DNA, 通过Qubit对DNA浓度进行定量, 并通过Agilent 2100对DNA完整性进行评价. DNA质量符合的样本进行文库构建.
文库构建:采用独特的二步PCR方法进行样本文库构建. 以不同样本DNA为模板, 通过PCR反应完成第一轮扩增. 采用磁珠法对PCR产物进行纯化后, 分别用含有不同index的引物(该引物含有与测序flow cell上面接头配对的序列、区分不同样本之间的index序列及悬挂接头序列的一部分)进行第二轮PCR扩增, 再经磁珠纯化后, 分别用Qubit和Agilent2100对文库的质量进行检测. 检测合格的文库将采用Illumina Miseq高通量测序平台对样品进行测序.
本项目采用Illumina公司的MiSeq测序仪进行高通量测序. 该测序平台可以针对16S rRNA的一个或多个高变区域进行测序, 样本制备文库的DNA起始量可低至50 ng. 文库制备完成后, 簇生成和测序都在MiSeq上完成.
对提取的DNA样本进行16S rRNA V3区基因扩增及测序, 扩增引物为5'-NNNNNNNNCCTACGGGAGGCAGCAG-3'和5'-NNNNNNNNATTACCGCGGCTGCT-3', 其中"NNNNNNNN"为对各样品进行扩增所设定的唯一性标签序列. 进行对各样品的PCR扩增和总体测序分析.
1.2.2 测序结果的生物信息学分析: 对测序结果根据不同的标签序列区分不同的样品相关序列并建立相应文库, 用CD-HIT软件进行聚类分析, 并进一步完成各文库中可操作分类单位(operational taxonomic units, OTUs)分析. 依托新一代DNA测序仪和计算平台, 经过宏基因组分析技术得到肠道菌群分布.
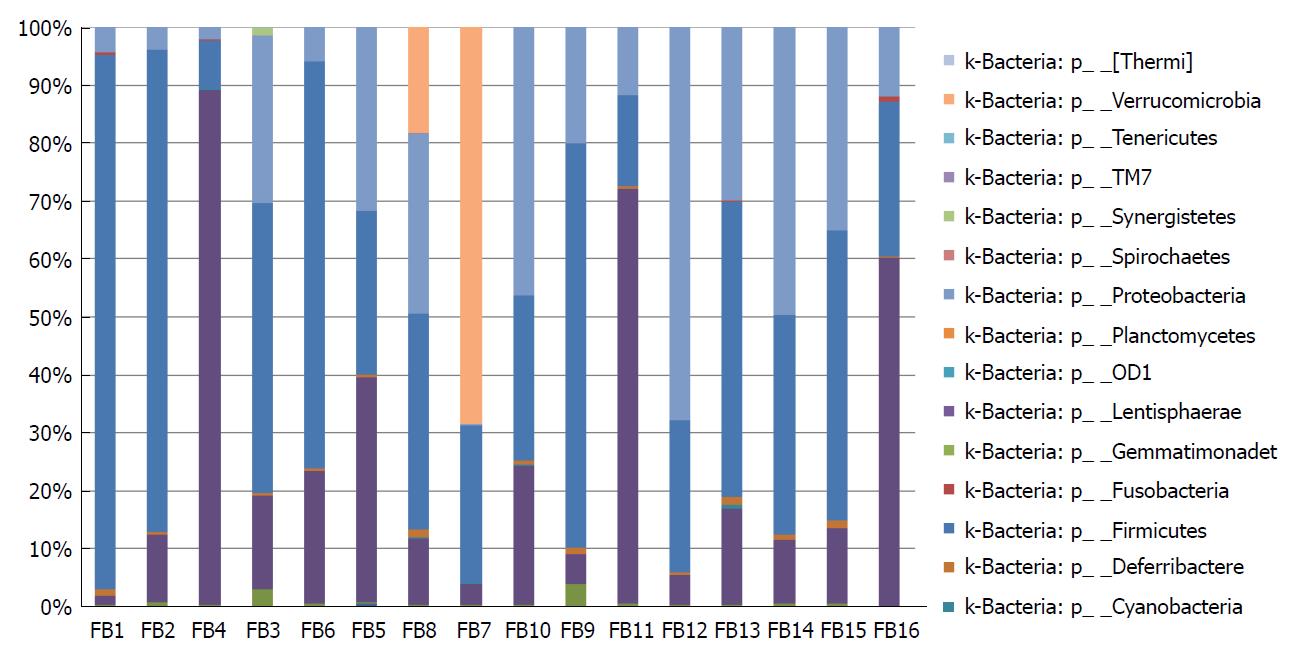
研究共包含16个样本, 其中FB1、FB4、FB6、FB8、FB10、FB11、FB13和FB15为UC样本, 其余8个样本为正常对照组. 在门的水平上, 中国人群肠道内一共含有属于19个门的细菌, 257个属. 其中以厚壁菌门、拟杆菌门和变形菌门最为优势, 比例占肠道内总细菌的90%以上. 各样本门水平上相对丰度分布如图1. 样本主要包含19个门, 疣微菌门(verrucomicrobi)、软壁菌门(tenericute)、TM7门(TM7)、互养菌门(Synergistetes)、螺旋体门(Spirochaetes)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、黏胶球形菌门(lentisphaerae)、黏胶球形菌门(Gemmatimonadet)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicute)、脱铁杆菌门(Deferribacteres)、蓝细菌门(Cyanobacter)、拟杆菌(Bacteroidetes)、放线菌(Actinobacteria)、酸杆菌门(Acidobacteria)等.
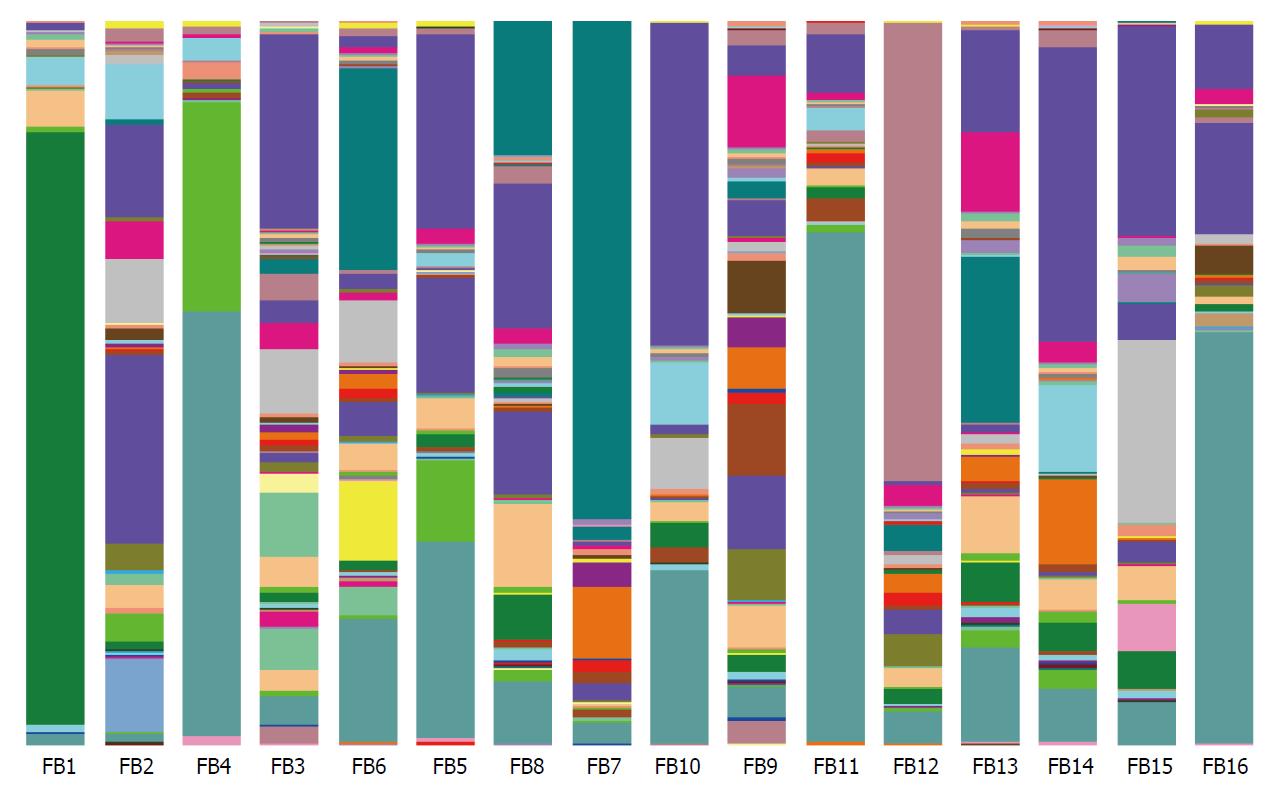
在种的水平, 所有序列根据97%的相似性水平划分为6489个分类操作单位OTUs. 人群肠道菌群属水平上的多样性组成呈现显著的个体差异, 如表1和图2.
| 属水平上物种分类 | UC组 | 对照组 | P值 | ||
| 平均丰度 | 标准差 | 平均丰度 | 标准差 | ||
| p__Actinobacteria; g__Collinsella(柯林斯氏菌) | 0.011 | 0.031 | 0.111 | 0.182 | 0.038 |
| p__Firmicutes; g__Clostridium(梭菌属) | 0.287 | 0.303 | 2.323 | 2.449 | 0.009 |
| p__Firmicutes; g__Coprococcus(粪球菌属) | 0.104 | 0.161 | 1.133 | 1.633 | 0.046 |
| p__Firmicutes; g__Lachnospira(毛螺菌属) | 0.008 | 0.014 | 0.128 | 0.186 | 0.038 |
| p__Firmicutes; g__Roseburia(罗斯氏菌属) | 0.080 | 0.100 | 1.670 | 2.227 | 0.012 |
| p__Proteobacteria; g__Flexispira(胃螺杆菌样细菌)1 | 0.062 | 0.053 | 0.018 | 0.014 | 0.038 |
| p__Bacteroidetes; g__Alistipes(理研菌) | 0 | 0 | 0.028 | 0.049 | 0.016 |
| p__Firmicutes; g__Turicibacter(未定) | 0.063 | 0.142 | 0.185 | 0.213 | 0.026 |
| p__Firmicutes; g__Anaerostipes(丁酸弧菌) | 0.0007 | 0.002 | 0.142 | 0.253 | 0.008 |
| p__Firmicutes; g__Megasphaera(巨球型菌属) | 0.0004 | 0.001 | 0.033 | 0.065 | 0.042 |
本研究通过宏基因组学16S rRNA测序技术分析了UC患者和正常人群肠道的菌群构成, 证实UC患者的肠道菌群整体结构与健康对照人群具有显著的差异, 主要表现为拟杆菌门、厚壁菌门含量降低, 变形菌门升高. Yao等[2]研究发现UC患者主要表现为拟杆菌门、变形菌门和厚壁菌门含量降低[3]和本研究结果稍有差异, 可能是个体条件或饮食结构不同所带来的差异. Ott等[4]对炎症性肠病(inflammatory bowel disease, IBD)急性期患者结肠各部位的活检标本菌群构成进行了基于16S rDNA的单链构型多态性检测, 发现克罗恩病(Crohn's disease, CD)患者肠道微生物多样性降低至50%, UC患者降低至30%, 肠道正常厌氧菌如拟杆菌属、真细菌属、乳杆菌属等减少. Manichanh等[5]对恢复期CD患者粪便菌群构成进行了16S rDNA测序分析, 结果发现CD患者厚壁菌门多样性显著降低, 特别是柔内梭菌、球形梭菌丰度较低, 而拟杆菌门变化不大. 由我国华大基因研究院负责的对欧洲124个成人个体进行的肠道宏基因组测序工作已经完成, 该研究证实IBD患者与健康个体间的细菌丰度存在差异, 非冗余的细菌基因在IBD患者与健康个体中亦存在差异. 由于UC患者存在梭菌属丰度较低的现象, 故临床常采用美沙拉嗪与酪酸梭菌肠球菌三联活菌片联合对UC进行治疗[6]. 上述研究说明UC的形成和发展同肠道菌群的分布存在较强的相关性.
对测得的序列通过KEGG数据库进行注释, 共注释到328个通路中. 其中在11个代谢通路中二者平均丰度存在显著差异(P<0.05, 表2). UC组微生物在以下8个通路中的平均丰度显著高于对照组(P<0.05).
| 代谢通路 | UC组 | 对照组 | P值 | ||
| 平均丰度 | 标准差 | 平均丰度 | 标准差 | ||
| Signal Transduction | |||||
| Phosphatidylinositol signaling system | 0.1022 | 0.0155 | 0.0845 | 0.0182 | 0.019 |
| Biosynthesis of Other Secondary | |||||
| Metabolites;Isoflavonoid biosynthesis | 8.97×10-6 | 8.03×10-6 | 9.75×10-7 | 1.39×10-7 | 0.003 |
| Novobiocin biosynthesis1 | 0.1161 | 0.01 | 0.1277 | 0.0122 | 0.025 |
| Lipid Metabolism | |||||
| Linoleic acid metabolism | 0.0851 | 0.0505 | 0.0518 | 0.0197 | 0.025 |
| Primary bile acid biosynthesis | 0.0416 | 0.0186 | 0.0257 | 0.012 | 0.019 |
| Secondary bile acid biosynthesis | 0.0414 | 0.0187 | 0.0255 | 0.012 | 0.018 |
| Nucleotide Metabolism | |||||
| Purine metabolism | 2.2171 | 0.2176 | 2.0283 | 0.1561 | 0.018 |
| Xenobiotics Biodegradation and Metabolism | |||||
| Ethylbenzene degradation | 0.0769 | 0.0643 | 0.0429 | 0.00795 | 0.018 |
| Naphthalene degradation | 0.1827 | 0.0823 | 0.13 | 0.0261 | 0.018 |
| Nitrotoluene degradation1 | 0.0651 | 0.0346 | 0.1022 | 0.0198 | 0.025 |
| Styrene degradation1 | 0.0155 | 0.0131 | 0.0329 | 0.0231 | 0.025 |
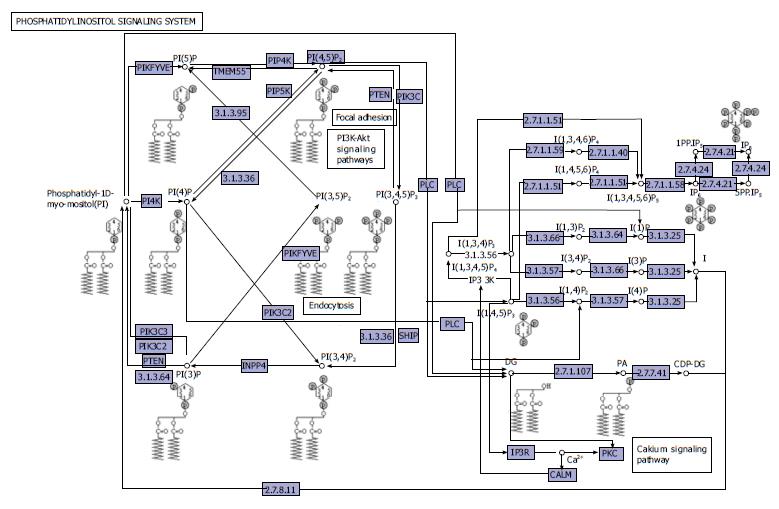
2.2.1 磷脂酰肌醇信号通路: 在UC炎症-肿瘤序列演进过程中, 抑癌基因PTEN蛋白表达的降低及原癌基因蛋白激酶B(protein kinase B, AKT)蛋白表达的增强, 可能是UC发生及癌变的重要原因之一[7]. PTEN蛋白表达的明显降低和AKT蛋白表达的明显增强有可能成为早期监测UC癌变的一个辅助指标. 黄晓丽等[8]通过对20例结肠癌旁正常组织标本, 采用体外组织培养法观察磷脂酰肌醇-3-激酶(phosphatidyl inositol 3-kinase, PI3K)/Akt信号传导通路抑制剂Wortmannin对UC患者肠黏膜活检组织肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)表达的影响, 结果表明PI3K/Akt信号传导通路参与了促炎性细胞因子TNF-α的调控与释放. 促炎因子TNF-α的表达失衡与UC的病情进展相关, 对UC的诊断和临床评估具有重要意义. 其次, 肠道菌群的结构的变化可能促使对PTEN蛋白具有调控作用的菌群增加从而进一步抑制PTEN蛋白表达进而导致UC的发生(图3).
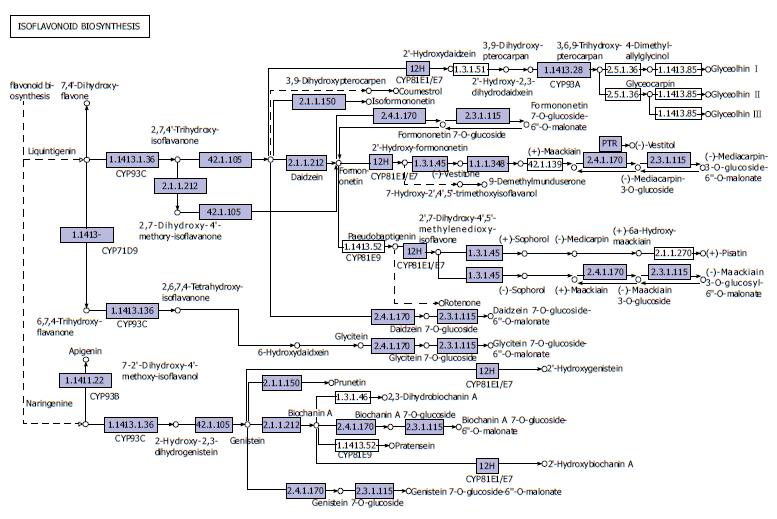
2.2.2 异黄酮的生物合成: 黄酮类化合物具有广泛的生物学作用. 近年来, 大量的实验证据和流行病学证据表明, 黄酮类化合物能预防和治疗多种癌症[9,10]. 黄酮类化合物的抗癌机制主要与其抑制癌细胞增殖并诱导凋亡、抑制癌细胞迁移、抑制新生血管形成、抗氧化、抗炎症和提高机体免疫力这几个方面有关. 异黄酮能够选择性地抑制大肠杆菌的生长, 促进有益菌乳酸杆菌的生长, 调节肠道微生物的微生态平衡. UC组别和正常人群的肠道菌群在异黄酮的生物合成通路上丰度存在显著差别, 说明菌群结构可能同异黄酮生物合成存在某种关联, 而体内异黄酮具有抗炎作用, 其水平的高低同时对炎症产生影响(图4).
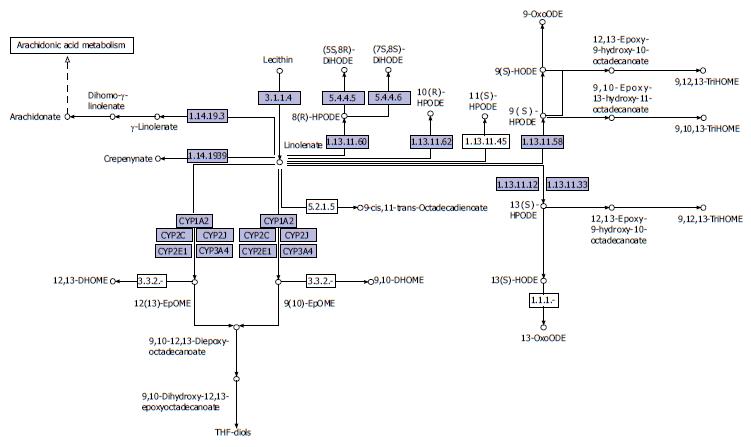
2.2.3 亚油酸代谢通路: 从代谢过程可知, 亚油酸(LA)在体内△-6脱氢酶的作用下, 依次产生γ-亚麻酸GLA和花生四烯酸AA等中间产物, 进而获得提供正常代谢机能的前列腺素等二十碳酸物质, 可以改善人体一些疾病状况如: 抗血栓、改善糖尿病、降低血压、改善皮肤炎、防止老化及抗癌等. 有研究[11]显示, 饮食中的亚油酸, 是一种多不饱和脂肪酸, 代谢成为花生四烯酸, 后者是结肠细胞膜的成分. 花生四烯酸代谢物有前炎症特性, 在UC患者的黏膜中增加. 饮食中亚油酸在UC发病中起一定作用, 估计有30%的病例与饮食中亚油酸摄入量过高有关. 花生四烯酸代谢物有炎症特性在UC患者的黏膜中增加, 可见亚油酸代谢通路深度参与了UC的发展过程(图5).
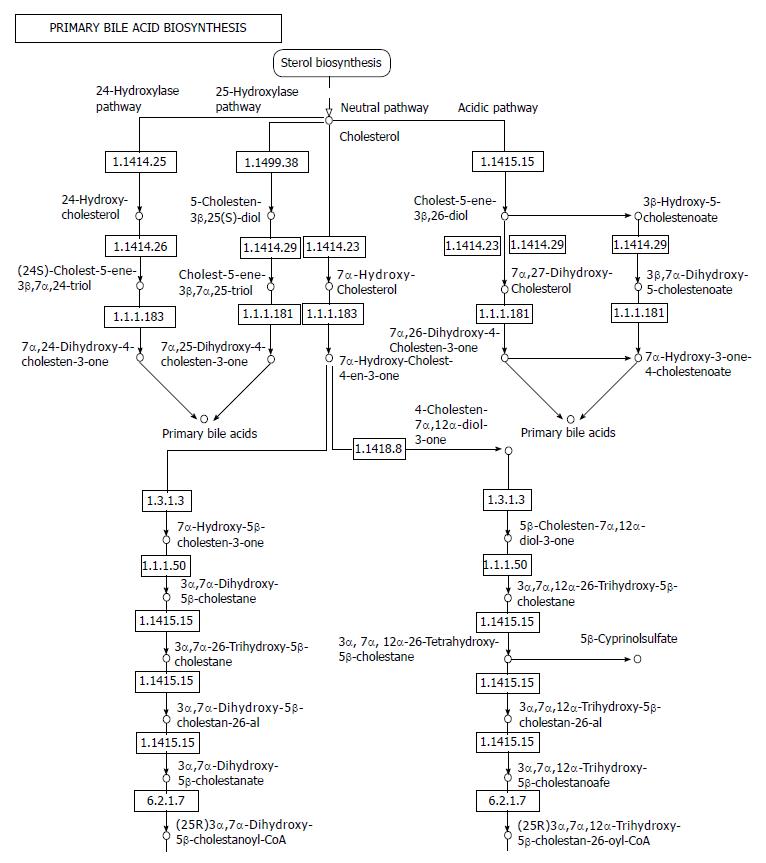
2.2.4 原发性胆汁酸的生物合成: 胃肠道细胞暴露在反复高水平的胆汁酸中是IBD和胃肠道癌症的一个重要的危险因素. 一些实验动物模型和临床患者研究[12]表明, 在炎症性肠病和结肠癌中胆汁酸水平升高. 因此, 有理由认为恢复胆汁酸的稳态有可能是治疗炎症性肠病及预防结肠癌的一种有用的方法. 然而, 目前对于胆汁酸在炎症性肠病中异常积聚的分子机制和信号通路还不是很清楚. 菌群丰度在原发性胆汁酸的生物合成及次级胆酸生物合成通路中的显著差异表明菌群结构可能对胆汁酸含量产生影响(图6).
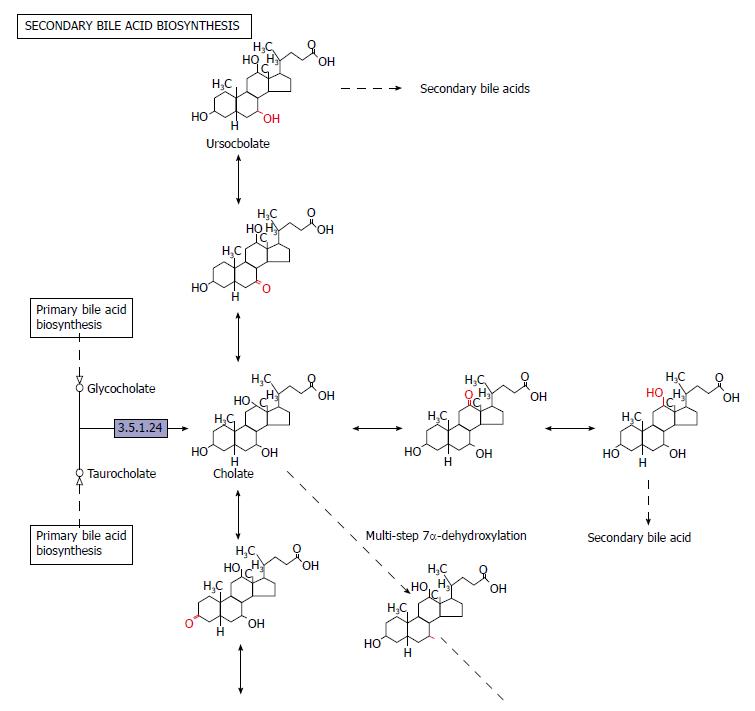
2.2.5 次级胆酸生物合成: 肠道菌群通过肝肠循环影响胆汁酸池的大小和成分. 在肠道菌群的作用下, 初级胆汁酸7α一羟基脱氧后生成次级胆汁酸, 即脱氧胆酸和石胆酸. 另外多种肠道细菌的胆汁酸盐水解酶共同催化水解N一乙酰氨基键, 完成结合型胆汁酸的解离. 肠道菌群通过法尼醇X受体(farnesoid X receptor, FXR)和G蛋白偶联胆汁酸受体(G protein-coupled bile acid receptor, TGR)5调节胆汁酸代谢, 并且参与有关胆汁酸合成、代谢和重吸收的基因表达. Sayin等发现肠道菌群不仅调节次级胆汁酸代谢, 而且通过对回肠中FXR的作用, 调节肝脏中胆汁酸的合成与代谢. 胆汁酸也是TGR5的配体, 可激活核受体FXROFXR对于控制脂肪在肝脏中的从头合成和甘油一酯的输出和转运起关键作用, TGR5刺激胰高血糖素样肽分泌, 与次级胆汁酸结合, 促进糖代谢(图7).
其他代谢通路包括嘌呤代谢等通路. 硫代嘌呤:包括6-巯嘌呤及硫唑嘌呤: 两者是嘌呤代谢的拮抗剂, 是目前临床上最广泛应用于IBD治疗的免疫抑制剂. 对于嘌呤代谢通路而言, 免疫抑制剂免疫系统的异常是引起UC发病的主要内在因素这一学说已经得到普遍认可, 而免疫抑制剂类药物正是通过主要抑制人体的免疫系统发挥作用而起到治疗UC的效果. 嘌呤信号主要包括3部分, 其中一部分为核苷酸及衍生物作用的特异性受体. 三磷酸腺苷(adenosine triphosphate, ATP)不仅在细胞能量代谢过程中发挥着重要作用. 细胞外ATP作为一种新的危险信号, 通过作用于2型嘌呤受体激活细胞内的信号级联反应, 参与机体内诸多病理生理过程, 如细胞增殖、分化、凋亡、炎症反应和代谢等. 饮食中的亚油酸可能与UC有关[11]. 上述通路参与了UC的形成和发展过程, 为研究UC的致病机制提供了可借鉴的意义.
UC在医学上是属于一种自身免疫性类别的疾病[13], 一般来说, 结肠炎都是因为某些病原体感染、遗传基因及精神因素所引起的, 并且病程时间较长, 很容易迁延不愈, 尤其UC疾病, 常常会出现大便带黏液和脓血, 而这些症状却并不是单纯地依靠通过调理脾胃、健脾益肠就可以彻底治愈的. 由于UC的病理机制尚不清楚, 所以导致对UC进行治疗后, 反复复发难以治愈. 单纯的药物治疗很难改变患者肠道既有的菌群分布, 而UC患者肠道微生态的改变可能是UC发病的关键诱因. 所以改善患者肠道微生态是UC治疗的基础.
人体肠道内共存在1000多种细菌, 每个人肠道中都有至少100多种优势细菌, 并被绝大多数个体所共有. 健康成年人肠道菌群中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)占优势地位, 放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)和变形菌门(Proteobacteria)等次之. 这些细菌在肠道内形成一定的比例, 从而控制着肠道菌群的平衡. 这种关系可以直接反映宿主自身健康状态, 如果肠道菌群失衡, 某类细菌增多, 就会导致疾病.
本研究通过对浙江杭州地区16例样本肠道菌群进行测序, 对UC患者肠道菌群结构的特征进行了描述. 选取8例UC患者和8例健康对照志愿者的粪便样品作为研究对象, 以高通量测序技术结合统计学方法检测细菌16S rRNA基因V3区的多样性[14]. 研究结果发现, UC患者的肠道菌群结构与健康对照组具有显著的差异, 其中主要表现为拟杆菌门、变形菌门和厚壁菌门细菌在UC患者肠道中的数量显著偏低, 而变形菌门(Proteobacteria)细菌则显著偏高. 经过统计学分析, 筛选出10个在两类人群肠道菌群结构的差异中最为关键的细菌种属. 这其中, 有7类细菌菌属均属于厚壁菌门, 其他3类分别属于梭杆菌门、放线菌门和变形菌门.
肠道菌群在UC的发生发展过程中起着重要的作用. 但是到目前为止, 针对UC肠道菌群进行的研究还不足以清楚完整地描述其组成结构. 长期的膳食结构与肠道菌群分型有着紧密的联系[15]. 长期食用高蛋白和高脂肪的人群拟杆菌属含量偏高, 碳水化合物的长期摄入会有普雷沃氏菌属富集的现象. 双歧杆菌属对肠道具有保护作用, 长期高脂饮食, 会使得双歧杆菌对肠道的保护作用消失. 所以肠道疾病患者更应注意饮食结构的调整, 尤其是益生菌的补给. 酸奶中的菌种包含嗜热链球菌(厚壁菌门、链球菌属)、长双岐杆菌(放射菌门、双歧杆菌属、可以到达大肠)、保加利亚乳杆菌(厚壁菌门、乳杆菌属)、嗜酸乳杆菌(厚壁菌门、乳杆菌属)、乳双歧杆菌BB-12(双歧杆菌菌株, 通过胃肠道可以存活). 患者应多注意长双岐杆菌和乳双歧杆菌BB-12的特殊作用, 这两种菌可以深入肠道, 对肠道微生态的改善具有特殊的作用. 其他菌种可能由于温度和体内环境等其他原因很难存活到达肠道. 先通过食疗对UC患者肠道微生态进行有效改善的基础上进行后续药物治疗, 治疗效果可能会优于目前单存的药物治疗方式.
总之, 本研究通过基于两组人群的群组比较分析, 发现了UC患者中普遍存在着肠道菌群结构失调的现象. 宿主肠道菌群结构的变化可能不仅在UC发生的初期即已发生, 而且可能伴随并影响后续疾病进展的整个发生过程. 本课题研究结果提示, 肠道菌群的结构改变可以作为一个优选指标, 用于监测肠道疾病易感人群的健康状态, 结合其他临床指标综合评估易感人群肠道疾病患病风险. 而本研究所揭示的与UC相关的菌群结构变化特征也将有助于更深入地研究宿主和肠道菌群之间在代谢和免疫等方面的相互作用, 并揭示菌群在UC发生发展过程中的作用.
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分清楚的结肠和直肠慢性非特异性炎症性疾病. 近几年研究发现肠道微生物群落可能与UC的发生发展具有很大的相关性.
采用高通量测序技术检测UC和正常人群的肠道菌群分布, 挖掘与UC形成和发展显著相关的菌属结构, 可促进UC的研究和新药开发.
单纯的药物治疗很难改变患者肠道既有的菌群分布, 而UC患者肠道微生态的改变可能是UC发病的关键诱因, 所以改善患者肠道微生态是UC治疗的基础.
目前UC的治疗主要以抗炎药物为主, 但效果有限, 极易复发. 因此挖掘UC新的宿主药物靶标, 开发创新新型药物是急需解决的问题. 本研究主要采用高通量技术手段挖掘UC患者肠道菌群的特征结构以期为菌群为靶点的药物开发提供可借鉴的思路.
本研究通过采用高通量测序技术检测UC和正常人群的肠道菌群分布, 挖掘与UC形成和发展显著相关的菌属结构, 以促进菌群为靶点的创新型药物开发.
肠道菌群: 健康人的胃肠道内寄居着种类繁多的微生物, 这些微生物称为肠道菌群.
本文通过采用粪便中DNA样本, 进行16S rRNA V3区基因扩增及焦磷酸测序技术, 初步分析了UC患者粪便中菌群的变化, 有一定的临床价值.
霍丽娟, 山西医科大学第一医院消化内科; 刘杰民, 副主任医师, 贵州省人民医院消化内镜科; 刘占举, 教授, 主任医师, 上海第十人民医院消化内科; 张晓岚, 主任医师, 河北医科大学第二附属医院消化内科
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:杜冉冉
| 1. | Lopetuso L, Gasbarrini A. Ulcerative colitis. Recenti Prog Med. 2016;107:297-308. [PubMed] [DOI] |
| 2. | Yao P, Cui M, Wang H, Gao H, Wang L, Yang T, Cheng Y. Quantitative Analysis of Intestinal Flora of Uygur and Han Ethnic Chinese Patients with Ulcerative Colitis. Gastroenterol Res Pract. 2016;2016:9186232. [PubMed] [DOI] |
| 4. | Ott SJ, Musfeldt M, Wenderoth DF, Hampe J, Brant O, Fölsch UR, Timmis KN, Schreiber S. Reduction in diversity of the colonic mucosa associated bacterial microflora in patients with active inflammatory bowel disease. Gut. 2004;53:685-693. [PubMed] [DOI] |
| 5. | Manichanh C, Rigottier-Gois L, Bonnaud E, Gloux K, Pelletier E, Frangeul L, Nalin R, Jarrin C, Chardon P, Marteau P. Reduced diversity of faecal microbiota in Crohn's disease revealed by a metagenomic approach. Gut. 2006;55:205-211. [PubMed] [DOI] |
| 7. | Li Z, Liu GX, Liu YL, Chen X, Huang XL, Gan HT. Effect of adenovirus-mediated PTEN gene on ulcerative colitis-associated colorectal cancer. Int J Colorectal Dis. 2013;28:1107-1115. [PubMed] [DOI] |
| 8. | 黄 晓丽, 郑 玉霞, 廖 再波, 尹 静, 甘 华田. 磷脂酰肌醇3激酶信号传导通路在溃疡性结肠炎发病中的作用. 四川大学学报(医学版). 2008;39:364-367. |
| 9. | Yun BH, Lee YH, Park KT, Jung SJ, Lee YS. Synthesis of novel flavone derivatives possessing substituted benzamides and their biological evaluation against human cancer cells. Bioorg Med Chem Lett. 2016;26:4170-4173. [PubMed] [DOI] |
| 10. | Kasala ER, Bodduluru LN, Barua CC, Gogoi R. Antioxidant and antitumor efficacy of Luteolin, a dietary flavone on benzo(a)pyrene-induced experimental lung carcinogenesis. Biomed Pharmacother. 2016;82:568-577. [PubMed] [DOI] |
| 11. | IBD in EPIC Study Investigators. Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, Hagglund G, Berglund G, Lindgren S, Grip O, Palli D, Day NE, Khaw KT, Bingham S, Riboli E, Kennedy H, Hart A. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009;58:1606-1611. [PubMed] [DOI] |
| 12. | Zhou X, Cao L, Jiang C, Xie Y, Cheng X, Krausz KW, Qi Y, Sun L, Shah YM, Gonzalez FJ. PPARα-UGT axis activation represses intestinal FXR-FGF15 feedback signalling and exacerbates experimental colitis. Nat Commun. 2014;5:4573. [PubMed] [DOI] |
| 13. | Weigmann B, Neurath MF. Oxazolone-Induced Colitis as a Model of Th2 Immune Responses in the Intestinal Mucosa. Methods Mol Biol. 2016;1422:253-261. [PubMed] [DOI] |
| 14. | Kevans D, Tyler AD, Holm K, Jørgensen KK, Vatn MH, Karlsen TH, Kaplan GG, Eksteen B, Gevers D, Hov JR. Characterization of Intestinal Microbiota in Ulcerative Colitis Patients with and without Primary Sclerosing Cholangitis. J Crohns Colitis. 2016;10:330-337. [PubMed] [DOI] |