修回日期: 2006-05-01
接受日期: 2006-05-11
在线出版日期: 2006-08-08
目的: 探讨慢性乙肝患者肝组织穿孔素表达的临床意义.
方法: 慢性乙肝患者47例, 进行肝穿刺活组织病理学检查, 其中的35例患者随后接受了α-2b干扰素抗病毒治疗. 用免疫组织化学技术检测肝组织穿孔素的表达, 同时检测外周血HBV DNA载量、乙肝病毒血清免疫学标志物和肝功能等.
结果: 慢性乙肝患者中有37例肝组织穿孔素表达阳性, 其中强阳性13例. 穿孔素表达强度与血清ALT水平、肝组织炎症程度具有显著的一致性关系(分别为χ2 = 8.004, P = 0.018; χ2 = 8.532, P = 0.014); 与肝组织纤维化程度无关(χ2 = 0.865, P = 0.649); 与外周血乙肝病毒载量呈显著的负向关系(χ2 = 7.902, P = 0.019), 与HBeAg水平也几乎呈显著的负向关系(χ2 = 5.283, P = 0.071). 35例接受干扰素抗病毒的患者治疗结束时完全应答为12例, 部分应答14例, 无应答9例, 分析显示治疗前穿孔素表达的强度与干扰素应答具有显著的一致性关系(χ2 = 7.533, P = 0.023).
结论: 慢性乙肝患者肝组织穿孔素的表达介导了肝细胞的损害, 有利于乙肝病毒的清除, 可能会促进干扰素的抗病毒效果, 并具有预测干扰素抗病毒疗效的价值.
引文著录: 王海燕, 贺永文, 朱传武, 钱峰, 李明, 罗湘蓉, 常建国, 张雪华. 慢性乙型肝炎患者肝组织穿孔素表达的临床意义. 世界华人消化杂志 2006; 14(22): 2207-2210
Revised: May 1, 2006
Accepted: May 11, 2006
Published online: August 8, 2006
AIM: To investigate the clinical significance of intrahepatic perforin expression in patients with chronic hepatitis B virus (HBV) infection.
METHODS: The hepatic biopsies were performed in 47 patients with chronic hepatitis B, and out of them, 35 patients subsequently received interferon α-2b antiviral therapy. The expression of perforin in liver tissues was detected by immunohistochemistry, and the HBV DNA loads, the serum HBV immunologic markers and transaminases were also determined in peripheral blood samples.
RESULTS: The expression of intrahepatic perforin was positive in 37 patients (13 cases strongly positive). The intensity of perforin showed a significant accordance with serum alanine aminotransferase (ALT) level (χ2 = 8.004, P = 0.018) and histological inflammation grades (χ2 = 8.532, P = 0.014), but did not correlate with the degrees of liver fibrosis (χ2 = 0.865, P = 0.649). The data showed a significantly negative correlation between perforin and the HBV DNA loads (χ2 = 7.902, P = 0.019), and there was almost significantly correlation between perforin and the level of HBeAg (χ2 = 5.283, P = 0.071). Among the 35 patients accepted interferon antiviral therapy, there were 12 cases with complete responses, 14 cases with partial responses and 9 without responses at the end of treatment. The intensity of perforin expression was positively correlated with the interferon responses (χ2 = 7.533, P = 0.023).
CONCLUSION: The expression of intrahepatic perforin can mediate the liver cell injury, contribute to the clearance of hepatitis B virus, and enhance the antiviral efficacy of interferon, and it may be a predictor to interferon antiviral therapy.
- Citation: Wang HY, He YW, Zhu CW, Qian F, Li M, Luo XR, Chang JG, Zhang XH. Clinical significance of intrahepatic perforin expression in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2207-2210
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2207.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2207
在乙肝病毒感染的过程中, 细胞毒T淋巴细胞(CTLs)的细胞毒效应是清除肝内乙肝病毒的主要作用机制. 通常, CTLs依赖2条独立的途径发挥其细胞毒作用, 即穿孔素途径和凋亡途径[1]. 国外的部分临床和动物研究已发现, 穿孔素与病毒性肝炎的肝细胞损害有密切的关系[2-3]. 为进一步探讨肝组织穿孔素的表达对肝脏炎症、纤维化、乙肝病毒及抗病毒治疗的影响, 我们对47例慢性乙肝患者的相关指标进行了如下研究.
2001-04/2005-03间的住院慢性乙型肝炎患者47例, 男36例, 女11例, 年龄21-52(平均30.4)岁. 其中轻度17例, 中度27例, 重度3例. 诊断参照2000年西安全国病毒性肝炎会议修订的临床诊断标准. 所有患者均排除了甲、丙、丁、戊型肝炎病毒重叠感染以及其他原因(如酒精、药物、自身免疫等)引起的肝脏损害. 其中35例接受了α-2b干扰素500 MU抗病毒治疗6 mo, 干扰素疗效判断标准依据2005-12中华医学会肝病学分会、感染病学分会制定的慢性乙型肝炎防治指南. 乙肝病毒血清免疫学标志物检测试剂购自美国Abbott公司; HBV DNA荧光定量PCR试剂购自深圳百雅克泰公司; 鼠抗人穿孔素mAb为美国Biolegend公司产品; 生物素标记的羊抗鼠抗体为英国KPL公司产品; ABC试剂盒及DAB底物试剂盒为美国Vector实验室产品. 采用沪产18号肝活检针, 抽吸负压后1 s快速穿刺, 获得肝组织长度均在1.5 cm以上, 所有肝标本均用40 g/L甲醛溶液立即固定, 24 h后石蜡包埋, 4 μm连续切片, 作病理学检查, 其余切片-20℃冰箱保存待作免疫组织化学染色. 同期采集血清检测HBV免疫学标志物和HBV DNA载量, 并检测肝功能和血常规. 干扰素抗病毒治疗者定期抽血复查以上指标.
肝组织穿孔素的免疫组化染色 采用亲和素-生物素-过氧化物酶技术(SABC法)检测, 镜下控制显色时间, 染色结束后自然干燥, 中性树胶封片, 研究设阴性对照. 根据穿孔素在肝组织内染色的深浅及分布范围, 按阴性: 不显色; 阳性: 显示µ棕黄色, 断续分布; 强阳性: 显示深棕黄色, 弥漫性或团块状分布.
统计学处理 数据分析采用Excel 2003软件的列联表χ2检验, 检验水准为α= 0.05.
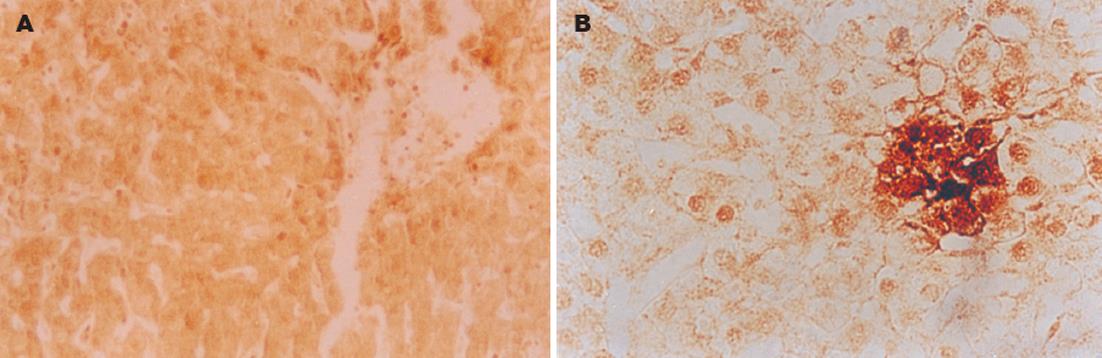
在47例慢性乙肝患者中, 肝组织穿孔素表达阳性者37例, 阳性率为78.7%, 其中强阳性13例. 穿孔素呈棕黄色或深棕黄色染色, 多表达于肝细胞质中, 呈点状、弥漫性或团块状分布, 主要分布于肝组织的炎症活动部位和汇管区(图1A-B).
以ALT和AST的3倍正常值上限(ULN)为界(本院ULN为46 IU/L, 约合766.8 nkat/L), 分析肝组织穿孔素表达与肝脏炎症的关系, 发现穿孔素表达的强度与ALT水平呈显著一致性关系(χ2 = 8.004, P = 0.018); 但与AST水平未见有显著性关系(χ2 = 2.779, P = 0.249, 表1). 参照2000年西安全国病毒性肝炎会议修订的肝脏病理学诊断标准, 将肝脏炎症和纤维化大致分为轻、中和重度3个级别, 以分析肝脏炎症及纤维化与穿孔素表达强度的关系(表1). 结果显示穿孔素表达与肝脏活动性炎症呈显著一致性关系(χ2 = 8.532, P = 0.014), 但与肝组织纤维化的程度无关(χ2 = 0.865, P = 0.649).
| 临床研究参数 | n | 穿孔素表达强度 | ||
| 阴性 | 阳性 | 强阳性 | ||
| ALT | ||||
| ≤19044 nkat/L | 20 | 8 | 9 | 3 |
| >19044 nkat/L | 27 | 2 | 15 | 10 |
| AST | ||||
| ≤19044 nkat/L | 22 | 7 | 10 | 5 |
| >19044 nkat/L | 25 | 3 | 14 | 8 |
| 炎症分级 | ||||
| 轻度(G1) | 15 | 6 | 8 | 1 |
| 中度(G2-G3) | 22 | 4 | 12 | 6 |
| 重度(G4) | 10 | 0 | 4 | 6 |
| 纤维化分期 | ||||
| 轻度(S1) | 15 | 5 | 7 | 3 |
| 中度(S2-S3) | 21 | 4 | 11 | 6 |
| 重度(S4) | 11 | 1 | 6 | 4 |
| 乙肝病毒载量 | ||||
| <105 copies/mL | 7 | 0 | 2 | 5 |
| 105-108 copies/mL | 27 | 4 | 16 | 7 |
| >108 copies/mL | 13 | 6 | 6 | 1 |
| 干扰素应答 | ||||
| 完全 | 12 | 0 | 4 | 8 |
| 部分 | 14 | 1 | 9 | 4 |
| 无 | 9 | 6 | 2 | 1 |
根据外周血HBV DNA载量的高低分为3组, 分析其与肝组织穿孔素表达强度的关系, 可见肝组织穿孔素表达越强, 外周血HBV DNA载量越低, 经显著性检验, 发现两者有显著的关系(χ2 = 7.902, P = 0.019, 表1). 对其中31例HBeAg阳性患者穿孔素表达的强度与HBeAg水平(以200 S/CO为界分为2组)进行分析, 发现穿孔素表达越强, HBeAg水平越低, 经显著性检验, 两者的关系为χ2 = 5.283, P = 0.071, 几乎具有统计学意义. 35例接受干扰素抗病毒治疗6 mo的患者, 应答结果: 为完全应答12例, 部分应答14例, 无应答9例. 分析表明, 治疗前穿孔素表达强度与干扰素的疗效具有显著的一致性关系(χ2 = 7.533, P = 0.023, 表1).
穿孔素主要是由CTLs和NK细胞产生的, 当CTLs被激活后, 胞质内的毒性颗粒借助微管作用被集中到靶细胞一侧, 并被释放到靶细胞与CTLs结合部位的间隙中, 穿孔素在Ca2+的作用下, 嵌入靶细胞膜的双层磷脂中, 形成管状的多聚穿孔素, 使细胞外的水分进入细胞内, 一些电解质和大分子物质流出胞外, 靶细胞终因渗透压改变而溶解死亡. 在慢性乙肝患者肝组织活检标本中均可以检测到穿孔素mRNA, 而在脂肪肝、Gilbert综合征和Dubin-Johnson综合征等患者的肝组织中则不能检测到[4]. 并且, 肝组织穿孔素mRNA表达的强度与乙型肝炎组织活动性指数及血清ALT水平呈正相关关系[4-5], 提示T细胞合成的穿孔素与慢性乙肝的发病机制密切相关. 我们在蛋白质水平上探讨肝组织穿孔素表达对慢性乙肝的临床影响, 发现在检测的所有患者中, 有37例肝组织穿孔素表达阳性, 阳性率为78.7%, 低于肝组织中mRNA检测的阳性率[4], 这可能主要是PCR方法的敏感性要显著高于免疫组化方法的敏感性. 本研究结果同样表明, 肝内穿孔素表达强度与血清ALT水平、肝组织炎症活动度具有显著的一致性关系. 但资料表明, 肝组织纤维化的程度与穿孔素的表达无关, 说明肝组织穿孔素的表达主要反映的是肝细胞炎症活动的当时状况, 而对炎症所致的结果并无直接的关联. 由于穿孔素可直接引起受染肝细胞的损害, 导致细胞溶解. 因此, 从理论上说, 穿孔素无疑是有利于乙肝病毒清除的. 本研究通过检测外周血乙肝病毒载量和HBeAg水平, 显示肝组织穿孔素的合成与病毒载量及其蛋白抗原的产生呈负向关系, 证实穿孔素对清除乙肝病毒确实是有利的.
进一步分析显示, 在接受干扰素治疗前, 肝组织穿孔素表达较强者, 治疗结束时的疗效要显著优于穿孔素表达低下和无表达者. 这表明慢性乙肝患者肝内穿孔素表达的水平反映了患者的免疫水平, 治疗前存在较强免疫应答者, 获得抑制或清除病毒的机会将会增大. 因此, 肝组织穿孔素表达的强度可以预测干扰素抗病毒的疗效. 在慢性丙肝的治疗中曾发现, 干扰素治疗前外周血单个核细胞中穿孔素基因表达较高者, 治疗后更易获得持续的生化应答[6]. 我们在慢性乙肝的肝组织中检测穿孔素的表达, 以及我们同期在检测患者外周血单个核细胞中穿孔素的表达时, 也发现与干扰素的治疗存在类似的关系. 研究结果表明, 在CTLs介导的特异性细胞免疫应答中, 作为反应终端的效应分子, 穿孔素在慢性乙肝的发病、病毒的清除以及干扰素的抗病毒疗效方面都发挥了一定的作用.
在慢性乙肝患者中, 细胞毒T淋巴细胞(CTLs)在清除乙肝病毒感染的同时也引起了肝细胞的损伤, 其细胞毒效应是依赖穿孔素和凋亡两条途径实现的, 通常以前者为主. 当特异性CTLs被激活后就会释放穿孔素, 使之成为肝细胞损害的终末效应分子, 因此, 近年来在病毒性肝炎的研究中受到了足够的重视.
本研究对慢性乙肝患者肝组织穿孔素的表达与血清酶学指标、肝组织炎症、纤维化、血清病毒蛋白、病毒载量和干扰素抗病毒治疗的关系进行了比较全面的研究, 进一步加深了对穿孔素与慢性乙肝发病关系的认识.
肝组织穿孔素的表达与病毒清除和肝脏炎症程度密切相关, 可能会促进干扰素的抗病毒应答, 因此, 根据治疗前肝脏穿孔素表达的强度可以预测干扰素的疗效.
穿孔素是由激活的CTLs和自然杀伤细胞产生的一种融细胞蛋白, 释放后插入靶细胞膜上形成跨膜通道, 引起细胞渗透压的改变, 导致靶细胞的溶解和死亡. 同时, 形成的跨膜通道可以引起颗粒酶B进入靶细胞, 导致靶细胞的凋亡.
本文通过对47例慢性乙肝患者进行肝穿, 探讨了肝组织穿孔素的表达对肝脏炎症、纤维化、乙肝病毒及抗病毒治疗的影响. 结果发现慢性乙肝患者肝组织穿孔素的表达介导了肝细胞的损害, 有利于乙肝病毒的清除, 可能会促进干扰素的抗病毒效果, 并具有预测干扰素抗病毒疗效的价值. 研究方法得当, 结果可靠, 有临床实用价值.
电编:张敏 编辑:潘伯荣
| 1. | Trapani JA, Davis J, Sutton VR, Smyth MJ. Proapoptotic functions of cytotoxic lymphocyte granule constituents in vitro and in vivo. Curr Opin Immunol. 2000;12:323-329. [PubMed] [DOI] |
| 2. | Hodgson PD, Grant MD, Michalak TI. Perforin and Fas/Fas ligand-mediated cytotoxicity in acute and chronic woodchuck viral hepatitis. Clin Exp Immunol. 1999;118:63-70. [PubMed] [DOI] |
| 3. | Tordjmann T, Soulie A, Guettier C, Schmidt M, Berthou C, Beaugrand M, Sasportes M. Perforin and granzyme B lytic protein expression during chronic viral and autoimmune hepatitis. Liver. 1998;18:391-397. [PubMed] [DOI] |
| 4. | Tagashira M, Yamamoto K, Fujio K, Nagano T, Okamoto R, Ibuki N, Yabushita K, Matsumura S, Okano N, Tsuji T. Expression of perforin and Fas ligand mRNA in the liver of viral hepatitis. J Clin Immunol. 2000;20:347-353. [PubMed] [DOI] |
| 5. | Lee JY, Chae DW, Kim SM, Nam ES, Jang MK, Lee JH, Kim HY, Yoo JY. Expression of FasL and perforin/granzyme B mRNA in chronic hepatitis B virus infection. J Viral Hepat. 2004;11:130-135. [PubMed] [DOI] |
| 6. | Balian A, Naveau S, Zou W, Durand-Gasselin I, Bouchet L, Foussat A, Galanaud P, Chaput JC, Emilie D. Pretreatment expression of the perforin gene by circulating CD8(+) T lymphocytes predicts biochemical response to interferon-alpha in patients with chronic hepatitis C. Eur Cytokine Netw. 2000;11:177-184. [PubMed] [DOI] |