修回日期: 2005-03-11
接受日期: 2005-03-22
在线出版日期: 2005-05-01
目的: 观察兔食管损伤后下括约肌(lower esophageal sphincter, LES)血管活性肠肽(VIP)的改变, 探讨血管活性肠肽(VIP)在兔实验性反流性食管炎发病中的作用.
方法: 采用 0.1 mol/L HCL( 1 mL/min, 30 min/d ) 连续行兔食管灌注4 d建立实验性反流性食管炎模型. 利用光镜、透射电镜下观察酸灌注48和96 h后LES的病理表现, 测定食管下扩约肌(LES)的压力, 并测定食管组织的VIP表达.
结果: 实验组酸灌注48和96 h后食管下端黏膜呈现明显食管炎性改变; LES压力在0.1 mol/L HCl 灌注96 h后明显下降[(1.4±0.16 vs 0.7±0.12) kPa, P<0.01]; 而在连续灌注48 h后无显著改变[(1.6±0.11 vs 1.4±0.13)kPa, P>0.05]. 对照组(生理盐水灌注96 h后)LES压力在灌注前后未见显著改变[(1.3±0.14 vs 1.4±0.12)kPa, P>0.05]; 食管组织VIP表达在动物模型(酸灌注48和96 h后)有明显的增加.
结论: 酸灌注后LES压力明显下降, 食管组织VIP表达明显增加. VIP在酸损伤食管炎的发生中可能起着重要作用.
引文著录: 韩勇, 徐晖, 李小飞, 王云杰. 兔酸灌注性食管炎发病机制中血管活性肠肽的作用. 世界华人消化杂志 2005; 13(9): 1065-1068
Revised: March 11, 2005
Accepted: March 22, 2005
Published online: May 1, 2005
AIM: To evaluate the role of vasoactive intestine peptide(VIP) in the development of experimental acid reflux esophagitis (ARE) in rabbits.
METHODS: The ARE model was established by 30 min perfusion of 0.1 mol/L HCl (1 mL/min) 5 cm above the lower esophageal sphincter (LES) for 4 consecutive days (96 h). Mucosal pathological changes of LES were examined under microscope. LES pressure was measured, and VIP expression were determined in the esophageal tissues 48 h and 96 h after the perfusion.
RESULTS: Significant inflammatory changes were observed in the esophageal mucosa after the acid perfusion (48 and 96 h). LES pressure was(1.4±0.16 kPa vs 0.7±0.12 kPa, P<0.01) at 96 h after perfusion. No significant change was detected at 48 h after perfusion(1.6±0.11 kPa vs 1.4±0.13 kPa, P>0.05). It was(1.3±0.14 vs 1.4±0.12) in the control rabbits(96 h after pNS perfusion). Expression of VIP in animal models after perfusion(48 and 96 h) was increased significantly compared with controls.
CONCLUSION: LES pressure was reduced, and expression of VIP was increased significantly in the esophageal tissue following acid perfusion. It is suggested that VIP might play an important role in the development of ARE in rabbits.
- Citation: Han Y, Xu H, Li XF, Wang YJ. Role of vasoactive intestine peptide in development of experimental acid esophagitis in rabbits. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1065-1068
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1065.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1065
胃食管反流病是食管黏膜受损的一种慢性疾病, 其发病率很高[1-4]. 长期慢性病变可以导致慢性食管炎、吸入性肺炎、食管狭窄, 甚至癌变, 严重威胁人类健康[5-9].食管功能障碍性疾病是多因素疾病, 其病因一直未得到证实, 其中食管收缩、舒张功能障碍成为其发病的主要因素. 血管活性肠肽作为非肾上腺能非胆碱能(NANC)的神经递质[10-12], 广泛存在于消化道中并发挥重要作用. 对胃肠道的运动有一定的抑制作用, 可以导致食管下扩约肌(LES)松弛, 影响LES功能. 关于VIP在反流性食管炎中作用究竟如何, 并不十分清楚. 我们在兔酸灌注食管炎模型上, 探讨了VIP在其发病机制中的作用.
健康新西兰白兔45只, 体重2-3 kg, 雌雄不拘. 随机等分为3组, 分别为实验组(酸灌注48及96 h组)和对照组(生理盐水灌注96 h组), 每组15只. 实验组手术前禁食12 h. VIP试剂盒购自Sigma公司.
Hanks液(g/L): NaCl 8.00, KCl 0.40, MgSO4-7H2O 0.20, Na2HPO4-12H2O 0.12, KH2PO4 0.06. D-glucose 1.00, CaCl2 0.14, NaHCO3 0.35. D-Hanks 液: 按Hanks液配方, 不加CaCl2和MgSO4. Hanks液和D-Hanks液均采用国产分析纯试剂和超纯水配制.
1.2.1 建立兔食管炎模型[13]: 用速眠新 0.2 mL/kg肌肉注射麻醉. 插入胃管至贲门LES上约3-5 cm处(LES位置的确定采用食管灌注测压的方法, 根据LES处的特定波形来定位), 灌注0.1 mol/L HCl(1 mL/min共30 min), 以此方法连续灌注96 h, 同时于酸灌注前后测定LES的压力.48及96 h后分别于家兔耳静脉注入空气约20 mL, 致家兔死亡后使兔仰卧固定于手术台上, 正中切口剖腹取出食管及贲门, 在胃贲门与食管相连处有一呈壶腹状膨大且黏膜增厚, 肌纤维呈环形排列的节段, 该节段即LES. 剥去浆膜, 环形切取带有黏膜的LES及从胃食管连接处向上5 cm的食管体部各长约0.8 cm平滑肌组织固定后制备光镜及电镜标本.30 g/L戊二醛固定组织. 经逐次脱水、石蜡包埋组织制备光镜标本. 用锋利刀片将组织切成3-4 mm小块, 用10 g/L锇酸后固定2 h, 乙醇逐级脱水, Epon812做倒扣包埋. 聚合后在90℃左右的温度下取下包埋块, 定位及超薄切片, 铀-铅双重染色后在H-800电镜下观察.
1.2.2 LES的压力测定: 用麻醉剂速眠新(846)0.2 mL/kg, im.麻醉兔, 使兔仰卧固定于手术台上. 通过兔口腔插入胃管. 使用三腔管腔内牵拉导管的方法测定兔食管全长的压力, 压力最高处为LES位置所在, 测定LES上方5 cm处的食管腔内压力.
1.2.3 食管组织VIP表达: 采用免疫组化EnVision法染色, 组织切片脱蜡至水; 加过氧化物酶阻断液5 min; 0.01 mol/L柠檬酸盐缓冲液微波抗原修复8 min; 加一抗置37℃恒温箱2 h; 加二抗30 min; 加新鲜配制的DAB液镜控显色8 min; HE复染. 以对照组组织作为阳性对照, 以PBS代替一抗作为阴性对照. 按照半定量积分方法, 每例均随机观察5个高倍视野(×400), 进行半定量积分判断VIP阳性结果: 阳性细胞≤5%为 0分, 6%-25%为 1分, 26%-50%为2分, 51%-75%为3分, >75为 4分; 阳性强度黄色为1分, 棕黄为2分, 棕褐色为3分. 将细胞阳性率与染色强度二者积分相乘: 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为中度阳性(++), 9-12分为强阳性(+++).
统计学处理 数据用mean±SD表示, 灌注前后LES压力测定数据采用配对t检验进行分析, P<0.05有统计学意义.
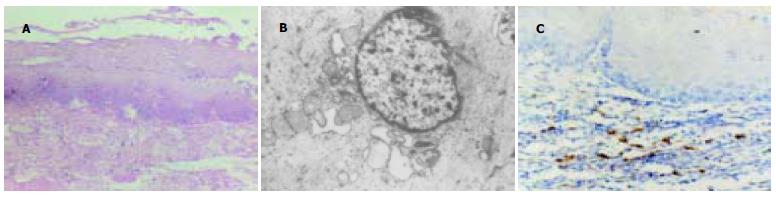
HE染色在正常家兔LES横切片上观察到LES的环肌、纵肌完全由平滑肌细胞构成. LES与食管相接处环肌层渐薄, 可见掺杂少许横纹肌纤维. 实验组家兔LES黏膜明显发红, 部分黏膜可见上皮脱落、表面溃疡. 光镜下可见实验组家兔食管黏膜基底细胞层明显增生, 黏膜下层内血管扩张, 充血, 部分鳞状上皮固缩脱落. 对照组未见明显异常. 电子显微镜下可见连续灌注96 h后实验组平滑肌细胞内线粒体肿大, 嵴溶解, 周围肌浆网明显扩张, 肌丝部分溶解减少. 对照组未见明显变化(图1 A-B).
LES压力在0.1 mol/L HCl灌注96 h后明显下降(1.4±0.16 vs 0.7±0.12)kPa, t = 13.55, P<0.01; 而在连续灌注48 h后无显著改变(1.6±0.11 vs 1.4±0.13)kPa, t = 4.54, P>0.05. 对照组(生理盐水灌注96 h后)LES压力在灌注前后未见显著改变(1.3±0.14 vs 1.4±0.12)kPa, t = 2.10, P>0.05.
以食管功能异常为主要表现的食管疾病, 是严重危害患者身心健康的常见病和多发病. 与此相对应的食管功能研究一直侧重于宏观器官和单纯动力学的研究, 明显限制了对食管疾病的发病机理的认识, 疾病的预防和治疗[14-17]. 目前对于食管炎的研究多为人体实验, 且局限于测量食管压力及pH值等方面. 对于动物实验研究, 目前大多是通过模拟酸及胃蛋白酶、胆汁、胰十二指肠液等反流物质的作用, 及通过手术对LES的破坏, 来建立反流性食管炎的模型[18-21]. 这些模型均存在一定的局限. 我们采用酸连续灌注4 d的方法建立了兔食管炎模型, 通过病理学的改变证实产生典型食管炎病理变化, 同时出现LES的功能变化, 是一种较好的急性食管炎模型.
乙酰胆碱(ACh)能神经是食管收缩的重要神经递质, 但是ACh的异常改变不能充分解释食管平滑肌功能障碍的机理. VIP为肠神经系统中非肾上腺素能、非胆碱能神经(NANC)的主要抑制性神经递质. 作为一种肽能神经递质主要以神经分泌方式在局部起作用, 在食管神经肌肉的调控中可能发挥重要作用[22-24]. 我们发现小鼠胚胎食管平滑肌内神经元含有VIP, 这些神经元的终端与运动终板相联系; 在豚鼠食管也发现有VIP免疫活性神经元; 这些神经元呈簇状存在于神经节, 沿VIP能神经网络散在分布于肌间神经丛内[25]. 推测食管平滑肌就是在胆碱能神经纤维和VIP等肽能神经纤维的协调支配下完成正常的舒缩功能. 我们对食管平滑肌血管活性肠肽(VIP)与反流性食管炎中的关系进行了探讨, 在本实验中, 酸灌注后食管组织均有明显上皮充血, 同时酸灌注48 h、96 h后食管组织VIP表达明显增加, 提示酸反流后刺激食管组织可能产生VIP, 导致组织中VIP表达明显升高, 酸损伤后VIP的明显升高可能对食管功能改变起到重要的作用.
本研究结果显示, 酸损伤后LES的压力明显下降, 证实酸侵害可以造成食管功能改变. 我们的前期工作证实[26-27] 酸灌注后LES的功能障碍可能与酸损伤造成了LES平滑肌细胞内钙离子的贮存与释放功能损伤及信号转导途径的改变有关. 然而内源性VIP作为一种抑制性调节递质, 在食管神经肌肉的调控中同样可能发挥重要作用. VIP可使袋鼠和犬食管下段括约肌及袋鼠食管体部平滑肌松弛, 这种平滑肌松弛不为一氧化氮合成酶抑制剂所阻滞. 贲门失弛缓症患者食管中呈抑制性作用的VIP神经元大量缺失, 而呈现兴奋性作用的胆碱能神经元相对增多, 可能是该病发生发展的机制之一[28-30]. 在本实验中我们发现, 酸损伤后LES组织中VIP含量明显增加的同时, 食管LES压力降低, 提示酸损伤后食管组织中VIP可能参与调节LES的功能, 进而导致LES压力下降, 最终导致反流的形成. 总之, 本研究结果显示酸损伤后食管组织VIP含量的增加, VIP在酸损伤食管炎的发生中可能起着重要作用.
编辑: 张海宁 电编: 潘伯荣
| 1. | Zhang J, Chen XL, Wang KM, Guo XD, Zuo AL, Gong J. Barrett's esophagus and its correlation with gastroesophageal reflux in Chinese. World J Gastroenterol. 2004;10:1065-1068. [PubMed] |
| 2. | Liu JF, Zhang J, Tian ZQ, Wang QZ, Li BQ, Wang FS, Cao FM, Zhang YF, Li Y, Fan Z. Long-term outcome of esophageal myotomy for achalasia. World J Gastroenterol. 2004;10:287-291. [PubMed] |
| 3. | Shah A, Uribe J, Katz PO. Gastroesophageal reflux disease and obesity. Gastroenterol Clin North Am. 2005;34:35-43. [PubMed] |
| 4. | Mudawi HM, Fedail SS. Familial achalasia in Sudan. Trop Gastroenterol. 2004;25:27. [PubMed] |
| 5. | Guo RB, Peng LH, Cheng LF, Wang WF. Alteration of esophageal motility in elderly patients with gastroesophageal reflux disease. Shijie Huaren Xiaohua Zazhi. 2004;12:125-128. |
| 6. | Cameron AJ. The history of Barrett esophagus. Mayo Clin Proc. 2001;76:94-96. [PubMed] |
| 7. | Cameron AJ, Arora AS. Barrett's esophagus and reflux esophagitis: is there a missing link? Am J Gastroenterol. 2002;97:273-278. [PubMed] |
| 8. | Leggett JJ, Johnston BT, Mills M, Gamble J, Heaney LG. Prevalence of gastroesophageal reflux in difficult asthma: relationship to asthma outcome. Chest. 2005;127:1227-1231. [PubMed] |
| 9. | Calleja JL, Suarez M, De Tejada AH, Navarro A; Pantogerd Group. Helicobacter pylori infection in patients with erosive esophagitis is associated with rapid heartburn relief and lack of relapse after treatment with pantoprazole. Dig Dis Sci. 2005;50:432-439. [PubMed] |
| 10. | Pfannkuche H, Schellhorn C, Schemann M, Gabel G. Reticular groove and reticulum are innervated by myenteric neurons with different neurochemical codes. Anat Rec A Discov Mol Cell Evol Biol. 2003;274:917-922. [PubMed] |
| 11. | Storr M, Geisler F, Neuhuber WL, Schusdziarra V, Allescher HD. Characterization of vagal input to the rat esophageal muscle. Auton Neurosci. 2001;91:1-9. [PubMed] |
| 12. | Ku SK, Lee HS, Lee JH, Park KD. An immunohistochemical study on the endocrine cells in the alimentary tract of the red-eared slider (Trachemys scripta elegans). Anat Histol Embryol. 2001;30:33-39. [PubMed] |
| 14. | Prakash C, Clouse RE. Value of extended recording time with wireless pH monitoring in evaluating gastroesophageal reflux disease. Clin Gastroenterol Hepatol. 2005;3:329-334. [PubMed] |
| 15. | Monteiro VR, Sdepanian VL, Weckx L, Fagundes-Neto U, Morais MB. Twenty-four-hour esophageal pH monitoring in children and adolescents with chronic and/or recurrent rhinosinusitis. Braz J Med Biol Res. 2005;38:215-220. [PubMed] |
| 16. | Shim CS, Jung IS, Cheon YK, Ryu CB, Hong SJ, Kim JO, Cho JY, Lee JS, Lee MS, Kim BS. Management of malignant stricture of the esophagogastric junction with a newly designed self-expanding metal stent with an antireflux mechanism. Endoscopy. 2005;37:335-339. [PubMed] |
| 17. | Heikkinen T, Koivukangas V, Wiik H, Saarnio J, Rautio T, Haukipuro K. The quality of life of gastroesophageal reflux disease patients waiting for an antireflux operation. Surg Endosc. 2004;18:1712-1715. [PubMed] |
| 18. | Tugtepe H, Iskit HS, Bozkurt S, Kiyan G, Yegen BC, Dagli TE. Effects of Stamm gastrostomy on gastric emptying rate in rats. Eur Surg Res. 2004;36:362-366. [PubMed] |
| 19. | Szentpali K, Eros G, Kaszaki J, Tiszlavicz L, Lazar G, Wolfard A, Balogh A, Boros M. Microcirculatory changes in the canine esophageal mucosa during experimental reflux oesophagitis: comparison of the effects of acid and bile. Scand J Gastroenterol. 2003;38:1016-1022. [PubMed] |
| 20. | Pera M, Pera M. Experimental Barrett's esophagus and the origin of intestinal metaplasia. Chest Surg Clin N Am. 2002;12:25-37. [PubMed] |
| 21. | Nishijima K, Miwa K, Miyashita T, Kinami S, Ninomiya I, Fushida S, Fujimura T, Hattori T. Impact of the biliary diversion procedure on carcinogenesis in Barrett's esophagus surgically induced by duodenoesophageal reflux in rats. Ann Surg. 2004;240:57-67. [PubMed] |
| 22. | Rumessen JJ, de Kerchove d'Exaerde A, Mignon S, Bernex F, Timmermans JP, Schiffmann SN, Panthier JJ, Vanderwinden JM. Interstitial cells of Cajal in the striated musculature of the mouse esophagus. Cell Tissue Res. 2001;306:1-14. [PubMed] |
| 23. | Jun CH, Lee TS, Sohn UD. NO/cyclic GMP pathway mediates the relaxation of feline lower oesophageal sphincter. Auton Autacoid Pharmacol. 2003;23:159-166. [PubMed] |
| 24. | Wu M, Majewski M, Wojtkiewicz J, Vanderwinden JM, Adriaensen D, Timmermans JP. Anatomical and neurochemical features of the extrinsic and intrinsic innervation of the striated muscle in the porcine esophagus: evidence for regional and species differences. Cell Tissue Res. 2003;311:289-297. [PubMed] |
| 25. | Smid SD, Blackshaw LA. Vagal ganglionic and nonadrenergic noncholinergic neurotransmission to the ferret lower oesophageal sphincter. Auton Neurosci. 2000;86:30-36. [PubMed] |
| 26. | 韩 勇, 王 云杰, 刘 锟. 酸灌注对食管下端扩约肌平滑肌细胞收缩功能的影响. 中国胸心血管外科临床杂志. 2000;7:252-255. |
| 28. | Qi BQ, Uemura S, Farmer P, Myers NA, Hutson JM. Intrinsic innervation of the oesophagus in fetal rats with oesophageal atresia. Pediatr Surg Int. 1999;15:2-7. [PubMed] |
| 29. | Cheng W, Poon KH, Lui VC, Yong JL, Law S, So KT, Tse K, Tam PK. Esophageal atresia and achalasialike esophageal dysmotility. J Pediatr Surg. 2004;39:1581-1583. [PubMed] |
| 30. | Cheng W, Bishop AE, Spitz L, Polak JM. Abnormal enteric nerve morphology in atretic esophagus of fetal rats with adriamycin-induced esophageal atresia. Pediatr Surg Int. 1999;15:8-10. [PubMed] |