修回日期: 2022-03-21
接受日期: 2022-04-19
在线出版日期: 2022-05-08
肝细胞癌(hepatocellular carcinoma, HCC)是较为常见的消化系统恶性肿瘤, 其确切发病机制不清. 大多数研究认为多基因的时空表达失调与HCC的发生密切相关.
探讨HCC差异表达基因及其作为分子标志物诊断HCC价值, 同时分析差异表达关键基因与HCC患者预后关系.
基因表达综合数据库(gene expression omnibus, GEO)中选取HCC与非HCC肝组织中差异表达基因谱数据, 并对差异表达基因进行筛选. 对筛选出的差异基因进行聚类, 并进行基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)和蛋白相互作用网络(protein-protein interaction, PPI)分析; 同时对差异表达基因进行关键基因(hub)鉴定. 根据鉴定的hub基因表达情况分为高低表达组, 比较高低表达组HCC患者总生存率(overall survival, OS)和无疾病进展生存(progression free survival, PFS)有无差异. 采用hub基因为诊断依据评估hub诊断HCC的价值.
GSE62232、GSE67764、GSE89377和GSE112790数据中HCC和正常肝组织中差异表达基因分别为370、1386、76和418个, 四个数据集中共差异表达的基因为37个. 37个差异表达基因主要富集于凋亡细胞的识别、过渡金属离子结合, KEGG信号通路富集于化学致癌作用等. 37个差异基因表达水平绘制聚类热图, 肿瘤组织与正常组织间聚类明显; 37基因PPI拓扑网络中有42个蛋白节点, 145个作用关系, 平均作用度为6.9, 区域聚类指数为0.586, 富集显著(P<0.05), CYP2E1, CYP3A4和CYP1A2为37个差异基因中的前三个hub基因; 以CYP2E1, CYP3A4和CYP1A2为参考诊断HCC的受试者工作特征曲线(receiver operating characteristic curve, ROC)下面积分别为0.83(95%CI: 0.74-0.93), 0.93(95%CI: 0.88-0.97)和0.96(95%CI: 0.924-0.98); CYP2E1高表达组OS(HR = 0.57, 95%CI: 0.39-0.84), PFS(HR = 0.63, 95%CI: 0.46-0.88)和CYP3A4高表达组OS(0.57, 95%CI: 0.40-0.81), PFS(0.61, 95%CI: 0.45-0.83)均显著高于低表达组, 且有统计学差异(P<0.05), 而CYP1A2高低表达组HCC患者OS和PFS无统计学差异(P>0.05).
CYP2E1, CYP3A4和CYP1A2可能与HCC的发生有关, 并可作为HCC诊断和预后的分子标志物.
核心提要: 细胞色素P450家族成员CYP2E1, CYP3A4和CYP1A2在肝细胞癌(hepatocellular carcinoma, HCC)患者癌组织中呈现明显的差异表达并与HCC发生有关, 有望成为HCC诊断和预后的分子标志物.
引文著录: 唐辉, 汪笑秋. 细胞色素P450家族成员CYP2E1, CYP3A4和CYP1A2表达与HCC发生有关并可作为HCC诊断和预后的分子标志物. 世界华人消化杂志 2022; 30(9): 402-410
Revised: March 21, 2022
Accepted: April 19, 2022
Published online: May 8, 2022
Hepatocellular carcinoma (HCC) is a common malignant tumor of the digestive system, and its exact pathogenesis is unclear. Most studies believe that dysregulation of the spatiotemporal expression of multiple genes is closely related to the occurrence of HCC.
To identify the differentially expressed genes in HCC, analyze their value as molecular markers for the diagnosis of HCC, and explore the relationship between differentially expressed key genes and prognosis of HCC patients.
The differentially expressed gene profiles in HCC patients and non-HCC liver tissues were selected from GEO database, and the differentially expressed genes were screened. The selected differential genes were clustered, and Kyoto encyclopedia of genes and genomes (KEGG) and protein-protein interaction (PPI) analyses were performed. At the same time, hub genes were identified from the differentially expressed genes. According to the identified HUB gene expression, the HCC patients were divided into high and low expression groups, and the overall survival (OS) and progression-free survival (PFS) were compared between the two groups. Hub genes were then evaluated for their value in HCC diagnosis.
In GSE62232, GSE67764, GSE89377, and GSE112790 data sets, differentially expressed genes in HCC and normal liver tissues were 370, 1386, 76, and 418, respectively, and a total of 37 common differentially expressed genes were found in the four data sets. These 37 differentially expressed genes are mainly enriched in recognition of apoptotic cells, transition metal ion binding, and chemical carcinogenesis. The clustering heat map of seven differentially expressed genes showed obvious clustering between tumor tissues and normal tissues. PPI topological network was plotted for the 37 differentially expressed genes, and there were 42 protein nodes and 145 action relationships in the network, with an average action degree of 6.9 and regional clustering index of 0.586, indicating significant enrichment (P < 0.05). CYP3A4 and CYP1A2 were the first three hub genes among the 37 differential genes. The areas under the ROC curves for HCC diagnosis based on CYP2E1, CYP3A4, and CYP1A2 alone were 0.83 (95% confidence interval [CI]: 0.74-0.93), 0.93 (95%CI: 0.88-0.97), and 0.96 (95%CI: 0.924-0.98), respectively. OS (hazard ratio [HR] = 0.57, 95%CI: 0.39-0.84; HR = 0.57, 95%CI: 0.40-0.81) and PFS (HR = 0.63, 95%CI: 0.46-0.88; HR = 0.61, 95%CI: 0.45-0.83) in the high CYP2E1 and CYP3A4 expression groups were significantly higher than those in their respective low expression groups (P < 0.05), while there was no statistical difference in OS or PFS in the CYP1A2 high and low expression groups (P > 0.05).
CYP2E1, CYP3A4, and CYP1A2 may be associated with the occurrence of HCC and can be applied as molecular markers for the prognosis and diagnosis of HCC.
- Citation: Tang H, Wang XQ. Cytochrome P450 family members CYP2E1, CYP3A4, and CYP1A2 are related to prognosis of HCC and can be used as molecular markers for its diagnosis. Shijie Huaren Xiaohua Zazhi 2022; 30(9): 402-410
- URL: https://www.wjgnet.com/1009-3079/full/v30/i9/402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i9.402
肝细胞癌(hepatocellular carcinoma, HCC)较为常见的消化系统恶性肿瘤. 流行病数据预计, 2021年全球范围内HCC每年新发病例为905677例, 因HCC死亡病例为830180例[1] 目前大多数研究认为HCC的发生主要与乙肝肝硬化有关, HBV感染后造成肝细胞的持续损伤、修复、再损伤循环, 从而造成肝硬化, 继而发生癌变, 但其确切发病机制不清[2,3] 大多数研究认为多基因的时空表达失调与HCC的发生密切相关[4,5], 但涉及HCC有关的时空表达失调的基因众多, 不同的差异表达基因在HCC发生发展及侵袭转移等生物学过程中可能发挥不同的作用. 现有的HCC发生及生物学行为相关基因有Tp53, Bcl-2, Bad-p, Bax[6], HULC和H19等[7]上述基因大多被相关文献报道, 而HCC差异表达基因集及其相关的生物学功能、与预后的关系和诊断价值鲜有报道.
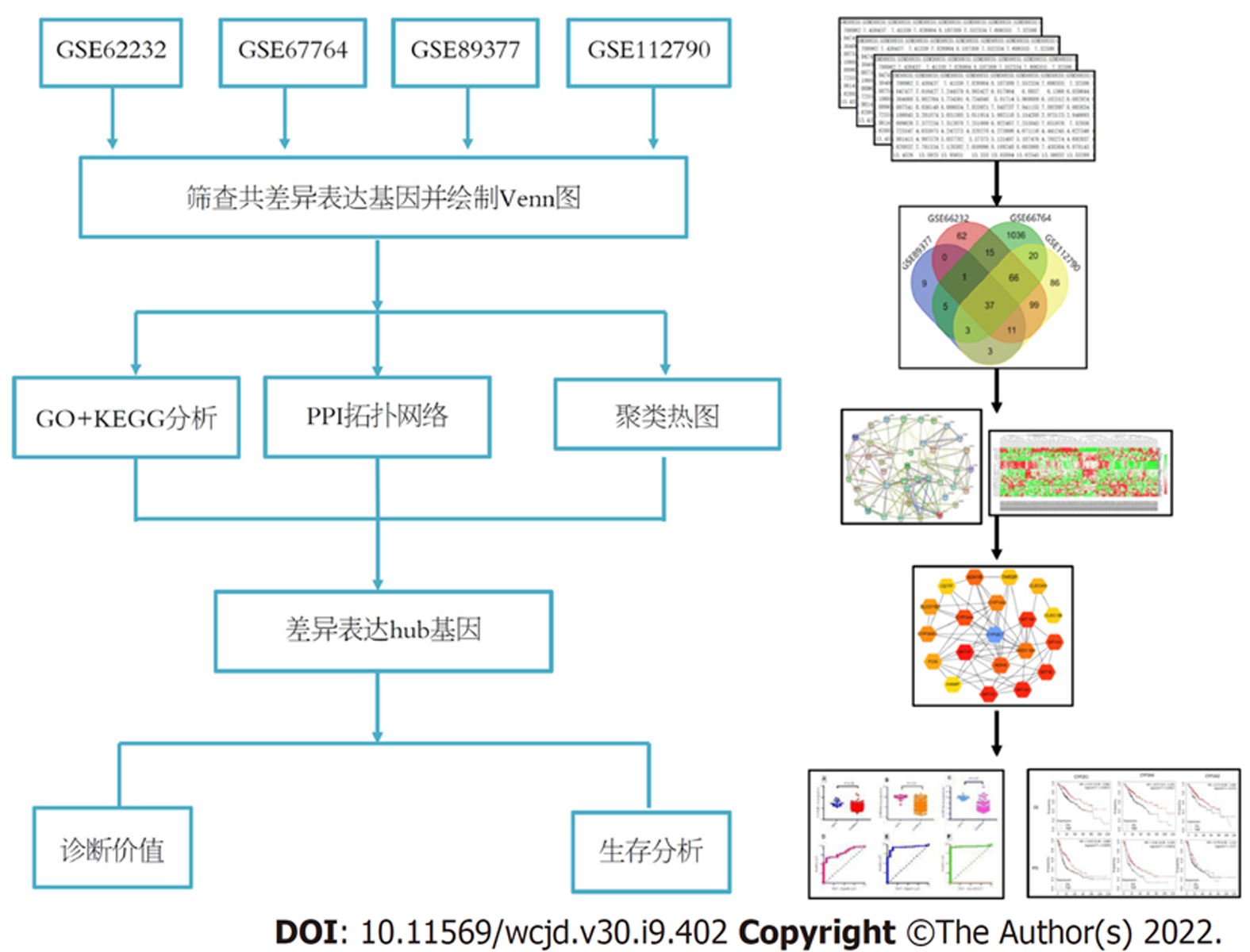
研究采用生物信息数据库分析, 首先在基因综合表达数据库[(gene expression omnibus, GEO)中筛选HCC与正常肝组织基因表达数据, 然后对数据集中的差异表达基因进行筛选, 对筛选出的差异基因进行基因本体论(gene ontology, GO), 基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)、蛋白相互作用网络(protein-protein interaction, PPI)和聚类分析. 对差异基因进行关键基因(hub基因)鉴定. Kaplan-Meier数据库对比关键基因高低表达与HCC患者预后关系. 同时, 采用受试者工作特征曲线(receiver operating characteristic curve, ROC)以hub基因为参考, 诊断HCC的价值, 图1.
研究选取(GEO, http://www.ncbi.nlm.nih.gov/geo/)、(KEGG, http://www.genome.jp/kegg/pathway.html)、蛋白互相作用拓扑网络数据库(STRING, http://string-db.org/cgi/input.pl)、肿瘤生存分析数据库(Kaplan-Meier, http://kmplot.com/analysis/index.php?p=service), 作为本次研究的主要数据来源.
GEO数据库中检索HCC基因表达数据集, 检索词为"Hepatocellular carcinoma (HCC)/liver cancer", 种属为"human". 进一步对检索到的结果进行筛选, 选取GSE62232[8]、GSE67764[9]、GSE89377[10]和GSE112790[11]四个数据集进行分析. 根据数据集中HCC与正常肝组织中基因表达谱情况进行筛选, 筛选条件为HCC组和正常组中上调或下调超过2个拷贝的基因, 且P<0.05; 分别对GSE62232、GSE67764、GSE89377和GSE112790数据集中的差异基因进行重叠分析, 选取公差异表达基因, 并绘制Venn图. 在STRING数据库中对筛选出的共差异表达基因进行蛋白相互作用拓扑网络构建, 构建条件为: 数据来源Textmining, co-expression, gene function和co-occurrence; 相互作用关系系数≥0.4; 相互作用蛋白不高于20个. 在KEGG数据库中对筛选出的差异表达基因相关信号通路进行分析富集. 物种选择"human"; 通路包含: 代谢、遗传信息、环境信息、细胞过程、人类疾病和药物开发等. 采用Cytoscapev3.7.2软件对拓扑网络中的hub基因进行筛选关键hub基因, 筛选依据为node-score. 在GSE112790数据中, 根据HCC与正常肝组织37个差异基因表达水平绘制聚类热图, 条件为: 行距离: 欧氏距离; 列距离: 欧氏距离.
统计学处理 相关统计分析采用R软件进行, 计量资料应用mean±SD表示, 肿瘤组织与正常组织比较采用t检验; 计数采用率表示, 应用χ2检验, P<0.05有统计学意义.
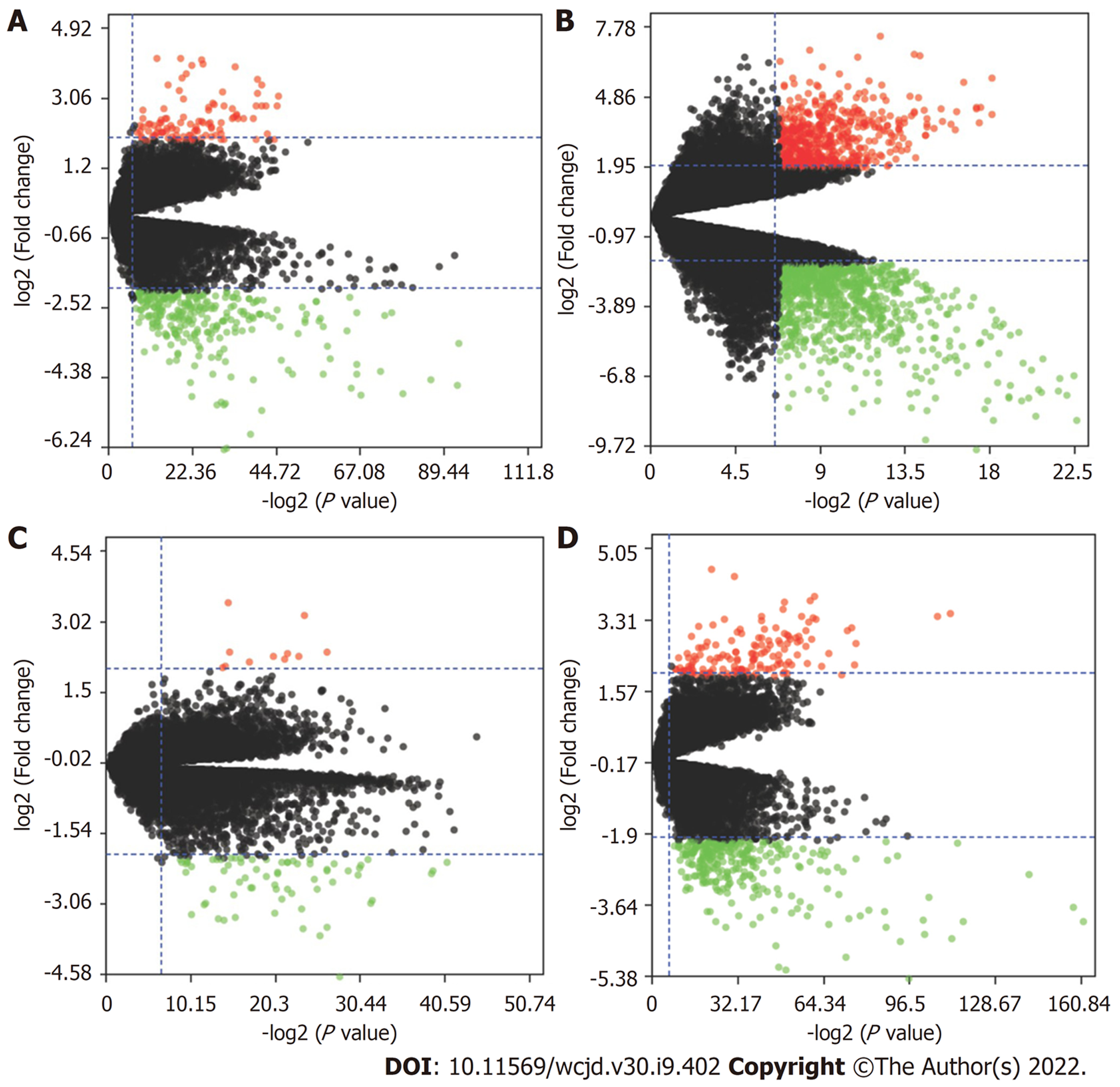
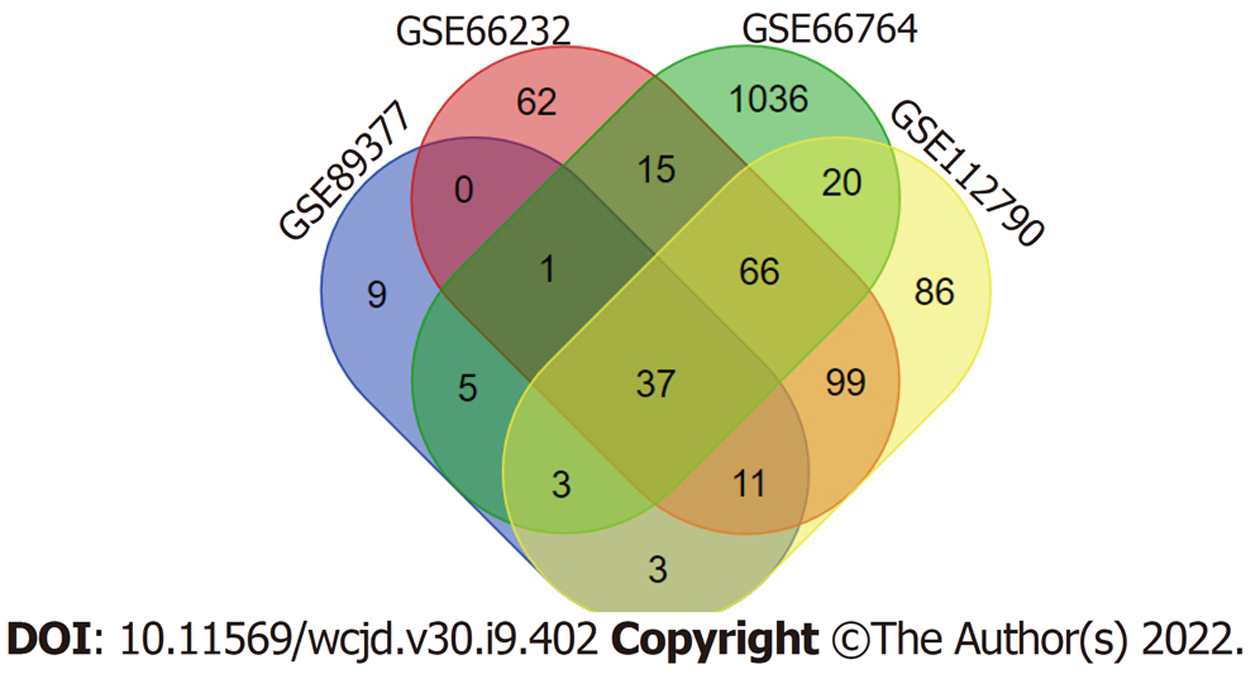
选取了GSE62232、GSE67764、GSE89377和GSE112790数据为研究对象, 四个数据集基本特征见表1. HCC和正常肝组织中差异表达基因分别为370、1386、76和418(图2), 四个数据集中共差异表达的基因为37个(图3).
筛选出的37个差异表达基因生物学过程主要富集于代谢过程、凋亡细胞的识别和细胞金属离子的反应; 细胞定位于转录因子ap-1复合体和高密度脂蛋白粒子; 生物学过程主要为过渡金属离子结合、芳香化酶活性和雌激素2-hydroxylase活性等, 见表2. KEGG信号通路富集于细胞色素P450对外来生物的代谢、化学致癌作用和药物代谢-细胞色素P450等, 见表3.
| GO | 基因数 | 背景基因 | 强度 | P value |
| 生物学过程 | ||||
| 铜离子解毒 | 6 | 14 | 2.3 | 7.37E-09 |
| 极低密度脂蛋白颗粒重塑 | 3 | 9 | 2.19 | 0.00087 |
| 脂质羟基化 | 2 | 7 | 2.12 | 0.0388 |
| 生物碱代谢过程 | 2 | 7 | 2.12 | 0.0388 |
| 凋亡细胞的识别 | 2 | 7 | 2.12 | 0.0388 |
| 细胞对铜离子的反应 | 7 | 27 | 2.08 | 3.68E-09 |
| 细胞对锌离子的反应 | 6 | 23 | 2.08 | 4.45E-08 |
| 对促红细胞生成素的反应 | 2 | 8 | 2.07 | 0.0436 |
| 细胞对镉离子的反应 | 8 | 37 | 2 | 7.77E-10 |
| 细胞成分 | ||||
| 转录因子ap-1复合物 | 3 | 4 | 2.54 | 0.00078 |
| 高密度脂蛋白颗粒 | 4 | 29 | 1.81 | 0.00087 |
| 分子功能 | ||||
| 过渡金属离子结合 | 13 | 1076 | 0.75 | 0.0013 |
| 类固醇羟化酶活性 | 4 | 36 | 1.71 | 0.0041 |
| 类固醇结合 | 5 | 104 | 1.35 | 0.0061 |
| 芳香化酶活性 | 3 | 24 | 1.77 | 0.0337 |
| 锌离子结合 | 9 | 811 | 0.71 | 0.0425 |
| 阳离子结合 | 21 | 4242 | 0.36 | 0.0425 |
| 雌激素2-羟化酶活性 | 2 | 5 | 2.27 | 0.0425 |
| KEGG富集 | 基因数 | 背景基因 | 强度 | P value |
| 细胞色素P450对外源性物质的代谢 | 6 | 69 | 1.61 | 5.45E-06 |
| 化学致癌 | 6 | 75 | 1.57 | 5.45E-06 |
| 矿物吸收 | 5 | 58 | 1.6 | 3.42E-05 |
| 药物代谢-细胞色素P450 | 5 | 64 | 1.56 | 4.06E-05 |
| 类固醇激素生物合成 | 4 | 59 | 1.5 | 0.0009 |
| 视黄醇代谢 | 4 | 64 | 1.46 | 0.001 |
| 亚油酸 | 3 | 29 | 1.68 | 0.0028 |
| 胆固醇代谢 | 3 | 48 | 1.46 | 0.0101 |
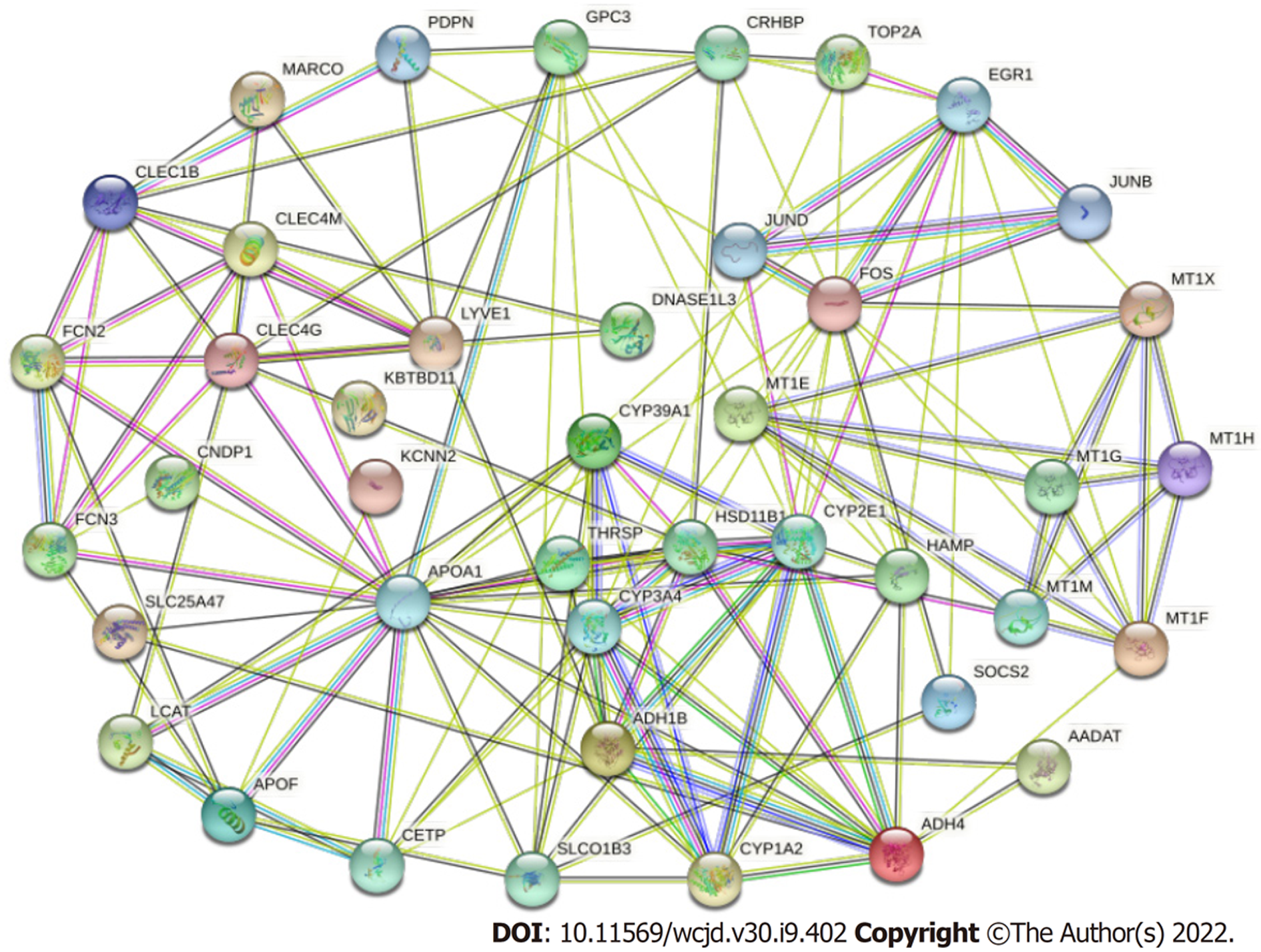
37个HCC与正常肝组织差异表达基因绘制PPI拓扑网络, 网络中有42个蛋白节点, 145个作用关系, 平均作用度为6.9, 区域聚类指数为0.586, 富集显著(P<0.05), 见图5. Cytoscapev3.7.2软件对拓扑网络中的hub基因进行筛选, CYP2E1, CYP3A4和CYP1A2为37个差异基因中的前三个hub基因, 见图6.
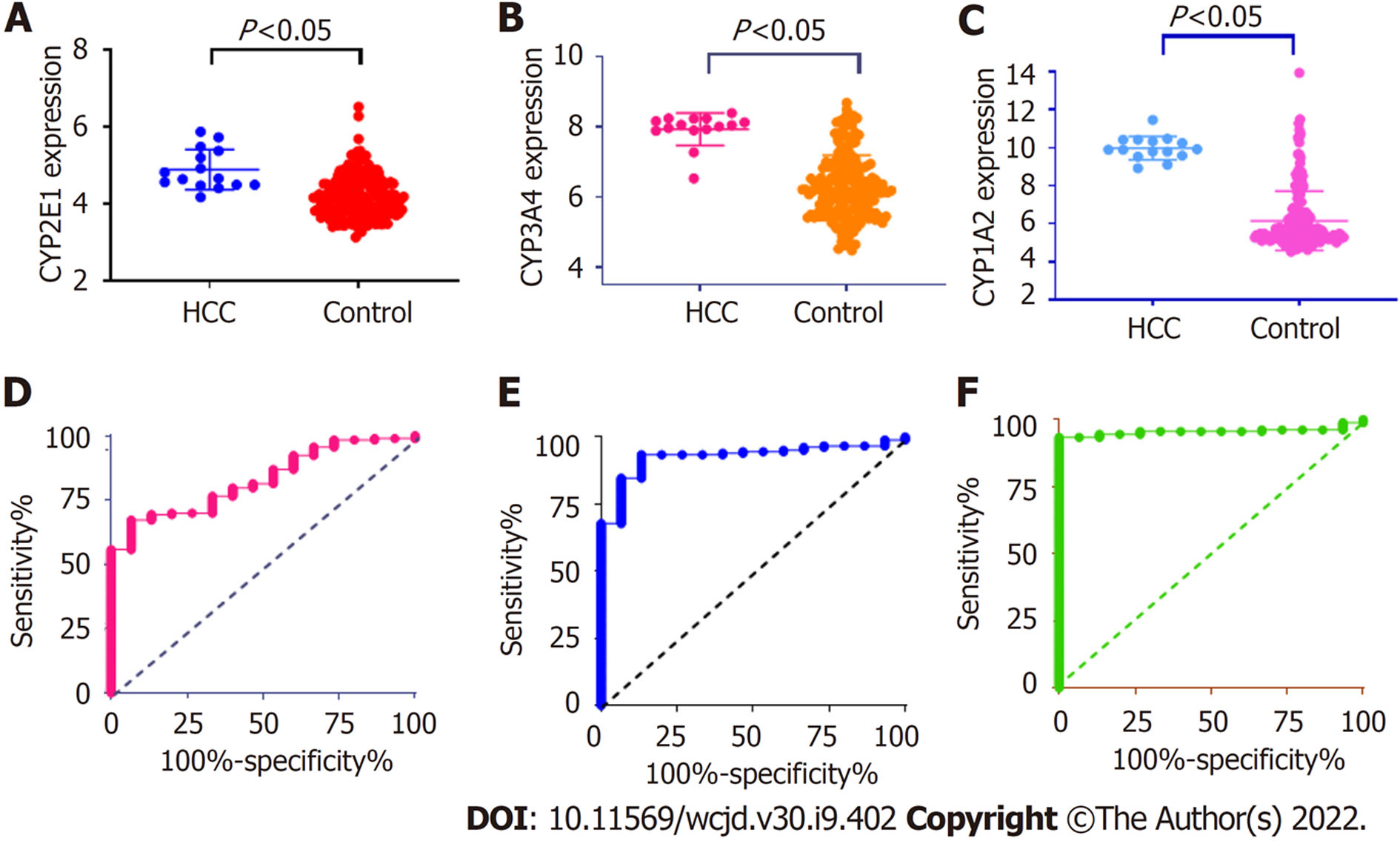
三个hub基因CYP2E1, CYP3A4和CYP1A2在HCC组织中的表达水平明显高于正常对照组织(P<0.05), 见图6. 以CYP2E1, CYP3A4和CYP1A2为参考诊断HCC的ROC曲线下面积分别为0.83(95%CI: 0.74-0.93), 0.93(95%CI: 0.88-0.97)和0.96(95%CI: 0.924-0.98), 见图7.
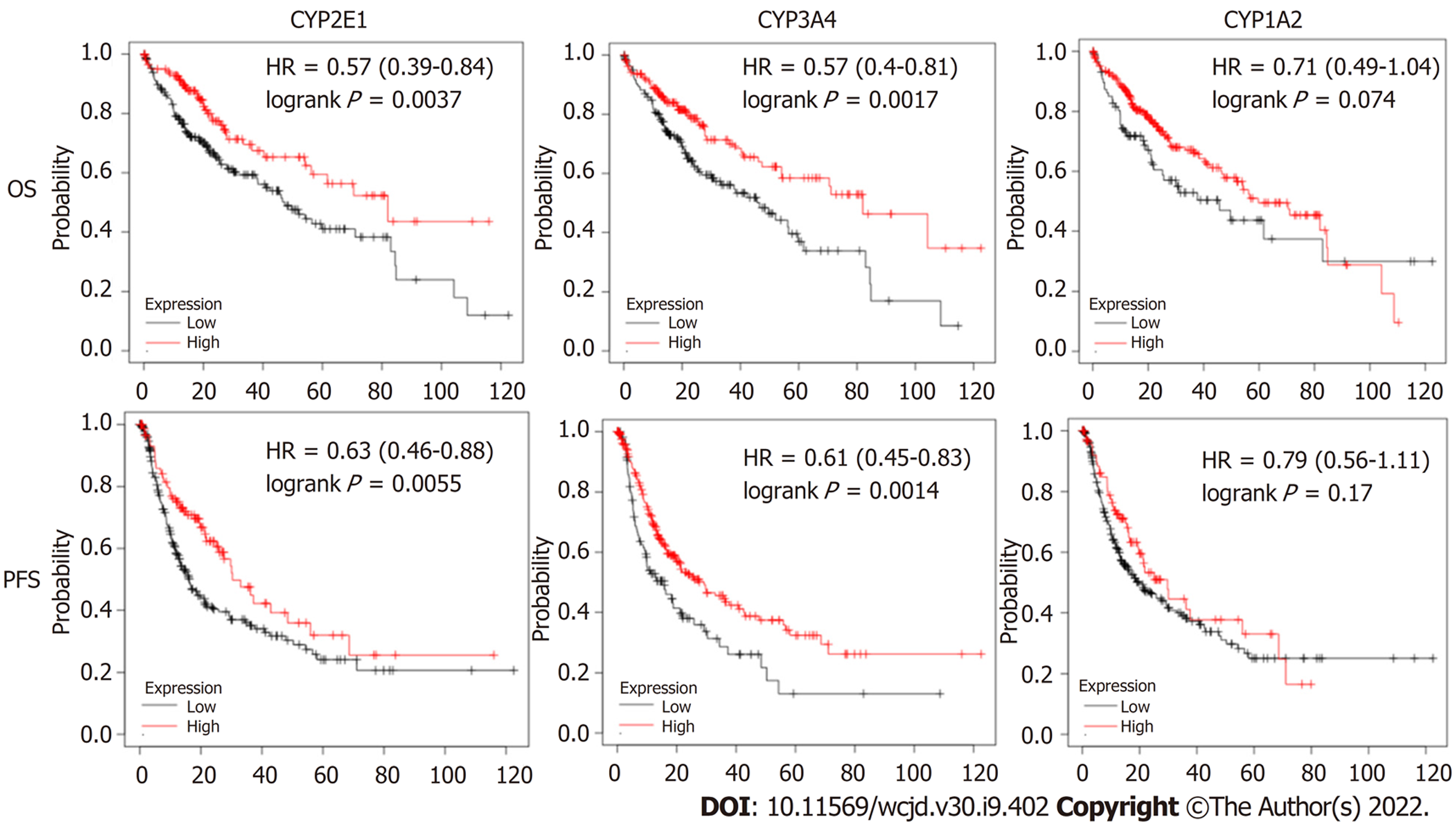
CYP2E1高表达组总生存率(overall survival, OS)(HR = 0.57, 95%CI: 0.39-0.84), 无疾病进展生存(progression free survival, PFS)(HR = 0.63, 95%CI: 0.46-0.88)和CYP3A4高表达组OS(0.57, 95%CI: 0.40-0.81), PFS(0.61, 95%CI: 0.45-0.83)均显著高于低表达组且有统计学差异(P<0.05), 而CYP1A2高低表达组HCC患者OS和PFS无统计差异(P>0.05), 见图8.
HCC是临床上较为常见的实体恶性肿瘤, 在常见的癌症中排名第六, 癌症相关死亡原因排名第四[12]乙肝病毒感染(hepatitis B virus, HBV)导致的肝硬化是HCC的最常见原因[13,14] 我国是HBV感染大国, HBV感染人数众多, 因而HCC的发生率也较高. HCC的预后极差, 5年生存率低于30%, 同时也缺乏有效的早期诊断方法[15] 甲胎蛋白(alpha-fetoprotein, AFP)是HCC早期诊断和术后监测复发的重要血清标志物, 但其可受到其他因素如妊娠、急慢性肝损伤等的影响而降低其诊断的敏感性和特异性[16] 同时, AFP明显升高后, HCC已形成和发展为非早期, 其作为早期预警或高危人群检测的指标效果并不理想.
近年来随着分子生物和高通量测序、芯片技术的发展, HCC发生、发展、侵袭转移、预后和诊断等分子标志物成为了研究热点. 对HCC患者和正常人群进行高通量差异表达基因的筛选, 并对筛选的结果进一步分析, 有望鉴定出HCC特异表达基因谱, 为HCC的诊断、预后、靶向药物研发提供新的靶点和思路. 为了筛选HCC和健康人体肝脏组织之间的差异表达基因(different expressed genes, DEGs), 我们从GEO数据库中下载了4个基因表达谱, 以获得HCC组织和正常组织样本之间的DEGs. 通过GO注释和KEGG信号通路富集, 对所选的DEGs进行潜在功能分析. 同时, 对差异表达基因进行了聚类分析, 并利用Cytoscape软件构建蛋白-蛋白相互作用拓扑网络核心基因, 寻找与HCC相关的枢纽基因. 使用在线数据库Kaplan-Meier plotter对这些关键hub基因进行生存分析, 评估其高低表达与HCC患者预后关系. 研究结果共纳入了4个数据集GSE62232、GSE67764、GSE89377和GSE112790中HCC和正常肝组织中差异表达基因分别为370、1386、76和418, 四个数据集中共差异表达的基因为37个. 37个差异表达基因主要富集于凋亡细胞的识别、过渡金属离子结合, KEGG信号通路富集于化学致癌作用等. CYP2E1, CYP3A4和CYP1A2为37个差异基因中的前三的hub基因; 分别以CYP2E1, CYP3A4和CYP1A2为参考诊断HCC的ROC曲线下面积分别为0.83, 0.93和0.96, 其诊断效能均较高; CYP2E1、CYP3A4高表达组OS和PFS均显著高于低表达组且有统计学差异(P<0.05), 而CYP1A2高低表达组HCC患者OS和PFS无统计差异.
CYP2E1, CYP3A4和CYP1A2均为细胞色素P450 (cytochrome P450)家族成员. 既往有文献报道CYP2E1表达与胃癌、膀胱癌等预后有关[2,17], 而CYP2E1表达与HCC相关性鲜有报道. 细胞色素P450酶负责药物、外源物质和内源性物质的生物转化. 这种酶活性可以由内在和外在因素调节, 从而改变机体对药物或某些毒性物质的反应. 从巨噬细胞、淋巴细胞和中性粒细胞释放的促炎性细胞因子, 如白细胞介素-1(interleukin 1, IL-1)、白细胞介素-6(interleukin 6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和干扰素-γ(interferon-γ, IFN-γ)等能够在导致细胞色素P450酶抑制或活化的. 上述细胞也存在于肿瘤微环境中, 参与癌症的发展. 在本研究中我们发现CYP2E1高表达者OS和PFS优于低表达者, 因而提示CYP2E1可能为HCC生存的优势基因, 可作为HCC术后预后较好的标记物. 同时CYP2E1也可作为HCC诊断的分子标记物, 其诊断HCC的ROC曲线下面积高达0.83. CYP3A4与肿瘤的生物学功能及预后亦有报道, 但和HCC的关系报道不多. 我们的研究也提示CYP3A4高表达与HCC预后较好有关.
然而本文存在一定的局限性, 首先研究结论主要基于生物信息数据库分析, 其结果和结论的可靠性需要进一步相关临床和基础试验进行证实. 其次, 欧美和日本HCC患者多有HCV感染背景, 而中国HCC患者多为HBV感染背景, 单纯HBV背景或HCV背景的HCC患者数据对研究中所获结果是否存在不同有待补充相关临床研究数据证实.
综上, CYP2E1, CYP3A4和CYP1A2可能与HCC发病有关, 并可作为HCC诊断和预后的分子标志物.
肝细胞癌(hepatocellular carcinoma, HCC)是较为常见的消化系统恶性肿瘤,预后差, 5年生存率低. 然而, 虽然HCC的发生与乙肝病毒感染有关, 但确切发病机制目前仍不十分清楚. 近年来已有研究提示HCC的发生与多基因的时空表达失调密切相关.
采用生物信息数据深度挖掘方法探寻HCC差异表达基因及其作为分子标志物诊断肝癌的临床价值, 同时进一步探讨差异表达关键基因与HCC患者预后关系, 评估差异表达基因作为HCC预后分子标志物的可行性.
探讨HCC差异表达基因及其与患者预后关系, 同时分析差异表达基因作为HCC诊断分子标志物的价值.
首先采用生物信息分析技术在基因综合表达数据库(gene expression omnibus, GEO)中选取HCC与非HCC肝组织中差异表达基因谱数据. 对筛选出的差异基因进行聚类, 基因注释及蛋白网络分析, 并鉴定差异表达基因进行关键基因(hub). 根据hub基因表达分为高低表达组, 比较高低表达组HCC患者总生存率(overall survival, OS)和无疾病进展生存(progression free survival, PFS)有无差异并评估hub诊断HCC的敏感性和特异性.
HCC在四个数据集中共共差异表达的基因为37个. 37个差异表达基因主要富集于凋亡细胞的识别、过渡金属离子结合, KEGG信号通路富集于化学致癌作用等. CYP2E1, CYP3A4和CYP1A2为37个差异基因中的前三个hub基因; CYP2E1, CYP3A4和CYP1A2为参考诊断HCC的AUC分别为0.83(95%CI: 0.74-0.93), 0.93(95%CI: 0.88-0.97)和0.96(95%CI: 0.924-0.98); CYP2E1高表达组OS(HR = 0.57, 95%CI: 0.39-0.84), PFS(HR = 0.63, 95%CI: 0.46-0.88)和CYP3A4高表达组OS(0.57, 95%CI: 0.40-0.81), PFS(0.61, 95%CI: 0.45-0.83)均显著高于低表达组, 且有统计学差异(P<0.05).
细胞色素P450家族成员CYP2E1, CYP3A4和CYP1A2差异表达与HCC发生有关, 有望成为HCC诊断和预后的分子标志物.
本研究通过生物信息数据挖掘技术发现细胞色素P450家族成员CYP2E1, CYP3A4和CYP1A2差异表达与HCC发生有关, 并可作为HCC诊断和预后的潜在生物学标记物.然而, 研究结果和结论主要基于相关的数据库生物信息学分析, 缺乏组织标本和细胞学验证结果. 后续应进补充临床组织标本和相关细胞学试验, 对研究结果和结论进行进一步的验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 2. | Yin X, Xiong W, Wang Y, Tang W, Xi W, Qian S, Guo Y. Association of CYP2E1 gene polymorphisms with bladder cancer risk: A systematic review and meta-analysis. Medicine (Baltimore). 2018;97:e11910. [PubMed] [DOI] |
| 3. | Liu Y, Guo LW, Xu HF, Kang RH, Zheng LY, Zhang LY, Chen Q, Sun XB, Zhang SK, Qiao YL. Risk of Liver Cirrhosis in HBV/HCV-Infected Individuals with First-Degree Relatives Who Have Liver Cancer: Development and Validation of a Simple Model. Cancer Prev Res (Phila). 2022;15:111-120. [PubMed] [DOI] |
| 4. | Li Y, Xiao F, Li W, Hu P, Xu R, Li J, Li G, Zhu C. Overexpression of Opa interacting protein 5 increases the progression of liver cancer via BMPR2/JUN/CHEK1/RAC1 dysregulation. Oncol Rep. 2019;41:2075-2088. [PubMed] [DOI] |
| 5. | Liu T, Yang H, Fan W, Tu J, Li TWH, Wang J, Shen H, Yang J, Xiong T, Steggerda J, Liu Z, Noureddin M, Maldonado SS, Annamalai A, Seki E, Mato JM, Lu SC. Mechanisms of MAFG Dysregulation in Cholestatic Liver Injury and Development of Liver Cancer. Gastroenterology. 2018;155:557-571.e14. [PubMed] [DOI] |
| 6. | Chang CS, Huang SM, Lin HH, Wu CC, Wang CJ. Different expression of apoptotic proteins between HBV-infected and non-HBV-infected hepatocellular carcinoma. Hepatogastroenterology. 2007;54:2061-2068. [PubMed] [DOI] |
| 7. | Yang Z, Lu Y, Xu Q, Tang B, Park CK, Chen X. HULC and H19 Played Different Roles in Overall and Disease-Free Survival from Hepatocellular Carcinoma after Curative Hepatectomy: A Preliminary Analysis from Gene Expression Omnibus. Dis Markers. 2015;2015:191029. [PubMed] [DOI] |
| 8. | Schulze K, Imbeaud S, Letouzé E, Alexandrov LB, Calderaro J, Rebouissou S, Couchy G, Meiller C, Shinde J, Soysouvanh F, Calatayud AL, Pinyol R, Pelletier L, Balabaud C, Laurent A, Blanc JF, Mazzaferro V, Calvo F, Villanueva A, Nault JC, Bioulac-Sage P, Stratton MR, Llovet JM, Zucman-Rossi J. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets. Nat Genet. 2015;47:505-511. [PubMed] [DOI] |
| 9. | Yang Y, Guo Y, Tan S, Ke B, Tao J, Liu H, Jiang J, Chen J, Chen G, Wu B. β-Arrestin1 enhances hepatocellular carcinogenesis through inflammation-mediated Akt signalling. Nat Commun. 2015;6:7369. [PubMed] [DOI] |
| 10. | Shen Q, Eun JW, Lee K, Kim HS, Yang HD, Kim SY, Lee EK, Kim T, Kang K, Kim S, Min DH, Oh SN, Lee YJ, Moon H, Ro SW, Park WS, Lee JY, Nam SW. Barrier to autointegration factor 1, procollagen-lysine, 2-oxoglutarate 5-dioxygenase 3, and splicing factor 3b subunit 4 as early-stage cancer decision markers and drivers of hepatocellular carcinoma. Hepatology. 2018;67:1360-1377. [PubMed] [DOI] |
| 11. | Shimada S, Mogushi K, Akiyama Y, Furuyama T, Watanabe S, Ogura T, Ogawa K, Ono H, Mitsunori Y, Ban D, Kudo A, Arii S, Tanabe M, Wands JR, Tanaka S. Comprehensive molecular and immunological characterization of hepatocellular carcinoma. EBioMedicine. 2019;40:457-470. [PubMed] [DOI] |
| 12. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 15. | Bosch FX, Ribes J, Borràs J. Epidemiology of primary liver cancer. Semin Liver Dis. 1999;19:271-285. [PubMed] [DOI] |
| 16. | Tzartzeva K, Singal AG. Testing for AFP in combination with ultrasound improves early liver cancer detection. Expert Rev Gastroenterol Hepatol. 2018;12:947-949. [PubMed] [DOI] |
| 17. | Wang RY, Chen XW, Zhang WW, Jiang F, Liu MQ, Shen XB. CYP2E1 changes the biological function of gastric cancer cells via the PI3K/Akt/mTOR signaling pathway. Mol Med Rep. 2020;21:842-850. [PubMed] [DOI] |