修回日期: 2022-01-21
接受日期: 2022-03-26
在线出版日期: 2022-04-28
胃癌发病机制复杂, 其中癌基因和抑癌基因表达失调是其进展的关键因素. miR-153-5p已被证实在肝癌中具有抑癌作用, lncRNA位于细胞周期激酶抑制因子4(INK4)基因座中反义RNA(ANRIL)促进肝癌细胞迁移. 但LINC01426是否靶向miR-153-5p参与胃癌进展仍有待研究.
探讨长基因间非编码RNA 01426(LINC01426)是否靶向miR-153-5p影响胃癌细胞的增殖、迁移和侵袭.
实时定量PCR(RT-qPCR)分析LINC01426和miR-153-5p在胃癌组织、癌旁组织、胃癌细胞系(SNU-1、AGS、HS-746T)和正常胃上皮细胞(GES1)中表达量. Pearson相关性分析胃癌组织中LINC01426和miR-153-5p表达的相关性. 生物信息学在线分析、双荧光素酶报告实验、RT-qPCR分析和证实LINC01426对miR-153-5p调控作用. 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)实验、Transwell实验分析LINC01426和miR-153-5p表达对SNU-1细胞增殖、迁移和侵袭的影响.
胃癌组织、细胞中LINC01426表达量显著高于癌旁组织和GES1细胞(P<0.05), miR-153-5p表达量显著高于癌旁组织和GES1细胞(P<0.05). Pearson相关性分析结果显示, 胃癌组织中LINC01426和miR-153-5p的表达呈负相关(r = -0.828, P<0.05). LINC01426靶向结合并负调控miR-153-5p. 抑制LINC01426表达或过表达miR-153-5p显著降低SNU-1细胞活力、迁移和侵袭能力(P<0.05), 而抑制miR-153-5p表达显著升高SNU-1细胞活力、迁移和侵袭能力(P<0.05). 抑制miR-153-5p表达显著逆转LINC01426抑制对SNU-1细胞活力、迁移和侵袭的影响(P<0.05).
抑制LINC01426可阻碍胃癌细胞增殖、侵袭和迁移, 这与LINC01426负调控miR-153-5p有关.
核心提要: LINC01426对miR-153-5p具有靶向负调控作用, 抑制miR-153-5p表达显著减弱了抑制LINC01426表达对SNU-1细胞增殖、迁移侵袭以及CyclinD1、基质金属蛋白酶2(matrix metallopeptidase 2, MMP2)和基质金属蛋白酶9(matrix metallopeptidase 9, MMP9)蛋白表达的抑制作用, 说明靶向负调控miR-153-5p是LINC01426参与胃癌进展的重要机制.
引文著录: 刘栋, 夏阿东, 李松, 张凯, 陈丹. LINC01426调控胃癌细胞增殖、迁移及侵袭的分子机制研究. 世界华人消化杂志 2022; 30(8): 356-363
Revised: January 21, 2022
Accepted: March 26, 2022
Published online: April 28, 2022
The pathogenesis of gastric cancer is complex, among which the dysregulation of expression of oncogenes and tumor suppressor genes is a key factor. MiR-153-5p has been confirmed to have a tumor suppressor effect in liver cancer, and antisense noncoding RNA in the INK4 locus (ANRIL) can promote liver cancer cell migration. However, whether long intergenic non-coding RNA 01426 (LINC01426) targets miR-153-5p and participates in the progression of gastric cancer remains to be studied.
To investigate whether LINC01426 targets miR-153-5p to affect the proliferation, migration, and invasion of gastric cancer cells.
Real-time quantitative PCR (RT-qPCR) was used to analyze the expression of LINC01426 and miR-153-5p in gastric cancer tissues, tumor adjacent tissues, gastric cancer cell lines (SNU-1, AGS, and HS-746T), and normal gastric epithelial cells (GES1). The correlation of LINC01426 and miR-153-5p expression in gastric cancer tissues was analyzed by Pearson correlation. Online bioinformatics analysis, dual luciferase reporter assay, and RT-qPCR were applied to confirm the regulatory effect of LINC01426 on miR-153-5p. The effect of LINC01426 and miR-153-5p expression on cell viability, migration, and invasion was evaluated by MTT and transwell assays.
LINC01426 was highly expressed in gastric cancer tissue and cells compared with tumor adjacent tissue and GES1 cells (P < 0.05), but miR-153-5 was lowly expressed in gastric cancer tissue and cells (P < 0.05). Pearson correlation analysis showed that the expression of LINC01426 and miR-153-5p in gastric cancer tissues was negatively correlated (r = -0.828, P < 0.05). LINC01426 could target and negatively regulate miR-153-5p. LINC01426 inhibition or miR-153-5p overexpression remarkably reduced the proliferation, migration, and invasion of SNU-1 cells (P < 0.05), while miR-153-5p inhibition had opposite effects (P < 0.05). The effects of LINC01426 inhibition on the proliferation, migration, and invasion of SNU-1 cells were significantly reversed by inhibiting miR-153-5p (P < 0.05).
Inhibition of LINC01426 could hinder the proliferation, invasion, and migration of gastric cancer cells, which is related to the negative regulation of miR-153-5p by LINC01426.
- Citation: Liu D, Xia AD, Li S, Zhang K, Chen D. Molecular mechanism for LINC01426 to regulate gastric cancer cell proliferation, migration, and invasion. Shijie Huaren Xiaohua Zazhi 2022; 30(8): 356-363
- URL: https://www.wjgnet.com/1009-3079/full/v30/i8/356.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i8.356
胃癌作为最常见的消化道恶性肿瘤之一, 严重威胁着人们生命和健康. 虽然手术、放化疗、靶向药物治疗、肿瘤免疫治疗等综合治疗策略不断发展, 但胃癌患者5年生存率并未得到明显提高[1]. 胃癌发病机制复杂, 其中癌基因和抑癌基因表达失调是其进展的关键因素. 近年来, 随着测序技术飞速进展越来越多与肿瘤相关的长链非编码RNA(lncRNA)被相继发现, 其通过吸附微小RNA(miRNA)、转录调控、转录后修饰等方式广泛参与细胞增殖、凋亡、浸润等细胞过程在肿瘤发生中发挥作用作用[2,3]. 长基因间非编码RNA 01426(LINC01426)位于21q22.12, 研究指出食管癌、结直肠癌等恶性肿瘤中表达增加, 是癌症诊断和预后预测的潜在标志物[4,5]. 胶质瘤中LINC01426高表达具有肿瘤启动子作用, 敲除LINC01426可抑制胶质瘤细胞增殖、迁移和侵袭, 诱导细胞凋亡[6]. 然而LINC01426在胃癌中表达和功能并不清楚. 序列分析显示, miR-153-5p是LINC01426的潜在靶基因. miR-153-5p已被证实在肝癌中具有抑癌作用, lncRNA 位于细胞周期激酶抑制因子4(INK4)基因座中反义RNA(ANRIL)通过下调miR-153-5p促进肝癌细胞迁移, 减少细胞凋亡[7]. 但LINC01426是否靶向miR-153-5p参与胃癌进展仍有待研究. 本研究主要分析了LINC01426、miR-153-5p在胃癌组织、细胞中表达水平, 探讨了其与胃癌细胞增殖、迁移侵袭的影响以及二者的相互作用, 现报道如下.
1.1.1 一般资料: 选择2017-01/2019-01期间于我院确诊并接受手术治疗的57例原发性胃癌患者. 其中男性36例, 女性21例, 年龄在45岁-72岁之间, 中位年龄58岁. 本研究经医院研究伦理委员会批准, 并由每位患者在术前签署书面知情同意书. 分离癌组织和癌旁组织(邻近的正常胃粘膜组织)立即置于液氮中冷冻, 随后保存于-80 ℃超低温冰箱.
1.1.2 细胞和试剂: 胃癌细胞系SNU-1、AGS、HS-746T、正常胃粘膜细胞GES1购自武汉普诺赛生命科技公司; LINC01426小干扰RNA(si-LINC01426)、miR-153-5p模拟物(mimics)、miR-153-5p抑制物(anti-miR-153-5p)、LINC01426过表达载体(pcDNA-LINC01426)以及各自对照、双荧光素酶载体购自上海吉玛制药公司; TRIzol试剂、ReverTra Ace qPCR逆转录试剂盒、SYBR qPCR Mix购自上海东洋纺生物公司; 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)试剂盒购于北京索莱宝生物; Transwell小室和基质胶购于北京优尼康生物; 兔抗人细胞周期素D1(CyclinD1)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)、基质金属蛋白酶9(matrix metalloproteinase 9, MMP9)、β-肌动蛋白(β-actin)单克隆抗体以山羊抗兔IgG二抗购于上海碧云生物公司.
1.2.1 细胞培养: SNU-1、AGS、HS-746T细胞分别采用RPMI-1640、ham's-F12、DMEM培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)培养. 培养箱条件为37 ℃、CO2体积分数5%. 换液频率为每周3次. 传代比例为1:3.
1.2.2 实验分组: 取1×106个对数期SNU-1细胞在6孔板中培养直到细胞50%融合时, 将待转染序列片段、载体分别用Lipofectamine 3000试剂转染到SNU-1细胞中. 根据转染物不同分为对照(NC)组、si-NC组、si-LINC01426组、miR-NC组、miR-153-5p组、anti-miR-NC组、anti-miR-153-5p组、si-LINC01426+anti-miR-NC组、si-LINC01426+anti-miR-153-5p组.
1.2.3 RT-qPCR检测LINC01426、miR-153-5p表达量: TRIzol试剂从胃癌组织、细胞、癌旁组织、GES1细胞中提取总RNA. 取200 ng RNA利用ReverTra Ace qPCR逆转录试剂盒合成cDNA, 以β-actin和U6基因作为内源性参照, 用SYBR qPCR Mix进行RT-qPCR检测, 2-∆∆Ct法分析LINC01426和miR-153-5p相对表达量. Linc01426上游引物5'-CGCACCCAGATACTTTTCGT-3', 下游引物5'-GCCGTTGAGGTTGTCGTAAT-3'; β-actin上游引物5'-ACTGCCGCATCCTCTTCCT-3', 下游引物5'-TCAACGTCACACTTCATGATGGA-3'; miR-153-5p上游引物5'-TGCATAGTCACAAAAGTGATCCTC-3', 下游引物5'-CTCAACTGGTGTCGTGGAGTC-3'; U6上游引物5'-CTCGCTTCGGCAGCACAT-3', 下游引物5'-AACGCTTCACGAATTTGCGT-3'.
1.2.4 MTT实验检测细胞活力: 将转染48 h细胞接种于96孔板(200 μL, 3×103细胞/孔), 每孔加入10 μL的MTT(质量浓度为5 mg/mL)继续孵育4 h, 随后加入150 μL的二甲基亚砜溶解沉淀. 用酶标仪在490 nm处测定吸光度(A).
1.2.5 Transwell实验检测迁移和侵袭: Transwell迁移实验中, 用不含血清的培养基重悬转染48 h细胞, 在上室加入200 μL(5×103个细胞), 在下室加入600 μL含10%胎牛血清培养液. 37 ℃孵育24 h后, 刮去膜上表面细胞, 95%乙醇固定下表面迁移细胞, 0.1%结晶紫染色30 min. 侵袭实验时采用包被基质胶的Transwell小室, 其他步骤与迁移实验一致. 细胞迁移或侵袭数量以显微镜下随机选择的5个视野的细胞数均值表示.
1.2.6 双荧光素酶报告实验: 双荧光素酶报告基因检测系统从测定荧光素酶活性. 合成含有miR-153-5p结合位点的野生型或突变型LINC01426序列, 将其插入pmir-GLO构建成野生型(wild type, WT)或突变型(mutant, MUT)LINC01426双荧光素酶载体, 该步骤由上海吉玛制药公司完成. 用Lipofectamine 2000将WT/MUT-LINC01426分别与miR-153-5p mimics、miR-NC共转染细胞, 48 h后测定荧光素酶活性. 相对荧光素酶活性以萤火虫荧光素酶活性和海肾荧光素酶活性的比值表示.
1.2.7 蛋白质印迹法(western blot)分析CyclinD1、MMP2、MMP9蛋白表达: 用放射免疫沉淀裂解液裂解蛋白, 用二喹啉甲酸法测定蛋白浓度. 用聚丙烯酰胺凝胶电泳分离蛋白, 并转移至聚偏二氟乙烯膜. 膜封闭后, 置于1:1000稀释的细胞周期蛋白D1(CyclinD1)、MMP2、MMP9一抗中4 ℃孵育过夜, 再置于辣根过氧化物酶标记的二抗中室温下孵育1 h. 化学发光法检测蛋白条带, Image J软件分析灰度值, 目的蛋白相对表达量以对应蛋白和内参灰度值比值表示.
统计学处理 实验独立重复3次, 每次设置3个平行. 数据采用均数±标准差(mean±SD)表示, 使用SPSS 20.0软件表示进行统计学分析, 采用单因素方差分析、SNk-q检验分析多组间差异, t检验分析两组间差异. P<0.05为有统计学意义.
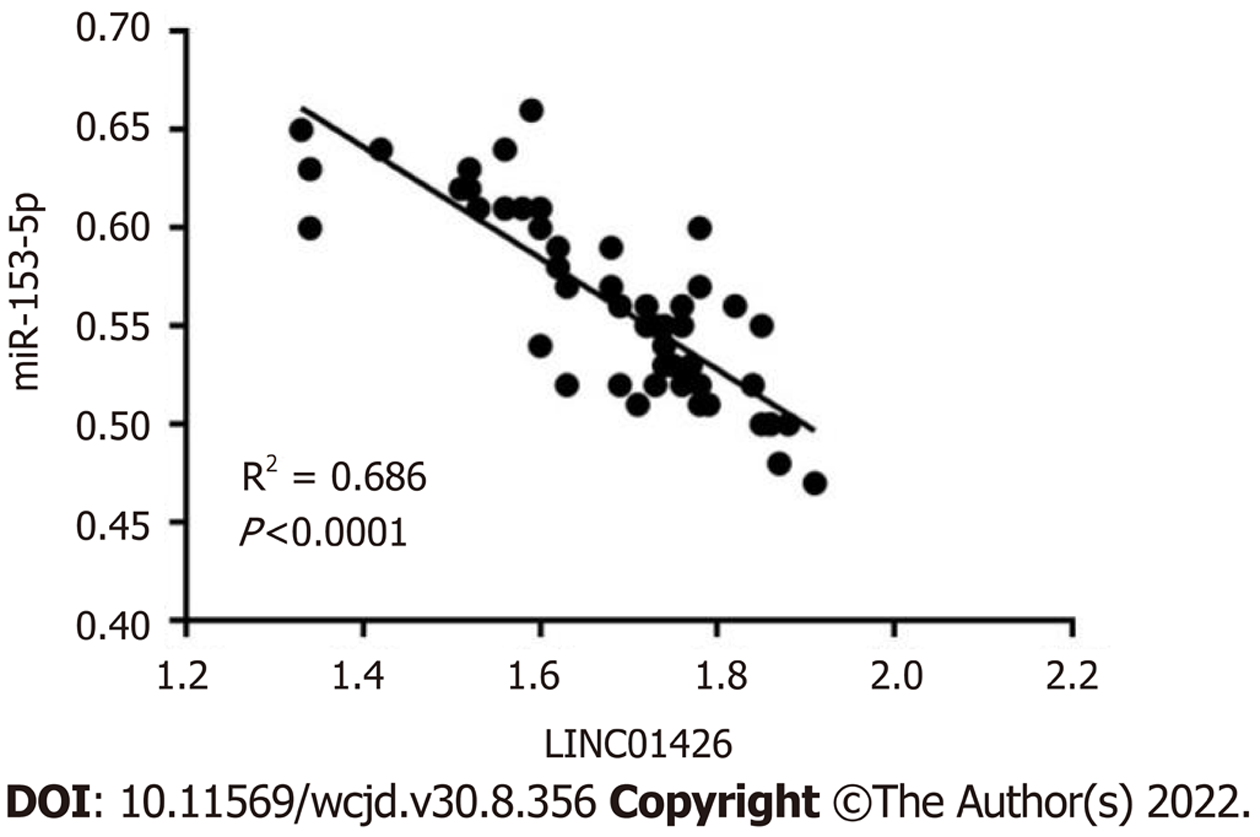
胃癌组织组织中LINC01426表达量显著高于癌旁组织(P<0.05), miR-153-5p表达量显著低于癌旁组织(P<0.05). Pearson相关性分析结果显示, 胃癌组织中LINC01426和miR-153-5p的表达呈负相关(r = -0.828, P<0.05), 见图1、表1.
胃癌细胞系SNU-1、AGS、HS-746T中LINC01426表达量显著高于人正常胃上皮细胞GES1(P<0.05), miR-153-5p表达量显著低于GES1细胞(P<0.05), 见表2.
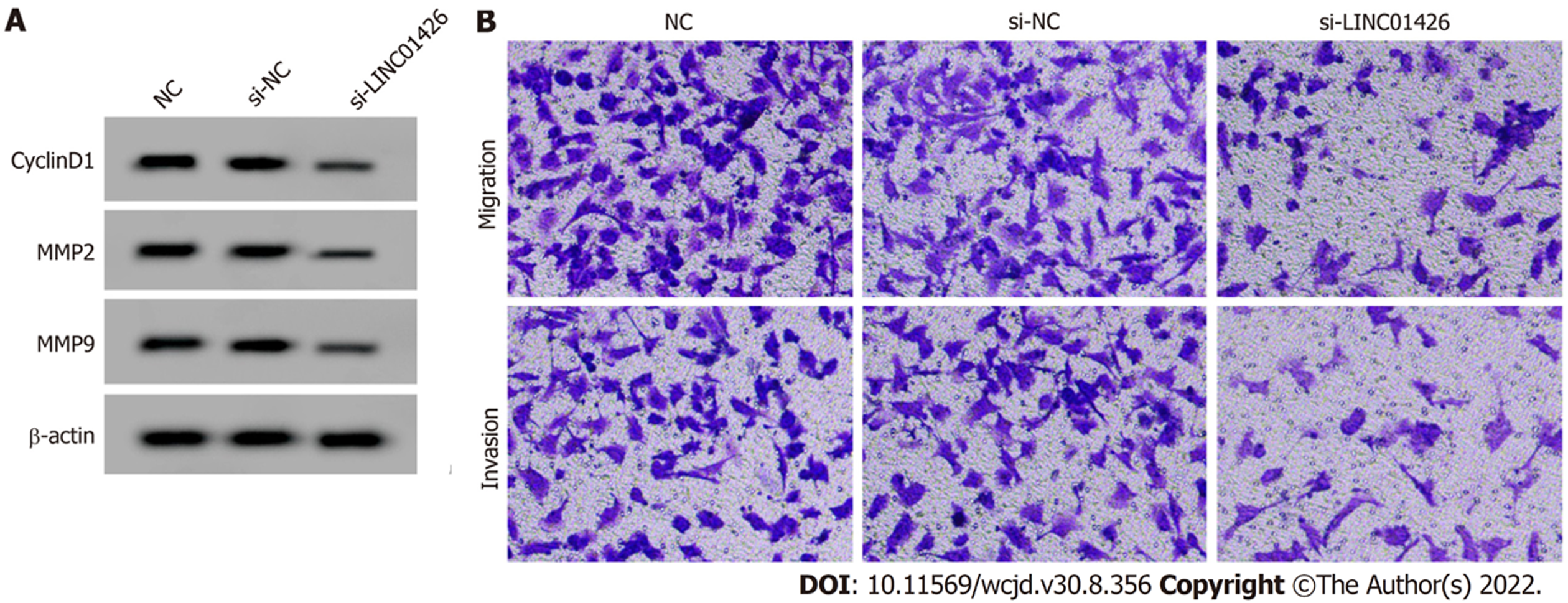
si-LINC01426组SNU-1细胞LINC01426表达量、CyclinD1、MMP2和MMP9蛋白表达量、细胞活力、细胞迁移和侵袭数量显著低于si-NC组, 见表3和图2.
| 组别 | LINC01426 | CyclinD1 | MMP2 | MMP9 | A值 | 细胞迁移数量(个) | 细胞侵袭数量(个) |
| NC | 1.00±0.11 | 0.86±0.08 | 0.73±0.07 | 0.67±0.06 | 1.025±0.09 | 183±16.02 | 120±11.35 |
| si-NC | 1.02±0.10 | 0.84±0.07 | 0.75±0.07 | 0.70±0.07 | 0.997±0.10 | 176±15.13 | 123±10.67 |
| si-LINC01426 | 0.44±0.04a | 0.41±0.04a | 0.33±0.03a | 0.27±0.02a | 0.476±0.04a | 82±7.96a | 61±5.91a |
| F | 123.494 | 135.279 | 141.645 | 174.843 | 131.031 | 156.466 | 118.887 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
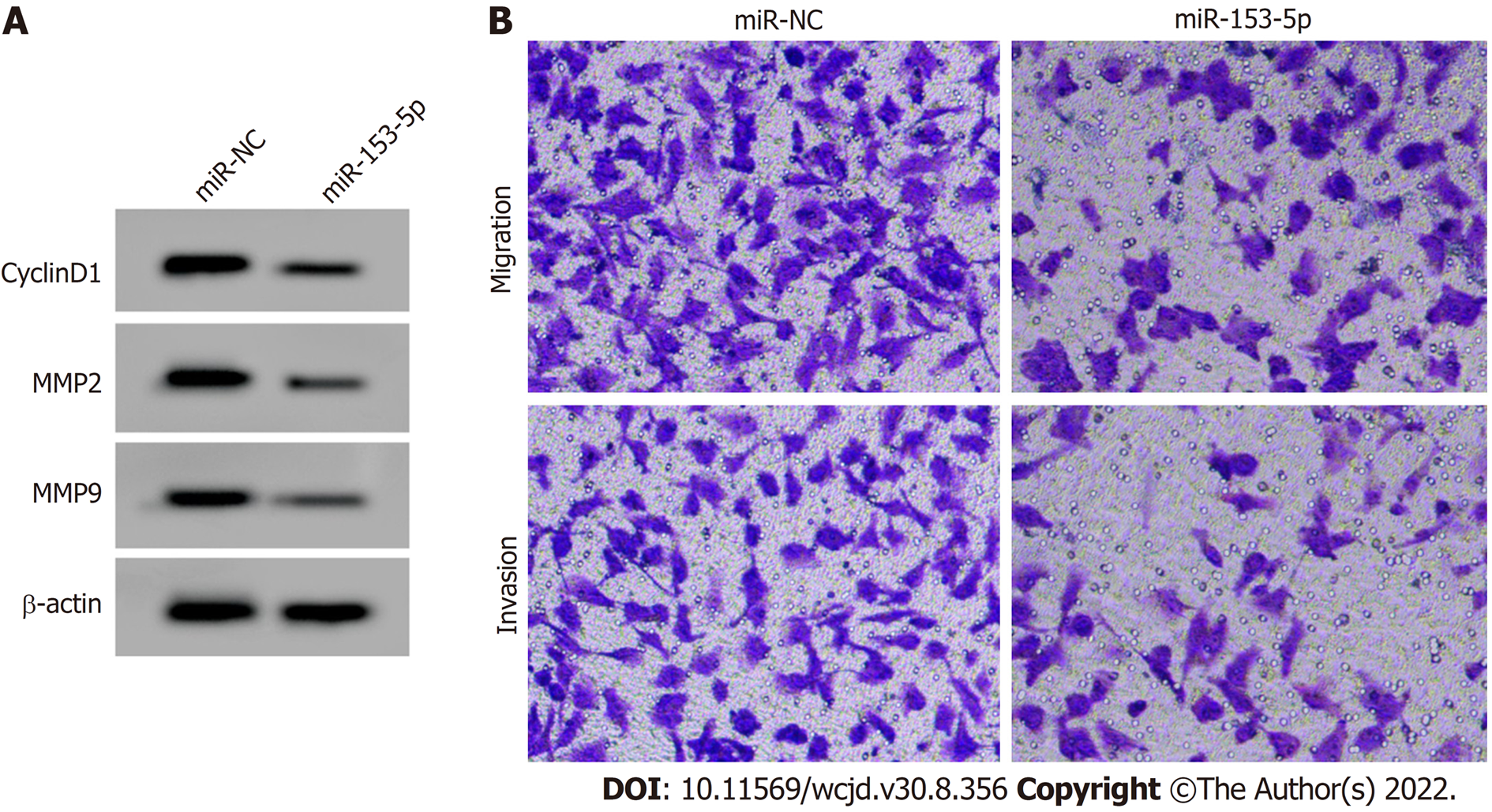
miR-153-5p组SNU-1细胞miR-153-5p表达量显著高于miR-NC组(P<0.05), CyclinD1、MMP2和MMP9蛋白表达量、细胞活力、细胞迁移和侵袭数量显著低于miR-NC组(P<0.05), 见表4和图3.
通过LncBase Predicted v.2在线预测LINC01426靶基因显示, miR-153-5p与LINC01426序列存在连续结合位点, 见图4. miR-153-5p mimics和WT-LINC01426共转染组SNU-1细胞相对荧光素酶活性显著低于miR-NC和WT-LINC01426共转染组(P<0.05), 而miR-153-5p mimics和MUT-LINC01426共转染组SNU-1细胞相对荧光素酶活性与MUT-LINC01426共转染组比较无显著变化, 见表5. si-LINC01426组SNU-1细胞miR-153-5p表达量显著高于si-NC组(P<0.05); pcDNA-LINC01426组SNU-1细胞miR-153-5p表达量显著低于pcDNA-NC组(P<0.05), 见表6.
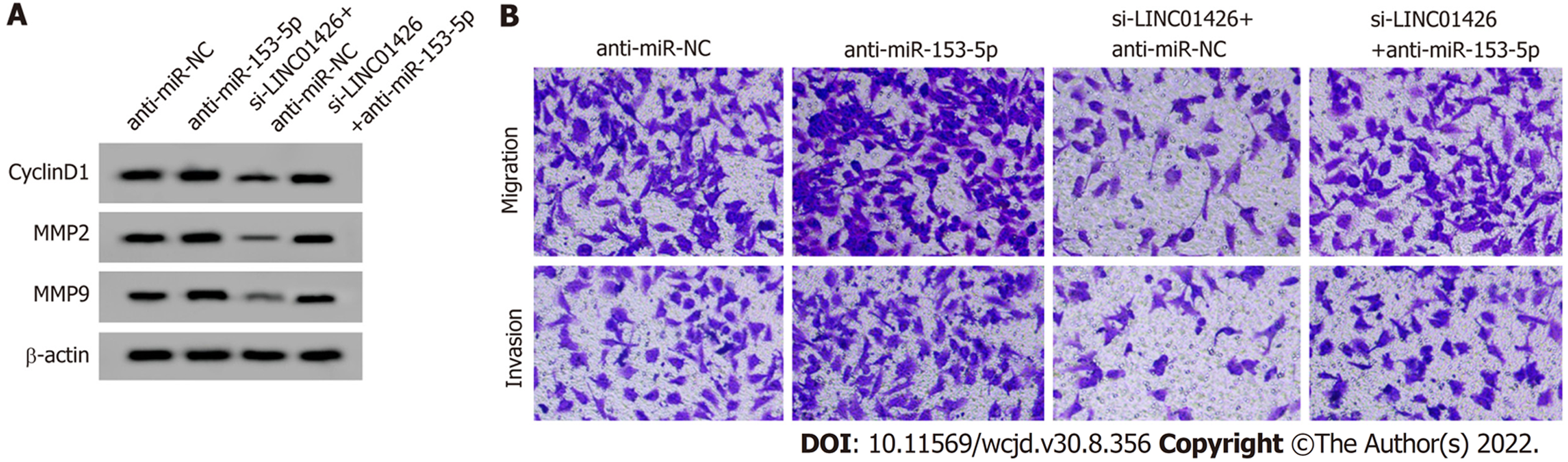
anti-miR-153-5p组SNU-1细胞miR-153-5p表达量显著低于anti-miR-NC组(P<0.05), CyclinD1、MMP2和MMP9蛋白表达量、细胞活力、细胞迁移和侵袭数量显著高于anti-miR-NC组(P<0.05); si-LINC01426+anti-miR-153-5p组SNU-1细胞miR-153-5p表达量显著低于si-LINC01426+anti-miR-NC组(P<0.05), CyclinD1、MMP2和MMP9蛋白表达量、细胞活力、细胞迁移和侵袭数量显著高于si-LINC01426+anti-miR-NC组(P<0.05), 见表7和图5.
| 组别 | miR-153-5p | CyclinD1 | MMP2 | MMP9 | A值 | 细胞迁移数量(个) | 细胞侵袭数量(个) |
| anti-miR-NC | 1.00±0.10 | 0.85±0.07 | 0.72±0.07 | 0.66±0.06 | 1.035±0.10 | 180±16.02 | 123±11.62 |
| anti-miR-153-5p | 0.46±0.05a | 1.28±0.11a | 1.03±0.10a | 0.95±0.09a | 1.476±0.13a | 241±22.07a | 178±16.25a |
| si-LINC01426+anti-miR-NC | 2.08±0.18a | 0.43±0.04a | 0.35±0.03a | 0.25±0.02a | 0.481±0.03a | 86±8.39a | 65±6.31a |
| si-LINC01426+anti-miR-153-5p | 1.23±0.11b | 0.83±0.07b | 0.75±0.06b | 0.63±0.06b | 0.988±0.08b | 161±15.67b | 115±11.02b |
| F | 286.879 | 184.685 | 144.541 | 189.153 | 174.458 | 138.632 | 137.546 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
最新全球癌症流行病学调查显示, 胃癌的发病率、死亡率分别高居恶性肿瘤排行榜第四位、第三位, 其仍是一种全球性健康问题[8]. 探讨与胃癌进展相关的lncRNA和miRNA有望为胃癌诊疗提供有效靶点.
本研究首先探讨了LINC01426在胃癌中的作用, 结果发现胃癌组织、细胞中LINC01426表达量显著升高, 选取SNU-1细胞进行功能缺失分析发现, 通过转染si-LINC01426抑制LINC01426表达显著降低细胞活力、迁移和侵袭能力, 提示在胃癌中LINC01426作为致癌基因发挥作用. CyclinD1是细胞增殖正向调节蛋白, 研究指出下调CyclinD1表达可抑制细胞从G1到S期的转变对胃癌细胞具有抗增殖作用[9]. MMP2和MMP9作为最重要的金属蛋白酶, 其通过降解细胞外基质的各种成分促进肿瘤细胞侵袭和转移. 本研究结果显示, 抑制LINC01426表达降低了SNU-1细胞中CyclinD1、MMP2和MMP9蛋白, 这进一步说明抑制LINC01426对胃癌细胞增殖、迁移和侵袭具有抑制作用[10]. 与本研究发现类似, Jiang等[11]报道透明细胞肾细胞癌中LINC01426表达上调, LINC01426缺失抑制了癌细胞的增殖和迁移. Cao等[12]证实恶性胶质瘤中LINC01426表达增加能够促进癌细胞增殖和生长, 促进恶性胶质瘤进展. 这些研究表明LINC01426在胃癌进展中具有致癌作用, 抑制LINC01426表达通过抑制胃癌细胞恶性增殖、迁移和侵袭能例进而抑制胃癌进展.
近年来, miR-153-5p被证实为一种人类癌症抑癌因子. 研究指出miR-153-5p低表达与急性髓性白血病细胞阿霉素耐药、结肠癌细胞的奥沙利铂耐药相关[13-15]. miR-153-5p通过诱导G2-M期阻滞还可增强紫杉醇对耐药三阴性乳腺癌细胞的增殖和迁移抑制作用, 逆转紫杉醇耐药[15]. 食管癌患者血清、食管癌组织中miR-153-5p表达降低, miR-153-5p通过靶向WT1参与食管癌细胞增殖和侵袭调控[16]. 本研究发现胃癌组织、细胞中miR-153-5p表达量显著降低, 通过转染miR-153-5p mimics进行功能获得实验显示, 过表达miR-153-5p显著下调CyclinD1、MMP2和MMP9蛋白表达, 并降低SNU-1细胞活力、迁移和侵袭能力, 与上述国内外研究报道基本吻合. 由于lncRNA通常通过充当miRNA的分子海绵发挥作用, 且miR-153-5p与LINC01426存在结合位点于是推测LINC01426可能通过靶向miR-153-5p参与调控胃癌进展, 并通过荧光素酶报告基因实验和RT-qPCR分析证实LINC01426对miR-153-5p的靶向负调控作用. 深入分析显示, 抑制miR-153-5p表达显著减弱了抑制LINC01426表达对SNU-1细胞增殖、迁移侵袭以及CyclinD1、MMP2和MMP9蛋白表达的抑制作用, 这进一步说明靶向负调控miR-153-5p是LINC01426参与胃癌进展的重要机制.
综上所述, LINC01426在胃组织和细胞系中上调, 抑制LINC01426通过负调控miR-153-5p显著抑制胃癌细胞增殖和转移, 这可能为胃癌治疗提供了潜在有效靶点.
胃癌发病机制复杂, 其中癌基因和抑癌基因表达失调是其进展的关键因素. miR-153-5p已被证实在肝癌中具有抑癌作用, lncRNA位于细胞周期激酶抑制因子4(INK4)基因座中反义RNA(ANRIL)促进肝癌细胞迁移. 但LINC01426是否靶向miR-153-5p参与胃癌进展仍有待研究.
通过分析LINC01426、miR-153-5p在胃癌组织、细胞中表达水平, 探讨其与胃癌细胞增殖、迁移侵袭的影响以及二者的相互作用,以期为胃癌患者发病机制提供参考依据和研究方向.
探讨长基因间非编码RNA 01426(LINC01426)是否靶向miR-153-5p影响胃癌细胞的增殖、迁移和侵袭.
实时定量PCR(RT-qPCR)分析LINC01426和miR-153-5p在胃癌组织、癌旁组织、胃癌细胞系(SNU-1、AGS、HS-746T)和正常胃上皮细胞(GES1)中表达量. Pearson相关性分析胃癌组织中LINC01426和miR-153-5p表达的相关性. 生物信息学在线分析、双荧光素酶报告实验、RT-qPCR分析和证实LINC01426对miR-153-5p调控作用. 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)实验、Transwell实验分析LINC01426和miR-153-5p表达对SNU-1细胞增殖、迁移和侵袭的影响.
胃癌组织、细胞中LINC01426表达量显著高于癌旁组织和GES1细胞(P<0.05), miR-153-5p表达量显著高于癌旁组织和GES1细胞(P<0.05). Pearson相关性分析结果显示, 胃癌组织中LINC01426和miR-153-5p的表达呈负相关(r = -0.828, P<0.05). LINC01426靶向结合并负调控miR-153-5p. 抑制LINC01426表达或过表达miR-153-5p显著降低SNU-1细胞活力、迁移和侵袭能力(P<0.05), 而抑制miR-153-5p表达显著升高SNU-1细胞活力、迁移和侵袭能力(P<0.05). 抑制miR-153-5p表达显著逆转LINC01426抑制对SNU-1细胞活力、迁移和侵袭的影响(P<0.05).
抑制LINC01426可阻碍胃癌细胞增殖、侵袭和迁移, 这与LINC01426负调控miR-153-5p有关.
本研究证实LINC01426在胃癌进展中具有致癌作用, 抑制LINC01426表达通过抑制胃癌细胞恶性增殖、迁移和侵袭能例进而抑制胃癌进展, miR-153-5p已被证实在肝癌中具有抑癌作用, 但LINC01426是否靶向miR-153-5p参与胃癌进展仍有待研究, 建议开展更大规模随机对照临床试验对本研究加以证实.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Strong VE. Progress in gastric cancer. Updates Surg. 2018;70:157-159. [PubMed] [DOI] |
| 2. | Cao HL, Liu ZJ, Huang PL, Yue YL, Xi JN. lncRNA-RMRP promotes proliferation, migration and invasion of bladder cancer via miR-206. Eur Rev Med Pharmacol Sci. 2019;23:1012-1021. [PubMed] [DOI] |
| 3. | Wang T, Tang X, Liu Y. LncRNA-ATB promotes apoptosis of non-small cell lung cancer cells through MiR-200a/β-Catenin. J BUON. 2019;24:2280-2286. [PubMed] |
| 4. | Wu H, Zheng J, Deng J, Zhang L, Li N, Li W, Li F, Lu J, Zhou Y. LincRNA-uc002yug.2 involves in alternative splicing of RUNX1 and serves as a predictor for esophageal cancer and prognosis. Oncogene. 2015;34:4723-4734. [PubMed] [DOI] |
| 5. | Wu X, He X, Li S, Xu X, Chen X, Zhu H. Long Non-Coding RNA ucoo2kmd.1 Regulates CD44-Dependent Cell Growth by Competing for miR-211-3p in Colorectal Cancer. PLoS One. 2016;11:e0151287. [PubMed] [DOI] |
| 6. | Wang SJ, Wang H, Zhao CD, Li R. Long noncoding RNA LINC01426 promotes glioma progression through PI3K/AKT signaling pathway and serves as a prognostic biomarker. Eur Rev Med Pharmacol Sci. 2018;22:6358-6368. [PubMed] [DOI] |
| 7. | Chen J, Huang X, Wang W, Xie H, Li J, Hu Z, Zheng Z, Li H, Teng L. LncRNA CDKN2BAS predicts poor prognosis in patients with hepatocellular carcinoma and promotes metastasis via the miR-153-5p/ARHGAP18 signaling axis. Aging (Albany NY). 2018;10:3371-3381. [PubMed] [DOI] |
| 8. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 9. | Zhang J, Zhang HY, Wang J, You LH, Zhou RZ, Zhao DM, Cheng MS, Li F. GL-1196 Suppresses the Proliferation and Invasion of Gastric Cancer Cells via Targeting PAK4 and Inhibiting PAK4-Mediated Signaling Pathways. Int J Mol Sci. 2016;17:470. [PubMed] [DOI] |
| 10. | Grzelczyk WL, Szemraj J, Józefowicz-Korczyńska M. The matrix metalloproteinase in larynx cancer. Postepy Hig Med Dosw (Online). 2016;70:1190-1197. [PubMed] |
| 11. | Jiang Y, Zhang H, Li W, Yan Y, Yao X, Gu W. LINC01426 contributes to clear cell renal cell carcinoma progression by modulating CTBP1/miR-423-5p/FOXM1 axis via interacting with IGF2BP1. J Cell Physiol. 2021;236:427-439. [PubMed] [DOI] |
| 12. | Cao J, Tang Z, Su Z. Long non-coding RNA LINC01426 facilitates glioblastoma progression via sponging miR-345-3p and upregulation of VAMP8. Cancer Cell Int. 2020;20:327. [PubMed] [DOI] |
| 13. | Shang J, Chen WM, Wang ZH, Wei TN, Chen ZZ, Wu WB. CircPAN3 mediates drug resistance in acute myeloid leukemia through the miR-153-5p/miR-183-5p-XIAP axis. Exp Hematol. 2019;70:42-54.e3. [PubMed] [DOI] |
| 14. | He Y, Zhang L, Tan F, Wang LF, Liu DH, Wang RJ, Yin XZ. MiR-153-5p promotes sensibility of colorectal cancer cells to oxaliplatin via targeting Bcl-2-mediated autophagy pathway. Biosci Biotechnol Biochem. 2020;84:1645-1651. [PubMed] [DOI] |
| 15. | Wang Y, Wu N, Zhang J, Wang H, Men X. MiR-153-5p Enhances the Sensitivity of Triple-Negative Breast Cancer Cells to Paclitaxel by Inducing G2M Phase Arrest. Onco Targets Ther. 2020;13:4089-4097. [PubMed] [DOI] |