修回日期: 2021-02-02
接受日期: 2021-03-15
在线出版日期: 2021-04-08
直肠癌根治术为治疗直肠癌的重要方法, 但手术引起的肠道菌群失调、基因表达变化均不利于预后改善, 积极探索术后肠道菌群、相关基因表达变化情况对指导干预措施的制定具有重要指导价值.
探讨结直肠癌根治术后肠道菌群、微小RNA-10a(microRNA-10a, miR-10a)表达变化情况, 并分析微生态肠内营养干预的作用.
选取2017-07/2020-06期间我院107例结直肠癌根治术患者作为研究对象, 比较不同肠道菌群情况患者肠道菌群、miR-10a表达变化, 分析肠道菌群、miR-10a表达与肠道菌群失调的关系, 并对肠道菌群紊乱患者进行微生态肠内营养干预, 对比干预前后患者肠道菌群、miR-10a表达, 比较不同疗效患者临床资料、肠道菌群、miR-10a表达, 分析微生态肠内营养干预疗效影响因素, 及肠道菌群、miR-10a表达对微生态肠内营养干预疗效的评估价值, 并分析肠道菌群失调患者肠道菌群与miR-10a表达的相关性.
结直肠癌根治术后菌群正常患者乳酸杆菌、双歧杆菌、真杆菌菌群菌落数、miR-10a表达均高于菌群失调Ⅰ度、Ⅱ度患者, 菌群失调Ⅰ度患者高于菌群失调Ⅱ度患者, 肠球菌均低于菌群失调Ⅰ度、Ⅱ度患者, 菌群失调Ⅰ度患者低于菌群失调Ⅱ度患者(P<0.05); 随着乳酸杆菌、双歧杆菌、真杆菌菌群菌落数、miR-10a表达降低、肠球菌菌群菌落数升高, 结直肠癌根治术后肠道菌群失调发生风险升高(P<0.05); 肠道菌群紊乱患者微生态肠内营养干预后乳杆菌、双歧杆菌、真杆菌菌群菌落数及miR-10a均高于干预前, 肠球菌菌群菌落数低于干预前(P<0.05); 年龄、DUKE分期、干预后乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达均与微生态肠内营养干预疗效显著相关(P<0.05); 干预后肠道菌群、miR-10a表达评估微生态肠内营养干预效果的曲线下面积(AUC)均>0.70.
结直肠癌根治术后肠道菌群、miR-10a表达变化与肠道菌群失调的发生显著相关, 给予微生态肠内营养干预可有效调节肠道菌群、miR-10a表达, 且肠道菌群、miR-10a表达可作为评估干预效果的指标.
核心提要: 本文重点探究结直肠癌根治术后肠道菌群、微小RNA-10a(microRNA-10a, miR-10a)表达变化情况, 并分析微生态肠内营养干预的作用, 旨在为结直肠癌根治术后干预措施的制定提供参考.
引文著录: 金佳琪, 贾新能, 宣俊毅. 结直肠癌根治术后肠道菌群、miR-10a表达变化及微生态肠内营养干预作用. 世界华人消化杂志 2021; 29(7): 356-365
Revised: February 2, 2021
Accepted: March 15, 2021
Published online: April 8, 2021
Radical resection is an important method for the treatment of rectal cancer, but the imbalance of intestinal flora and changes in gene expression caused by surgery are not conducive to the improvement of prognosis. It is of great value to explore the changes of intestinal flora and related gene expression after surgery for the formulation of intervention measures.
To investigate the changes in intestinal flora and microRNA-10a (miR-10a) expression after radical resection of colorectal cancer, and to analyze the effect of microecological enteral nutrition intervention.
From July 2017 to June 2020, 107 patients with colorectal cancer undergoing radical resection at our hospital were selected as research subjects. The intestinal flora and miR-10a expression changes of patients with different intestinal flora were compared, and the relationship between the intestinal flora, miR-10a expression, and dysbacteriosis was analyzed. Microecological enteral nutrition intervention was carried out for patients with intestinal flora disorders, and the intestinal flora and miR-10a expression of patients before and after the intervention were compared. Clinical data, intestinal flora, and miR-10a expression of patients with different curative effects were compared. Factors affecting the efficacy of microecological enteral nutrition intervention were analyzed, as well as the value of intestinal flora and miR-10a expression in evaluation of efficacy of microecological enteral nutrition intervention. The correlation between the intestinal flora and the expression of miR-10a in patients with dysbacteriosis was analyzed.
The numbers of colonies of Lactobacillus, Bifidobacterium, and Eubacterium, and miR-10a expression were higher in patients with normal flora after radical resection of colorectal cancer than those in patients with dysbacteriosis degrees Ⅰ and Ⅱ, and in patients with dysbacteriosis degree Ⅰ than in those with dysbacteriosis degree Ⅱ. The number of Enterococcus was lower in patients with normal flora after radical resection of colorectal cancer than in those with dysbacteriosis degrees Ⅰ and Ⅱ, and in patients with dysbacteriosis degree Ⅰ than in those with dysbacteriosis degree Ⅱ (P < 0.05). As the numbers of Lactobacillus, Bifidobacterium, and Eubacterium, and the expression of miR-10a decreased, and the number of Enterococcus increased, the risk of dysbacteriosis in patients after radical resection of colorectal cancer increased (P < 0.05). The numbers of Lactobacillus, Bifidobacterium, and Eubacterium and miR-10a expression were higher and the number of Enterococcus was lower in patients after microecological enteral nutrition intervention than in patients before intervention (P < 0.05). Age, Duke stage, numbers of Lactobacillus, Bifidobacterium, Enterococcus and Eubacterium after intervention, and miR-10a expression were all significantly correlated with the efficacy of microecological enteral nutrition intervention (P < 0.05). After intervention, the areas under the curves of the intestinal flora and miR-10a expression in evaluating the efficacy of microecological enteral nutrition intervention were both > 0.7.
The intestinal flora and miR-10a expression changes after radical resection of colorectal cancer are significantly related to the occurrence of dysbacteriosis. Microecological enteral nutrition intervention can effectively regulate the intestinal flora and miR-10a expression, and the intestinal flora and miR-10a expression can be used as indicators to evaluate the intervention efficacy.
- Citation: Jin JQ, Jia XN, Xuan JY. Changes of intestinal flora and miR-10a expression after radical resection of colorectal cancer: Effect of microecological enteral nutrition intervention. Shijie Huaren Xiaohua Zazhi 2021; 29(7): 356-365
- URL: https://www.wjgnet.com/1009-3079/full/v29/i7/356.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i7.356
结直肠癌是消化道最常见恶性肿瘤之一, 资料显示[1,2], 结直肠癌发病率仅次于肺癌、乳腺癌, 被称为世界第三大恶性肿瘤, 每年约有70万例结直肠癌患者死亡. 目前, 临床治疗结直肠癌患者以结直肠癌根治术为主, 放疗、化疗为辅, 手术可有效切除肿瘤病灶, 在控制肿瘤进展、延长患者生存期方面具有良好效果[3]. 但手术操作导致患者肠道屏障受损, 易发生肠道菌群失调. 相关研究[4,5]指出, 结直肠癌根治术后肠道菌群失调与患者预后、甚至术后肿瘤复发、发展有关, 加强相关干预非常有必要. 微生态肠内营养干预是治疗结直肠癌术后肠道菌群失调的安全、可靠方法, 同时能明显增强患者免疫功能, 抑制炎症反应[6,7]. 此外, 微小RNA-10a(microRNA-10a, miR-10a)被证实具有调控机体固有免疫、获得性免疫的作用, 与炎症性肠病的发病密切相关, 参与肠粘膜的炎症损伤过程[8]. 基于此, 本研究尝试探讨结直肠癌根治术后肠道菌群、miR-10a表达变化情况, 并分析miR-10a表达与肠道菌群失调的关系, 及肠道菌群、miR-10a表达在评估微生态肠内营养干预效果方面的价值. 报告如下.
经我院伦理委员会审批通过(审批号为S789356), 选取2017-07/2020-06我院107例结直肠癌根治术患者作为研究对象, 其中男57例, 女50例; 年龄39-78岁, 平均(61.38±8.29)岁; 侵袭深度: 63例T1-T2, 44例T3-T4; 临床分型: 49例肿块型, 35例溃疡型, 23例浸润型; DUKE分期: 68例A、B期, 39例C、D期. 其中侵袭深度、临床分型、DUKE分期均参照《中国结直肠癌诊疗规范(2017年版)》[9]判定.
纳入标准: (1)符合结直肠癌诊断标准[9], 并经术后病理诊断确诊; (2)原发病灶均经结直肠癌根治术切除; (3)肿瘤无远处转移; (4)术前1 mo内未服用过抗生素、微生态活菌制剂及导泻药; (5)患者知晓本研究, 已签署同意书.
排除标准: (1)合并其他原发恶性肿瘤者; (2)伴有肠道梗阻、胃穿孔等其他胃肠道疾病者; (3)自身免疫性疾病患者; (4)严重感染性疾病患者; (5)血液系统疾病患者; (6)精神疾病患者; (7)严重心脑血管疾病、肝肾功能障碍者.
肠道菌群检测方法: 所有患者均于结直肠癌根治术后2 wk取中段、新鲜粪便标本, 由专业检测人员进行肠道菌群检测, 具体检测方法: 采用无菌试杯收集患者新鲜粪便1 g, 于30 min内检测, 取0.1 g新鲜粪便标本, 采用0.9 mL稀释液充分稀释, 采用10倍稀释法稀释至1000 mL, 随后采用血琼脂及麦康凯平板接种, 37 ℃恒温培养48 h后分离出乳酸杆菌、双歧杆菌、肠球菌及真杆菌, 采用平板计数法对菌株计数. 参照相关文献[10]将肠道菌群情况分为菌群正常、菌群失调Ⅰ度和菌群失调Ⅱ度.
微生态肠内营养干预方法: 根据术后2 wk肠道菌群检测结果, 给予肠道菌群失调患者微生态肠内营养干预, 经营养管滴入肠内营养混悬液[纽迪希亚制药(无锡)有限公司, 国药准字H20010285], 速度15 mL/h, 第1 d滴入250 mL, 第2 d适当增加肠内营养混悬液滴入速度, 共入滴入500 mL, 第3 d起, 视患者耐受情况, 逐渐增加到1000-1500 mL, 共干预7 d. 干预结束后再次采集患者中段、新鲜粪便标本进行肠道菌群检测.
miR-10a检测方法: 于结直肠癌根治术后2 wk、微生态肠内营养干预后, 分别采集微生态肠内营养干预前后患者外周静脉血3 mL, 以3500 r/min转速离心处理5 min(离心半径8 cm)后取血清, 置于-70 ℃冷藏室保存, 由专业检测人员统一检测, 取血清标本, 采用实时荧光聚合酶链式反应检测血清miR-10a水平, Trizol法提取心脏组织总RNA, RNA提取试剂盒购自北京索莱宝科技有限公司), 取1 μL按1:50稀释, 混匀, 采用紫外分光光度仪检测RNA质量与浓度, 后以1.2%甲醛变性凝胶电泳. 根据miRRase 18.0版, 利用Primer 5引物设计软件对所设计的引物进行选择与确认. 以U6为内参, 逆转录引物为5'-AACGCTTCACGAATTTGCGT-3', miR-10a上游引物、下游引物分别为5'-GCGGTAAGTGCTTCCATGTTTTAGTAG-3'、5'-ATGAACTCTGCGGATGGTG-3'. 上下游引物均购自广州锐博生物科技有限公司. 随后进行荧光聚合酶链式反应, 试剂盒购自德国Qiagen公司, 检测操作均由专业人员严格按照试剂盒说明书完成, 选取U6为内参照, 应用公式2-ΔΔct计算miR-10a相对表达水平.
(1)不同肠道菌群情况患者肠道菌群、miR-10a表达; (2)分析结直肠癌根治术后肠道菌群、miR-10a表达与肠道菌群失调的关系; (3)肠道菌群紊乱患者微生态肠内营养干预前后肠道菌群、miR-10a表达; (4)不同微生态肠内营养干预疗效患者临床资料、肠道菌群、miR-10a表达, 临床资料包括性别、年龄、病程、侵袭深度、临床分型、DUKE分期, 菌群失调下降≥1度为疗效良好, <1度则为不良[11]; (5)分析微生态肠内营养干预疗效的影响因素; (6)分析肠道菌群、miR-10a表达对微生态肠内营养干预疗效的评估价值; (7)分析肠道菌群失调患者肠道菌群与miR-10a表达的相关性.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验, 计量资料以mean±SD描述, 多组间比较采用单因素方差分析, 进一步两两组间比较采用SNK-q检验, 组内比较采用配对t检验, 两组间比较采用独立样本t检验, 相关性分析采用Pearson相关系数模型, 通过Logistic进行多因素回归分析, 评估效能分析采用受试者工作特征(receiver operating characteristic, ROC)曲线, 获取曲线下面积(area under the curve, AUC)、置信区间、敏感度、特异度及cut-off值, 不同评估方案间曲线下面积比较采用DeLong检验, 均采用双侧检验, P<0.05为差异有统计学意义.
不同肠道菌群情况患者乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达相比, 差异有统计学意义(P<0.05). 见表1.
以结直肠癌根治术后是否发生肠道菌群失调为因变量(未发生 = 0, 发生 = 1), 纳入肠道菌群、miR-10a作为自变量, 进行Logistic回归分析显示, 乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达与结直肠癌根治术后肠道菌群失调有关(P<0.05). 见表2.
| 因素 | β | S.E. | χ2 | P | OR | 95%CI |
| 肠道菌群菌落数 | ||||||
| 乳杆菌 | -0.84 | 0.26 | 10.55 | <0.05 | 0.43 | 0.30-0.63 |
| 双歧杆菌 | -0.41 | 0.13 | 10.42 | <0.05 | 0.67 | 0.45-0.98 |
| 肠球菌 | 1.67 | 0.34 | 23.85 | <0.05 | 5.29 | 3.13-8.94 |
| 真杆菌 | -0.63 | 0.22 | 7.88 | <0.05 | 0.54 | 0.36-0.79 |
| miR-10a | -0.71 | 0.22 | 10.65 | <0.05 | 0.49 | 0.27-0.89 |
与干预前相比, 微生态肠内营养干预后乳杆菌、双歧杆菌、真杆菌菌群菌落数及miR-10a均明显升高, 肠球菌菌群菌落数明显下降, 差异有统计学意义(P<0.05). 见表3.
| 时间 | 例数 | 肠道菌群菌落数(×108 CFU/g) | miR-10a | |||
| 乳杆菌 | 双歧杆菌 | 肠球菌 | 真杆菌 | |||
| 干预前 | 62 | 7.09±0.52 | 8.03±0.52 | 9.19±0.65 | 6.00±0.49 | 0.17±0.08 |
| 干预后 | 62 | 8.65±0.62 | 9.41±0.49 | 8.02±0.52 | 7.31±0.56 | 0.29±0.12 |
| t | 15.18 | 15.21 | 11.07 | 13.86 | 6.55 | |
| P | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | |
不同疗效患者性别、病程、侵袭深度、临床分型、干预前乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达相比, 差异无统计学意义; 疗效良好患者年龄、DUKE分期、干预后乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达相比, 差异有统计学意义(P<0.05). 见表4.
| 指标 | 疗效良好(n = 45) | 疗效不良(n = 17) | t/χ2 | P |
| 性别 | 0.08 | 0.78 | ||
| 男 | 23(51.11) | 8(47.06) | ||
| 女 | 22(48.89) | 9(52.94) | ||
| 年龄(岁) | 4.27 | <0.05 | ||
| ≤60 | 29(64.44) | 6(35.29) | ||
| >60 | 16(35.56) | 11(64.71) | ||
| 病程(年) | 0.15 | 0.70 | ||
| ≤1 | 21(46.67) | 7(41.18) | ||
| >1 | 24(53.33) | 10(58.82) | ||
| 侵袭深度 | 0.69 | 0.41 | ||
| T1-T2 | 29(64.44) | 9(52.94) | ||
| T3-T4 | 16(35.56) | 8(47.06) | ||
| 临床分型 | 1.24 | 0.54 | ||
| 肿块型 | 23(51.11) | 6(35.29) | ||
| 溃疡型 | 12(26.67) | 6(35.29) | ||
| 浸润型 | 10(22.22) | 5(29.41) | ||
| DUKE分期 | 6.51 | <0.05 | ||
| A、B期 | 34(75.56) | 7(41.18) | ||
| C、D期 | 11(24.44) | 10(58.82) | ||
| 肠道菌群菌落数 | ||||
| 干预前乳杆菌 | 7.16±0.49 | 6.98±0.41 | 1.35 | 0.18 |
| 干预后乳杆菌 | 8.92±1.02 | 7.95±1.15 | 3.23 | <0.05 |
| 干预前双歧杆菌 | 8.07±0.37 | 7.96±0.41 | 1.01 | 0.32 |
| 干预后双歧杆菌 | 9.58±0.69 | 8.97±0.74 | 3.05 | <0.05 |
| 干预前肠球菌 | 9.05±0.89 | 9.44±0.82 | 1.57 | 0.12 |
| 干预后肠球菌 | 7.92±0.36 | 8.28±0.38 | 3.46 | <0.05 |
| 干预前真杆菌 | 5.98±0.42 | 6.12±0.49 | 1.12 | 0.268 |
| 干预后真杆菌 | 7.58±1.37 | 6.61±1.25 | 2.55 | <0.05 |
| 干预前miR-10a | 0.18±0.08 | 0.14±0.06 | 1.87 | 0.07 |
| 干预后miR-10a | 0.32±0.14 | 0.21±0.10 | 2.96 | <0.05 |
以微生态肠内营养干预疗效为因变量(赋值: 疗效良好 = 1, 疗效不佳 = 2), 将结果2.4中有差异因素纳入Logistic回归分析, 结果显示, 年龄、DUKE分期、干预后乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达均为微生态肠内营养干预疗效的影响因素(P<0.05). 见表5.
| 因素 | β | S.E. | χ2 | P | OR | 95%CI |
| 年龄 | 1.66 | 0.31 | 28.13 | <0.05 | 5.26 | 3.03-9.14 |
| DUKE分期 | 1.60 | 0.37 | 18.33 | <0.05 | 4.96 | 2.79-8.79 |
| 干预后肠道菌群菌落数 | ||||||
| 乳杆菌 | -0.67 | 0.25 | 7.14 | <0.05 | 0.51 | 0.38-0.69 |
| 双歧杆菌 | -0.47 | 0.19 | 6.46 | <0.05 | 0.63 | 0.42-0.94 |
| 肠球菌 | 1.72 | 0.37 | 21.06 | <0.05 | 5.56 | 2.75-11.28 |
| 真杆菌 | -0.87 | 0.29 | 8.66 | <0.05 | 0.42 | 0.31-0.57 |
| 干预后miR-10a | -0.81 | 0.25 | 10.29 | <0.05 | 0.45 | 0.24-0.83 |
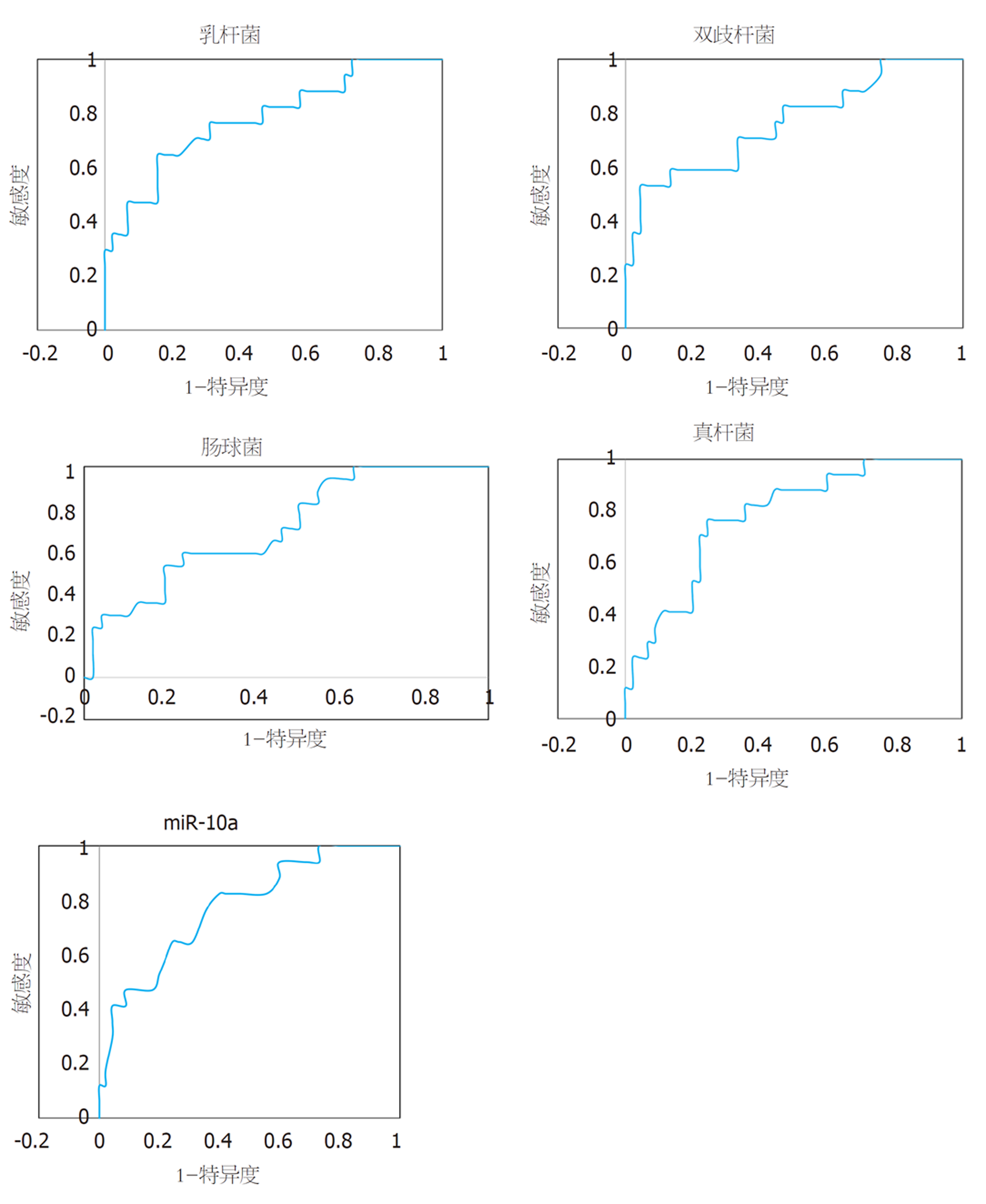
绘制干预后肠道菌群、miR-10a表达评估微生态肠内营养干预效果的ROC曲线, 结果显示各指标评估的AUC均>0.7, 其中乳杆菌评估的AUC最大, 为0.78, 截断值下评估敏感度、特异度分别为64.71%、84.44%. 见表6、图1.
| 指标 | AUC | 95%CI | Z统计 | P | 截断值 | 敏感度 | 特异度 |
| 干预后肠道菌群菌落数 | |||||||
| 乳杆菌 | 0.78 | 0.66-0.88 | 4.14 | <0.05 | ≤8.31×108 CFU/g | 64.71% | 84.44% |
| 双歧杆菌 | 0.76 | 0.64-0.86 | 3.59 | <0.05 | ≤8.41×108 CFU/g | 52.94% | 95.56% |
| 肠球菌 | 0.71 | 0.58-0.82 | 2.94 | <0.05 | >8.07×108 CFU/g | 58.82% | 75.56% |
| 真杆菌 | 0.78 | 0.66-0.88 | 4.48 | <0.05 | ≤7.04×108 CFU/g | 76.47% | 75.56% |
| miR-10a | 0.77 | 0.65-0.87 | 4.12 | <0.05 | ≤0.29 | 82.35% | 60.00% |
肠道菌群是组成肠道保护屏障的重要部分, 而结直肠癌根治术围术期需进行多种准备和操作, 如术前肠道准备、手术切除肠道、禁食、术后抗生素的应用等, 均会给肠道菌群平衡带来明显影响[12,13]. 肠道菌群失调可导致大量细菌产生肠道毒素, 加重患者局部炎症反应, 降低机体免疫功能, 也在一定程度上影响肿瘤浸润[14,15].
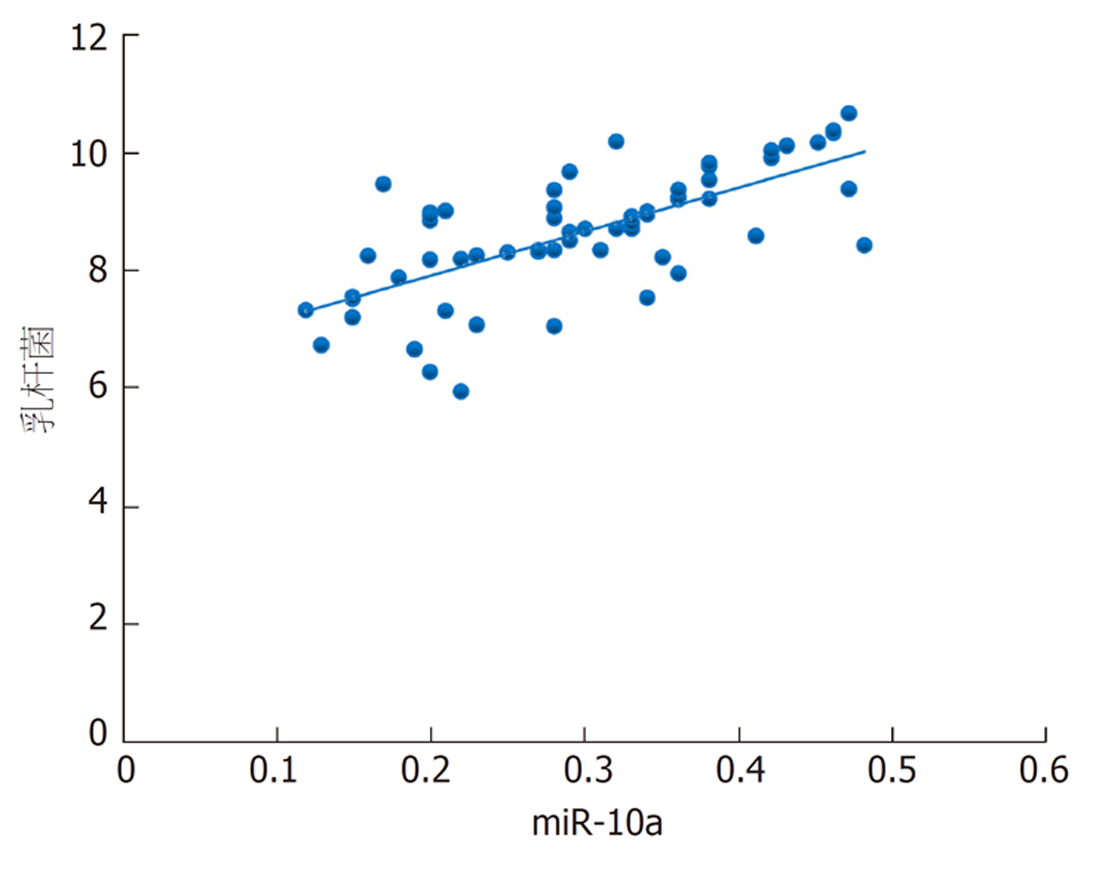
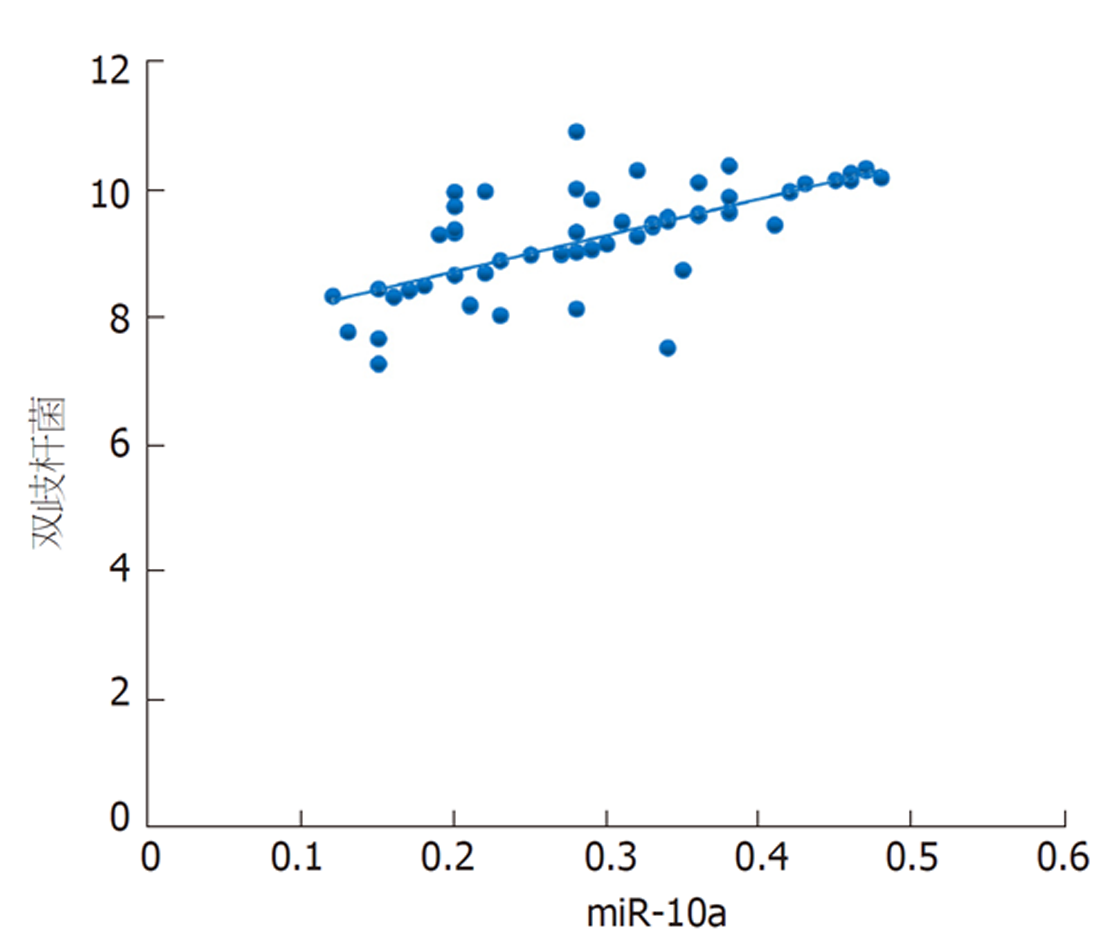
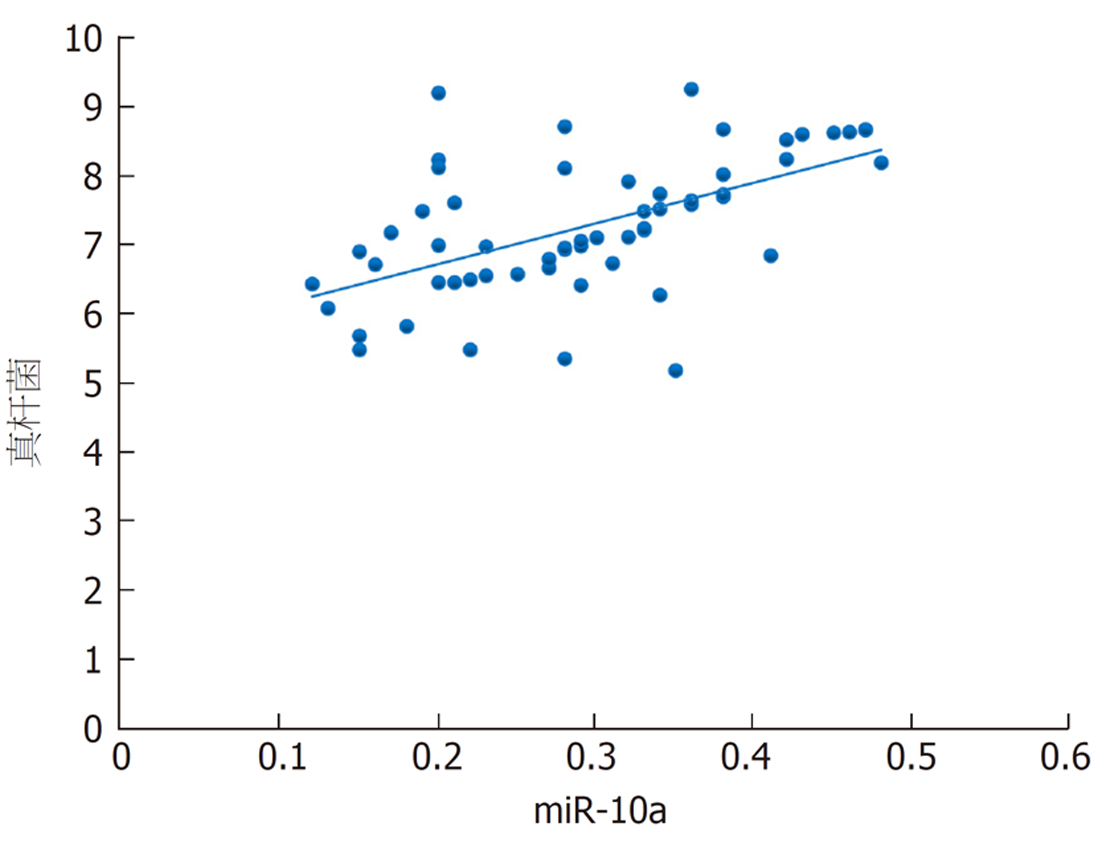
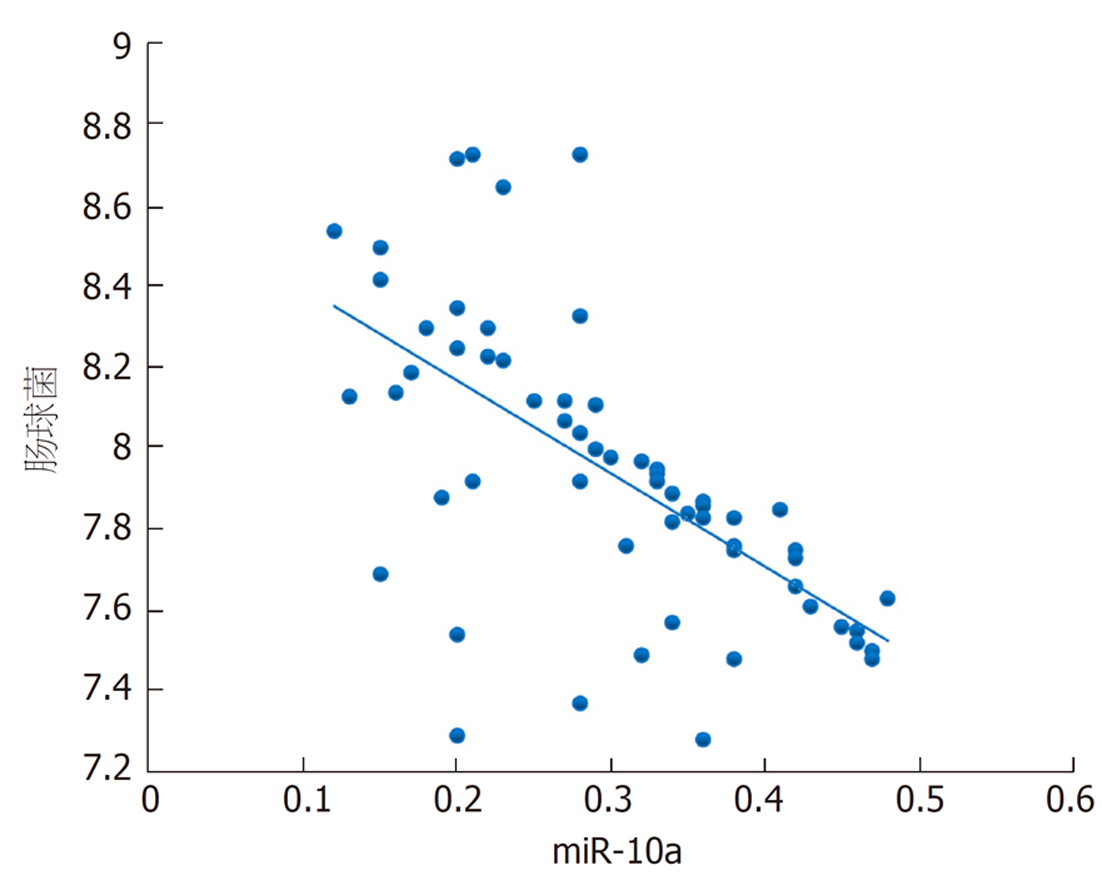
本研究发现, 结直肠癌根治术后发生菌群失调患者乳酸杆菌、双歧杆菌、真杆菌菌群菌落数明显低于菌群正常患者, 而肠球菌则明显高于菌群正常患者, 进一步经多因素分析发现上述肠道菌群菌落数变化与结直肠癌根治术后菌群失调的发生显著相关. 肠道菌群以厌氧菌为基础, 其中乳酸杆菌、双歧杆菌、真杆菌是组成肠道菌群的主要益生菌, 益生菌与肠上皮细胞在特异性受体结合情况下形成一道保护屏障, 此屏障具有一定层次性, 受占位效应保护, 在阻碍肠球菌等有害菌增殖方面发挥重要作用[16,17]. 手术等一系列操作导致乳酸杆菌、双歧杆菌等益生菌菌落数减少, 其抑制有害菌的作用减弱, 致使肠球菌菌落数增加, 最终形成肠道菌群失调[18]. 本研究还发现, 结直肠癌根治术后发生菌群失调患者血清miR-10a表达水平明显降低, 且其水平降低可明显增加术后肠道菌群失调发生风险, 提示miR-10a表达与肠道菌群失调有关. miR-10a是定位于17号染色体短臂HOXB4与HOXB5之间的非编码RNA, 其在多种恶性肿瘤中表达降低, 如胃癌、前列腺癌[19,20]. 新近研究指出[21], 转移的结直肠癌细胞中miR-10a表达降低, 与肿瘤的转移和浸润呈负相关. 程海霞等[22]研究发现, miR-10a具有介导肠道黏膜屏障功能的作用, 并指出结直肠癌患者围手术期应用益生菌可有效上调miR-10a表达. 本研究发现, 对结直肠癌根治术后发生菌群失调患者进行微生态肠内营养干预7 d后, 患者血清miR-10a均高于干预前, 与上述研究结果一致, 同时患者乳杆菌、双歧杆菌、真杆菌、肠球菌菌群菌落数均得到明显改善, 且本研究通过相关性分析发现患者干预后乳杆菌、双歧杆菌、真杆菌菌群菌落数与miR-10a呈正相关, 肠球菌菌群菌落数与miR-10a呈负相关. 笔者认为微生态肠内营养干预能上调血清miR-10a表达水平, miR-10a可介导肠道黏膜屏障相关蛋白表达, 从而修复、改善肠道黏膜屏障功能, 进而纠正肠道菌群失调.
从本研究结果2.4可见, 不同微生态肠内营养干预疗效患者的干预后乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达存在明显差异, 进一步经多因素分析发现上述指标均与疗效显著相关, 据此笔者推测干预后肠道菌群、miR-10a表达可作为评估微生态肠内营养干预疗效的指标. 本研究首次采用ROC曲线分析干预后肠道菌群、miR-10a表达对微生态肠内营养干预效果的评估价值, 结果发现各指标评估干预效果的AUC均在0.7以上, 具有良好评估效能, 证实了笔者推测的正确性, 各指标中乳杆菌评估的AUC最大, 为0.78, 可为临床评估微生态肠内营养干预疗效提供更准确参考. 本研究还发现, 年龄>60岁、DUKE分期为C、D期均为微生态肠内营养干预疗效不良的危险因素, 因此对于老年、DUKE分期较高的结直肠癌患者, 临床应给予足够重视, 加强术后微生态肠内营养干预, 尽量纠正肠道菌群失调.
综上可知, 结直肠癌根治术后肠道菌群、miR-10a表达变化是发生肠道菌群失调的影响因素, 采用微生态肠内营养干预在改善肠道菌群、miR-10a表达方面具有良好效果, 干预后通过检测肠道菌群、miR-10a表达可辅助临床评估干预效果, 具有较高临床应用价值. 但本研究收集的病例数有限, 研究结果可能存在一定偏倚, 后续工作中仍需纳入更多病例进一步验证.
结直肠癌为临床常见恶性肿瘤, 近年来其发病率逐渐升高, 本研究主要探讨直肠癌根治术后肠道菌群失调、基因表达变化, 以期获得指导术后干预的指标.
随着直肠癌患者的增加, 直肠癌根治术随之增多, 本研究主题为探究手术引起的肠道菌群失调、基因表达变化情况, 并分析其在微生态肠内营养干预效果的关系, 以期明确肠道菌群、相关基因表达变化情况在指导干预措施制定方面的指导价值.
本研究主要目标为分析结直肠癌根治术后肠道菌群、微小RNA-10a(microRNA-10a, miR-10a)表达变化情况, 并分析微生态肠内营养干预的作用, 旨在为结直肠癌根治术后干预措施的制定提供参考.
本研究选取我院107例结直肠癌根治术患者, 根据其术后肠道菌群情况分组, 所有患者均于结直肠癌根治术后2 wk取中段、新鲜粪便标本及血清标本, 检测术后2周肠道菌群及血清miR-10a水平, 通过对比不同肠道菌群情况患者肠道菌群、miR-10a表达变化, 分析肠道菌群、miR-10a表达与肠道菌群失调的关系, 并对肠道菌群紊乱患者予以微生态肠内营养干预, 对比干预前后患者肠道菌群、miR-10a表达, 不同疗效患者临床资料、肠道菌群、miR-10a表达, 分析微生态肠内营养干预疗效影响因素, 通过ROC曲线分析肠道菌群、miR-10a表达对微生态肠内营养干预疗效的评估价值, 采用Pearson相关系数模型分析肠道菌群失调患者肠道菌群、miR-10a表达相关性.
本研究通过实验达到了主要目标, 结果发现: (1)结直肠癌根治术后菌群正常患者乳酸杆菌、双歧杆菌、真杆菌菌群菌落数、miR-10a表达均高于菌群失调Ⅰ度、Ⅱ度患者, 菌群失调Ⅰ度患者高于菌群失调Ⅱ度患者, 肠球菌均低于菌群失调Ⅰ度、Ⅱ度患者, 菌群失调Ⅰ度患者低于菌群失调Ⅱ度患者(P<0.05); (2)随着乳酸杆菌、双歧杆菌、真杆菌菌群菌落数、miR-10a表达降低、肠球菌菌群菌落数升高, 结直肠癌根治术后肠道菌群失调发生风险升高(P<0.05); (3)肠道菌群紊乱患者微生态肠内营养干预后乳杆菌、双歧杆菌、真杆菌菌群菌落数及miR-10a均高于干预前, 肠球菌菌群菌落数低于干预前(P<0.05); (4)疗效良好患者年龄≤60岁占比、DUKE分期A、B期占比、干预后乳酸杆菌、双歧杆菌、真杆菌菌群菌落数、miR-10a表达均高于疗效不良患者, 干预后肠球菌低于疗效不良患者(P<0.05); (5)年龄、DUKE分期、干预后乳酸杆菌、双歧杆菌、肠球菌及真杆菌菌群菌落数、miR-10a表达均与微生态肠内营养干预疗效显著相关(P<0.05); (6)干预后肠道菌群、miR-10a表达评估微生态肠内营养干预效果的曲线下面积(AUC)均>0.7, 其中乳杆菌评估的AUC最大, 为0.784, 截断值下评估敏感度、特异度分别为64.71%、84.44%; (7)肠道菌群失调患者微生态肠内营养干预后乳杆菌、双歧杆菌、真杆菌菌群菌落数与miR-10a呈正相关, 肠球菌菌群菌落数与miR-10a呈负相关(P<0.05).
结直肠癌根治术后肠道菌群、miR-10a表达变化是发生肠道菌群失调的影响因素, 采用微生态肠内营养干预在改善肠道菌群、miR-10a表达方面具有良好效果.
本研究收集的病例数有限, 研究结果可能存在一定偏倚, 后续工作中仍需纳入更多病例进一步验证. 未来我们将探究检测肠道菌群、miR-10a表达在辅助临床评估干预效果方面的价值, 可通过设计对比试验进行探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394:1467-1480. [PubMed] [DOI] |
| 2. | 高 乐, 于 树青, 杨 继春, 马 峻岭, 詹 思延, 孙 凤. 全球结直肠癌筛查指南的质量评价. 北京大学学报(医学版). 2019;51:548-555. [DOI] |
| 12. | Han S, Gao J, Zhou Q, Liu S, Wen C, Yang X. Role of intestinal flora in colorectal cancer from the metabolite perspective: a systematic review. Cancer Manag Res. 2018;10:199-206. [PubMed] [DOI] |
| 13. | Xu Q, Xu P, Cen Y, Li W. Effects of preoperative oral administration of glucose solution combined with postoperative probiotics on inflammation and intestinal barrier function in patients after colorectal cancer surgery. Oncol Lett. 2019;18:694-698. [PubMed] [DOI] |
| 16. | Reis SAD, da Conceição LL, Peluzio MDCG. Intestinal microbiota and colorectal cancer: changes in the intestinal microenvironment and their relation to the disease. J Med Microbiol. 2019;68:1391-1407. [PubMed] [DOI] |
| 19. | 吴 江, 阿里木江·阿不都热合曼, 庞澜, 朱勇荷, 马秀英, 陈鹏, 张荔霜, 岳 跃明. 抑癌因子miR-10a抑制Tiam1表达对胃癌细胞凋亡和迁移的影响. 现代生物医学进展. 2020;20:2830-2837+2867. |
| 20. | Mu H, Xiang L, Li S, Rao D, Wang S, Yu K. MiR-10a functions as a tumor suppressor in prostate cancer via targeting KDM4A. J Cell Biochem. 2019;120:4987-4997. [PubMed] [DOI] |
| 21. | Wang J, Liu Y, Li Y, Zheng X, Gan J, Wan Z, Zhang J, Liu Y, Wang Y, Hu W, Li Y, Liu Y. ExosomalmiR10a derived from colorectal cancer cells suppresses migration of human lung fibroblasts, and expression of IL6, IL8 and IL1β. Mol Med Rep. 2021;23:1. [PubMed] [DOI] |