修回日期: 2021-03-08
接受日期: 2021-04-02
在线出版日期: 2021-06-08
乳糖酶作为肠道重要的功能酶之一, 其活性的表达与腹泻密切相关. 中药治疗腹泻性疾病具有独特优势, 中药治疗腹泻的疗效机制至今尚不明确. 本文探究不同因素诱导下的腹泻与肠道乳糖酶活性的关系, 中药治疗腹泻与肠道乳糖酶活性的关系, 发现不同因素诱导的腹泻会降低肠道乳糖酶活性, 中药治疗后提高肠道乳糖酶活性水平. 肠道乳糖酶活性的提高与中药作用于肠道黏膜与肠道菌群, 帮助修复肠道黏膜、调整肠道菌群有关, 中药或许能调控乳糖酶细菌基因的表达提高肠道乳糖酶活性, 具体机制值得进一步研究.
核心提要: 本文通过综述腹泻与乳糖酶活性变化的关系, 以及中药疗效发挥与乳糖酶活性表达的关系. 发现不同因素诱导的腹泻存在不同程度的肠道黏膜损伤与肠道菌群紊乱, 与乳糖酶活性的差异表达有关, 而中医中药治疗能恢复或提高肠道乳糖酶的表达, 这或许与中药与肠道黏膜、肠道菌群相互作用相关; 此外发现对细菌乳糖酶基因的研究值得进一步深入.
引文著录: 吴仪, 谭周进. 腹泻与肠道乳糖酶活性的关系研究进展. 世界华人消化杂志 2021; 29(11): 571-576
Revised: March 8, 2021
Accepted: April 2, 2021
Published online: June 8, 2021
Lactase is one of the most important functional enzymes in the intestine, and it is closely related to diarrhea. Traditional Chinese medicine (TCM) has unique advantages in the treatment of diarrhea, but its curative effect mechanism on diarrhea is still unclear. In this paper, we discuss the relationship between diarrhea caused by different factors and intestinal lactase activity, and the relationship between diarrhea treatment by TCM and intestinal lactase activity. The activity of lactase in the intestinal tract can be increased by TCM, because TCM is helpful to repair the intestinal mucosa and regulate intestinal microbiota. TCM may improve the activity of intestinal lactase by regulating bacterial gene expression of lactase, and its specific mechanism is worthy of further study.
- Citation: Wu Y, Tan ZJ. Relationship between diarrhea and intestinal lactase activity. Shijie Huaren Xiaohua Zazhi 2021; 29(11): 571-576
- URL: https://www.wjgnet.com/1009-3079/full/v29/i11/571.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i11.571
乳糖酶, 又称β-半乳糖苷酶, 是肠道重要的功能酶之一, 能分解乳糖成单糖为机体供能, 也可将乳糖催化成低聚半乳糖, 促进肠道益生菌增殖, 对维持肠道健康有重要意义. 乳糖酶主要由小肠绒毛刷状缘及肠道细菌分泌, 与腹泻密切相关. 研究表明, 机体缺乏乳糖酶时会出现乳糖不耐受的症状, 如严重的腹泻、腹胀、排气增多等, 或伴有呕吐、乳酸尿症, 严重者可出现脱水、酸中毒、营养不良及生长障碍等. 中医中药治疗腹泻效果明显, 本课题组发现对使用抗生素后的慢性腹泻, 中药治疗有较大的优势. 中药可能通过改善肠道黏膜屏障、调节肠道菌群, 提高肠道乳糖酶活性, 中药对腹泻疗效与乳糖酶基因的关系值得进一步探究. 故本文论述不同原因导致的腹泻与肠道乳糖酶活性表达的关系, 以及中药治疗腹泻的疗效与肠道乳糖酶活性表达之间的关系.
乳糖是人乳中存在的唯一双糖, 由半乳糖和葡萄糖通过1,4-糖苷键的表达更科学连接而成, 是绒毛刷状缘表达的乳糖酶-根皮苷水解酶(lactase-phlorizinhydrolase, LPH)的主要底物, 在肠黏膜呈灶块状分布, 在空肠中部表达最高. 乳糖酶又称为β-半乳糖苷酶、乳糖酶-根皮苷水解酶, 由两条相同的胞外160 kDa多肽链和一个短的胞质内部分组成. 乳糖酶的α-葡萄糖苷酶活性将乳糖分解成单糖葡萄糖和半乳糖, 然后由钠(+)/葡萄糖(半乳糖)共转运蛋白(Na+/glucose cotransporter, SGLT1)主动转运到上皮细胞(肠细胞)中[1], 此外乳糖酶具有转糖基活性,可将乳糖催化形成低聚半乳糖[2].
人体肠道乳糖酶主要来源于以下3个途径: (1)主要由宿主乳糖酶基因合成, 分布在小肠绒毛刷状缘的黏膜表面; (2)肠道菌群能少量合成乳糖酶, 如双歧杆菌、乳杆菌、大肠杆菌, 酵母菌和霉菌; (3)服用外源乳糖酶补充[3,4]. 因此, 乳糖酶以人体胃肠黏膜(gastrointestinal mucosa, GIT)分泌为主, 同时也由肠道微生物所分泌. 乳糖酶宿主基因与微生物的互作经历了长久的过程. 首先在宿主基因不断地选择压力下, 由乳糖不持久性(lactase non persistence, LNP)变为乳糖持久性(lactase persistence, LP), 同时宿主基因会优先与有益的微生物合作. 最初的自然条件下, 人乳是乳糖唯一的来源, 乳糖酶基因会在断乳后逐渐关闭[5], 但畜牧业发展以来人类能更普遍的摄入含乳糖制品, 掀起了肠道内部一场巨变. 在没有LP等位基因的情况下, 代谢乳糖的细菌发挥了分解乳糖的巨大作用[6], 后来有益的宿主等位基因才出现并取代了微生物群功能, 并在部分人体内稳定下来[7,8]. 但这种分布具有种族与地域差异, 西欧及高加索地区的人更多的携带了乳糖酶基因, 而亚洲人则普遍缺乏. 另一方面, 肠道内微生物仍在发挥着乳糖代谢的作用, 双歧杆菌[9,10]、乳杆菌、大肠杆菌、酵母菌和霉菌是主要产乳糖酶的菌种. 虽然微生物代谢乳糖产能较少, 且乳糖酶在GIT分泌为主, 宿主与微生物间存在乳糖酶位点竞争关系, 但微生物产乳糖酶可以减少乳糖酶基因型之间的适应性差异, 减轻LP等位基因的选择压力, 从而保持人群中乳糖酶基因的多样性. 综上所述, 乳糖酶活性表达与机体肠道黏膜完整情况及细菌多样性相关.
乳糖酶作为重要的肠道功能酶之一, 与腹泻密切相关. 腹泻过程中普遍存在肠道黏膜破坏、菌群失调、胃肠动力障碍等肠道失调机制. 肠道黏膜受损, 刷状缘表达的乳糖酶水平降低, 或正常肠道菌群构成的破坏, 产肠道乳糖酶菌株受到抑制, 都会降低乳糖酶活性. 此外破坏或抑制乳糖酶基因的表达也会降低肠道乳糖酶活性. 经过课题组的研究, 发现不同干预因素(包括药物、饮食、温度湿度等)诱导的腹泻乳糖酶的表达有差异.
1.2.1 药物诱导的腹泻与肠道乳糖酶活性: 抗生素抗生素相关性腹泻(antibiotic-associated diarrhea, AAD)是临床使用抗生素治疗最容易发生的不良反应之一, AAD主要与黏膜的破坏和肠道微生物组成及功能失调有关. 如表1[11-16]中所示, 我们的前期研究证明使用混合抗生素溶液灌胃后小鼠肠道内容物及黏膜乳糖酶活性自第一天开始下降, 直至第5天差异达到极致[11]. 杨春富等[16]发现婴幼儿肺炎用药后尿半乳糖含量或活性下降, 乳糖不耐受阳性率达81.8%. 进一步对AAD小鼠肠道内容物及肠道黏膜细菌进行16Sr RNA测序, 结果表明抗生素降低了肠道细菌多样性, 尽管抗生素处理后杀死一些致病菌, 如支原体和幽门螺旋杆菌, 但更为严重的是抗生素导致了变形菌门的扩张[17,18]. 据报道[19], 变形菌门近来被证明可作为肠道上皮功能障碍的诊断特征, 肠道炎症或抗生素处理可增加结肠上皮的氧化作用, 从而破坏厌氧环境, 驱动兼性厌氧的变形菌门的扩张. 过量混合抗生素的使用降低了肠道乳酸杆菌的丰度, 减弱了肠道黏膜的定植抗力, 增加其他机会致病菌对肠道黏膜的破坏作用(如肠球菌属及梭菌属), 降低肠道黏膜乳糖酶活性. 另一方面, 混合抗生素导致了肠道内容物菌群失调[17], 降低了肠道内容物乳酸菌丰度、减少了肠道乳酸杆菌数量[20], 并通过抑制乳糖酶产生菌而降低乳糖酶活性.
课题组对细菌乳糖酶基因的研究发现了抗生素可能通过破坏或抑制肠道内容物乳糖酶基因的形成与表达, 降低细菌乳糖酶基因的多样性[21]; 黏膜细菌乳糖酶基因多样性增加, 可能与黏膜结构被破坏, 肠道定植抗力减弱, 大量菌群迁移至黏膜层有关[22]. 我们的研究证明抗生素的使用并未影响小鼠细菌乳糖酶基因13910位点多态性[23].
总之, 过量混合抗生素的使用破坏了肠道黏膜屏障, 改变了菌群在黏膜与内容物中的构成, 增加了细菌的多样性, 但减少了产乳糖酶关键菌群的菌群. 乳糖酶以黏膜分泌为主, 故肠道黏膜的破坏是抗生素导致乳糖酶活性下降的主要原因. 抗生素的使用会影响细菌乳糖酶基因多样性, 但具体机制需进一步研究.
番泻叶诱导腹泻的肠道机理主要是减少对水、电解质的吸收造成肠道非推进性收缩增强, 以及改变肠道微生物菌群与代谢[24]. 本课题发现番泻叶能明显抑制肠道内容物乳糖酶活性, 而对肠道黏膜乳糖酶活性没有影响, 这可能是因为番泻叶致泻并非明显的损伤了肠道黏膜, 所以对肠道黏膜乳糖酶并无影响[15].
1.2.2 环境因素诱导的腹泻与肠道乳糖酶活性水平相关性: 多项研究证明, 环境因素与物种基因是影响肠道菌群的重要因素, 在同一物种中环境因素对肠道菌群的影响, 甚至比宿主自身因素(年龄/性别)更显著. 这种环境因素包括季节气候、居住条件、地域、食物构成等[25,26]. 中医泄泻是以排便次数增多, 粪质溏薄或完谷不化, 甚至泻出如水样为主症的病证. 从病因学角度, 中医认为外感寒湿或湿热之邪, 饮食不当, 脾虚体质, 情志变化等都是引起泄泻的重要因素. 从微生物学角度来看, 这些因素都能对肠道菌群产生影响.
温度、湿度、饮食都是影响机体肠道菌群的重要因素, 温热环境增强了菌群的多胺生物合成, 使乙酰亚精胺和腐胺等多胺水平升高[27]. 短暂的高糖饮食虽然不会促进小鼠肠炎的形成, 但会改变肠道菌群的构成, 增加黏液降解细菌, 削弱肠道黏液屏障[28]. Tian等人[29]发现高温环境下的绍兴鸭肠道内乳酸杆菌为优势菌属; 惠华英等[12]通过"高糖高脂+高温高湿+白酒+冰水"的复合因素模拟中医肠道湿热证泄泻, 发现高脂高糖饮食损伤肠道黏膜, 降低了肠道黏膜酶活性(表1), 同时多种复合因素下改变了肠道菌群的构成, 提高了肠道微生物产乳糖酶的能力, 促细菌产乳糖酶的主要影响因素为高脂高糖饮食.
由上可知, 腹泻与肠道乳糖酶活性具有相关性, 且与乳糖酶活性下降成呈正相关. AAD对肠道黏膜及肠道菌群的损伤最严重, 降低了小肠黏膜与内容物的乳糖酶活性; 环境与饮食诱导的腹泻与乳糖酶关系密切, 主要降低了肠道内容物乳糖酶活性; 番泻叶诱导的腹泻主要降低了肠道黏膜乳糖酶活性. 这提示我们不同因素诱导的腹泻与乳糖酶活性降低相关, 且具体因素影响下的活性变化有区别.
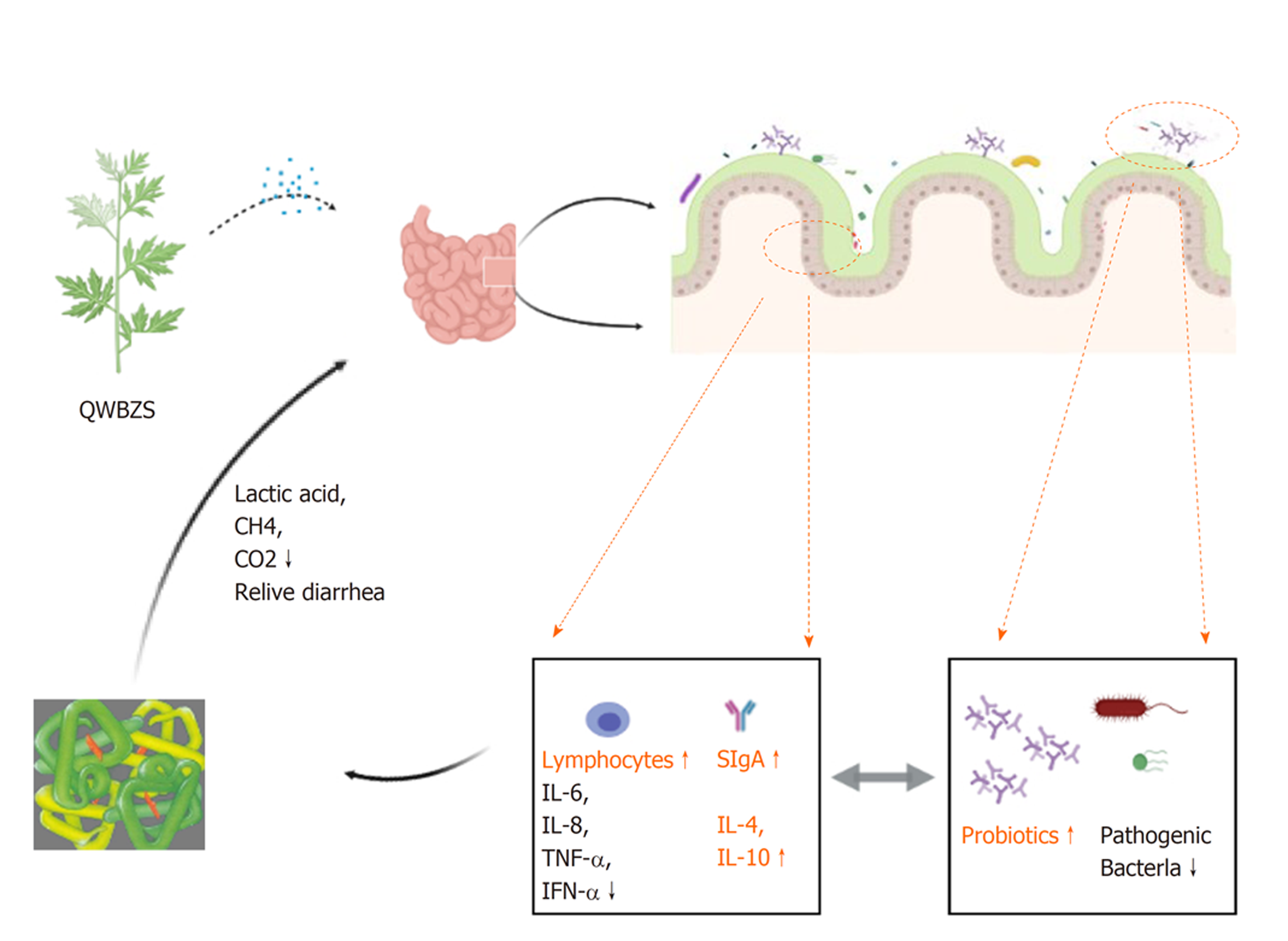
中医药对腹泻具有明显的治疗优势, 但其疗效机制尚不明确, 尤其中医学认为腹泻具有不同的方证, 这使研究变得更加复杂. 贺璐等[30]认为中草药对肠道消化酶水平具有调控作用, 主要是通过修复肠道黏膜损伤、改善肠道环境及调整肠道微生物调节肠道消化酶活性水平. 表2[12-14,31-32]说明了中药对肠道乳糖酶具有调控作用, 中医药治疗腹泻后肠道乳糖酶活性会明显提高. 从消化酶活性水平着手, 探究中药对泄泻的肠道疗效机制及微生态调节机制具有创新性, 根据课题组实验结果表明, 中药提高腹泻下肠道乳糖酶的活性可能通过以下两个主要途径: 肠道黏膜修复与肠道菌群调整(图1).
肠道黏膜是饮食消化吸收的重要场所, 同时也是肠道免疫的重要防线. 一旦肠黏膜屏障受损, 肠上皮细胞间的完整连接结构受损, 肠上皮通透性增加. 宿主乳糖酶主要由肠黏膜上皮细胞分泌, 因此黏膜乳糖酶的活性高低与肠道黏膜的损伤状态密切相关. 惠华英等[31]证明七味白术散能恢复且提高AAD小鼠肠道黏膜乳糖酶活性, 吴仪等[32]使用痛泻要方治疗肝气乘脾泄泻小鼠, 发现中药组小鼠肠黏膜乳糖酶、蔗糖酶等二糖酶活性明显提高, 对治疗腹泻具有一定作用. 肠黏膜上肥大细胞活化分数反映肠道黏膜炎症, 研究证明痛泻要方能降低肥大细胞活化分数, 帮助修复肠黏膜[33]. 蛋白酶激活受体2是一种丝氨酸蛋白酶受体, 广泛分布于肠上皮细胞上. 肠道PAR-2受体信号与肠上皮细胞屏障损伤密切相关. 谭许鹏等发现痛泻要方及防风能改善肠上皮Caco-2细胞屏障, 这与方中有效活性成分如槲皮素等密切相关. 惠华英等[12]实验证明, 葛根芩连汤明显提高了肠道湿热证泄泻小鼠肠道黏膜乳糖酶活性, 能促进肠道黏膜分泌乳糖酶, 这与葛根芩连汤参与修复肠黏膜屏障有关. 张宁等[34]实验证明加味葛根芩连汤明显降低黏膜低氧诱导因子-1α(HIF-1α)、二胺氧化酶(DAO)、D-乳酸(D-LA), 对重度湿热型溃疡性结肠炎具有黏膜修复的作用.
中药所含成分非常复杂, 除含有大量的活性成分外, 还有多糖、蛋白质、脂类等大分子物质及微生物、微量元素等. 中药成分进入肠道后, 某些机体无法消化的物质需要肠道内庞大的微生物参与, 这些成分会直接刺激对应菌群的增长, 从而改变肠道菌群的构成, 调整肠道菌群的平衡. 厚壁菌门是产乳糖酶的主要菌门[35], Akkermansia muciniphila (Akk菌)、肠道乳酸杆菌及肠道共生的多形拟杆菌(Bacteroides thetaiotaomicron, BT)也被证实能产生β-半乳糖苷酶[36,37]. 研究证明[20], QWBZS能增加AAD小鼠黏膜乳酸菌和拟杆菌S24-7的丰度, 抑制内容物中拟杆菌和Ochrobactrum的增长, 增加Osillospir, Dorea, Coprococcus and Blautia丰度, 调整肠道菌群的结构分布及多样性; 葛根芩连汤通过增加乳酸菌的数量, 缓解AAD; 痛泻要方能促进益生菌的增长和抑制病原菌、条件致病菌(普雷沃氏菌和理研菌、肠杆菌等)[38]; 四君子汤能增加小鼠肠道内乳酸杆菌和双歧杆菌的数量[39]. FDA法测定肠道总微生物活性简便快捷, 能迅速地反应肠道内微生物的活跃程度, 实验证明痛泻要方能提高肝气乘脾泄泻小鼠的肠道微生物活度, 说明中药能整体提高肠道内酶活性水平[40].
β-半乳糖苷酶基因编码是由4个亚基组成的四聚体. 从不同物种提取的β-半乳糖苷酶的蛋白质序列有着较高的同源性和相似性. 人体胃肠道微生物组蕴含着丰富的微生物酶类基因资源, 共有基因支持着微生物日常生存的基本功能, 如酶的消耗和分解, 能量转换和代谢[41]. 乳糖酶基因的多样性可为物种进化提供材料,从而提高乳糖酶的催化效率. 中药能调控乳糖酶活性治疗腹泻, 在酶量及酶基因表达水平都有可能发挥作用. 从乳糖酶基因的表达水平有助于深入认识中药的疗效机制[31].
哺乳动物乳糖酶基因存在多个单核苷酸多态性(single nucleotide polymorphism, SNP)位点, 其基因多态性与乳糖酶活性存在显著相关性. 课题组研究证明与QWBZS对AAD疗效的发挥与乳糖酶基因13910位点多态性没有相关性, 可能存在其他多态性位点或其他方面的调控机制[23]. 此外, 我们的研究表明QWBZS能促进肠道黏膜乳糖酶基因的多样性恢复至正常水平, 同时QWBZS能调节肠道黏膜细菌的构成, 说明QWBZS主要通过改变细菌的结构, 帮助修复肠屏障黏膜, 调节乳糖酶活性治疗腹泻[42]. QWBZS处理没有增加细菌乳糖酶基因的多样性, 其对腹泻的疗效可能与其促进新的或一些关键的产乳糖酶菌株的生长有关[43].
不同的干预因素及中药治疗改变了肠道菌群的组成与特定肠道菌群, 尤其影响了产乳糖酶细菌. 不同的干预因素不同程度的降低了肠道内容物或黏膜的乳糖酶活性, 与肠道黏膜状态及肠道菌群的变化差异有关. 中药调控肠道黏膜以及肠道菌群, 提高肠道乳糖酶活性, 与腹泻的疗效成正相关. 乳糖酶基因表达水平及酶基因编码功能的研究需要进一步深入. 未来应该继续研究中药对腹泻疗效的物质基础, 重点是寻找不同干预因素下的与乳糖酶活性密切相关的肠道产乳糖酶细菌, 对细菌乳糖酶基因的研究值得进一步深入.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): E
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Chen L, Tuo B, Dong H. Regulation of Intestinal Glucose Absorption by Ion Channels and Transporters. Nutrients. 2016;8. [PubMed] [DOI] |
| 3. | Leis R, de Castro MJ, de Lamas C, Picáns R, Couce ML. Effects of Prebiotic and Probiotic Supplementation on Lactase Deficiency and Lactose Intolerance: A Systematic Review of Controlled Trials. Nutrients. 2020;12. [PubMed] [DOI] |
| 4. | Oak SJ, Jha R. The effects of probiotics in lactose intolerance: A systematic review. Crit Rev Food Sci Nutr. 2019;59:1675-1683. [PubMed] [DOI] |
| 6. | Ségurel L, Bon C. On the Evolution of Lactase Persistence in Humans. Annu Rev Genomics Hum Genet. 2017;18:297-319. [PubMed] [DOI] |
| 7. | Itan Y, Jones BL, Ingram CJ, Swallow DM, Thomas MG. A worldwide correlation of lactase persistence phenotype and genotypes. BMC Evol Biol. 2010;10:36. [PubMed] [DOI] |
| 8. | Sturm RA, Duffy DL. Human pigmentation genes under environmental selection. Genome Biol. 2012;13:248. [PubMed] [DOI] |
| 9. | Hove H, Nørgaard H, Mortensen PB. Lactic acid bacteria and the human gastrointestinal tract. Eur J Clin Nutr. 1999;53:339-350. [PubMed] [DOI] |
| 10. | Szilagyi A. Adaptation to Lactose in Lactase Non Persistent People: Effects on Intolerance and the Relationship between Dairy Food Consumption and Evalution of Diseases. Nutrients. 2015;7:6751-6779. [PubMed] [DOI] |
| 14. | 张 晓利, 王 迎春, 徐 倩倩, 王 丽叶, 霍 晓青, 曹 玲芝, 张 永辉, 董 世山. 白头翁复方对腹泻小鼠肠道粘膜乳糖酶活性的影响. 河北农业大学学报. 2010;33:99-102. [DOI] |
| 17. | Xie G, Tan K, Peng M, Long C, Li D, Tan Z. Bacterial diversity in intestinal mucosa of antibiotic-associated diarrhea mice. 3 Biotech. 2019;9:444. [PubMed] [DOI] |
| 18. | Shao H, Zhang C, Xiao N, Tan Z. Gut microbiota characteristics in mice with antibiotic-associated diarrhea. BMC Microbiol. 2020;20:313. [PubMed] [DOI] |
| 19. | Litvak Y, Byndloss MX, Tsolis RM, Bäumler AJ. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction. Curr Opin Microbiol. 2017;39:1-6. [PubMed] [DOI] |
| 20. | 刘 茜明, 杨 光勇, 何 光志, 田 维毅, 蔡 琨, 王 平, 黄 高, 梁 建东, 王 文佳. 葛根芩连汤对抗生素相关腹泻肠道乳酸杆菌属的影响研究. 家畜生态学报. 2016;37:74-78. |
| 21. | Long CX, He L, Guo YF, Liu YW, Xiao NQ, Tan ZJ. Diversity of bacterial lactase genes in intestinal contents of mice with antibiotics-induced diarrhea. World J Gastroenterol. 2017;23:7584-7593. [PubMed] [DOI] |
| 22. | Long C, Liu Y, He L, Tan Q, Yu Z, Xiao N, Tan Z. Bacterial lactase genes diversity in intestinal mucosa of mice with dysbacterial diarrhea induced by antibiotics. 3 Biotech. 2018;8:176. [PubMed] [DOI] |
| 23. | 龙 承星, 贺 璐, 刘 又嘉, 郭 艳芳, 于 子真, 任 婷, 谭 周进. 菌群失调腹泻造模及七味白术散治疗对小鼠乳糖酶基因13910多态性的影响. 中国微生态学杂志. 2017;29:766-770. [DOI] |
| 25. | Ren T, Boutin S, Humphries MM, Dantzer B, Gorrell JC, Coltman DW, McAdam AG, Wu M. Seasonal, spatial, and maternal effects on gut microbiome in wild red squirrels. Microbiome. 2017;5:163. [PubMed] [DOI] |
| 26. | Kers JG, Velkers FC, Fischer EAJ, Hermes GDA, Stegeman JA, Smidt H. Host and Environmental Factors Affecting the Intestinal Microbiota in Chickens. Front Microbiol. 2018;9:235. [PubMed] [DOI] |
| 27. | Chevalier C, Kieser S, Çolakoğlu M, Hadadi N, Brun J, Rigo D, Suárez-Zamorano N, Spiljar M, Fabbiano S, Busse B, Ivanišević J, Macpherson A, Bonnet N, Trajkovski M. Warmth Prevents Bone Loss Through the Gut Microbiota. Cell Metab. 2020;32:575-590.e7. [PubMed] [DOI] |
| 28. | Khan S, Waliullah S, Godfrey V, Khan MAW, Ramachandran RA, Cantarel BL, Behrendt C, Peng L, Hooper LV, Zaki H. Dietary simple sugars alter microbial ecology in the gut and promote colitis in mice. Sci Transl Med. 2020;12. [PubMed] [DOI] |
| 29. | Tian Y, Li G, Chen L, Bu X, Shen J, Tao Z, Zeng T, Du X, Lu L. High-temperature exposure alters the community structure and functional features of the intestinal microbiota in Shaoxing ducks (Anas platyrhynchos). Poult Sci. 2020;99:2662-2674. [PubMed] [DOI] |
| 35. | Wang W, Hu H, Zijlstra RT, Zheng J, Gänzle MG. Metagenomic reconstructions of gut microbial metabolism in weanling pigs. Microbiome. 2019;7:48. [PubMed] [DOI] |
| 36. | Kostopoulos I, Elzinga J, Ottman N, Klievink JT, Blijenberg B, Aalvink S, Boeren S, Mank M, Knol J, de Vos WM, Belzer C. Akkermansia muciniphila uses human milk oligosaccharides to thrive in the early life conditions in vitro. Sci Rep. 2020;10:14330. [PubMed] [DOI] |
| 37. | Gil-Cruz C, Perez-Shibayama C, De Martin A, Ronchi F, van der Borght K, Niederer R, Onder L, Lütge M, Novkovic M, Nindl V, Ramos G, Arnoldini M, Slack EMC, Boivin-Jahns V, Jahns R, Wyss M, Mooser C, Lambrecht BN, Maeder MT, Rickli H, Flatz L, Eriksson U, Geuking MB, McCoy KD, Ludewig B. Microbiota-derived peptide mimics drive lethal inflammatory cardiomyopathy. Science. 2019;366:881-886. [PubMed] [DOI] |
| 41. | Tierney BT, Yang Z, Luber JM, Beaudin M, Wibowo MC, Baek C, Mehlenbacher E, Patel CJ, Kostic AD. The Landscape of Genetic Content in the Gut and Oral Human Microbiome. Cell Host Microbe. 2019;26:283-295.e8. [PubMed] [DOI] |