修回日期: 2020-11-16
接受日期: 2020-11-26
在线出版日期: 2021-01-08
我国结肠癌发病率与死亡率逐年上升, 目前结肠癌的发病机制尚未阐明, LncRNA在结肠癌等肿瘤发生过程中可发挥重要调控作用, 其主要通过竞争性结合miRNA而发挥作用, 已知LncRNA LINC01224在肿瘤中可能发挥癌基因作用, 但LINC01224在结肠癌形成及发展过程中的作用机制尚未阐明.
探讨LncRNA LINC01224/miR-513b-5p对结肠癌细胞SW1116增殖、迁移、侵袭的影响及其可能作用机制.
采用qRT-PCR法检测癌旁组织与结肠癌组织中LINC01224、miR-513b-5p的表达量; si-NC、si-LINC01224、si-LINC01224与anti-miR-NC、si-LINC01224与anti-miR-513b-5p分别转染入人结肠癌细胞SW1116; 采用qRT-PCR法检测SW1116细胞中LINC01224、miR-513b-5p的表达量; 采用MTT实验检测细胞存活率; 应用流式细胞仪检测细胞周期; 采用Transwell小室实验检测细胞迁移及侵袭; 双荧光素酶报告实验检测LINC01224与miR-513b-5p的靶向关系; Western blot法检测E-cadherin、N-cadherin蛋白表达量.
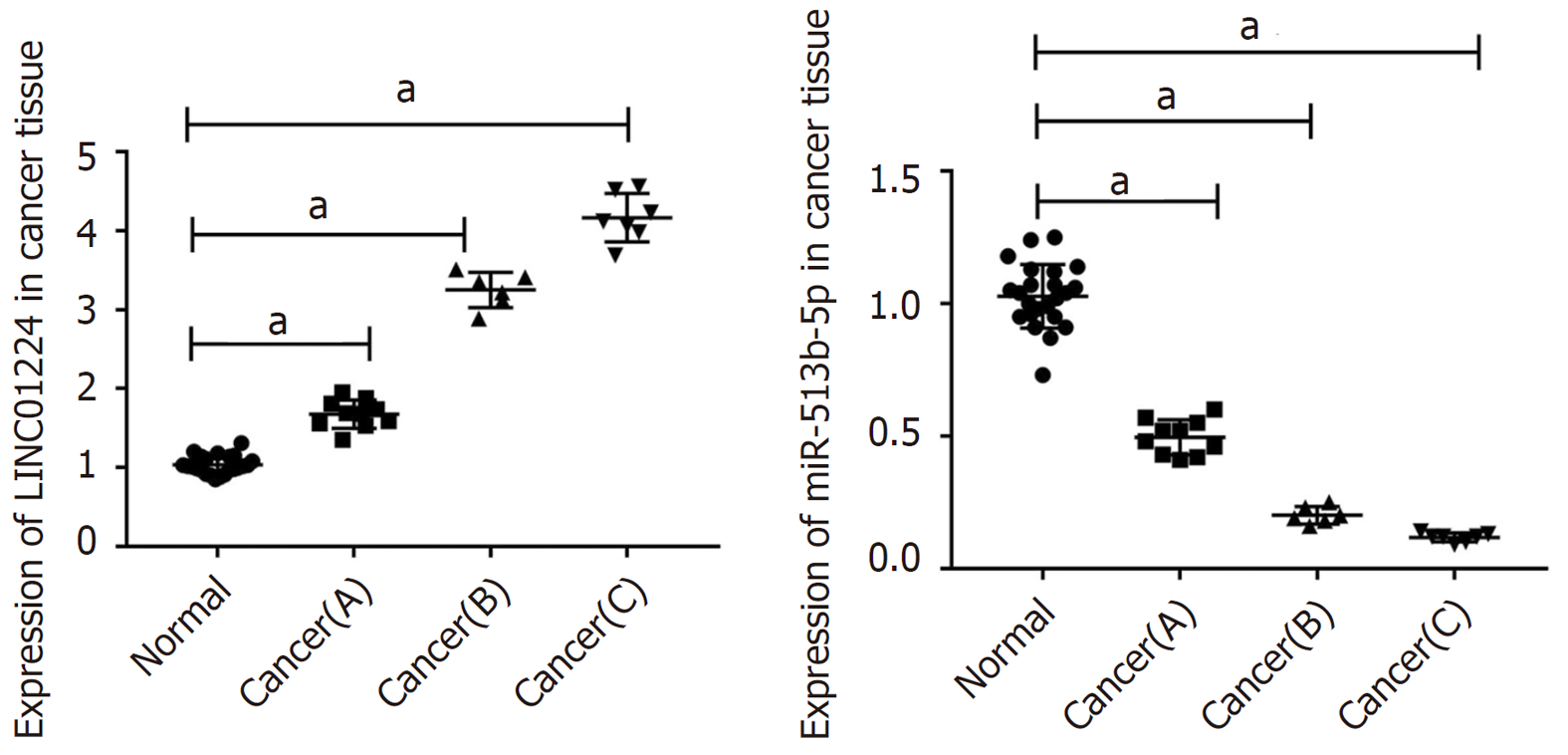
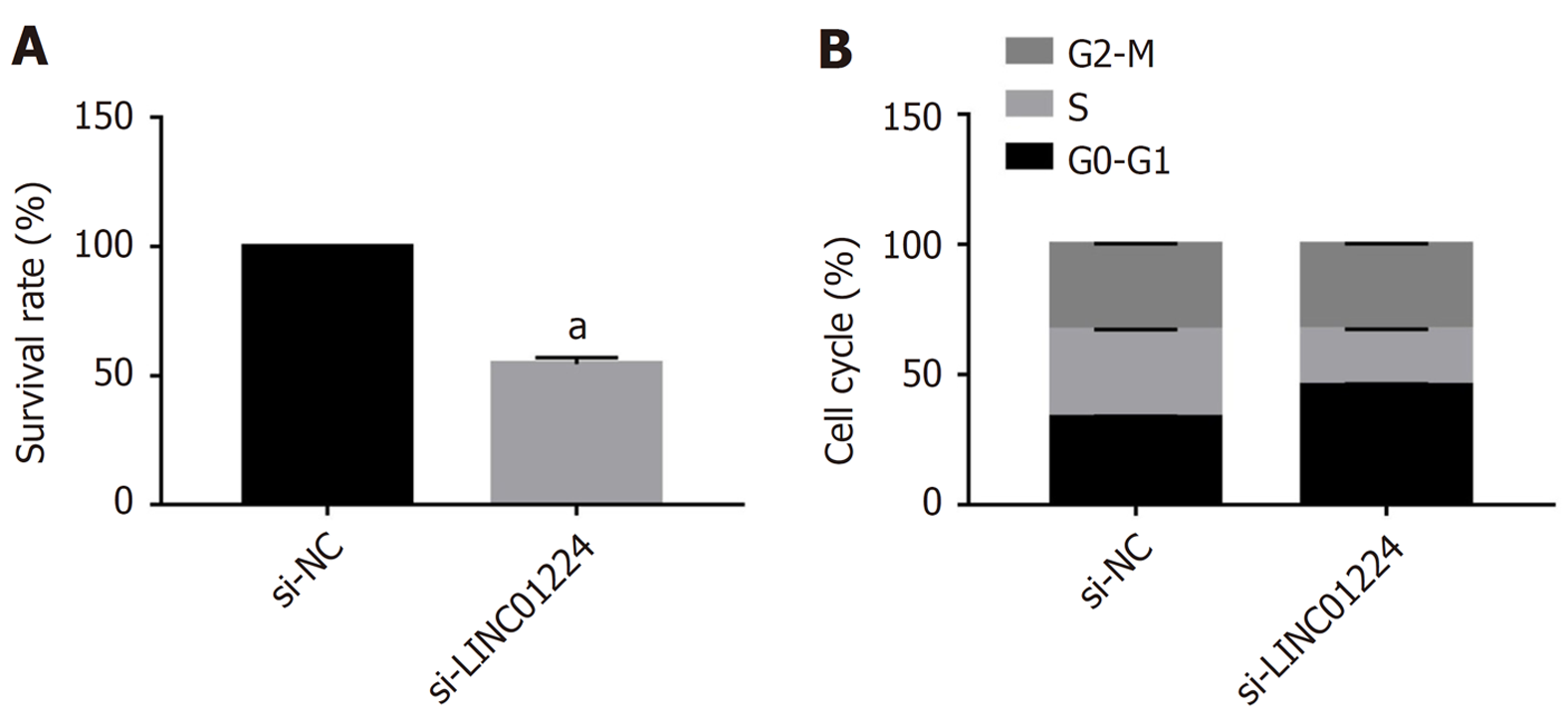
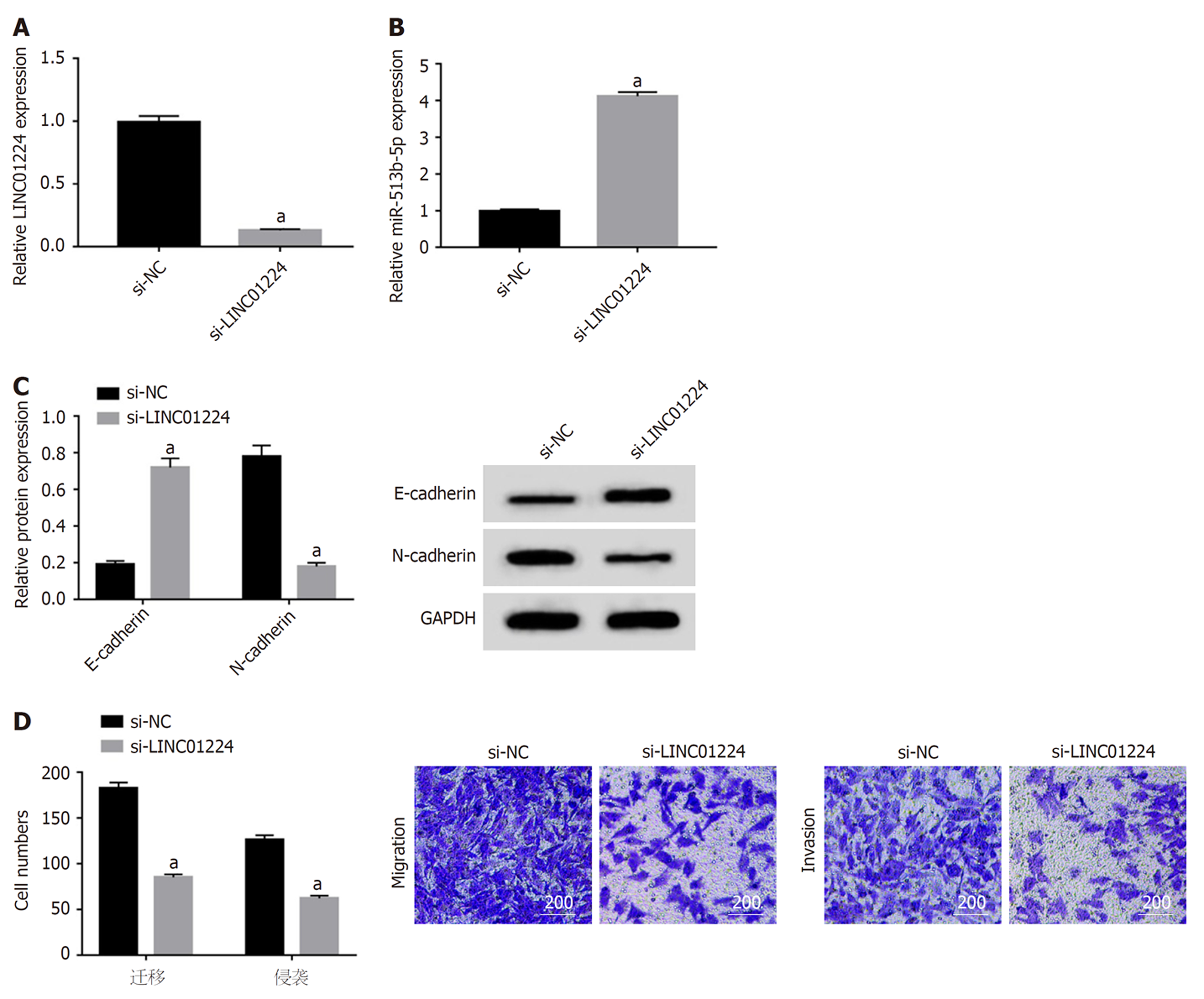
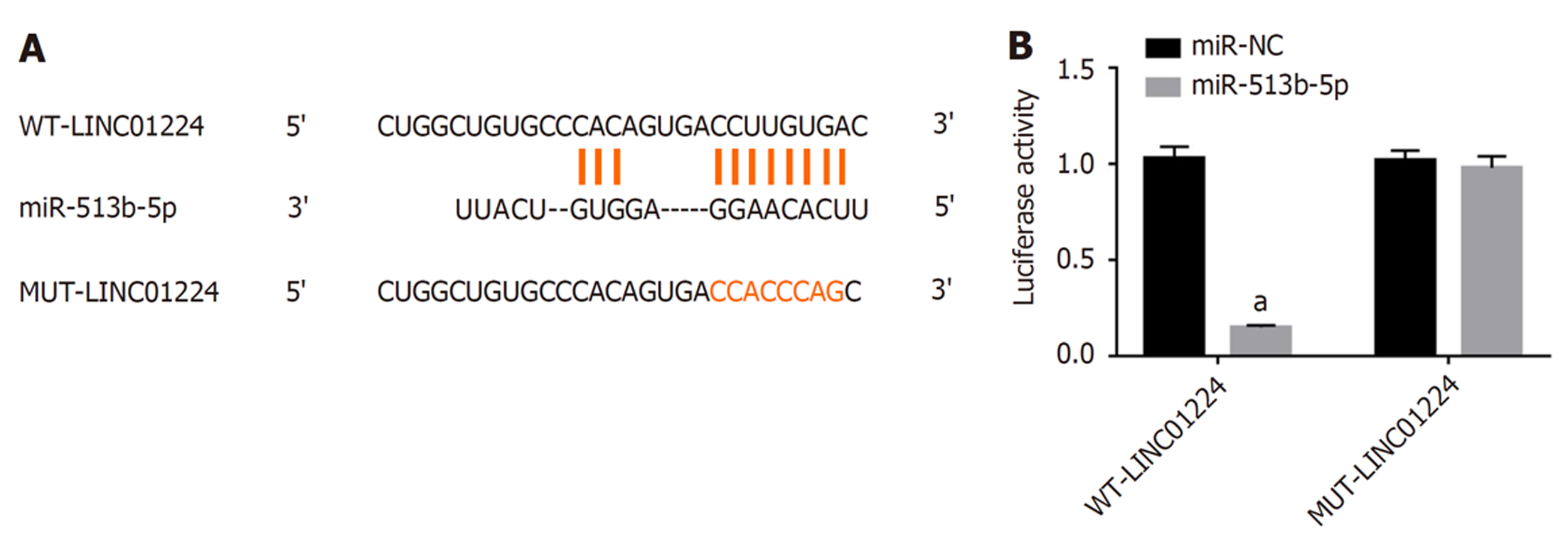
与癌旁组织比较, 结肠癌组织中LINC01224的表达水平升高(P<0.05), miR-513b-5p的表达水平降低(P<0.05); 与si-NC组比较, si-LINC01224组细胞存活率降低(P<0.05), G0-G1期细胞比例升高(P<0.05), S期细胞比例降低(P<0.05), 迁移及侵袭细胞数减少(P<0.05), E-cadherin蛋白水平升高(P<0.05), N-cadherin蛋白水平降低(P<0.05); 双荧光素酶报告实验证实LINC01224可靶向结合miR-513b-5p; 与si-LINC01224+anti-miR-NC组比较, si-LINC01224+anti-miR-513b-5p组细胞存活率升高(P<0.05), G0-G1期细胞比例降低(P<0.05), S期细胞比例升高(P<0.05), 迁移及侵袭细胞数增多(P<0.05), E-cadherin蛋白水平降低(P<0.05), N-cadherin蛋白水平升高(P<0.05).
干扰LINC01224表达可通过上调miR-513b-5p而减弱结肠癌细胞增殖、迁移及侵袭能力, 并可诱导细胞周期阻滞于G0-G1期.
核心提要: LINC01224在结肠癌中表达上调, 而miR-513b-5p则表达下调, LINC01224可吸附miR-513b-5p而负向调控miR-513b-5p的表达, 体外细胞实验证实干扰LINC01224表达可通过竞争性结合miR-513b-5p而调节结肠癌细胞增殖、迁移、侵袭、细胞周期过程, LINC01224可能作为结肠癌治疗的潜在靶点, 可为阐明结肠癌的发病机制及其治疗提供新方向.
引文著录: 张兆辉, 王利民. LncRNA LINC01224/miR-513b-5p对结肠癌细胞SW1116增殖、迁移及侵袭的影响. 世界华人消化杂志 2021; 29(1): 7-14
Revised: November 16, 2020
Accepted: November 26, 2020
Published online: January 8, 2021
The incidence and mortality of colon cancer in China are increasing year by year. At present, the pathogenesis of colon cancer has not been elucidated. Long non-coding RNAs (lncRNAs) play an important regulatory role in the occurrence of colon cancer and other tumors mainly by competitively binding microRNAs. It is known that the lncRNA LINC01224 may play an oncogenic role in tumors, but the mechanism of LINC01224 in the development and progression of colon cancer has not been elucidated.
To explore the effects of lncRNA LINC01224/miR-513b-5p on the proliferation, migration, and invasion of colon cancer SW1116 cells and the possible mechanism involved.
qRT-PCR was used to detect the expression of LINC01224 and miR-513b-5p in colon cancer and tumor adjacent tissues. si-NC, si-LINC01224, and si-LINC01224, as well as anti-miR-NC, si-LINC01224, and anti-miR-513b-5p were transfected into human colon cancer SW1116 cells. qRT-PCR was used to detect the expression of LINC01224 and miR-513b-5p in SW1116 cells. MTT assay was used to detect the cell survival rate. Flow cytometry was used to detect the cell cycle. Transwell assay was used to detect cell migration and invasion. The dual luciferase reporter assay was used to detect the targeting relationship between LINC01224 and miR-513b-5p. Western blot method was used to detect the expression of E-cadherin and N-cadherin proteins.
Compared with adjacent tissues, the expression level of LINC01224 in colon cancer tissues was increased (P < 0.05), and the expression level of miR-513b-5p was decreased (P < 0.05). Compared with the si-NC group, the survival rate of cells in the si-LINC01224 group was reduced (P < 0.05), the proportion of cells in the G0-G1 phase was increased (P < 0.05), the proportion of cells in the S phase was reduced (P < 0.05), the numbers of migrating and invasive cells were decreased (P < 0.05), the protein level of E-cadherin was increased (P < 0.05), and the protein level of N-cadherin was decreased (P < 0.05). The dual luciferase reporter assay confirmed that LINC01224 could target miR-513b-5p. Compared with the si-LINC01224 + anti-miR-NC group, the cell survival rate of cells in the si-LINC01224 + anti-miR-513b-5p group was increased (P < 0.05), the proportion of cells in the G0-G1 phase was decreased (P < 0.05), the proportion of cells was increased (P < 0.05), the numbers of migrating and invasive cells were increased (P < 0.05), the protein level of E-cadherin was decreased (P < 0.05), and the protein level of N-cadherin was increased (P < 0.05).
Interfering with the expression of LINC01224 reduces the proliferation, migration, and invasion of colon cancer cells by up-regulating miR-513b-5p, and induces cell cycle arrest in G0-G1 phase.
- Citation: Zhang ZH, Wang LM. Effects of lncRNA LINC01224/miR-513b-5p on proliferation, migration, and invasion of colon cancer SW1116 cells. Shijie Huaren Xiaohua Zazhi 2021; 29(1): 7-14
- URL: https://www.wjgnet.com/1009-3079/full/v29/i1/7.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i1.7
结肠癌是常见的一种恶性肿瘤, 我国结肠癌发病率与死亡率逐年上升, 已严重威胁人类生命安全, 目前结肠癌发病机制尚未阐明, 已有研究证实长链非编码RNA (LncRNA)在结肠癌等肿瘤发生过程中可能发挥重要调控作用, LncRNA MALAT1通过调节miR-129-5p/HMGB1轴诱导结肠癌的发展[1]. LncRNA HOTAIR通过下调miRNA-34a促进结肠癌的发展[2]. LncRNA CASC15通过调节miR-4310/LGR5/Wnt/β-catenin信号通路而促进结肠癌细胞的增殖和转移[3]. LncRNA FENDRR通过抑制SOX4而抑制结肠癌的进展[4]. LncRNA LINC01224在肝癌中呈高表达, 沉默LINC01224通过调控miR-330-5p/CHEK1表达而抑制肝癌的进展[5]. 但LINC01224在结肠癌发生及发展过程中的作用机制尚未阐明. 靶基因预测显示miR-513b-5p与LINC01224存在结合位点, miR-513b-5p通过靶向IRF2抑制睾丸胚胎癌细胞增殖[6]. 但LINC01224/miR-513b-5p对结肠癌细胞生物学行为的影响尚未阐明. 因此, 本研究主要探讨LINC01224与miR-513b-5p在结肠癌中的表达及其对结肠癌细胞SW1116增殖、迁移及侵袭的影响.
选取2018-05/2019-10期间本院收治的23例结肠癌患者为研究对象, 所有患者均经病理诊断为结肠癌, 其中男15例, 女8例, 年龄56-68岁, 平均年龄62.35岁±5.69岁, 术中切除结肠癌组织与癌旁组织后置于-80 ℃超低温冰箱内保存. 本研究经本院伦理委员会批准, 所有患者知情且签署同意书. 人结肠癌细胞SW1116购自上海研卉生物科技有限公司; DMEM培养基购自美国Gibco公司; 胎牛血清、Lipofectamine2000购自美国Thermo Fisher公司; Trizol试剂购自美国Invitrogen公司; 反转录与荧光定量PCR试剂购自北京天根生化科技有限公司; si-NC、si-LINC01224、miR-NC、miR-513b-5p mimics、anti-miR-NC、anti-miR-513b-5p购自广州锐博生物科技有限公司; Transwell小室购自美国Corning公司; MTT试剂、Matrigel基质胶购自北京索莱宝科技有限公司; 兔抗人E-cadherin、N-cadherin抗体购自美国Santa Cruz公司; 辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉艾美捷科技有限公司.
1.2.1 实验分组: 使用不含胎牛血清的细胞培养液与si-NC、si-LINC01224、si-LINC01224与anti-miR-NC、si-LINC01224与anti-miR-513b-5p混合后室温孵育5 min (A液), Lipofectamine2000转染试剂与不含胎牛血清的细胞培养液充分混合(B液), A液与B液充分混匀后室温孵育20 min, 并将其加入SW1116细胞, 转染6 h弃上清液后更换含10%胎牛血清、100 U/mL青霉素与100 μg/mL链霉素的DMEM培养液后继续培养48 h, 分别记为si-NC组、si-LINC01224组、si-LINC01224+anti-miR-NC组、si-LINC01224+anti-miR-513b-5p组.
1.2.2 qRT-PCR检测LINC01224、miR-513b-5p的表达水平: 采用Trizol法提取癌旁组织、结肠癌组织及各组SW1116细胞总RNA, 应用紫外分光光度计测定RNA浓度. 反转录体系: 5×g DNA Buffer 2 μL, 10×King RT Buffer 2 μL, FastKing RT Enzyme Mix 1 μL, FQ-RT Primer Mix 2 μL, RNA(2 μg), RNase-Free ddH2O补足体系至20 μL; 反应条件: 42 ℃ 15 min, 95 ℃ 3 min. 以cDNA为模板进行qRT-PCR反应, 参照荧光定量PCR试剂说明书配置反应体系与设置反应条件, 应用罗氏LightCycler480荧光定量PCR仪检测LINC01224、miR-513b-5p相对表达量. LINC01224正向引物5'-TGACACTTCTTGCCTGCAAC-3', 反向引物5'-ACTTCTGCTTCCCGAGTTCA-3'; miR-513b-5p正向引物5'-TGACACTTCTTGCCTGCAAC-3', 反向引物5'-ACTTCTGCTTCCCGAGTTCA-3'; U6正向引物5'-ATTGGAACGATACAGAGAAGATT-3', 反向引物5'-GGAACGCTTCACGAATTTG-3'; GAPDH正向引物5'-AACGGATTTGGTCGTATTG-3', 反向引物5'-GGAAGATGGTGATGGGATT-3'.
1.2.3 MTT检测细胞增殖: SW1116细胞(1×105个/mL)接种于96孔板(100 μL/孔), 每孔加入MTT溶液20 μL后置于培养箱内孵育4 h, 弃上清后加入DMSO (150 μL/孔) , 室温孵育5 min后应用酶标仪检测各孔吸光度值并计算细胞存活率[实验组OD值/对照组OD值×100%].
1.2.4 检测细胞周期: 收集各组SW1116细胞(1×105个/mL)后加入预冷PBS洗涤, 3000 r/min转速离心5 min后弃上清, 加入预冷PBS (500 μL)重悬细胞, 加入预冷70%乙醇(3.5 mL), 充分混匀后置于4 ℃冰箱内孵育24 h, 弃上清, 采用PBS洗涤后再次弃上清, 向细胞沉淀中加入RNaseA (50 μL)后水浴30 min (37 ℃), 加入PI染色液(450 μL)染色30 min (4 ℃), 应用流式细胞仪检测细胞周期.
1.2.5 Transwell实验检测细胞迁移与侵袭: 各组SW1116细胞(1×105个/mL)加入小室(6.5 mm 0.33 cm2 0.4 μm 24孔板)的上室(200 μL/孔), 下室加入含10%胎牛血清的培养液(600 μL/孔), 将其置于培养箱内孵育24 h后使用PBS洗涤, 经过多聚甲醛(20 min)与0.1%结晶紫染液处理(10 min), 观察迁移细胞数. 使用培养液稀释Matrigel基质胶后加入小室的上室(40 μL/孔), 将其置于培养箱内孵育5 h后加入各组SW1116细胞, 后续实验步骤同上, 观察侵袭细胞数.
1.2.6 双荧光素酶报告基因检测LINC01224与miR-513b-5p: LncBase v.2预测显示LINC01224与miR-513b-5p存在结合位点, 并应用基因突变技术将结合位点进行突变, 含有结合位点与突变位点的序列插入荧光素酶报告基因载体分别构建野生型载体WT-LINC01224与突变型载体MUT-LINC01224, miR-NC、miR-513b-5p mimics与WT-LINC01224、MUT-LINC01224分别共转染入SW1116细胞后继续培养24 h, 收集细胞并检测荧光素酶活性.
1.2.7 Western blot检测E-cadherin、N-cadherin蛋白表达: 收集各组SW1116细胞加入适量RIPA裂解液提取细胞总蛋白, SDS-PAGE分离蛋白, 转膜、封闭(2 h), 孵育一抗稀释液(1:1000)后4 ℃条件下孵育24 h, 采用TBST洗涤后孵育二抗稀释液(1:2000), 室温孵育1 h, 滴加ECL显影, 应用ImageJ软件分析各条带灰度值.
统计学处理 应用SPSS 21.0统计学软件分析数据, 计量资料以mean±SD表示且均符合正态分布, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, 以P<0.05为差异具有统计学意义.
与癌旁组织比较, 结肠癌组织中LINC01224的表达水平升高(P<0.05), miR-513b-5p的表达水平降低(P<0.05), 见图1.
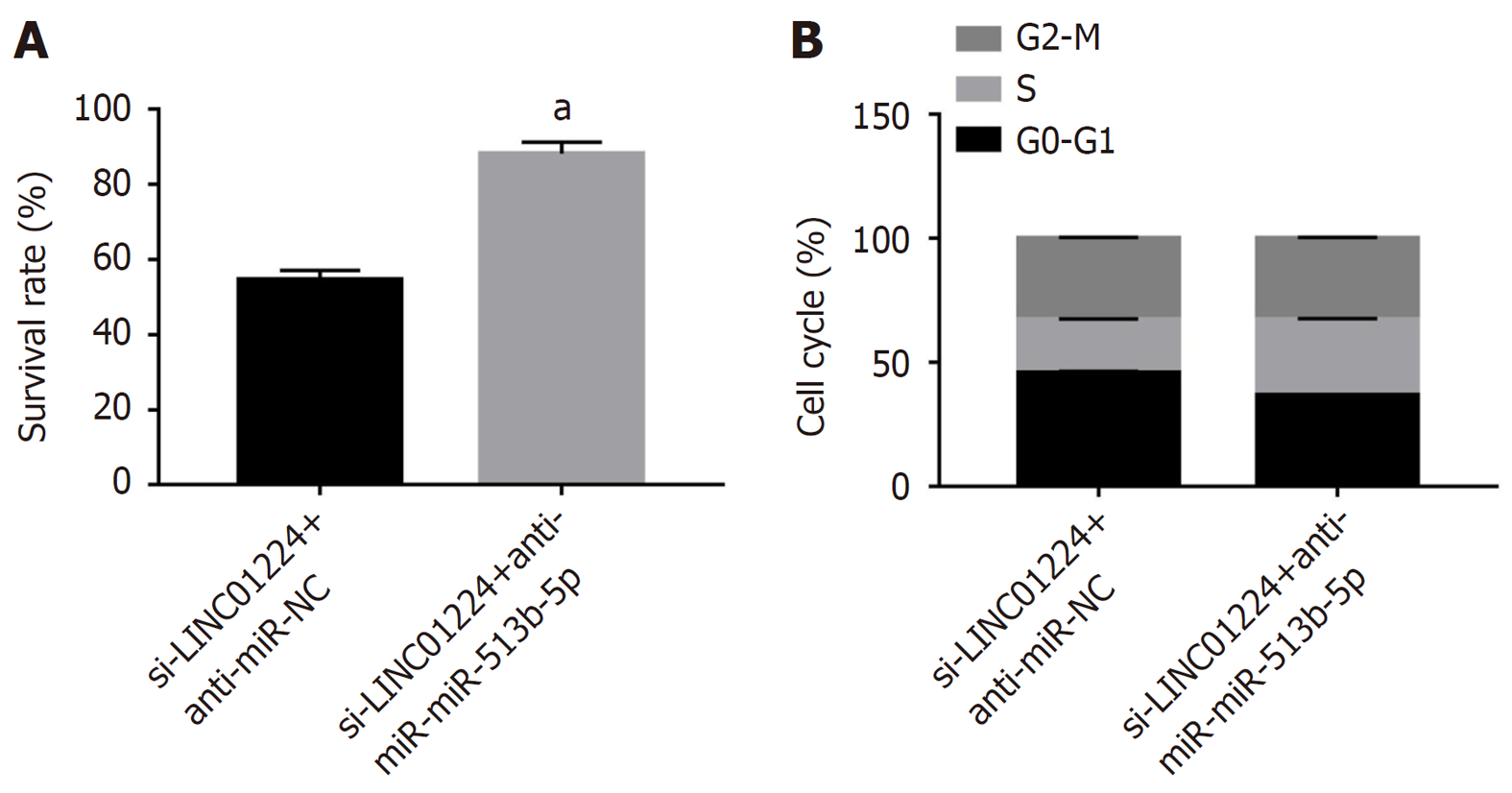
与si-NC组比较, si-LINC01224组细胞存活率降低(P<0.05), G0-G1期细胞比例升高(P<0.05), S期细胞比例降低(P<0.05), G2-M期细胞比例比较无统计学意义(P>0.05), 见图2.
与si-NC组比较, si-LINC01224组迁移及侵袭细胞数减少(P<0.05), E-cadherin蛋白水平升高(P<0.05), N-cadherin蛋白水平降低(P<0.05), 见图3.
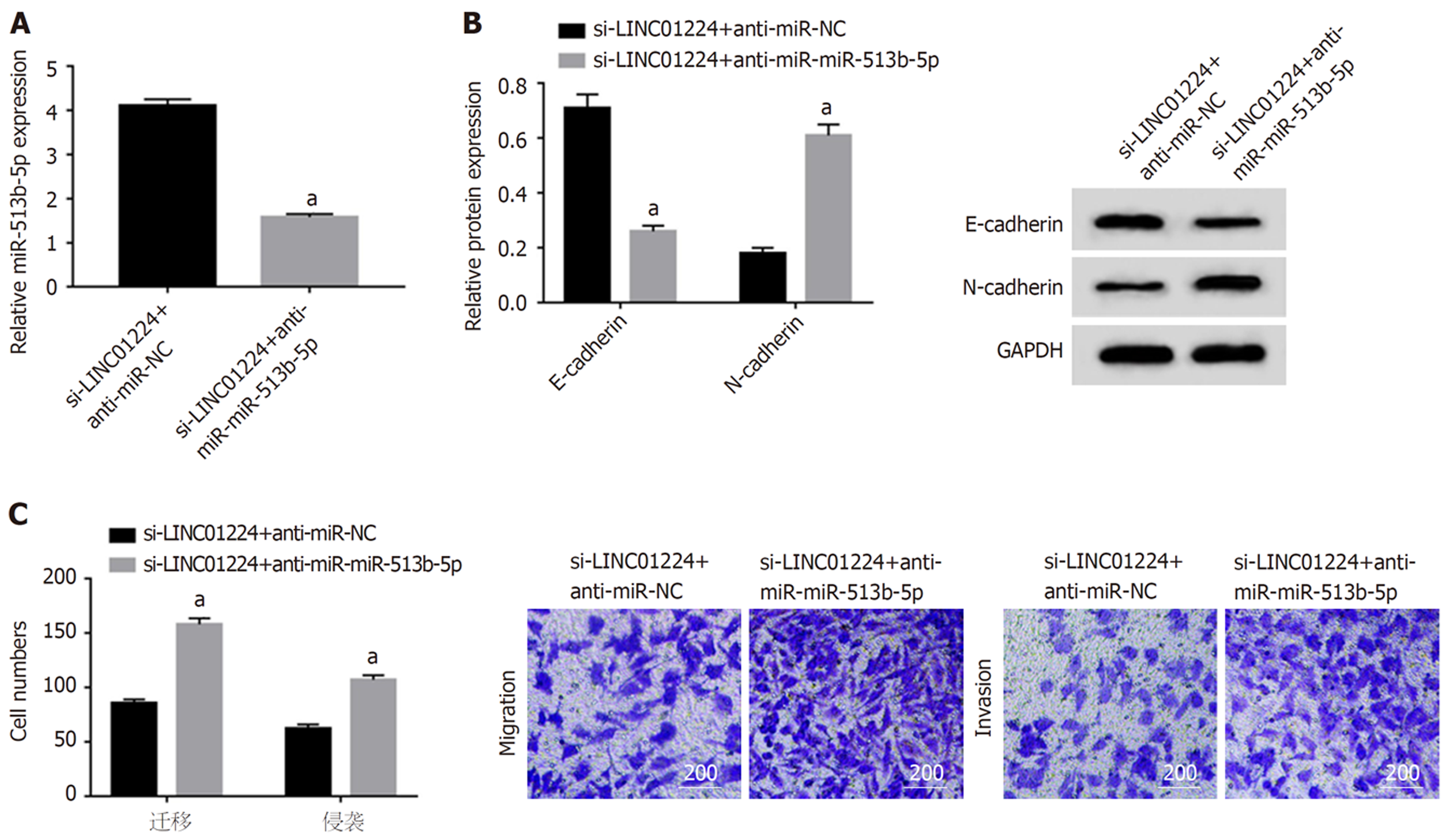
LncBase v.2预测显示LINC01224与miR-513b-5p存在结合位点, 见图2. miR-513b-5p过表达可降低野生型载体WT-LINC01224的荧光素酶活性(P<0.05), 而对突变型载体MUT-LINC01224的荧光素酶活性无明显影响(P>0.05), 见图4.
与si-LINC01224+anti-miR-NC组比较, si-LINC01224+anti-miR-513b-5p组细胞存活率升高(P<0.05), G0-G1期细胞比例降低(P<0.05), S期细胞比例升高(P<0.05), G2-M期细胞比例比较无统计学意义(P>0.05), 见图5.
与si-LINC01224+anti-miR-NC组比较, si-LINC01224+anti-miR-513b-5p组迁移及侵袭细胞数增多(P<0.05), E-cadherin蛋白水平降低(P<0.05), N-cadherin蛋白水平升高(P<0.05), 见图6.
LncRNA在结肠癌中表达上调或下调, 并可充当miRNA竞争性内源RNA分子从而调控结肠癌细胞增殖、迁移等生物学过程, 下调LncRNA AWPPH通过抑制GLUT-1而抑制结肠癌细胞的增殖[7]. LncRNA LINC00662通过与miR-340-5p竞争性结合而促进结肠癌的生长和转移[8]. LncRNA LINC00261通过充当miR-324-3p竞争性内源RNA分子而抑制结肠癌的发展[9]. LncRNA B3GALT5-AS1通过抑制miR-203而抑制结肠癌肝转移[10]. 但仍有部分LncRNA在结肠癌发生及发展过程中的作用机制尚未阐明.
LINC01224在上皮性卵巢癌中表达水平升高, 并可通过miR-485-5p介导的PAK4而促进上皮性卵巢癌的发展[11]. 本研究结果显示, 结肠癌组织中LINC01224的表达水平升高, 提示LINC01224在结肠癌发生过程中可能发挥癌基因作用. 本研究结果显示, 干扰LINC01224表达可明显降低结肠癌细胞存活率, 提高G0-G1期细胞比例, 而降低S期细胞比例, 提示干扰LINC01224表达可抑制结肠癌细胞增殖及诱导细胞周期阻滞于G0-G1期. 上皮-间质转化(EMT)可促进结肠癌转移, 上皮细胞标志物E-cadherin表达下调可促进细胞转移, 而间充质细胞标志物N-cadherin表达下调可抑制细胞转移[12,13]. 本研究结果显示, 干扰LINC01224表达可明显减少迁移及侵袭细胞数, 并可抑制N-cadherin的表达及促进E-cadherin的表达, 提示干扰LINC01224表达可抑制结肠癌细胞迁移及侵袭.
本研究证实LINC01224可作为miR-513b-5p竞争性内源RNA分子, 并可负向调控miR-513b-5p的表达, 提示LINC01224可能通过竞争性结合miR-513b-5p而发挥作用. 研究表明miR-513b-5p表达上调可抑制乳腺癌的发生及发展[14]. 上调circ_LARP4的表达可通过调节miR-513b-5p/LARP4轴而抑制卵巢癌细胞的增殖和迁移[15]. miR-513b-5p在结肠癌组织中表达水平降低, 并可能在结肠癌发生及发展中发挥抑癌基因作用[16]. 本研究结果显示, 结肠癌组织中miR-513b-5p的表达水平降低, 进一步研究显示抑制miR-513b-5p表达可降低干扰LINC01224表达对结肠癌细胞增殖、迁移及侵袭的作用.
综上所述, 结肠癌组织中LINC01224的表达水平升高, 而miR-513b-5p的表达水平降低, 干扰LINC01224表达可通过上调miR-513b-5p而抑制结肠癌细胞增殖、迁移及侵袭及诱导细胞周期阻滞于G0-G1期, LINC01224/miR-513b-5p在结肠癌发生及发展过程中可发挥重要调控作用, 并可能作为结肠癌治疗的潜在靶标.
早期结肠癌患者临床症状不明显导致患者确诊时已失去最佳治疗时机, 目前尚缺乏结肠癌早期诊断的有效标志物, 手术、化疗等是临床治疗结肠癌的常用手段, 但患者预后很差, 随着医疗技术的进步, 分子靶向治疗成为研究重点, 但目前尚缺乏结肠癌发展相关的基因作为治疗靶点, LncRNA作为非编码RNA, 其基因序列可吸附多个miRNA而发挥癌基因或抑癌基因作用, 因而急需探寻新型LncRNA作为结肠癌治疗靶点.
LINC01224在肝癌等肿瘤中表达水平升高, 并可能作为癌基因而参与多种肿瘤发生及发展过程, 但LINC01224在结肠癌中的表达及其可能作用机制尚未阐明. 同时通过靶基因预测显示miR-513b-5p与LINC01224存在结合位点, miR-513b-5p在结肠癌中表达水平降低, 因而本研究主要探究LINC01224/miR-513b-5p分子轴在结肠癌发生及发展过程中的作用机制.
验证LINC01224在结肠癌发生及发展过程中发挥癌基因作用, LINC01224可靶向调控miR-513b-5p从而参与结肠癌发生及发展过程.
采用qRT-PCR法检测结肠癌组织中LINC01224与miR-513b-5p的表达水平; 采用MTT法检测细胞增殖; 应用流式细胞仪检测细胞周期; 采用Transwell小室实验检测细胞迁移及侵袭; 双荧光素酶报告基因实验验证LINC01224与miR-513b-5p的靶向关系.
结肠癌组织中LINC01224的表达水平升高, 而miR-513b-5p的表达水平降低, 干扰LINC01224表达可抑制结肠癌细胞增殖、迁移及侵袭及诱导细胞周期阻滞于G0-G1期; LINC01224可吸附miR-513b-5p而负向调控其表达及活性; 抑制miR-513b-5p表达可拮抗干扰LINC01224表达对结肠癌细胞周期、增殖、迁移及侵袭的作用.
LINC01224可通过靶向抑制miR-513b-5p的表达而促进结肠癌细胞增殖、迁移及侵袭.
LINC01224可能作为结肠癌靶向治疗的潜在靶点, 还可能作为临床早期诊断结肠癌的潜在生物标记物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Wu Q, Meng WY, Jie Y, Zhao H. LncRNA MALAT1 induces colon cancer development by regulating miR-129-5p/HMGB1 axis. J Cell Physiol. 2018;233:6750-6757. [PubMed] [DOI] |
| 2. | Peng CL, Zhao XJ, Wei CC, Wu JW. LncRNA HOTAIR promotes colon cancer development by down-regulating miRNA-34a. Eur Rev Med Pharmacol Sci. 2019;23:5752-5761. [PubMed] [DOI] |
| 3. | Jing N, Huang T, Guo H, Yang J, Li M, Chen Z, Zhang Y. LncRNA CASC15 promotes colon cancer cell proliferation and metastasis by regulating the miR4310/LGR5/Wnt/βcatenin signaling pathway. Mol Med Rep. 2018;18:2269-2276. [PubMed] [DOI] |
| 4. | Liu J, Du W. LncRNA FENDRR attenuates colon cancer progression by repression of SOX4 protein. Onco Targets Ther. 2019;12:4287-4295. [PubMed] [DOI] |
| 5. | Gong D, Feng PC, Ke XF, Kuang HL, Pan LL, Ye Q, Wu JB. Silencing Long Non-coding RNA LINC01224 Inhibits Hepatocellular Carcinoma Progression via MicroRNA-330-5p-Induced Inhibition of CHEK1. Mol Ther Nucleic Acids. 2020;19:482-497. [PubMed] [DOI] |
| 6. | Wang X, Zhang X, Wang G, Wang L, Lin Y, Sun F. Hsa-miR-513b-5p suppresses cell proliferation and promotes P53 expression by targeting IRF2 in testicular embryonal carcinoma cells. Gene. 2017;626:344-353. [PubMed] [DOI] |
| 7. | Bai J, Xu J, Zhao J, Zhang R. Downregulation of lncRNA AWPPH inhibits colon cancer cell proliferation by downregulating GLUT-1. Oncol Lett. 2019;18:2007-2012. [PubMed] [DOI] |
| 8. | Cheng B, Rong A, Zhou Q, Li W. LncRNA LINC00662 promotes colon cancer tumor growth and metastasis by competitively binding with miR-340-5p to regulate CLDN8/IL22 co-expression and activating ERK signaling pathway. J Exp Clin Cancer Res. 2020;39:5. [PubMed] [DOI] |
| 9. | Yan D, Liu W, Liu Y, Luo M. LINC00261 suppresses human colon cancer progression via sponging miR-324-3p and inactivating the Wnt/β-catenin pathway. J Cell Physiol. 2019;234:22648-22656. [PubMed] [DOI] |
| 10. | Wang L, Wei Z, Wu K, Dai W, Zhang C, Peng J, He Y. Long noncoding RNA B3GALT5-AS1 suppresses colon cancer liver metastasis via repressing microRNA-203. Aging (Albany NY). 2018;10:3662-3682. [PubMed] [DOI] |
| 11. | Xing S, Zhang Y, Zhang J. LINC01224 Exhibits Cancer-Promoting Activity in Epithelial Ovarian Cancer Through microRNA-485-5p-Mediated PAK4 Upregulation. Onco Targets Ther. 2020;13:5643-5655. [PubMed] [DOI] |
| 12. | Yue B, Qiu S, Zhao S, Liu C, Zhang D, Yu F, Peng Z, Yan D. LncRNA-ATB mediated E-cadherin repression promotes the progression of colon cancer and predicts poor prognosis. J Gastroenterol Hepatol. 2016;31:595-603. [PubMed] [DOI] |
| 13. | Xia L, Lin J, Su J, Oyang L, Wang H, Tan S, Tang Y, Chen X, Liu W, Luo X, Tian Y, Liang J, Su Q, Liao Q, Zhou Y. Diallyl disulfide inhibits colon cancer metastasis by suppressing Rac1-mediated epithelial-mesenchymal transition. Onco Targets Ther. 2019;12:5713-5728. [PubMed] [DOI] |
| 14. | Muti P, Donzelli S, Sacconi A, Hossain A, Ganci F, Frixa T, Sieri S, Krogh V, Berrino F, Biagioni F, Strano S, Beyene J, Yarden Y, Blandino G. MiRNA-513a-5p inhibits progesterone receptor expression and constitutes a risk factor for breast cancer: the hOrmone and Diet in the ETiology of breast cancer prospective study. Carcinogenesis. 2018;39:98-108. [PubMed] [DOI] |
| 15. | Lin W, Ye H, You K, Chen L. Up-regulation of circ_LARP4 suppresses cell proliferation and migration in ovarian cancer by regulating miR-513b-5p/LARP4 axis. Cancer Cell Int. 2020;20:5. [PubMed] [DOI] |