修回日期: 2020-01-11
接受日期: 2020-02-06
在线出版日期: 2020-02-28
胃癌(gastric cancer, GC)是常见恶性肿瘤之一, 发病率、死亡率均排在全国、乃至全世界前列, 是影响人类健康的重要问题. 目前仍缺乏GC早期诊断、治疗及GC预后相关的基因靶点.
探讨母源性表达基因8(maternally expressed gene 8, MEG8)及转谷氨酰胺酶2(transglutaminase 2, TGM2)在GC组织中的表达及临床意义.
通过荧光定量聚合酶链式反应检测30对GC及癌旁组织中MEG8、TGM2表达情况, 分析表达情况与GC患者临床病理特征相关性, 通过摘录Oncomine数据库中相关研究数据, 分析TGM2表达差异性及与GC患者的生存状态的相关性.
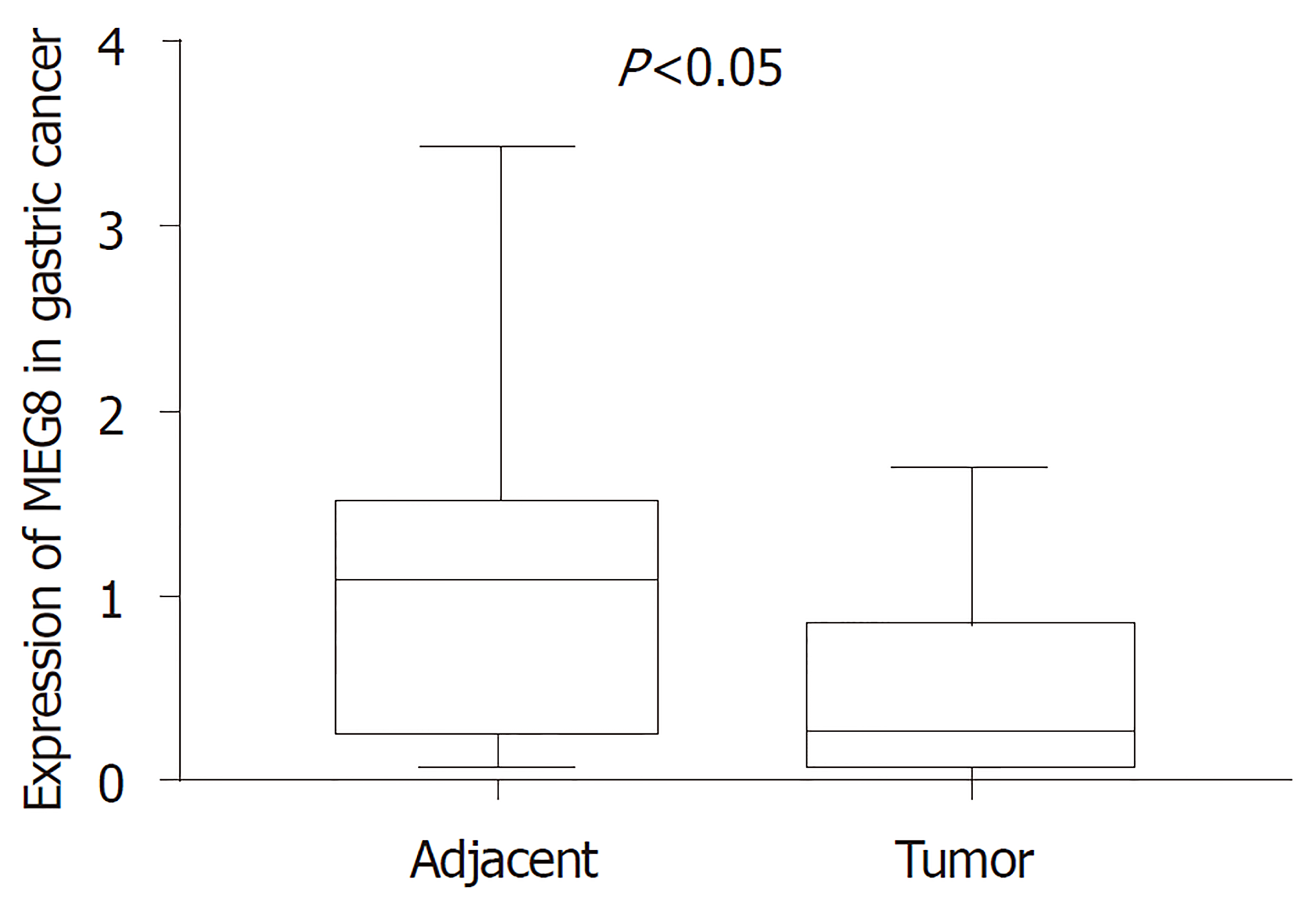
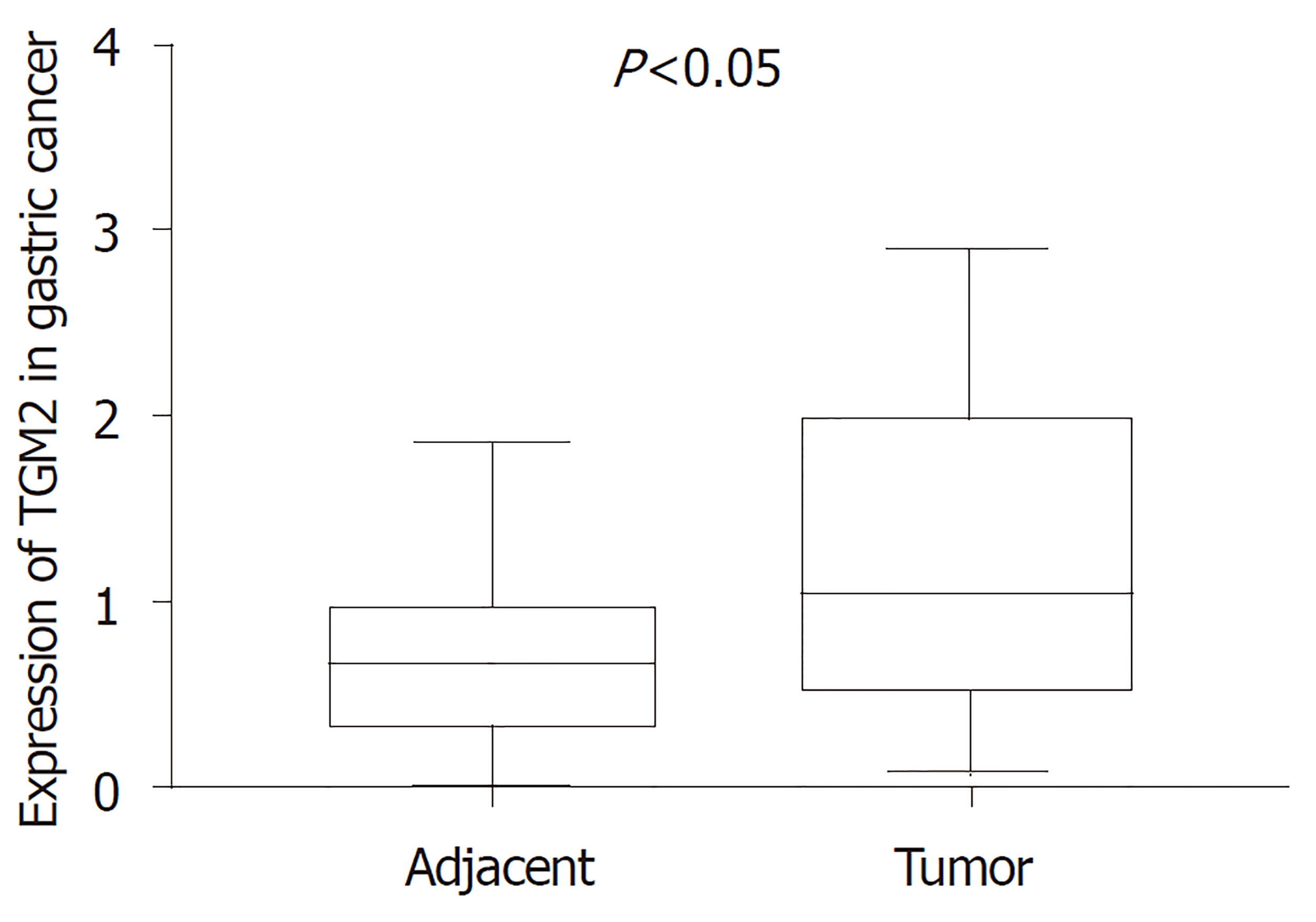
MEG8在GC组织中的表达量低于癌旁组织(0.462±0.082 vs 1.048±0.149), TGM2在GC组织中的表达量高于癌旁组织(1.202±0.143 vs 0.742±0.083), 差异具有统计学意义(P<0.05); MEG8表达与年龄、临床分期有关(P<0.05), TGM2表达与临床分期有关(P<0.05); TGM2表达高低与GC患者生存状态无关(P>0.05).
MEG8、TGM2参与GC的发生发展过程, 可作为GC诊断及预后的潜在靶点.
核心提要: 本文首次通过荧光定量聚合酶链式反应检测发现母源性表达基因8在胃癌(gastric cancer, GC)及其对应的癌旁组织中表达具有差异性, 在GC组织中的表达量低于癌旁组织.
引文著录: 安健健, 李思源, 管鑫, 徐晓娜, 姜相君. MEG8、TGM2在胃癌组织中的表达及临床意义. 世界华人消化杂志 2020; 28(4): 122-128
Revised: January 11, 2020
Accepted: February 6, 2020
Published online: February 28, 2020
Gastric cancer (GC) is one of the common malignant tumors, and its incidence and mortality rates are among the highest in China and even the world, posing an important threat to human health. There is still a lack of early diagnosis, treatment, and prognosis-related gene targets for GC.
To investigate the expression of maternally expressed gene 8 (MEG8) and transglutaminase-2 (TGM2) in GC and analyze their clinical significance.
The expression of MEG8 and TGM2 in 30 pairs of GC and tumor-adjacent tissues was detected by fluorescence quantitative polymerase chain reaction. The correlation between MEG8 and TGM2 expression and clinicopathological features of GC patients was analyzed. The difference of TGM2 expression and its correlation with the survival status of GC patients were analyzed by employing the relevant research data in Oncomine database.
The expression of MEG8 in GC tissues was significantly lower than that in tumor-adjacent tissues (0.462 ± 0.082 vs 1.048 ± 0.149, P < 0.05), and the expression of TGM2 in GC tissues was significantly higher than that in tumor-adjacent tissues (1.202 ± 0.143 vs 0.742 ± 0.083, P < 0.05). The expression of MEG8 was correlated with age and clinical stage, and the expression of TGM2 was correlated with clinical stage (P < 0.05). The expression of TGM2 was not related to the survival status of patients with GC (P > 0.05).
MEG8 and TGM2 may be involved in the occurrence and development of GC and can be used as potential targets for the diagnosis and prognosis of GC.
- Citation: An JJ, Li SY, Guan X, Xu XN, Jiang XJ. Clinical significance of expression of MEG8 and TGM2 genes in gastric cancer. Shijie Huaren Xiaohua Zazhi 2020; 28(4): 122-128
- URL: https://www.wjgnet.com/1009-3079/full/v28/i4/122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i4.122
胃癌(gastric cancer, GC)是一种死亡率高的常见恶性肿瘤, 根据最新全球癌症统计报告分析, GC位居全球常见肿瘤第五位, 成为癌症死亡的第三大原因[1]. 在我国, GC发病率和死亡率分别排名第二位和第三位[2]. GC的发病机制十分复杂, 其发生发展过程是多因素共同作用、长期积累的结果, 基因组学[3]、表观基因组[4]、代谢组学[5]等多方面仍在不断探索. 目前尚未发现有效的GC普查方法, 内镜筛查也尚未普及, 即使在GC发病率高的日本、韩国等发达国家[6], 且早期GC无特殊临床症状, 多数GC患者确诊时为进展期, GC的5年生存率仅为30%-35%[7], 迫切需要探索新的分子标志物协助GC诊断及预后判断, 非编码RNA(non-coding RNA, ncRNA)、蛋白质编码RNA是重要的功能调节分子, 介导多种细胞过程的, 参与多种疾病发生发展过程, 尤其是癌症基因调控过程[8,9]. 长链ncRNA母源性表达基因3(long ncRNA MEG3, lncRNA MEG3)在GC组织中表达下调, 抑制GC细胞增殖、迁移和侵袭, 在GC发生中起重要的调控作用[10]. 与MEG3共享DLK1-DIO3位点的母源性表达基因8(maternally expressed gene 8, MEG8)在GC方面尚未有研究报道. 转谷氨酰胺酶家族, 以其催化转酰胺或交联反应的能力为依据[11], 被广泛研究并发现其在多种疾病中发挥作用. 转谷氨酰胺酶2(transglutaminase 2, TGM2)可以促进或抑制细胞死亡, 参与多种生理及病理过程, 可诱导具有肽交联活性的肿瘤抑制因子降解, 参与肿瘤侵袭转移过程[12,13]. TGM2与GC患者预后间的关系需进一步证实. 本研究旨在通过检测 MEG8、TGM2在GC组织中的表达, 分析其在组织中的表达与患者临床病理特征之间的关系.
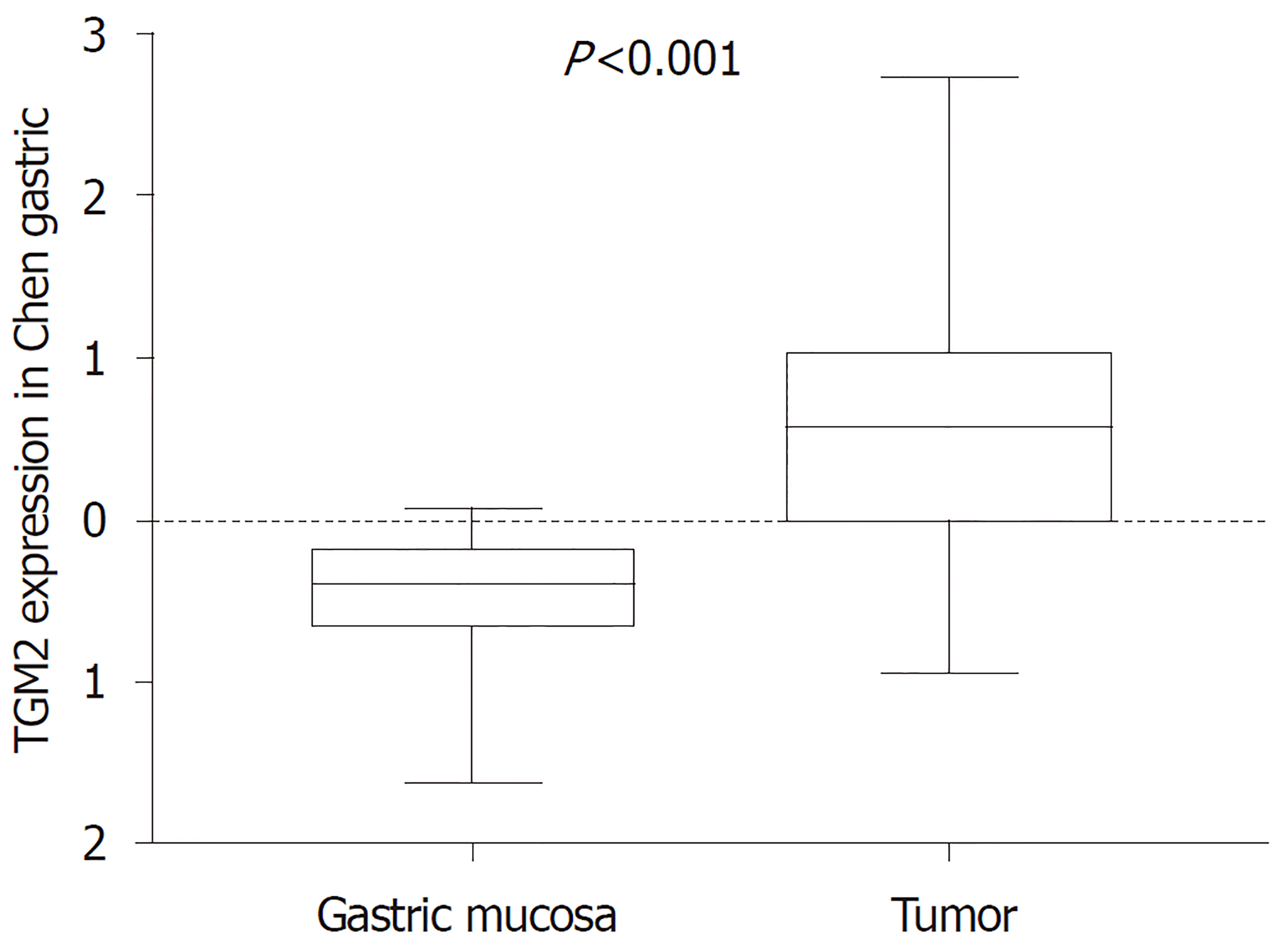
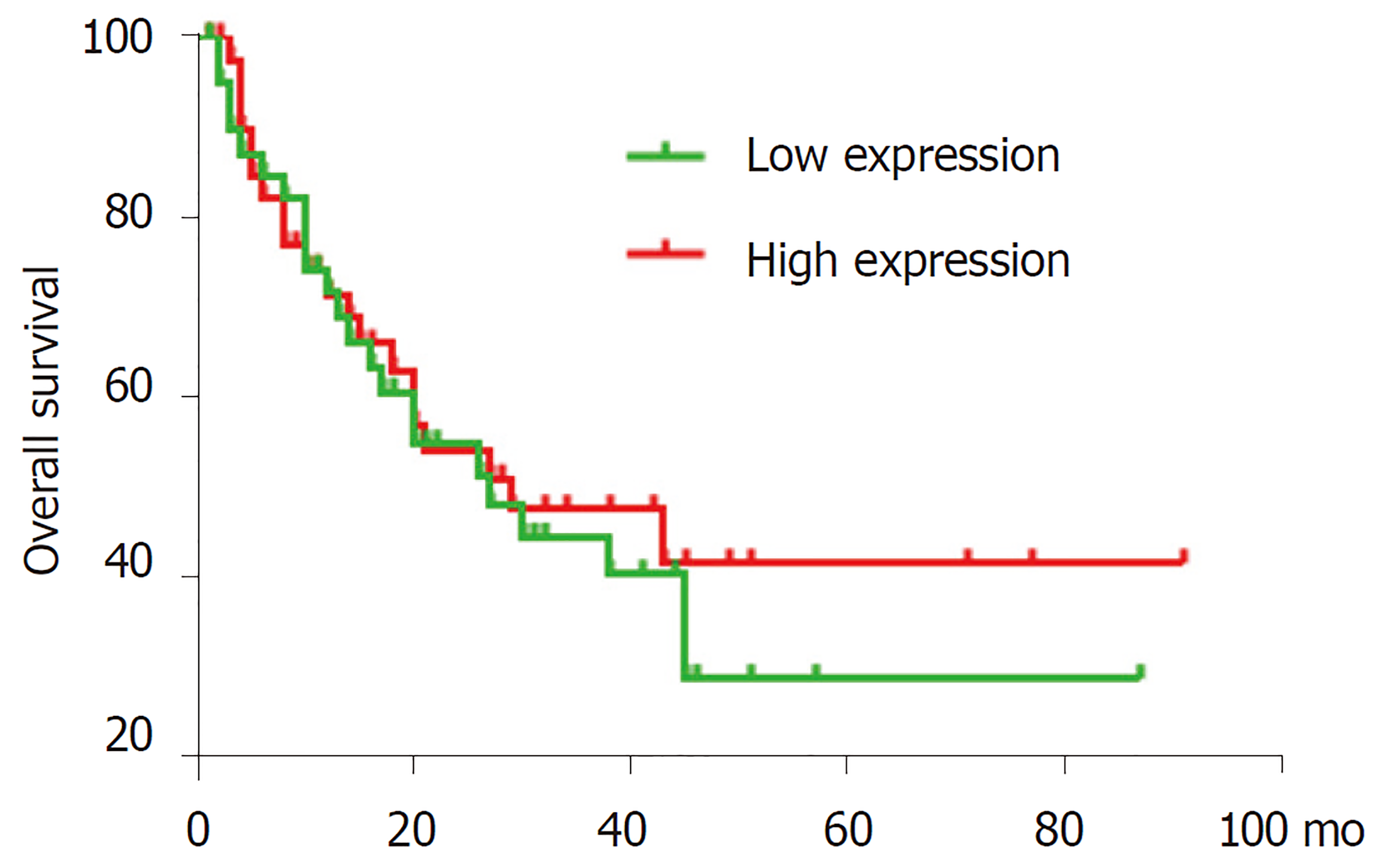
收集自2018-01/2019-01于我院普外科收治的30例GC患者的手术切除的GC组织及癌旁组织标本, 癌旁组织取距离癌变边缘≥5 cm处. 患者术前均未行放化疗, 病历资料完整, 男性19例, 女性11例; 年龄44-85岁, 平均年龄66.9岁, Ⅰ期4例, Ⅱ期14例, Ⅲ期9例, Ⅳ期4例; 淋巴结转移者18例, 无淋巴结转移者12例; 远处转移4例, 无远处转移26例. 从Oncomine数据库中摘录来自Chen的GC研究数据(http://smd.stanford.edu/cgi-bin/publication/viewPublication.pl?pub_no=232), 展示了mRNA TGM2在29例胃正常黏膜、65例GC组织中的表达情况, 并根据所包含的85例GC患者随访数据, 分析TGM2表达与患者生存时间的关系. 本研究经本院伦理委员会批准(表1).
组织样本RNA提取和荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测: 采用TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒提取GC组织标本中总RNA. 参照TaKaRa PrimeScriptTM RT reagent KIt with gDNA Eraser(Perfect Real Time)试剂盒说明书, 将提取的RNA进行逆转录反应, 在20 μL反转录反应体系中加入不超过1 μg总RNA进行cDNA 的合成. qRT-PCR使用TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)、ROX Reference Dye Ⅱ(50×)取2 μL cDNA 作为模板, lncRNA MEG8引物序列: 5'-TCCATGGCCACCAGCCTTA-3'; 5'-GGAACACAACAATCTTGATCCCAAC-3', mRNA TGM2引物序列: 5'-CCCAGCAGGGCTTTATCTACCA-3'; 5'-GCAGATGTCTAGGATCCCATCTTCA-3'引物浓度0.5 μmol/L, 20 μL体系进行扩增, 根据目标基因设计合成相应上、下游引物进行PCR扩增, 以GAPDH作为内参照. PCR反应在定量PCR反应仪上进行. 实验所得的数据运用公式RQ = 2-ΔΔCt的方法进行分析. 根据2-ΔΔCt值的中位数定义低表达和高表达, 即表达量<2-ΔΔCt中位数, 为低表达, 反之为高表达.
统计学处理 采用SPSS 19.0版软件进行统计学处理. 根据资料的类型不同, 采用不同的统计学方法分析, 连续变量采用t检验, 分类变量采用χ2检验, 有序变量采用回归分析. 采用Kaplan-Meier法绘制生存曲线, 并行Log-rank检验分析结果. P<0.05为差异具有统计学意义.
MEG8在30例GC组织中的相对表达量为0.462±0.082, 明显低于癌旁组织的1.048±0.149, P<0. 05, 具有统计学差异; TGM2在GC组织中的相对表达量明显高于癌旁组织(1.202±0.143 vs 0.742±0.083), P<0.05, 差异具有统计学意义(图1、2).
MEG8表达与性别、肿瘤部位、分化程度、肿瘤大小、淋巴转移及远处转移无关, P>0.05, 差异无统计学意义; 而与年龄、临床分期有关, P<0.05, 差异具有统计学意义. TGM2表达在年龄、性别、肿瘤部位、分化程度、肿瘤大小、淋巴转移及远处转移方面均未见明显差异(P>0.05), 与临床分期有关, 差异具有统计学意义(P<0.05)(表1).
肿瘤是威胁人类健康的重要原因, 权威期刊报道, 2018年癌症新增病例1810万例, 死亡病例达960万, 其中GC新增病例超过100万例, 估计有78.3万例死亡[1], 杨之洵等对我国GC发病趋势分析, 预计2020年中国GC发病率为24.30/10万, 新发病例数约为34.6万, 其中男性远多于女性, 我国各年龄组的GC发病率已呈现出下降趋势, 全人群的发病率增长趋势也有所缓解, 但仍高于世界平均水平[14]. 手术、放疗、化疗是恶性肿瘤传统的治疗方法, 但各有利弊[15], 为延长肿瘤患者的生存时间, 改善生活质量, 促使研究人员发展癌症治疗的新技术、新方法, 例如: 免疫疗法, 研究证实癌症免疫疗法已经取得了显著的临床疗效[16]. 由于GC早期临床症状不明显, 部分患者被确诊为晚期, 且局部肿瘤易侵袭、转移和复发, 中国GC 5年生存率仅为35.9%[17]. 因此, 对GC发生发展的分子机制研究是十分有必要的, 有助于GC的早期诊断及治疗.
在人类基因组中占多数的转录本不编码蛋白质, 即ncRNA, 被认为是解决疾病中基因失调的关键[18,19]. 长度>200 nt的ncRNA被称为lncRNA[20], 参与多种生物学过程, 如: 组蛋白修饰, DNA甲基化和细胞转录等[21]. lncRNA、mRNA在GC的发生发展过程中发挥其功能多样性, 例如: lncRNA GASL1通过阻断Wnt/β-catenin信号通路抑制GC细胞的增长[22]; lncRNA FLVCR1-AS1通过竞争性结合miR-155促进c-myc表达, 通过FLVCR1-AS1-miR-155-c-Myc信号通路在GC中发挥癌基因的作用[23]. 抑制性κB激酶(inhibitory κB kinases, IKKS)和抑制性NF-κB激酶亚基ε的抑制因子(suppressor of IKKε, SIKE)的mRNA表达与GC的预后有着独特的关系, 可作为GC预后的有价值的生物标志物和潜在的治疗靶点[24]. lncRNA、mRNA均可均可从血液、组织等临床样本中检测, 可作为早期诊断标志物; 表达差异可能与肿瘤分期、肿瘤类型等方面相关, 可用于判断预后; 可作为治疗靶点, 以对抗癌症进展[25], 为肿瘤的诊断、治疗、预后提供了新思路、新方向.
MEG8与MEG3共享DLK1-DIO3位点, 位于染色体14q32.3上. DLK1-DIO3印记区包括长链非编码RNA(MEG3、MEG8、MEG9和Linc00524)、miRNA、蛋白质编码基因等[26]. DLK1-DIO3簇某些组分的改变与疾病病理过程有关[27], 相关研究已证实, DLK1-DIO3簇某些蛋白编码基因参与肺癌及肝癌的发生过程; miRNA参与了不同肿瘤的发展, 如淋巴瘤、胶质母细胞瘤、胃肿瘤等[28]. MEG3被认为是一个非常重要的抑癌基因, 在肿瘤发生发展过程中发挥重要作用[29], 在肺癌、肝癌、GC、宫颈癌、结肠癌中表达下降, 与肿瘤的发生、发展、转移和化疗耐药有关[29]. 最近研究显示, 在肺癌及胰腺癌细胞株中, lncRNA MEG8参与转化生长因子-β介导的上皮间质转化(epithelial-mesenchy maltransition, EMT)过程, 对表观遗传EMT的诱导有显著的促进作用[30]; LncRNA MEG8通过竞争性结合miR-181a-5p促进PPARα蛋白表达, 调节血管平滑肌细胞增殖, 迁移和凋亡, 在血管动脉粥样硬化中发挥重要作用[31]; 差异性表达的lncRNA MEG8可能在病理性新生血管生成过程中起到重要调控作用, 可能参与婴幼儿血管瘤的血管生成[32]. 但是目前lncRNA MEG8在GC方面尚无研究报道. 本研究通过测定lncRNA MEG8在GC组织与其对应的癌旁组织中的表达量, 分析了两组间表达差异情况及与临床病理因素相关性, 结果显示lncRNA MEG8在GC组织中的表达明显低于癌旁组织, 差异具有统计学意义(P<0.05); MEG8的表达与患者年龄及临床分期相关(P<0.05), 临床分期越高, MEG8在GC组织中的相对表达越低, 以上研究结果提示MEG8可以作为GC诊断的潜在靶点, 为GC诊断提供新思路.
mRNA TGM2是转谷氨酰胺酶家族成员之一, 通过钙依赖性酰基转移反应(转酰胺化)催化蛋白质的特异性翻译后修饰. 此外, 该酶显示出多种酶活性, 例如鸟嘌呤核苷酸结合和水解、蛋白激酶、二硫键异构酶活性, 并参与细胞粘附. 是参与肿瘤发生各个阶段的关键酶之一. 在癌症干细胞上皮-间质转化, 细胞凋亡、分化以及侵袭性转移表型形成中起重要作用[33]. 已有研究显示TGM2在消化道肿瘤中发挥重要作用, TGM2通过的Wnt/β-catenin的通路调节血管生成, 干扰结肠癌细胞凋亡[34]. TGM2在GC血管内皮细胞中上调, 新型肽GX1可以通过直接结合TGM2抑制血管生成, 从而抑制其下游途径(NF-κB/HIF1α)[35]. TGM2在食管腺癌中过表达, 并与肿瘤分期分化相关[36]. 本实验检测TGM2在GC及癌旁组织中表达具有显著差异, TGM2在GC组织中的相对表达量明显高于癌旁组织(P<0.05), 表达差异与GC分期相关, 与性别、年龄、肿瘤部位、肿瘤大小、转移情况无明显相关. TGM2在GC及癌旁组织表达差异结果与Oncomine数据库中其在GC及正常胃黏膜组织的表达差异性相似, 并分析85例GC患者TGM2的表达情况与患者生存时间的关系, 发现随访时间超过30个月时, TGM2高表达患者的生存率较低表达患者略高, 但无统计学差异(P = 0.607, P>0.05). 有研究表明高表达的TGM2是肿瘤存活的一个因素[37], 本次研究结果并没有体现, 由于本研究纳入样本量较小, 需要进一步行大样本研究进行验证. 综上所述, TGM2在GC组织中的表达相对癌旁组织明显升高, 可作为GC诊断潜在分子标志物, 其表达情况对于GC患者预后意义有待进一步大样本统计研究.
本研究仍存在不足, 因为包括的患者例数相对偏少, 基因相对表达量离散程度较大, 初步获得的结果可能并不能准确反映其在GC中的表达情况, 需要在大样本中重复验证; 其次, 本次实验仅局限于组织表达分析, 未能体现细胞及动物层面研究, 基因在GC中的作用机制需进一步实验完善验证. 近年来虽然GC发生率较前有所改善, 但由于中国人口基数大, 且GC初期临床症状不典型, 仍面临巨大的癌症防治压力, 迫切需要发现新的分子标志物, 为GC的防治提供机会.
胃癌(gastric cancer, GC)是世界范围内的一种重要癌症, 尽管在过去几十年中GC事件的发生率有所下降, 成为第五位最常见的癌症, 依然是影响全球健康的一个主要问题. 2018年GC新增病例超过100万例, 估计有78.3万例死亡, 成为全球第三大与癌症相关的死亡原因. 新病例确诊后5年存活率仅达28.3%. GC是一个多方面因素综合作用、长期积累的最终结果, 这一发生发展过程甚至需要经过几十年, 其发病机制涉及许多基因、分子信号通路及表观遗传学变化. 从分子水平上了解GC相关基因表达水平及调控模式是十分有必要的, 结合现在热门的基因靶向治疗理念, 将对GC的诊断、治疗以及预后等方面提供重要依据.
本研究主要探究GC与GC相关基因的表达及临床意义. 通过阅读文献及应用生物信息学分析, 筛选出可能在GC中有表达意义的分子MEG8及TGM2. 通过聚合酶链式反应检测基因在GC组织及其癌旁对照组织中的表达情况, 比较表达差异性, 进一步联系临床因素分析MEG8与GC患者临床病理因素相关性, 为GC的诊治及预后研究提供潜在的分子标志物.
由于GC严重威胁人类健康, 且预后差, 本研究通过实验检测相关基因在GC及其对应的癌旁组织的表达情况, 分析基因表达与GC临床病理因素相关性, 以及基因表达与GC患者预后相关情况, 旨在为GC研究通过新生物标志物.
收集GC、及癌旁组织标本; 待样本离体后, 立即置入RNA样本保存液中, 送至实验室, 置4 ℃冰箱过夜处理后, 置入-80 ℃冰箱冻存; 经过组织RNA提取、逆转录等过程, 通过PCR检测MEG8、TGM2表达量, 统计分析GC组织与癌旁对照组织间存在表达差异(P<0.05), 记录、汇总实验数据, 完善患者信息(年龄、性别、肿瘤分期、分化程度、有无淋巴结转移及有无远处转移), 运用统计学方法分析实验结果意义所在, 是否与年龄、性别、临床分期、远处转移等存在关联性, 分析TGM2表达与GC预后的关系及意义.
本篇论文实验结果基本符合假设目标, 通过检测基因在GC及癌旁组织中的表达情况, 发现MEG8在GC组织中表达低于癌旁组织, 可能成为GC诊断潜在靶点; TGM2在GC组织表达高于癌旁组织, 但并未发现TGM2表达与GC患者预后情况有显著意义.
本次研究首次发现MEG8在GC及癌旁组织中表达具有统计学差异, 发现MEG8、TGM2在GC组织中表达与GC临床分期具有相关性, 可能为GC诊治及预后提供潜在生物标志物.
本研究初步探讨MEG8在GC及癌旁组织中具有表达差异性, 但其在GC发生、发展过程中的作用机制尚不清楚, 急需进一步实验研究证明, 为GC的诊治提供新的研究思路及靶点; TGM2在GC发生机制已有相关研究, 其表达情况与GC患者预后相关性需收集大样本进一步统计分析, 为GC预后提供判断依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | 郑 荣寿, 孙 可欣, 张 思维, 曾 红梅, 邹 小农, 陈 茹, 顾 秀瑛, 魏 文强, 赫 捷. 2015年中国恶性肿瘤流行情况分析. 中华肿瘤杂志. 2019;41:19-28. [DOI] |
| 3. | Cho J, Ahn S, Son DS, Kim NK, Lee KW, Kim S, Lee J, Park SH, Park JO, Kang WK, An JY, Choi MG, Lee JH, Sohn TS, Bae JM, Kim S, Kim KM. Bridging genomics and phenomics of gastric carcinoma. Int J Cancer. 2019;145:2407-2417. [PubMed] [DOI] |
| 4. | Padmanabhan N, Ushijima T, Tan P. How to stomach an epigenetic insult: the gastric cancer epigenome. Nat Rev Gastroenterol Hepatol. 2017;14:467-478. [PubMed] [DOI] |
| 5. | Xiao S, Zhou L. Gastric cancer: Metabolic and metabolomics perspectives (Review). Int J Oncol. 2017;51:5-17. [PubMed] [DOI] |
| 6. | Hamashima C; Systematic Review Group and Guideline Development Group for Gastric Cancer Screening Guidelines. Update version of the Japanese Guidelines for Gastric Cancer Screening. Jpn J Clin Oncol. 2018;48:673-683. [PubMed] [DOI] |
| 7. | Chon SH, Berlth F, Plum PS, Herbold T, Alakus H, Kleinert R, Moenig SP, Bruns CJ, Hoelscher AH, Meyer HJ. Gastric cancer treatment in the world: Germany. Transl Gastroenterol Hepatol. 2017;2:53. [PubMed] [DOI] |
| 8. | Anastasiadou E, Jacob LS, Slack FJ. Non-coding RNA networks in cancer. Nat Rev Cancer. 2018;18:5-18. [PubMed] [DOI] |
| 10. | Peng W, Si S, Zhang Q, Li C, Zhao F, Wang F, Yu J, Ma R. Long non-coding RNA MEG3 functions as a competing endogenous RNA to regulate gastric cancer progression. J Exp Clin Cancer Res. 2015;34:79. [PubMed] [DOI] |
| 11. | Katt WP, Antonyak MA, Cerione RA. The diamond anniversary of tissue transglutaminase: a protein of many talents. Drug Discov Today. 2018;23:575-591. [PubMed] [DOI] |
| 12. | Choi J, Yoon S, Kim D, Moon YW, Lee CH, Seo S, Cheon J, Gho YS, Kim C, Lee ER, Kim SY, Lee K, Ha JY, Park SR, Kim SW, Park KS, Lee DH. Transglutaminase 2 induces intrinsic EGFR-TKI resistance in NSCLC harboring EGFR sensitive mutations. Am J Cancer Res. 2019;9:1708-1721. [PubMed] |
| 13. | Mehta K, Kumar A, Kim HI. Transglutaminase 2: a multi-tasking protein in the complex circuitry of inflammation and cancer. Biochem Pharmacol. 2010;80:1921-1929. [PubMed] [DOI] |
| 16. | Mi Y, Hagan CT 4th, Vincent BG, Wang AZ. Emerging Nano-/Microapproaches for Cancer Immunotherapy. Adv Sci (Weinh). 2019;6:1801847. [PubMed] [DOI] |
| 17. | Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nikšić M, Bonaventure A, Valkov M, Johnson CJ, Estève J, Ogunbiyi OJ, Azevedo E Silva G, Chen WQ, Eser S, Engholm G, Stiller CA, Monnereau A, Woods RR, Visser O, Lim GH, Aitken J, Weir HK, Coleman MP; CONCORD Working Group. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391:1023-1075. [PubMed] [DOI] |
| 18. | Su Y, Wu H, Pavlosky A, Zou LL, Deng X, Zhang ZX, Jevnikar AM. Regulatory non-coding RNA: new instruments in the orchestration of cell death. Cell Death Dis. 2016;7:e2333. [PubMed] [DOI] |
| 19. | Kaikkonen MU, Adelman K. Emerging Roles of Non-Coding RNA Transcription. Trends Biochem Sci. 2018;43:654-667. [PubMed] [DOI] |
| 20. | Quinn JJ, Chang HY. Unique features of long non-coding RNA biogenesis and function. Nat Rev Genet. 2016;17:47-62. [PubMed] [DOI] |
| 21. | Wei JW, Huang K, Yang C, Kang CS. Non-coding RNAs as regulators in epigenetics (Review). Oncol Rep. 2017;37:3-9. [PubMed] [DOI] |
| 22. | Peng C, Li X, Yu Y, Chen J. LncRNA GASL1 inhibits tumor growth in gastric carcinoma by inactivating the Wnt/β-catenin signaling pathway. Exp Ther Med. 2019;17:4039-4045. [PubMed] [DOI] |
| 23. | Liu Y, Guo G, Zhong Z, Sun L, Liao L, Wang X, Cao Q, Chen H. Long non-coding RNA FLVCR1-AS1 sponges miR-155 to promote the tumorigenesis of gastric cancer by targeting c-Myc. Am J Transl Res. 2019;11:793-805. [PubMed] |
| 24. | Gayed DT, Wodeyar J, Wang ZX, Wei X, Yao YY, Chen XX, Du Z, Chen JC. Prognostic values of inhibitory κB kinases mRNA expression in human gastric cancer. Biosci Rep. 2019;39. [PubMed] [DOI] |
| 25. | Arun G, Diermeier SD, Spector DL. Therapeutic Targeting of Long Non-Coding RNAs in Cancer. Trends Mol Med. 2018;24:257-277. [PubMed] [DOI] |
| 26. | Irving MD, Buiting K, Kanber D, Donaghue C, Schulz R, Offiah A, Mohammed SN, Oakey RJ. Segmental paternal uniparental disomy (patUPD) of 14q32 with abnormal methylation elicits the characteristic features of complete patUPD14. Am J Med Genet A. 2010;152A:1942-1950. [PubMed] [DOI] |
| 27. | Benetatos L, Hatzimichael E, Londin E, Vartholomatos G, Loher P, Rigoutsos I, Briasoulis E. The microRNAs within the DLK1-DIO3 genomic region: involvement in disease pathogenesis. Cell Mol Life Sci. 2013;70:795-814. [PubMed] [DOI] |
| 28. | Molina-Pinelo S, Salinas A, Moreno-Mata N, Ferrer I, Suarez R, Andrés-León E, Rodríguez-Paredes M, Gutekunst J, Jantus-Lewintre E, Camps C, Carnero A, Paz-Ares L. Impact of DLK1-DIO3 imprinted cluster hypomethylation in smoker patients with lung cancer. Oncotarget. 2018;9:4395-4410. [PubMed] [DOI] |
| 29. | He Y, Luo Y, Liang B, Ye L, Lu G, He W. Potential applications of MEG3 in cancer diagnosis and prognosis. Oncotarget. 2017;8:73282-73295. [PubMed] [DOI] |
| 30. | Terashima M, Ishimura A, Wanna-Udom S, Suzuki T. MEG8 long noncoding RNA contributes to epigenetic progression of the epithelial-mesenchymal transition of lung and pancreatic cancer cells. J Biol Chem. 2018;293:18016-18030. [PubMed] [DOI] |
| 31. | Zhang B, Dong Y, Zhao Z. LncRNA MEG8 regulates vascular smooth muscle cell proliferation, migration and apoptosis by targeting PPARα. Biochem Biophys Res Commun. 2019;510:171-176. [PubMed] [DOI] |
| 32. | 刘 筱雯. 基于转录组芯片筛选的lncRNAs在婴幼儿血管瘤中的作用及其机制研究. 济南: 山东大学 2017; . |
| 33. | Tabolacci C, De Martino A, Mischiati C, Feriotto G, Beninati S. The Role of Tissue Transglutaminase in Cancer Cell Initiation, Survival and Progression. Med Sci (Basel). 2019;7. [PubMed] [DOI] |
| 34. | Yang P, Yu D, Zhou J, Zhuang S, Jiang T. TGM2 interference regulates the angiogenesis and apoptosis of colorectal cancer via Wnt/β-catenin pathway. Cell Cycle. 2019;18:1122-1134. [PubMed] [DOI] |
| 35. | Lei Z, Chai N, Tian M, Zhang Y, Wang G, Liu J, Tian Z, Yi X, Chen D, Li X, Yu P, Hu H, Xu B, Jian C, Bian Z, Guo H, Wang J, Peng S, Nie Y, Huang N, Hu S, Wu K. Novel peptide GX1 inhibits angiogenesis by specifically binding to transglutaminase-2 in the tumorous endothelial cells of gastric cancer. Cell Death Dis. 2018;9:579. [PubMed] [DOI] |
| 36. | Leicht DT, Kausar T, Wang Z, Ferrer-Torres D, Wang TD, Thomas DG, Lin J, Chang AC, Lin L, Beer DG. TGM2: a cell surface marker in esophageal adenocarcinomas. J Thorac Oncol. 2014;9:872-881. [PubMed] [DOI] |
| 37. | Eckert RL, Fisher ML, Grun D, Adhikary G, Xu W, Kerr C. Transglutaminase is a tumor cell and cancer stem cell survival factor. Mol Carcinog. 2015;54:947-958. [PubMed] [DOI] |