修回日期: 2018-11-29
接受日期: 2019-01-22
在线出版日期: 2019-02-28
通过整理现代医学研究文献, 总结溃疡性结肠炎(ulcerative colitis, UC)的发病是以遗传易感性为背景, 环境、心理等多种因素共同作用的结果, 是以肠黏膜屏障(以生物屏障、免疫屏障为核心)损伤为中心, 涉及"神经-内分泌-免疫"网络(以脑肠肽为代表)的复杂慢性炎症过程, 并提出"菌-肠-脑轴"或可成为阐释UC发病机制的突破点.
核心提要: 本文主要通过文献查阅与总结, 认为溃疡性结肠炎(ulcerative colitis, UC)的发生是以肠黏膜屏障损伤为核心, 涉及"神经-内分泌-免疫"网络的复杂慢性炎症过程, 并提出"菌-肠-脑轴"或可成为阐释UC发病机制的突破点.
引文著录: 甄建华, 黄光瑞. 溃疡性结肠炎病因和发病机制的现代医学研究进展. 世界华人消化杂志 2019; 27(4): 245-251
Revised: November 29, 2018
Accepted: January 22, 2019
Published online: February 28, 2019
According to the modern medical research on ulcerative colitis (UC), many factors, including environmental and psychological factors as well as hereditary susceptibility, participate in the pathogenesis of UC, which is a complex process involving chronic inflammation. Intestinal mucosal barrier damage and disorder of neuroendocrine immune network, such as dysfunction of biological barrier, immune barrier, and brain-gut peptide, play a critical role in this process. Meanwhile, we suggest that the microbiome-gut-brain axis is the key to elucidating the pathogenesis of UC.
- Citation: Zhen JH, Huang GR. Etiology and pathogenesis of ulcerative colitis from the perspective of modern medicine. Shijie Huaren Xiaohua Zazhi 2019; 27(4): 245-251
- URL: https://www.wjgnet.com/1009-3079/full/v27/i4/245.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i4.245
溃疡性结肠炎(ulcerative colitis, UC)属于炎症性肠病(inflammatory bowel disease, IBD)的范畴, 是主要累及直肠、结肠黏膜和黏膜下层的慢性非特异性炎症, 临床以腹痛、腹泻、黏液脓血便等为主要表现, 以发作、缓解及复发交替为疾病特点, 好发于直肠和乙状结肠, 多见于20-40岁青壮年人群, 是消化系统的常见病、多发病、疑难病. 目前有关UC的病因、发病机制尚不明确, 现代医学认为其是在遗传、环境、心理等多种因素的共同影响下, 导致肠黏膜屏障损伤, 神经内分泌功能失调和免疫失衡, 从而引起肠黏膜局部溃疡而发病.
目前认为UC的发生是多因素共同作用的结果, 主要与遗传易感性、环境因素及心理因素有关, 现分述如下.
UC的发病具有种族差异性和家族聚集性, 多见于白种人, 而黄种人和黑种人的发病率则相对较低, 且不同人种的病变程度、患病部位及肠外表现亦有所差别. 据一项来自泰国某国际医院的就诊资料显示, 在2005至2010年间, 白种人的UC发病率为2.82‰, 黑种人的UC发病率仅为0.92‰, 且前者中有11.90%的患者表现为重度UC, 45.35%为全结肠炎, 9.30%伴发肠外症状, 而后者中则几乎全部为轻中度UC, 但有60%的患者为全结肠炎, 40%伴发肠外症状[1]. 另有文献研究表明, UC患者中IBD家族史阳性率高达12%[2]. 近年来的遗传学研究显示UC具有多基因联合的复杂遗传背景, 基因的多态性和异质性与其易感性密切相关, 如白介素(interleukin, IL)及其受体、人类白细胞抗原(human leucocyte antigen, HLA)及其受体的基因多态性均在UC的发病密切相关. 目前已有研究证据支持的与UC发病相关的基因包括HLA-DR2、HLA-DRB1、IL-6R、IL-10、IL-17、IL-23R、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、死亡受体4(death receptor 4, DR4)、维生素D受体(vitamin D receptor, VDR)、溶质相关载体26A3(solute-linked carrier family 26 member A3, SLC26A3)、岩藻糖基转移酶3(fucosyltransferase 3, FUT3)、亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase, MTHFR)、甲硫氨酸合成酶(methionine synthetase, MS)、酪氨酸磷酸酶(protein tyrosine phosphatase non-receptor type 2, PTPN2)、PTPN-22、MT-ND4、MAGI3、PTEN、TJP1、GSTM1等[3-19].
1.2 环境因素 UC发病率的种族差异, 除与遗传易感性有关外, 当属环境因素的影响最为明确, 其中又以饮食结构和吸烟状态的作用最为突出. 如有研究表明, UC患者的高脂饮食率显著高于健康对照组(49.73%与20.13%, P<0.01)[20], 且卡嗪胶摄食量是UC复发的诱因[21], 另外以反式脂肪、饱和脂肪为代表的促炎性饮食亦是UC发病的危险因素[22,23]; 而吸烟对于UC发病率的影响则是与GSTP1基因的多态性相关: 吸烟对UC发病的促进作用主要表现在GSTP1(GG/AG)个体中, 而在GSTP1(AA)个体中则表现得不甚明显[24].
1.3 心理因素 目前尚无明确的证据证明精神心理因素是UC发病的直接原因, 但不可否认的是, 精神心理状态与UC的病情之间具有双向作用[25]. 情绪紧张或低落抑郁均可加重UC患者的肠易激样症状[26], 而UC患者的消极应对情绪和压力感知水平也明显高于健康对照者[27,28], 并且也表现出更加明显的不安全感和依赖感[29].
上已述及, UC的发病具有复杂的遗传背景, 在基因多态性和异质性的基础上, 环境、心理等多种因素共同作用, 导致肠黏膜局部屏障功能受损, 上皮通透性改变, 神经内分泌调节紊乱, 肠道菌群易位, 其代谢产物侵入肠黏膜, 甚至入血, 激发或加重肠黏膜局部炎症反应, 最终导致溃疡形成.
UC患者结肠黏膜固有层内可见大量炎性细胞浸润, 且在其发病过程中伴随有多种IL、TNF等炎症因子的表达异常, 由此可见, 免疫失衡是UC发病的重要环节.
2.1.1 免疫细胞: 作为机体免疫调节的核心环节, T淋巴细胞据其功能的不同可分为辅助性T细胞(help T cell, Th)、抑制性T细胞(regulatory T cell, Treg)和细胞毒性T细胞(cytotoxic T cell, Tc), 目前有关UC发病机制的研究中主要涉及前两者, 即Th细胞和Treg细胞. Th细胞通过分泌相关细胞因子, 分别参与调节细胞免疫(Th1)、体液免疫(Th2)及自身免疫(Th17), 且各种细胞因子间保持动态平衡. Treg细胞则具有抑制炎症反应、避免免疫过度损伤机体的作用. 在正常肠道黏膜中, T淋巴细胞各组分处于动态平衡, 从而保持肠道黏膜免疫反应的稳定性, 若其中任何一种组分出现功能紊乱, 表现为亢进或低下, 均可导致平衡状态被打破从而引起炎症的发生. 如有研究指出, UC患者肠黏膜炎症组织中可检测出Th17、Treg细胞的富集, 且伴随有Th1、Th2、Th17细胞相关转录因子(T-bet、GATA-3、RORγt)含量的增高, 但外周血中Th17与Treg细胞含量的变化则不甚一致, 表现为Th17细胞比例的上调和Treg细胞比例的下调[30-34].
树突状细胞(Dendritic cells, DC)是目前所知功能最强大的抗原递呈细胞(antigen presenting cells, APC), 通过高效摄取、加工处理和递呈抗原, 激活T细胞从而参与机体的免疫应答, 处于启动、调控、维持免疫的中心环节. 据其来源可分为髓样DC(myeloid Dendritic cells, mDC)和浆细胞样DC(Plasmacytoid dendritic cells, pDC). 未成熟的DC通常分布于与外界接触的皮肤黏膜部位, 包括结肠黏膜上皮, 当其被外界抗原活化时即可迁移至肠黏膜淋巴组织中, 通过多种共刺激因子、跨膜糖蛋白的表达, 如CD11c、CD80、CD83、CD86、CD200/CD200R1等, 与其他免疫细胞相互作用, 刺激细胞因子的分泌, 从而导致炎症的发生. 已有研究表明, UC患者外周血中mDC和pDC的含量均较健康对照者明显减少, 但其细胞表面的CD80、CD86、CD200表达率明显上升[34-36]; 另有研究表明, UC患者肠黏膜局部的CD83mRNA含量明显上升, 表明活化的DC于肠黏膜内聚集并启动免疫反应[37,38].
2.1.2 细胞因子: 作为免疫反应中的重要信号传递者, 长期而持久的细胞因子分泌失衡可使炎症反应呈现慢性化表现. 目前已知与UC发病密切相关的细胞因子主要涉及IL、TNF、干扰素(interferon, IFN)和转化生长因子(transforming growth factor, TGF), 如已知UC模型大鼠结肠组织及血清中的促炎性因子IL-1、IL-1β、IL-6、IL-23、TNF-α及IFN-γ含量均显著升高, 而IL-4、IL-13、TGF-β1含量显著降低[39-42], 结肠组织中IL-8含量显著升高[43,44], 外周血清中IL-8、IL-17、IL-18含量显著升高, 而IL-10含量显著降低[45-47]; UC患者中也表现出相同的变化趋势[48-52].
神经内分泌功能主要由神经内分泌细胞分泌的神经激素介导调控, 是神经系统与内分泌系统之间协同作用、维持机体内部稳态的表现, 其既可以神经递质的形式调节神经反馈, 又能发挥内分泌激素的局部调节作用, 同时还可结合免疫细胞上的相关受体参与免疫应激, 因此又称为"神经-内分泌-免疫" 网络. 目前UC相关发病机制研究中涉及的神经内分泌激素以脑肠轴相关多肽, 即脑肠肽, 为主要切入点. 如已有研究表明, UC患者血清中的胃动素(motilin, MTL)、血管活性肠肽(vasoactive intestinal peptide, VIP)较之对照者显著升高, 而神经肽Y(neuropeptide Y, NPY)则显著降低, 其结肠黏膜组织中的VIP mRNA含量却显著降低[53,54]. 脑肠肽分泌紊乱, 一方面作用于肠神经系统, 导致肠道平滑肌收缩、痉挛, 肠黏膜缺血, 另一方面以自分泌或旁分泌的形式作用于肠黏膜免疫系统, 促进其对肠道菌群的免疫应答, 引起多种促炎性因子的释放, 从而导致局部炎症的形成.
肠黏膜屏障分为机械屏障、生物屏障、免疫屏障和化学屏障四部分, 各屏障之间既相互独立, 又相互影响, 形成了一个能够共同抵抗外来致病物质侵害的复杂防御体系.
2.3.1 机械屏障: 机械屏障是指完整的彼此紧密连接的肠黏膜上皮细胞及其分泌的黏液, 其结构基础为肠黏膜上皮细胞的完整性及其之间的紧密连接, 可有效防止外源性物质侵入组织深部, 是肠黏膜屏障的重要组成部分. 肠黏膜上皮为单层柱状上皮, 其间分布有杯状细胞, 可分泌由水分、黏蛋白(mucin, MUC)、肠三叶因子(intestinal trefoil factor, ITF)等为主要成分的粘液[55], 除润滑肠道之外, 尚可避免肠道微生物与肠上皮直接接触, 减少机械性、化学性损伤的风险; 肠黏膜上皮细胞间的紧密连接由咬合蛋白occludin、闭合蛋白claudin、连接黏附分子(junction adhesion molecule, JAMs)三种完整的跨膜蛋白和闭合小环蛋白(ZO-1、ZO-2、ZO-3)等外周胞浆蛋白组成, 能有效阻止病原微生物通过上皮细胞, 是固有免疫的主要组成部分. 既往研究提示, 在UC的发病过程中, 伴随有肠黏膜上皮细胞损伤, 杯状细胞数量明显减少, 且伴有线粒体肿胀、内质网扩张等结构破坏, 黏蛋白合成量也明显降低, 同时伴有紧密连接蛋白occludin、claudin及ZO-1表达异常[56-61].
2.3.2 生物屏障: 肠道微生态, 即定植于肠道内的正常细菌、病毒、真菌等微生物的总称, 总数可达1014, 共同参与宿主的营养代谢与免疫应激, 并具有生物屏障功能. 其中以肠道菌群为当前研究的热点. 一方面, 肠道菌群可将饮食中的植物纤维分解为多种氨基酸、维生素及短链脂肪酸(short chain fatty acids, SCFAs)等, 除为宿主提供必需的营养成分之外, 以丁酸为代表的SCFAs亦是肠黏膜上皮细胞合成紧密连接蛋白的必要条件, 且可通过肠黏膜上皮细胞表面蛋白受体参与炎症反应; 另一方面, 肠道菌群亦可分泌多种抗菌肽抑制外来致病菌的定植与生长; 此外, 肠道菌群作为原驻优势微生物, 占据了主要的生存、定植空间, 在维持群落微生物稳态的情况下, 产生定植抗力以抵抗致病菌的侵袭. 已有研究证实, UC患者伴有肠道菌群失调, 主要表现为菌群多样性的减少及优势菌群丰度的变化, 优势菌群涉及厚壁菌门、拟杆菌门、变形菌门及梭杆菌门[62-65], 其中以Faecali bacterium为代表的丁酸产生菌丰度显著下降, 即可导致肠道机械屏障障碍、免疫失衡而引起UC发病.
2.3.3 免疫屏障: 肠黏膜免疫屏障由肠相关淋巴组织(gut-associated lymphoid tissue, GALT)构成, 包含有黏膜相关淋巴样组织及弥散免疫细胞, 前者主要是指分布于消化道内的集合淋巴小结, 即Peyer结, 及黏膜下淋巴组织, 后者主要是指分布于黏膜固有层及上皮下的相对密集或散在的免疫细胞, 以上皮内淋巴细胞(intraepithelial lymphocytes, IELs)和固有层淋巴细胞(lamina propria lymphocytes, LPLs)为代表[66,67]. Peyer结内包含B细胞及Th细胞, 主要行使免疫诱导与活化作用; IELs主要为Tc细胞, 具有较强的细胞毒性作用, 并能分泌多种细胞因子, 如IL、TNF-α、IFN-γ、TGF等, 参与炎症免疫; LPLs包括B细胞、T细胞、巨噬细胞等, 主要功能为合成、分泌免疫球蛋白A(immunoglobulin A, IgA)和IgM, 其中部分IgA以外分泌的形式与黏膜上皮细胞的分泌片(secretory component, SC)结合形成分泌型IgA(secretory immunoglobulin A, sIgA), 与肠腔内的病原微生物形成抗原抗体复合物, 继而发挥免疫效应, 是肠黏膜局部免疫的重要组分[67,68]. 已有研究表明, 较之健康对照者, UC患者肠黏膜固有层中的CD3+ T细胞明显增多, IELs增高虽无统计学意义, 但其主导分泌的IL-1β含量明显升高[69,70]; 而在UC动物模型中, IELs亚群比例发生改变, LPLs凋亡率降低, 且结肠组织内的sIgA含量明显降低[71-74]. 由此可知, 肠道免疫屏障受损是UC炎症持续存在的关键.
2.3.4 化学屏障: 消化系统内分泌的肠液、胆汁、胰液及各种消化酶等均汇聚于肠道内, 共同构成化学屏障, 发挥一定的抗菌作用. 但由于取样方法的限制及肠道环境的复杂性等因素, 目前尚无相关研究涉及于此.
前已述及, 肠黏膜屏障各部分之间存在相互联系; 如化学屏障构成的酸碱平衡为保持机械屏障完整性的重要条件, 也是免疫屏障中sIgA发挥效用的外环境, 直接影响其生物活性; 生物屏障产生的SCFAs既参与了机械屏障中紧密连接蛋白的合成[61], 亦是构成化学屏障的组分, 同时还可通过肠黏膜上皮细胞表面的蛋白受体参与炎症调节, 此外, 生物屏障中的微生物个体本身亦可作为免疫刺激源介导GALT内的免疫应答, 参与免疫屏障功能的发挥, 而化学屏障、机械屏障、免疫屏障也共同构成了生物屏障的生存环境, 对其群落结构具有调节作用. 由此可知, 肠黏膜屏障是一个复杂的防御体系, 而以肠道菌群为代表的生物屏障及免疫屏障处于其核心地位.
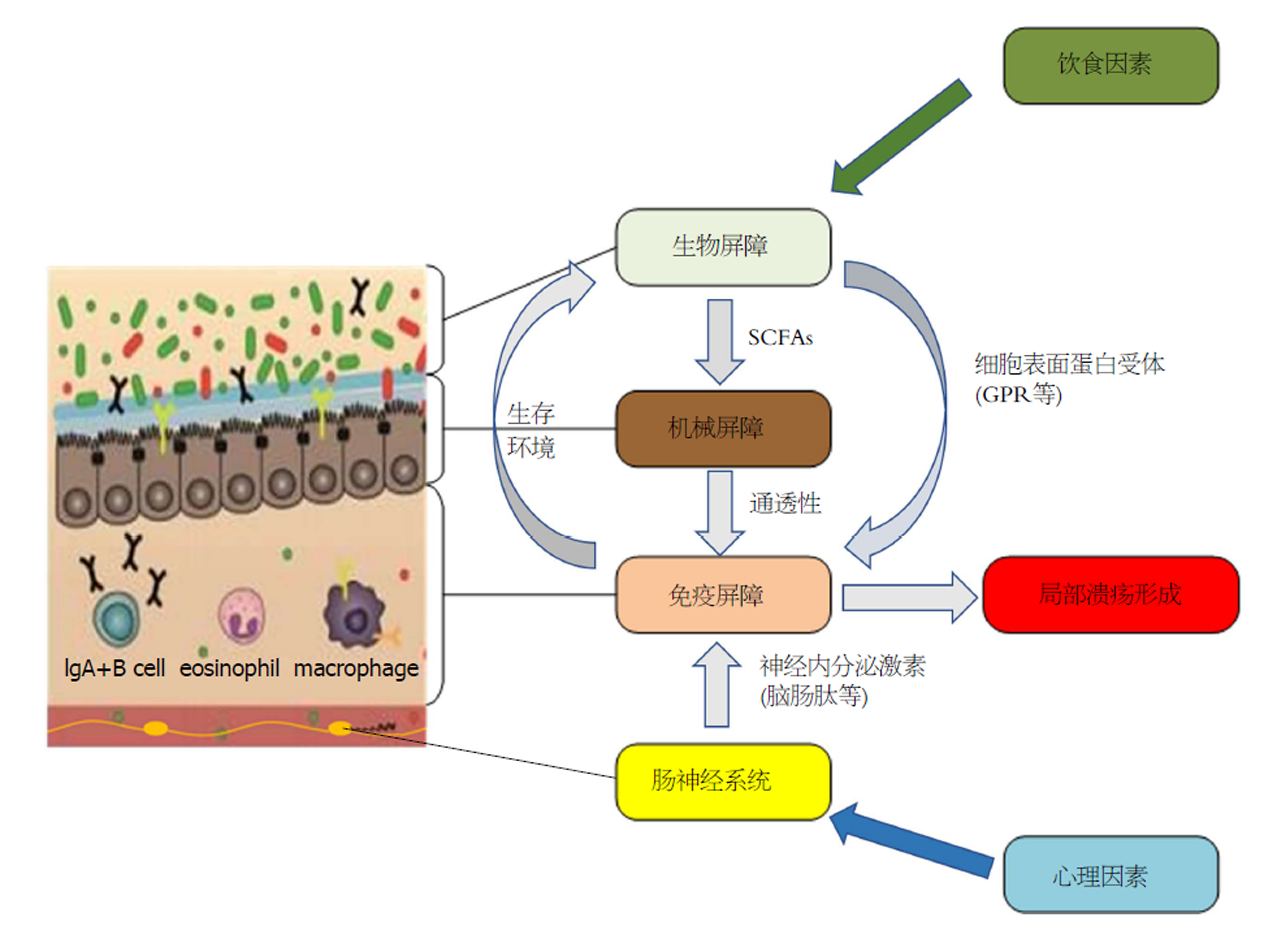
在上述UC相关病因、发病机制研究的基础上, 我们推测: 在遗传易感性的背景下, 饮食、心理等因素或直接作用于肠道菌群, 引起肠黏膜生物屏障损伤, 进而导致机械屏障功能障碍, 肠黏膜通透性增高, 外源性致病菌或肠道正常菌群及其代谢产物侵入肠黏膜上皮, 诱发免疫屏障紊乱而形成局部溃疡; 或通过影响神经内分泌激素参与调节免疫应答, 导致肠黏膜免疫屏障功能损伤, 进而引起肠道微环境的改变, 影响肠道菌群在肠黏膜及肠腔内的定植, 诱发生物屏障障碍, 加重免疫炎症损伤, 形成闭合环路反应而促进局部溃疡的发生(图1). 由此可见, UC的发生是以肠黏膜屏障损伤为中心, 涉及"神经-内分泌-免疫"网络的复杂慢性炎症过程; 但当前研究多局限于单一视角、单一环节、单一靶点, 并未将肠黏膜屏障与"神经-内分泌-免疫"网络作为统一整体进行研究与阐述, 从而导致研究结果的不全面性与偏颇性.
前已述及, UC发病过程中伴随着脑肠肽的分泌紊乱, 并通过"神经-内分泌-免疫"网络调节炎症反应, 导致局部溃疡形成; 肠道菌群失调亦可通过对肠黏膜机械、免疫屏障的影响, 诱发免疫失衡而形成局部溃疡. 但近年来有研究提示, 肠道菌群可通过分泌神经递质, 如5-羟色胺(5-hydroxytryptamine, 5-HT)、γ-氨基丁酸(gamma aminobutyric acid, GABA)等, 直接作用于肠神经系统, 调控脑肠轴相关活动; 而脑肠轴分泌的多种肽类物质, 如MTL、VIP等, 亦可通过调节炎症因子的合成与分泌, 影响肠腔内环境, 从而对肠道菌群结构产生一定的影响[75]. 因此, "菌-肠-脑轴"(microbiome gut brain axis, MGBA)这一双向调节概念应运而生, 为肠黏膜屏障与"神经-内分泌-免疫"网络的结合性研究提供了一个可能的切入点. 目前关于MGBA的研究多为理论探索, 预期所涉疾病主要涵盖消化系统疾病及神经系统疾病, 如肠易激综合征(irritable bowel syndrome, IBS)、帕金森病(parkinson's disease, PD)、抑郁症等[76-78], 但尚无临床证据对其相关内容进行系统阐释. 既往研究中提示, UC患者的疾病活动与情绪心理障碍之间具有双向作用, 焦虑情绪可将UC复发风险提高6倍以上, UC患者的焦虑抑郁情绪也较之健康人明显升高[25,27-29], 因此, MGBA或可成为阐释UC发病机制的突破口.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Permpoon V, Pongpirul K, Anuras S. Ethnic variations in ulcerative colitis: Experience of an international hospital in Thailand. World J Gastrointest Pharmacol Ther. 2016;7:428-433. [PubMed] [DOI] |
| 2. | Childers RE, Eluri S, Vazquez C, Weise RM, Bayless TM, Hutfless S. Family history of inflammatory bowel disease among patients with ulcerative colitis: a systematic review and meta-analysis. J Crohns Colitis. 2014;8:1480-1497. [PubMed] [DOI] |
| 3. | Venkateswaran S, Prince J, Cutler DJ, Marigorta UM, Okou DT, Prahalad S, Mack D, Boyle B, Walters T, Griffiths A, Sauer CG, LeLeiko N, Keljo D, Markowitz J, Baker SS, Rosh J, Pfefferkorn M, Heyman MB, Patel A, Otley A, Baldassano R, Noe J, Rufo P, Oliva-Hemker M, Davis S, Zwick ME, Gibson G, Denson LA, Hyams J, Kugathasan S. Enhanced Contribution of HLA in Pediatric Onset Ulcerative Colitis. Inflamm Bowel Dis. 2018;24:829-838. [PubMed] [DOI] |
| 5. | Parisinos CA, Serghiou S, Katsoulis M, George MJ, Patel RS, Hemingway H, Hingorani AD. Variation in Interleukin 6 Receptor Gene Associates With Risk of Crohn's Disease and Ulcerative Colitis. Gastroenterology. 2018;155:303-306.e2. [PubMed] [DOI] |
| 10. | 姜 利佳, 朱 丽明, 胡 向跃, 李 成安, 金 捷, 杜 君彦, 黄 志养, 黄 春伟, 蔡 静, 周 晴接. 溃疡性结肠炎患者DR4和DR5基因单核苷酸多态性分析. 实用医学杂志. 2015;31:3684-3687. [DOI] |
| 12. | 郑 波, 闵 小彦, 王 建嶂, 裴 继华, 徐 昌隆, 蒋 益. 维生素D受体基因Bsm I、Apa I、Taq I单核苷酸多态性与溃疡性结肠炎的相关性分析. 中华全科医学. 2016;14:368-370. [DOI] |
| 13. | 陈 一鹏, 杨 威, 吴 超群, 吴 小丽, 金 捷, 余 俐琴, 蒋 益. 291例溃疡性结肠炎患者中溶质相关载体26A3基因多态性分析. 医学研究杂志. 2017;46:105-111. [DOI] |
| 14. | 吴 昊, 叶 方鹏, 王 文星, 林 秀清, 林 道泼, 金 捷, 蒋 益. FUT2和FUT3基因多态性及其表达与溃疡性结肠炎的关系. 解放军医学杂志. 2017;42:34-40. [DOI] |
| 17. | Dankowski T, Schröder T, Möller S, Yu X, Ellinghaus D, Bär F, Fellermann K, Lehnert H, Schreiber S, Franke A, Sina C, Ibrahim SM, König IR. Male-specific association between MT-ND4 11719 A/G polymorphism and ulcerative colitis: a mitochondria-wide genetic association study. BMC Gastroenterol. 2016;16:118. [PubMed] [DOI] |
| 18. | Norén E, Almer S, Söderman J. Genetic variation and expression levels of tight junction genes identifies association between MAGI3 and inflammatory bowel disease. BMC Gastroenterol. 2017;17:68. [PubMed] [DOI] |
| 19. | Moini M, Saadat M, Saadat H, Esmailnejad A, Safarpour A. Association Study of Glutathione S-transferases Gene Polymorphisms (GSTM1 and GSTT1) with Ulcerative Colitis and Crohn's Disease in the South of Iran. Adv Biomed Res. 2017;6:67. [PubMed] [DOI] |
| 20. | 张 超贤, 郭 李柯, 郭 晓凤. 环氧合酶-2-1195G/A和锰超氧化物歧化酶9Ala/Val基因多态性与高脂饮食的交互作用及其与溃疡性结肠炎的关系. 中国医学科学院学报. 2015;37:37-43. [DOI] |
| 21. | Bhattacharyya S, Shumard T, Xie H, Dodda A, Varady KA, Feferman L, Halline AG, Goldstein JL, Hanauer SB, Tobacman JK. A randomized trial of the effects of the no-carrageenan diet on ulcerative colitis disease activity. Nutr Healthy Aging. 2017;4:181-192. [PubMed] [DOI] |
| 22. | Shivappa N, Hébert JR, Rashvand S, Rashidkhani B, Hekmatdoost A. Inflammatory Potential of Diet and Risk of Ulcerative Colitis in a Case-Control Study from Iran. Nutr Cancer. 2016;68:404-409. [PubMed] [DOI] |
| 23. | Shivappa N, Steck SE, Hurley TG, Hussey JR, Hébert JR. Designing and developing a literature-derived, population-based dietary inflammatory index. Public Health Nutr. 2014;17:1689-1696. [PubMed] [DOI] |
| 24. | Ananthakrishnan AN, Nguyen DD, Sauk J, Yajnik V, Xavier RJ. Genetic polymorphisms in metabolizing enzymes modifying the association between smoking and inflammatory bowel diseases. Inflamm Bowel Dis. 2014;20:783-789. [PubMed] [DOI] |
| 25. | Gracie DJ, Guthrie EA, Hamlin PJ, Ford AC. Bi-directionality of Brain-Gut Interactions in Patients With Inflammatory Bowel Disease. Gastroenterology. 2018;154:1635-1646.e3. [PubMed] [DOI] |
| 26. | Jonefjäll B, Öhman L, Simrén M, Strid H. IBS-like Symptoms in Patients with Ulcerative Colitis in Deep Remission Are Associated with Increased Levels of Serum Cytokines and Poor Psychological Well-being. Inflamm Bowel Dis. 2016;22:2630-2640. [PubMed] [DOI] |
| 27. | Kuroki T, Ohta A, Aoki Y, Kawasaki S, Sugimoto N, Ootani H, Tsunada S, Iwakiri R, Fujimoto K. Stress maladjustment in the pathoetiology of ulcerative colitis. J Gastroenterol. 2007;42:522-527. [PubMed] [DOI] |
| 29. | Agostini A, Spuri Fornarini G, Ercolani M, Campieri M. Attachment and perceived stress in patients with ulcerative colitis, a case-control study. J Psychiatr Ment Health Nurs. 2016;23:561-567. [PubMed] [DOI] |
| 30. | Globig AM, Hennecke N, Martin B, Seidl M, Ruf G, Hasselblatt P, Thimme R, Bengsch B. Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+coproducing CD4+ T cells in active inflammatory bowel disease. Inflamm Bowel Dis. 2014;20:2321-2329. [PubMed] [DOI] |
| 31. | 吴 昊, 夏 盛隆, 夏 宣平, 徐 昌隆, 胡 定元, 邵 晓晓, 蒋 益. 结肠组织中Th1/Th2和Th17细胞失衡与溃疡性结肠炎的关系. 解放军医学杂志. 2017;42:793-798. [DOI] |
| 32. | Li J, Ueno A, Fort Gasia M, Luider J, Wang T, Hirota C, Jijon HB, Deane M, Tom M, Chan R, Barkema HW, Beck PL, Kaplan GG, Panaccione R, Qian J, Iacucci M, Gui X, Ghosh S. Profiles of Lamina Propria T Helper Cell Subsets Discriminate Between Ulcerative Colitis and Crohn's Disease. Inflamm Bowel Dis. 2016;22:1779-1792. [PubMed] [DOI] |
| 34. | Elshal MF, Aldahlawi AM, Saadah OI, McCoy JP. Reduced Dendritic Cells Expressing CD200R1 in Children with Inflammatory Bowel Disease: Correlation with Th17 and Regulatory T Cells. Int J Mol Sci. 2015;16:28998-29010. [PubMed] [DOI] |
| 35. | 郑 天送, 贾 妮娜, 王 香莉, 肖 晋美, 高 虹, 张 继萍, 张 桓虎. 树突状细胞及TLR2、TLR9表达在溃疡性结肠炎中的作用研究. 临床医药实践. 2016;25:7-10. [DOI] |
| 36. | 王 香莉, 郑 天送, 贾 妮娜, 肖 晋美, 高 虹, 张 继萍, 张 桓虎. 活动期溃疡性结肠炎患者外周血中CD11c+髓样树突状细胞频数和细胞表型的变化. 中国继续医学教育. 2016;8:33-35. [DOI] |
| 37. | 田 志颖, 王 丽华, 苏 新爱, 李 炜, 班 海玲, 王 彦红, 孙 建顺, 袁 双珍. 溃疡性结肠炎患者树突状细胞及IL-6、IL-12研究. 胃肠病学和肝病学杂志. 2010;19:1036-1039. [DOI] |
| 38. | 巫 华志, 蔡 曼妮, 谭 玲婵, 肖 倩, 孙 晓宁. RunX3基因调节TGF-β1介导的树突状细胞在溃疡性结肠炎中的作用. 海南医学院学报. 2014;20:1305-1308; 1312. [DOI] |
| 39. | 殷 银霞, 许 雅清, 李 海龙, 邱 家权, 程 小丽, 明 海霞, 梁 永林, 吴 玉泓. IL-1、IL-6、TNF-α及IFN-γ在脾肾阳虚型溃疡性结肠炎模型大鼠血清及组织中的表达. 中国实验动物学报. 2015;23:139-142. [DOI] |
| 40. | Zhang H, Gong C, Qu L, Ding X, Cao W, Chen H, Zhang B, Zhou G. Therapeutic effects of triptolide via the inhibition of IL-1β expression in a mouse model of ulcerative colitis. Exp Ther Med. 2016;12:1279-1286. [PubMed] [DOI] |
| 42. | Pervin M, Hasnat MA, Lim JH, Lee YM, Kim EO, Um BH, Lim BO. Preventive and therapeutic effects of blueberry (Vaccinium corymbosum) extract against DSS-induced ulcerative colitis by regulation of antioxidant and inflammatory mediators. J Nutr Biochem. 2016;28:103-113. [PubMed] [DOI] |
| 43. | 丁 凌辉, 贾 育新, 成 映霞, 马 文, 段 永强, 明 海霞, 万 生芳, 程 小丽. 参苓白术散对脾虚湿困型溃疡性结肠炎大鼠结肠IL-13、IL-23及COX-2、CREB表达的影响. 中国实验方剂学杂志. 2018;24:67-72. [DOI] |
| 47. | 张 瑞芳, 陈 朝晖, 李 灿, 刘 海荣, 刘 漪沦, 刘 卫华. 白头翁复方灌肠对溃疡性结肠炎模型大鼠MUC2、IL-6及IL-10的影响. 成都医学院学报. 2018;13:135-141. [DOI] |
| 48. | 张 海峰, 周 国雄, 张 彬. IL-1β在溃疡性结肠炎中的表达及意义. 南通大学学报(医学版). 2016;36:417-420. [DOI] |
| 50. | 马 旭园, 代 志峰, 王 慧超, 杨 静楠, 唐 向阳, 康 玉华, 丁 春生, 李 玉霞, 杨 瑞林, 林 旭红. 溃疡性结肠炎患者肠道菌群的变化及其与IL-23/IL-17轴的关系. 中国病理生理杂志. 2018;34:884-892. [DOI] |
| 52. | Spagnuolo R, Dattilo V, D'Antona L, Cosco C, Tallerico R, Ventura V, Conforti F, Camastra C, Mancina RM, Catalogna G, Cosco V, Iuliano R, Carbone E, Perrotti N, Amato R, Doldo P. Deregulation of SGK1 in Ulcerative Colitis: A Paradoxical Relationship Between Immune Cells and Colonic Epithelial Cells. Inflamm Bowel Dis. 2018;. [PubMed] [DOI] |
| 56. | 洪 流东, 黄 会云, 陈 玉, 陈 思羽, 张 涛. 健脾清热活血类方药对溃疡性结肠炎肠黏膜功能障碍及claudin-2、claudin-5的影响. 中国中西医结合消化杂志. 2015;23:599-603; 607. [DOI] |
| 57. | Poritz LS, Harris LR, Kelly AA, Koltun WA. Increase in the tight junction protein claudin-1 in intestinal inflammation. Dig Dis Sci. 2011;56:2802-2809. [PubMed] [DOI] |
| 59. | 卫 江鹏, 刘 刚, 张 霆, 王 建林, 刘 彤. 溃疡性结肠炎患者肠道机械屏障变化与STAT3信号通路关系的研究. 胃肠病学与肝病学杂志. 2016;25:47-50. [DOI] |
| 60. | Dorofeyev AE, Vasilenko IV, Rassokhina OA, Kondratiuk RB. Mucosal barrier in ulcerative colitis and Crohn's disease. Gastroenterol Res Pract. 2013;2013:431231. [PubMed] [DOI] |
| 61. | Devriese S, Eeckhaut V, Geirnaert A, Van den Bossche L, Hindryckx P, Van de Wiele T, Van Immerseel F, Ducatelle R, De Vos M, Laukens D. Reduced Mucosa-associated Butyricicoccus Activity in Patients with Ulcerative Colitis Correlates with Aberrant Claudin-1 Expression. J Crohns Colitis. 2017;11:229-236. [PubMed] [DOI] |
| 62. | 余 今菁, 李 欢, 胡 邱宇, 魏 舒, 王 强, 方 沈应, 吴 清明. 基于高通量测序技术的溃疡性结肠炎患者肠道菌群多样性研究. 华中科技大学学报(医学版). 2018;47:460-465. [DOI] |
| 64. | Shah R, Cope JL, Nagy-Szakal D, Dowd S, Versalovic J, Hollister EB, Kellermayer R. Composition and function of the pediatric colonic mucosal microbiome in untreated patients with ulcerative colitis. Gut Microbes. 2016;7:384-396. [PubMed] [DOI] |
| 65. | Duranti S, Gaiani F, Mancabelli L, Milani C, Grandi A, Bolchi A, Santoni A, Lugli GA, Ferrario C, Mangifesta M, Viappiani A, Bertoni S, Vivo V, Serafini F, Barbaro MR, Fugazza A, Barbara G, Gioiosa L, Palanza P, Cantoni AM, de'Angelis GL, Barocelli E, de'Angelis N, van Sinderen D, Ventura M, Turroni F. Elucidating the gut microbiome of ulcerative colitis: bifidobacteria as novel microbial biomarkers. FEMS Microbiol Ecol. 2016;92. [PubMed] [DOI] |
| 69. | Torrente F, Barabino A, Bellini T, Murch SH. Intraepithelial lymphocyte eotaxin-2 expression and perineural mast cell degranulation differentiate allergic/eosinophilic colitis from classic IBD. J Pediatr Gastroenterol Nutr. 2014;59:300-307. [PubMed] [DOI] |
| 70. | Regner EH, Ohri N, Stahly A, Gerich ME, Fennimore BP, Ir D, Jubair WK, Görg C, Siebert J, Robertson CE, Caplan L, Frank DN, Kuhn KA. Functional intraepithelial lymphocyte changes in inflammatory bowel disease and spondyloarthritis have disease specific correlations with intestinal microbiota. Arthritis Res Ther. 2018;20:149. [PubMed] [DOI] |
| 72. | 李 志晋, 詹 丽英, 胡 俊, 郑 闽, 徐 燕琴, 马 春曦. 地塞米松对溃疡性结肠炎鼠外周血及肠黏膜固有层淋巴细胞凋亡的影响. 江西医药. 2013;48:386-387; 396. [DOI] |
| 73. | 韩 桂华, 王 春敏, 孙 雪丹, 遇 常红, 郑 强, 陈 刚, 颜 玉, 鲍 秀琦. 低聚果糖对溃疡性结肠炎模型小鼠肠黏膜屏障影响的研究. 中国微生态学杂志. 2017;29:139-141. [DOI] |
| 74. | 傅 永锦, 张 小牧, 连 大卫, 吕 俊华, 梁 基智, 潘 竞锵. 肠炎清对溃疡性结肠炎模型大鼠中分泌型免疫球蛋白A和P选择素的影响. 中国实验方剂学杂志. 2014;20:148-152. [DOI] |
| 76. | Moser G, Fournier C, Peter J. Intestinal microbiome-gut-brain axis and irritable bowel syndrome. Wien Med Wochenschr. 2018;168:62-66. [PubMed] [DOI] |
| 77. | Caputi V, Giron MC. Microbiome-Gut-Brain Axis and Toll-Like Receptors in Parkinson's Disease. Int J Mol Sci. 2018;19. [PubMed] [DOI] |
| 78. | Cepeda MS, Katz EG, Blacketer C. Microbiome-Gut-Brain Axis: Probiotics and Their Association With Depression. J Neuropsychiatry Clin Neurosci. 2017;29:39-44. [PubMed] [DOI] |