修回日期: 2019-05-27
接受日期: 2019-08-02
在线出版日期: 2019-11-28
胃癌(gastric cancer, GC)作为一种常见的恶性肿瘤, 在疾病的发生、发展及手术的过程中极易发生营养不良的情况. 快速康复(fast track surgery, FTS)作为一种基于循证医学的围手术期医疗理念, 在营养管理中发挥着重要的作用, 包括术前营养不良筛查和治疗、术前营养管理, 术后早期口服喂养、加速促进胃肠道功能的恢复、提供营养支持. 基于一系列的小样本研究, FTS在GC腹腔镜营养管理中的安全性和重要性逐渐显现, 而临床实施中却进展困难. 本文将就近十年来FTS在GC腹腔镜营养管理领域的研究进展进行综述.
核心提要: 胃癌(gastric cancer, GC)及胃癌术后导致的营养不良严重影响患者的生存质量, 快速康复(fast track surgery, FTS)在术前和术后营养层面的管理为GC患者提供了更高的生存获益, 为更好的发挥FTS的作用效果, 要进一步推动FTS在GC腹腔镜营养管理领域的发展.
引文著录: 苗瑛铭, 王杰, 刘君儿, 李珑. 快速康复理念下胃癌腹腔镜手术患者营养管理研究现状. 世界华人消化杂志 2019; 27(22): 1349-1355
Revised: May 27, 2019
Accepted: August 2, 2019
Published online: November 28, 2019
As a common malignant tumor, patients with gastric cancer (GC) are prone to malnutrition during the development and treatment of the disease. Fast track surgery (FTS), as a perioperative medical concept based on evidence-based medicine, plays an important role in nutrition management, including preoperative malnutrition screening and treatment, preoperative nutritional management, postoperative early oral feeding, accelerated promotion of gastrointestinal function recovery, and nutritional support. Based on a series of small sample studies, the safety and importance of FTS in laparoscopic nutrition management of GC are gradually emerging, but clinical implementation is difficult. This article will review the research progress of FTS in the field of laparoscopic nutrition management of GC in the past decade.
- Citation: Miao YM, Wang J, Liu JE, Li L. Nutritional management of patients undergoing laparoscopic surgery for gastric cancer based on the concept of rapid rehabilitation. Shijie Huaren Xiaohua Zazhi 2019; 27(22): 1349-1355
- URL: https://www.wjgnet.com/1009-3079/full/v27/i22/1349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i22.1349
胃癌(gastric cancer, GC)作为全球第四大常见恶性肿瘤, 同时也在全球所有恶性肿瘤的致死率中占据第二位, 全球发病率差异很大, 其中中国、日本、拉丁美洲和东欧的发病率最高, 尽管在过去的30-40年中, 我国总生存率稳定保持为30%-40%[1], 同时GC的发病率稳步下降[2], 但相较术后生存率高达90%的日本仍有很大的差距[3]. GC根治术是GC的主要治疗手段[4], 除传统的开腹手术外, 近年来腹腔镜手术也逐渐在临床上应用发展, 但术后发生营养不良及其并发症的情况仍屡见不鲜, 这严重影响了患者术后康复情况, 因此GC术后营养管理成为临床中评估和实施的重点内容[5]. 近年来, 快速康复(fast track surgery, FTS)已被广泛证实在结直肠癌、妇科手术中对患者的营养管理有重要意义[6]; 目前, 这一理念也引入GC腹腔镜领域, 一系列小样本研究和Meta分析也证实FTS在GC营养管理方面取得了令人欣喜的结果. 本文将近年FTS理念下GC腹腔镜手术患者营养管理的研究现状进行简要综述.
FTS, 又称术后加速康复(enhanced recovery after surgery, ERAS), 是指通过多学科的协作, 遵循基于循证医学证据的围手术期医疗理念, 对常规临床和护理措施进行优化和改良, 从而加速术后病人的FTS的重要理念[7]. 腹腔镜手术与FTS理念相结合的治疗方式, 更好的实现了对GC手术患者的营养管理, FTS[6]主要包括术前营养不良筛查和治疗、术前营养管理, 术后早期口服喂养、提供营养支持和加速促进胃肠道功能的恢复.
受到肿瘤的机械作用造成的上消化道阻塞, 可能会导致GC患者出现吞咽困难、早饱、恶心和呕吐, 这些情况可能导致癌症相关性营养不良[8]. 根据2018年西班牙医学肿瘤学会癌症患者营养临床指南[9], 营养缺乏症已经影响了15%-40%的癌症患者, 晚期癌症确认中度或重度营养不良的发生率为52%, 其中GC的发生率为50%, 仅次于食管癌之后; 另还有36.4%的肿瘤患者在出院时处于营养风险中[10]. 15%诊断为GC的患者在前6 mo内体重损失>10%, 在GC的高级阶段中, 80%的GC患者发生营养不良[11,12], 尽管如此, 临床上仅有1/3的患者获得了营养支持[13]. 因此营养不良的筛查和治疗是GC手术患者治疗的一项重要内容, 也是开展GC患者营养管理的重要前提.
但也并非全部的GC患者都存在营养不良的问题, 因此首先要对患者进行营养不良筛查和营养状态的评估. 在传统观念下, 营养不良筛查被认为是护理领域中对住院患者进行的常规评定项目, 其测量结果常被用来评估是否存在压疮风险. 在FTS领域, 营养不良筛查与营养状态的评定是术前评估的重要内容, 也是术后并发症的独立预后因素, 在促进FTS方面具有重要意义. 具体来说: (1)GC患者大都有明显的食欲减退、恶心、呕吐等影响营养物质消化吸收的症状, 导致GC患者的淋巴细胞、免疫球蛋白、补体及细胞因子普遍较低, 使机体的免疫功能的受损, 机体肿瘤抑制功能的减弱, 增加肿瘤复发转移的风险, 因此改善GC手术患者的营养状况至关重要[14]; (2)纠正术前营养不良, 可以减少术后感染和吻合口瘘的发生率等并发症的发生[15]; (3)肿瘤患者会因为疼痛、焦虑和食欲不振等原因导致术后营养不良的发生, 因此术前的营养支持能够对改善围手术期患者的营养状态进行优化处理, 保证患者营养物质充足[16], 术前的营养支持会根据患者个体情况设定每日营养目标, 并优先选择经口营养或肠内营养.
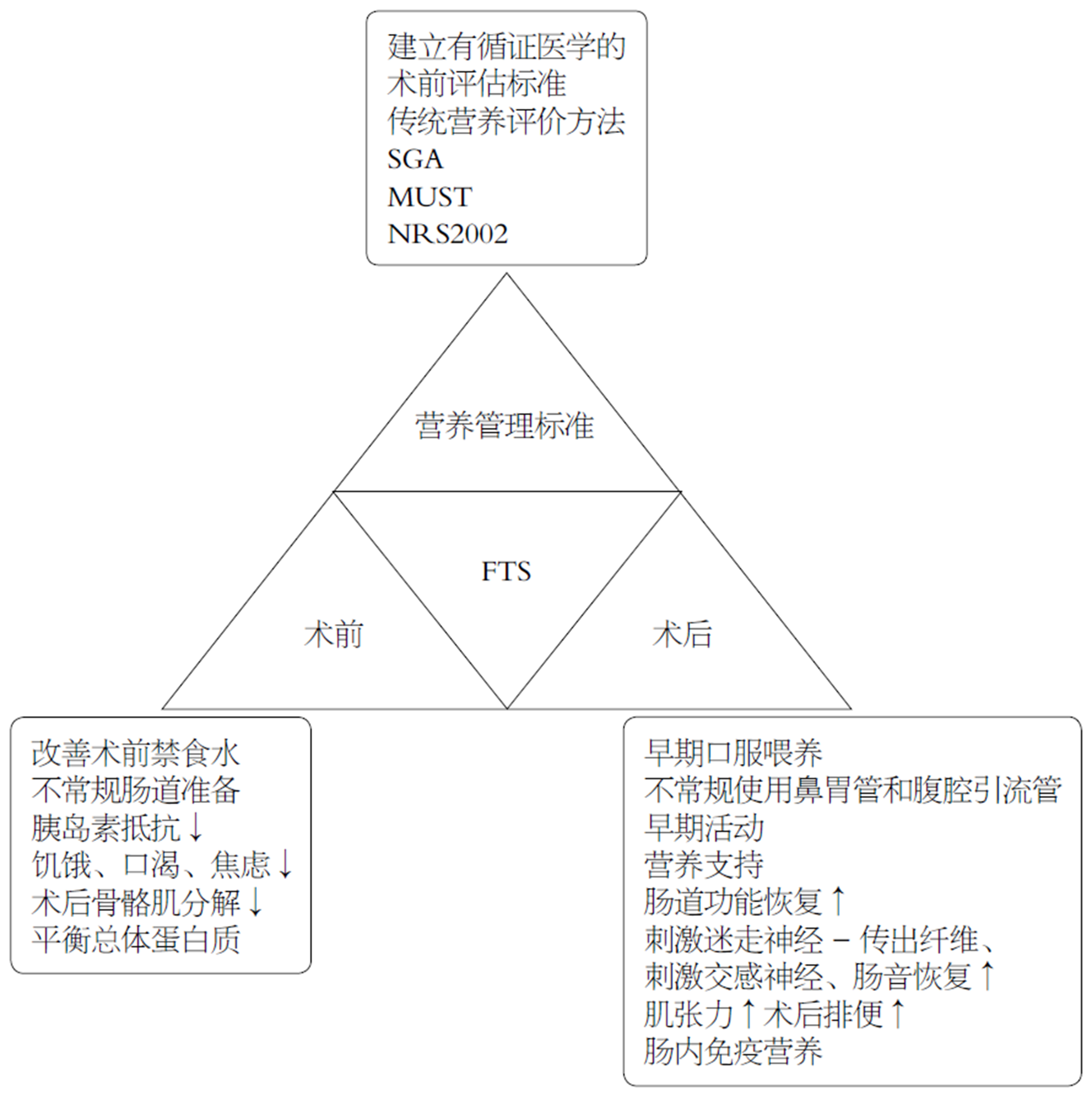
在当前FTS领域中建立有循证医学的术前评估标准和评估体系, 是推动GC营养管理的重要任务[17]. 营养评分是进行良好营养支持的重要前提, 术前营养不良的患者应根据术前营养评分进行相应的营养支持. 影响营养评分的因素主要包括营养不良风险筛查人员和筛查工具本身: 首先, 与未接受过营养不良风险筛查培训的卫生专业人员相比, 接受过营养不良风险筛查培训的卫生专业人员能进一步提升营养不良风险筛查的准确性, 因此, 确保筛查人员得到适当的教育、培训和支持, 以实施营养不良筛查和转诊的途径, 是为患者实施更具成本效益的重要策略[18], 也是作为良好营养支持的重要开端. 我国临床实际工作中, 对营养不良筛查人员进行专业的培训并未得到足够的重视, 相比于国外研究机构仍处于起步阶段. 其次, 更大的影响因素还是筛查工具本身. 我国临床上常用的营养不良筛查工具有: 主要有传统营养评价方法、主观全面评价法、营养不良筛检方法、营养风险筛查(nutritional risk screening 2002, NRS2002)等. 其中, "NRS2002"由欧洲肠外肠内营养学会于2003年提出并推荐使用, 同时也被中华医学会肠外肠内营养学分会推荐, 中国2016年FTS围手术期管理专家共识[6]也更推荐使用"NRS2002", 它通过四个方面来判断患者是否存在营养风险: (1)人体测量; (2)近期体重变化; (3)膳食摄入情况; (4)疾病严重程度.
肖端等[19]的一项研究中, 相比于常规组, TFS组术后第3天、第7天血清营养状况指标(血清清蛋白、前清蛋白、转铁清蛋白和免疫球蛋白、T淋巴亚群水平明显高于对照组. 这说明FTS理念下GC腹腔镜手术能进一步改善患者的营养状态, 改善机体的免疫功能, 对增强术后患者抗肿瘤转移和复发的能力、改善远期预后具有积极的意义.
对于择期手术的GC患者, 纠正营养不良、维持良好的营养状态是术前准备阶段中一项有意义的措施, 在FTS中同样强调术前营养的维持. 营养咨询(包括口服营养补充剂)是第一个, 也是最常用的干预措施, 已被证实可以改善体重, 能量摄入, PG-VSG分数和生活质量的某些方面, 应向所有能够进食但营养不良或有营养不良风险的癌症患者推荐营养咨询. 其次是人工营养, 包括肠内和肠外营养(parenteral nutrition, PN), 这取决于GC的程度、并发症、营养状况评分情况和持续时间[20].
为保证术前空腹状态、避免误吸, 传统术前一夜禁食水的做法在临床应用已超过一个世纪, 但最近的研究[21]显示在患者麻醉诱导前1.5-2 h内口服250 mL水或5%的葡萄糖溶液, 其平均残留胃液量为15-19 mL, 最大存留胃液量是34-50 mL, 远低于可能引起被动性胃液反流和吸入性肺炎的200 mL容量; 反而是术前长时间禁食会使患者处于代谢的应激状态, 可致胰岛素抵抗, 增加术后并发症的发生率. 美国麻醉医师协会明确规定允许患者在术前2 h外进食透明液体[22], 并认为这不会增加胃容量[23]. 基于循证医学的FTS理念认为术前6 h内应禁食固态食物, 麻醉前2 h应口服葡萄糖液, 可明显降低术后胰岛素抵抗, 改善患者饥饿、口渴、焦虑的症状, 获得良好的总体蛋白质平衡, 减少术后骨骼肌分解[24]. 也有研究[25]认为, 与禁食组相比, FTS组的术前准备并不能使患者肌肉力量和营养状况有明显改善, 其原因是两组患者术前、术后一周、术后一个月的血清蛋白、体重、握力无明显差异, 但FTS组的住院时间明显短于常规组1 d. 特别强调, 糖尿病合并神经病变患者可能存在胃排空延迟, 增加误吸和反流的风险, 无并发症的2型糖尿病患者胃排空正常; 对于合并梗阻的GC患者应通过静脉注射来实现术前碳水化合物的补充[26].
在GC手术中, 由于担心术后早期进食对吻合口的直接刺激和腔内压力升高而导致吻合口瘘而实施术后早期禁食[28]. 但越来越多的实践证明了术后早期口服喂养的安全性、可行性和益处, 这得益于FTS的发展. FTS鼓励患者术后早期进食, 这不仅不会增加患者的不适感, 反而可以促进胃肠功能的FTS[29]. Tweed等[30]将4篇随机对照研究进行对比, 结果表明, 与常规护理相比, 早期口服喂养术后第一次排便时间更快, 从6.5 h-1.5 d不等, 且不会增加术后并发症的风险, 同时能够降低住院天数[20,30,31]. 日本的一项研究对354家每年至少做50例GC手术的医生和患者进行了调查, 结果显示, 术后天数是开始口服喂养的最常用指标, 术后平均住院时间与开始口服喂养时间呈正相关, 住院时间越短, 开始口服喂养越早(P<0.01)[32]. 术后早期进食水和食物能够更快地刺激肠道功能恢复, 但过度水合会导致肠水肿[33,34]. 因此, 建议GC术后尽早开展口服喂养.
既往影响患者术后早期进食的一个重要问题是肠麻痹, 一般是通过术后肠道休息和鼻胃管减压等措施来解决, 并且在术后肠道功能完全恢复后才开始进食, 这通常需要4-5 d. 2014年欧洲《胃切除术加速康复外科指南》[34], 强烈推荐GC患者术后不常规使用鼻胃管. Wang等[35]的一项研究认为患者术后使用腹腔引流管对胃切除术后患者胃胀气、半流质饮食的摄入、住院时间及术后30 d并发症无影响, 因此患者术后使用腹腔引流管证据不足.
麻痹性肠梗阻是腹部手术的常见并发症, 并且会导致疼痛、呕吐和腹胀, 这将延迟术后病人胃肠道功能的恢复. 中国加速康复外科围手术期管理专家共识(2016)[6]明确建议预防术后肠麻痹的措施包括咀嚼口香糖. 在既往结直肠和妇科手术的研究中咀嚼口香糖被证实会通过激活迷走神经-传出纤维来响应与食物有关的感官刺激. 口香糖咀嚼刺激人体进食和增加肠蠕动, 由于头-迷走神经反射的作用加速肠梗阻的恢复. 但也有研究证实在GC切除术中咀嚼口香糖不足以对胃肠功能产生作用: 首先, 接受GC手术的患者, 在进行腔镜下胃切除术期间迷走神经干被分开, 这可能会阻断头部-迷走神经反应并且在理论上使得口香糖咀嚼无效; 其次, 假性喂养促进肠蠕动的效果可能被FTS计划中规定的早期喂养程序所抵消; 最后, 由咀嚼口香糖导致的微弱改善在腹腔镜检查后不足以观察到, 相反会在术后第二天增加患者疼痛, 因此仍需进一步的调查研究[36].
胃切除术后的体重减轻是不可避免的重要因素, 其发生机制主要是手术应激引起的炎症反应引起高分解代谢, 因储存功能的丧失而减少的食物摄入量, 以及血饥饿素水平的降低[39], 若营养管理较差会导致患者术后营养状况不良, 降低生活质量和辅助化疗的依存性, 进而导致生存不良[40]. 营养支持是术后机体恢复的基础, 富含免疫刺激营养素的围手术期营养支持能够减少GC手术后的并发症的发病率、改善早期和长期术后营养状况、缩短住院时间.
根据大宗病例的结果: 术后应重视营养支持, 但并非营养支持越早越好. 一个多中心的随机对照研究报道了4640例ICU患者的营养支持, 常规组术后一周内行早期肠内营养(early enteral nutrition, EEN)支持, 同时由PN进行热量补充, 对照组也在一周内行EEN支持, 但在一周后对热量不足部分进行PN补充, 与预期结果相反, 对照组病人的结果更好[41]. 因此, 可以认为蛋白质及脂肪的储存可以维持数周, 营养支持的适应症应修正为当有营养缺乏时进行营养支持[42].
近年来肠内免疫营养(immune enteral nutrition, IEN)成为一种新型营养支持方法, IEN是在标准营养配方中补充一些特殊营养素, 主要包括ω-3脂肪酸(ω-3-FAs)、谷氨酰胺(Gln)、精氨酸(Arg)等, ω-3-FAs具有免疫调节和抗炎作用; Gln是肠黏膜细胞代谢所必需的营养物质, 在手术、感染等严重应激下, 谷氨酰胺的肠黏膜上皮细胞迅速耗竭, 导致肠道免疫功能受损; Arg是一种在细胞代谢中起多重作用的半必需氨基酸. 此外, IEN已被认为是减少胃肠道癌症患者术后感染和非感染性并发症, 提高宿主免疫力, 改善预后的重要手段[43]. 一项Meta分析[44]证实了IEN组中T细胞的CD4升高, 肺部并发症发生率(不包括肺炎)显著降低、60 d死亡率降低, 证明与标准肠内营养相比, 术后IEN可提高机体免疫能力、减少呼吸系统并发症、降低术后死亡率. 因此, 在临床实施是可行和安全的, 可作为GC手术的主要营养支持方式.
多项Meta分析证实FTS成功的关键在于术后肠功能的快速恢复, FTS组的GC患者第一次排气时间、住院时长、体重减轻、经济成本、血清炎症反应、静脉输液的时间将较常规组有明显优势[45,46]. 目前, 有关FTS的研究逐步渗透到GC患者领域. 波兰一项研究[47]对接受腔镜手术的患者进行了接受FTS的态度调查, 结果显示出院后有100%的患者同意并推荐FTS, FTS方案引入日常的临床实践会对GC手术患者的主观体验产生积极的影响[47,48].
但许多研究组织中发现FTS的实际应用率很低[28,49]. 韩国一项调查显示仅有50%的胃外科医生积极地为患者应用FTS, 在进一步的详细调查中显示, 这些医生并未将FTS完全应用到临床实际工作中来, 例如术后早期口服营养并未开展, 在实践中FTS的执行率仅有10%-40%[50], 这表明许多证明不必要的甚至产生损害的传统做法仍在进行. 这可能是由于缺乏对FTS的认识, 同时也没有足够的证据来说服外科医生改变原始的行为规范, 或者是自己认为所处的医疗机构不足以承担实施FTS的风险、受到传统习惯的阻碍等. 欧洲的调查也显示, 虽然FTS成绩显著, 目前仅有1/3的医院真正的开展.
FTS理念是继腹腔镜手术的又一大外科革命, 腔镜手术在FTS理念的基础上能进一步发挥外科微创手术的优势. 术前营养状况直接影响术后预后, 术前和术后营养层面的管理为FTS对GC患者提供了更高的生存获益, 带来了一系列以证据为基础的益处(图1). 对于接受GC手术的患者, FTS的一系列证据都在改善患者营养状态层面发挥着重要的意义. 因此, 在这个GC手术治疗已进入精细化管理时代, 是时候大力发挥FTS在GC患者营养管理层面的重要作用. 同时, 为了进一步推广FTS在GC外科领域的发展, 医生本身和学术团队应付出更多的努力.
学科分类: 胃肠病学和肝病学
手稿来源地: 海南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:崔丽君 电编:刘继红
| 1. | Ang YL, Yong WP, Tan P. Translating gastric cancer genomics into targeted therapies. Crit Rev Oncol Hematol. 2016;100:141-146. [PubMed] [DOI] |
| 2. | Muñoz N, Franceschi S. Epidemiology of gastric cancer and perspectives for prevention. Salud Publica Mex. 1997;39:318-330. [PubMed] [DOI] |
| 3. | Tan MC, Balakrishnan M, Graham DY. Gastric Cancer Worldwide Except Japan: With Special Focus on Studies from Japan. Gastric Cancer. 2018;3:17-28. [DOI] |
| 4. | Sitarz R, Skierucha M, Mielko J, Offerhaus GJA, Maciejewski R, Polkowski WP. Gastric cancer: epidemiology, prevention, classification, and treatment. Cancer Manag Res. 2018;10:239-248. [PubMed] [DOI] |
| 5. | Imamura H, Nishikawa K, Kishi K, Inoue K, Matsuyama J, Akamaru Y, Kimura Y, Tamura S, Kawabata R, Kawada J, Fujiwara Y, Kawase T, Fukui J, Takagi M, Takeno A, Shimokawa T. Effects of an Oral Elemental Nutritional Supplement on Post-gastrectomy Body Weight Loss in Gastric Cancer Patients: A Randomized Controlled Clinical Trial. Ann Surg Oncol. 2016;23:2928-2935. [PubMed] [DOI] |
| 8. | Rosania R, Chiapponi C, Malfertheiner P, Venerito M. Nutrition in Patients with Gastric Cancer: An Update. Gastrointest Tumors. 2016;2:178-187. [PubMed] [DOI] |
| 9. | de Las Peñas R, Majem M, Perez-Altozano J, Virizuela JA, Cancer E, Diz P, Donnay O, Hurtado A, Jimenez-Fonseca P, Ocon MJ. SEOM clinical guidelines on nutrition in cancer patients (2018). Clin Transl Oncol. 2019;21:87-93. [PubMed] [DOI] |
| 10. | Segura A, Pardo J, Jara C, Zugazabeitia L, Carulla J, de Las Peñas R, García-Cabrera E, Luz Azuara M, Casadó J, Gómez-Candela C. An epidemiological evaluation of the prevalence of malnutrition in Spanish patients with locally advanced or metastatic cancer. Clin Nutr. 2005;24:801-814. [PubMed] [DOI] |
| 11. | Gupta D, Lis CG, Granick J, Grutsch JF, Vashi PG, Lammersfeld CA. Malnutrition was associated with poor quality of life in colorectal cancer: a retrospective analysis. J Clin Epidemiol. 2006;59:704-709. [PubMed] [DOI] |
| 12. | Deans DA, Tan BH, Wigmore SJ, Ross JA, de Beaux AC, Paterson-Brown S, Fearon KC. The influence of systemic inflammation, dietary intake and stage of disease on rate of weight loss in patients with gastro-oesophageal cancer. Br J Cancer. 2009;100:63-69. [PubMed] [DOI] |
| 13. | Planas M, Álvarez-Hernández J, León-Sanz M, Celaya-Pérez S, Araujo K, García de Lorenzo A; PREDyCES® researchers. Prevalence of hospital malnutrition in cancer patients: a sub-analysis of the PREDyCES® study. Support Care Cancer. 2016;24:429-435. [PubMed] [DOI] |
| 14. | Shimura T, Toiyama Y, Tanaka K, Saigusa S, Kitajima T, Kondo S, Okigami M, Yasuda H, Ohi M, Araki T, Inoue Y, Uchida K, Mohri Y, Kusunoki M. Angiopoietin-like Protein 2 as a Predictor of Early Recurrence in Patients After Curative Surgery for Gastric Cancer. Anticancer Res. 2015;35:4633-4639. [PubMed] |
| 17. | Ni X, Jia D, Chen Y, Wang L, Suo J. Is the Enhanced Recovery After Surgery (ERAS) Program Effective and Safe in Laparoscopic Colorectal Cancer Surgery? A Meta-Analysis of Randomized Controlled Trials. J Gastrointest Surg. 2019;. [PubMed] [DOI] |
| 18. | Marshall S, Young A, Isenring E. The Malnutrition Screening Tool in Geriatric Rehabilitation: A Comparison of Validity When Completed by Health Professionals With and Without Malnutrition Screening Training Has Implications for Practice. J Acad Nutr Diet. 2018;118:118-124. [PubMed] [DOI] |
| 20. | Ida S, Hiki N, Cho H, Sakamaki K, Ito S, Fujitani K, Takiguchi N, Kawashima Y, Nishikawa K, Sasako M, Aoyama T, Honda M, Sato T, Nunobe S, Yoshikawa T. Randomized clinical trial comparing standard diet with perioperative oral immunonutrition in total gastrectomy for gastric cancer. Br J Surg. 2017;104:377-383. [PubMed] [DOI] |
| 21. | Kehlet H, Wilmore DW. Evidence-based surgical care and the evolution of fast-track surgery. Ann Surg. 2008;248:189-198. [PubMed] [DOI] |
| 22. | Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology. 2017;126:376-393. [PubMed] [DOI] |
| 23. | de Aguilar-Nascimento JE, Dock-Nascimento DB. Reducing preoperative fasting time: A trend based on evidence. World J Gastrointest Surg. 2010;2:57-60. [PubMed] [DOI] |
| 24. | Scholcover F, Gillan DJ. Using Temporal Sensitivity to Predict Performance Under Latency in Teleoperation. Hum Factors. 2018;60:80-91. [PubMed] [DOI] |
| 25. | Makuuchi R, Sugisawa N, Kaji S, Hikage M, Tokunaga M, Tanizawa Y, Bando E, Kawamura T, Terashima M. Enhanced recovery after surgery for gastric cancer and an assessment of preoperative carbohydrate loading. Eur J Surg Oncol. 2017;43:210-217. [PubMed] [DOI] |
| 26. | 杨 林东, 王 向东, 李 芹, 梁 玉河, 陈 瑜, 吴 明君, 许 峰. 快速康复外科在大于60岁老年胃癌患者中的适用性分析. 现代肿瘤医学. 2015;19:2814-2817. [DOI] |
| 27. | 韩 超, 解 曙哲, 连 长红, 宋 应明, 赵 强. 加速康复外科理念在全腹腔镜远端胃癌根治、胃十二指肠三角吻合术中的应用研究. 中华普外科手术学杂志(电子版). 2019;13:80-82. [DOI] |
| 28. | Li YJ, Huo TT, Xing J, An JZ, Han ZY, Liu XN, Zhao QC. Meta-analysis of efficacy and safety of fast-track surgery in gastrectomy for gastric cancer. World J Surg. 2014;38:3142-3151. [PubMed] [DOI] |
| 29. | Tanaka R, Lee SW, Kawai M, Tashiro K, Kawashima S, Kagota S, Honda K, Uchiyama K. Protocol for enhanced recovery after surgery improves short-term outcomes for patients with gastric cancer: a randomized clinical trial. Gastric Cancer. 2017;20:861-871. [PubMed] [DOI] |
| 30. | Tweed T, van Eijden Y, Tegels J, Brenkman H, Ruurda J, van Hillegersberg R, Sosef M, Stoot J. Safety and efficacy of early oral feeding for enhanced recovery following gastrectomy for gastric cancer: A systematic review. Surg Oncol. 2019;28:88-95. [PubMed] [DOI] |
| 31. | Liu XX, Pan HF, Jiang ZW, Zhang S, Wang ZM, Chen P, Zhao Y, Wang G, Zhao K, Li JS. "Fast-track" and "Minimally Invasive" Surgery for Gastric Cancer. Chin Med J (Engl). 2016;129:2294-2300. [PubMed] [DOI] |
| 32. | Shimizu N, Hatao F, Fukatsu K, Aikou S, Yamagata Y, Mori K, Yamashita H, Nomura S, Seto Y. Results of a nationwide questionnaire-based survey on nutrition management following gastric cancer resection in Japan. Surg Today. 2017;47:1460-1468. [PubMed] [DOI] |
| 33. | Kang SH, Lee Y, Min SH, Park YS, Ahn SH, Park DJ, Kim HH. Multimodal Enhanced Recovery After Surgery (FTS) Program is the Optimal Perioperative Care in Patients Undergoing Totally Laparoscopic Distal Gastrectomy for Gastric Cancer: A Prospective, Randomized, Clinical Trial. Ann Surg Oncol. 2018;25:3231-3238. [PubMed] [DOI] |
| 34. | Mortensen K, Nilsson M, Slim K, Schäfer M, Mariette C, Braga M, Carli F, Demartines N, Griffin SM, Lassen K; Enhanced Recovery After Surgery (ERAS®) Group. Consensus guidelines for enhanced recovery after gastrectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Br J Surg. 2014;101:1209-1229. [PubMed] [DOI] |
| 35. | Wang Z, Chen J, Su K, Dong Z. Abdominal drainage versus no drainage post gastrectomy for gastric cancer. Cochrane Database Syst Rev. 2011;CD008788. [PubMed] [DOI] |
| 36. | Ge B, Zhao H, Lin R, Wang J, Chen Q, Liu L, Huang Q. Influence of gum-chewing on postoperative bowel activity after laparoscopic surgery for gastric cancer: A randomized controlled trial. Medicine (Baltimore). 2017;96:e6501. [PubMed] [DOI] |
| 37. | Shi J, Li S, Wang Y, Zheng L. Retrospective study on recovery of 521 gastrointestinal tumor patients after laparoscopic surgery. Oncol Lett. 2018;16:3531-3536. [PubMed] [DOI] |
| 38. | Shoji Y, Nunobe S, Ida S, Kumagai K, Ohashi M, Sano T, Hiki N. Surgical outcomes and risk assessment for anastomotic complications after laparoscopic proximal gastrectomy with double-flap technique for upper-third gastric cancer. Gastric Cancer. 2019;. [PubMed] [DOI] |
| 39. | Ryan AM, Healy LA, Power DG, Rowley SP, Reynolds JV. Short-term nutritional implications of total gastrectomy for malignancy, and the impact of parenteral nutritional support. Clin Nutr. 2007;26:718-727. [PubMed] [DOI] |
| 40. | Aoyama T, Sato T, Maezawa Y, Kano K, Hayashi T, Yamada T, Yukawa N, Oshima T, Rino Y, Masuda M, Ogata T, Cho H, Yoshikawa T. Postoperative weight loss leads to poor survival through poor S-1 efficacy in patients with stage II/III gastric cancer. Int J Clin Oncol. 2017;22:476-483. [PubMed] [DOI] |
| 41. | Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, Debaveye Y, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011;365:506-517. [PubMed] [DOI] |
| 42. | Koretz RL, Avenell A, Lipman TO. Nutritional support for liver disease. Cochrane Database Syst Rev. 2012;CD008344. [PubMed] [DOI] |
| 43. | Pérez Cruz E, Reyes Marín A, Asbun Bojalil J, Arteaga Morfin JI. Effectiveness of Immunonutrition on Inflammatory Markers in Patients with Cancer; Randomized Clinical Trial. Nutr Hosp. 2015;32:1676-1682. [PubMed] [DOI] |
| 44. | Fujita F, Fujita M, Sakamoto Y, Shimozuma K, Inaba H, Taguchi T. [Combination chemotherapy with 3 or 4 drugs on human breast and gastrointestinal cancer xenografts in nude mice (II)]. Gan To Kagaku Ryoho. 1987;14:1252-1259. [PubMed] [DOI] |
| 45. | Beamish AJ, Chan DS, Blake PA, Karran A, Lewis WG. Systematic review and meta-analysis of enhanced recovery programmes in gastric cancer surgery. Int J Surg. 2015;19:46-54. [PubMed] [DOI] |
| 46. | Ding J, Sun B, Song P, Liu S, Chen H, Feng M, Guan W. The application of enhanced recovery after surgery (ERAS)/fast-track surgery in gastrectomy for gastric cancer: a systematic review and meta-analysis. Oncotarget. 2017;8:75699-75711. [PubMed] [DOI] |
| 47. | Zychowicz A, Pisarska M, Łaskawska A, Czyż M, Witowski J, Kisielewski M, Kulawik J, Budzyński A, Pędziwiatr M. Patients' opinions on enhanced recovery after surgery perioperative care principles: a questionnaire study. Wideochir Inne Tech Maloinwazyjne. 2019;14:27-37. [PubMed] [DOI] |
| 48. | Sugisawa N, Tokunaga M, Makuuchi R, Miki Y, Tanizawa Y, Bando E, Kawamura T, Terashima M. A phase II study of an enhanced recovery after surgery protocol in gastric cancer surgery. Gastric Cancer. 2016;19:961-967. [PubMed] [DOI] |
| 50. | Jeong O, Kim HG. Implementation of Enhanced Recovery after Surgery (FTS) Program in Perioperative Management of Gastric Cancer Surgery: a Nationwide Survey in Korea. J Gastric Cancer. 2019;19:72-82. [PubMed] [DOI] |