修回日期: 2018-05-21
接受日期: 2018-06-02
在线出版日期: 2018-07-08
胃癌微创外科经过20余年的飞速发展已成为胃癌治疗中不可缺少的一部分. 手术适应证的变化, 微创设备的革新以及手术技术与理念的创新是目前胃癌腹腔镜微创外科的部分热点问题. 本文就这些问题结合文献及自身体会做一述评.
核心提要: 本文就目前胃癌微创外科的部分热点问题, 即手术适应证变化, 全腹腔镜下消化道重建方式, 3D视野的特点以及ERAS理念下的腹腔镜胃癌手术进行了阐述, 对外科医生有一定的指导性意义.
引文著录: 邵欣欣, 田艳涛. 胃癌微创外科诊治热点与问题. 世界华人消化杂志 2018; 26(19): 1149-1155
Revised: May 21, 2018
Accepted: June 2, 2018
Published online: July 8, 2018
Minimally invasive surgery has become an indispensable part of gastric cancer treatment after more than 20 years of rapid development. The change of operation indications, the innovation of minimally invasive devices and surgical technique, and the idea of innovation are hot issues in minimally invasive surgery for gastric cancer. In this paper, we will discuss these hot issues in detail.
- Citation: Shao XX, Tian YT. Hot issues in minimally invasive surgery for gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(19): 1149-1155
- URL: https://www.wjgnet.com/1009-3079/full/v26/i19/1149.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i19.1149
胃癌是我国常见的消化道恶性肿瘤之一, 2013年我国肿瘤发病率和死亡率统计结果显示, 胃癌发病率居恶性肿瘤发病率的第2位, 死亡率居第3位[1], 严重威胁患者生存, 造成沉重的经济和社会负担. 手术切除是胃癌唯一可能获得根治的办法. 微创技术具有出血少、恢复快、瘢痕小等优点, 对外科有着里程碑式的意义, 它大大减轻了患者的手术创伤. 日本学者Kitano等[2]首次报道了腹腔镜胃癌根治术, 经过20余年临床的探索, 加上理念的更新和科技的进步, 腹腔镜胃癌手术不断得到规范、推广和普及. 期间外科医师经历了对腹腔镜胃癌手术排斥、观望, 到接受, 再到推荐的变化过程. 微创设备也经历了早期普通2D显示屏、单一电钩器械、不稳定气腹设备到高清显示屏、3D技术、超声刀、能量平台、稳定气腹再到达芬奇手术操作系统的发展. 目前, 微创技术已成为胃癌诊治过程中不可或缺的一部分.
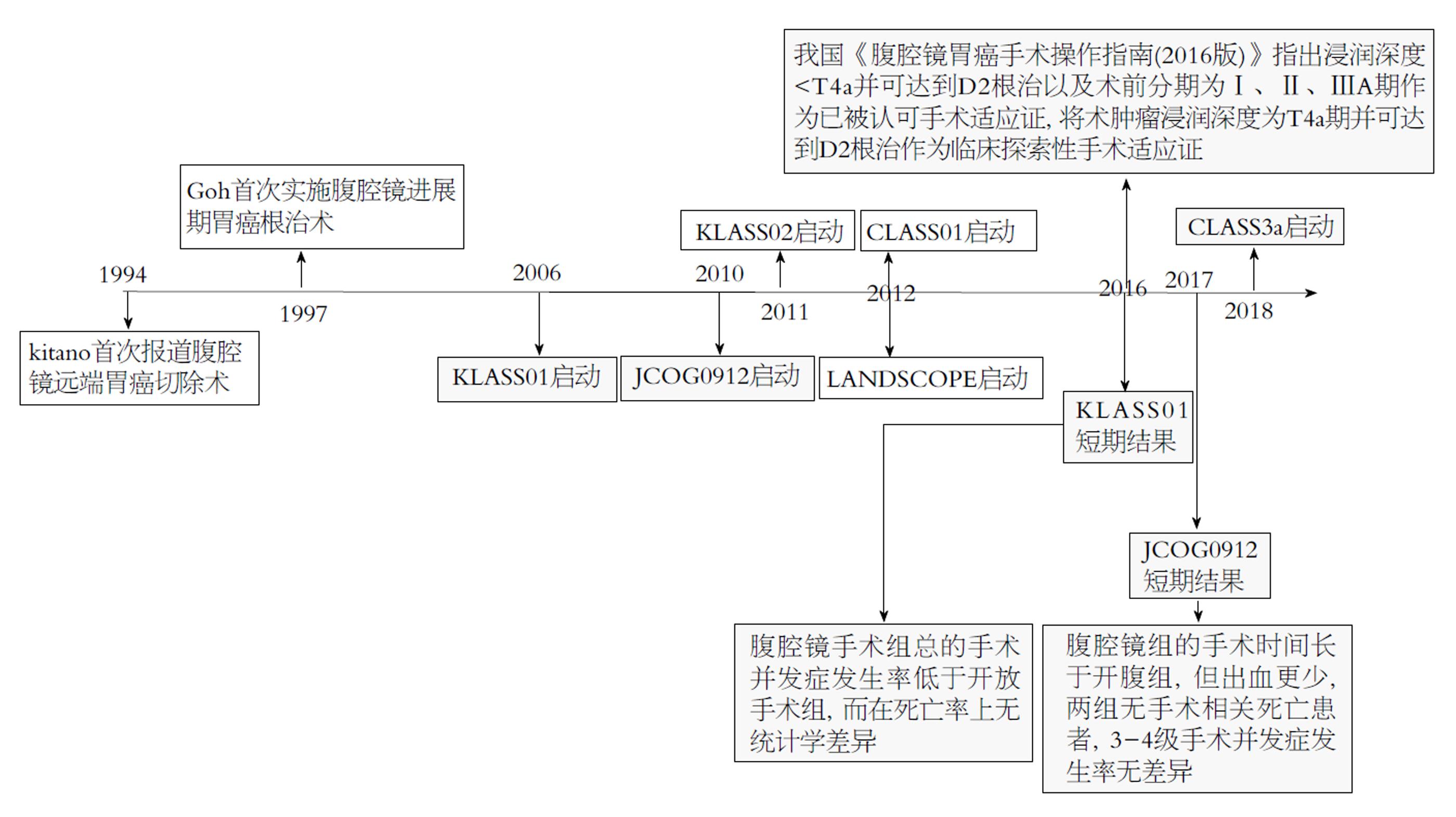
腹腔镜胃癌根治性手术在早期的发展并不顺利. 首先, 外科医师对肿瘤根治性持排斥和观望态度, 担心因腹腔镜产生医源性播散以及气腹相关并发症等问题. 其次, 由于早期设备落后, 器械单一, 术者对腹腔镜技术不适应, 胃癌根治术操作相对复杂, 对术者也提出了较高的技术要求. 上述原因导致早期腹腔镜胃癌手术发展缓慢. 随着技术设备的革新, 术者临床经验的积累, 以及高质量临床试验的开展(图1), 使得胃癌腹腔镜手术被越来越多的外科医师所接受, 其适应证也逐渐明确.
对于早期胃癌, 腹腔镜手术已基本无争议, 其重要临床证据来自于日本临床肿瘤学组(Japan Clinical Oncology Group, JCOG)的JCOG0912研究, 以及韩国腹腔镜胃肠外科研究组(Korean Laparoscopic Gastrointestinal Surgery Study Group, KLASS)的KLASS-01研究. JCOG0912研究显示腹腔镜辅助远端胃癌手术组的手术时间长于开腹远端胃癌手术组(278 min vs 194 min, P<0.01), 但出血明显减少(38 mL vs 115 mL, P<0.01), 3-4级手术并发症发生率无差异(3.3% vs 3.7%)[3]. KLASS-01研究表明, 腹腔镜辅助远端胃癌手术组总的手术并发症发生率低于开放远端胃癌手术组(13.0% vs 19.9% , P = 0.001), 而在死亡率上无统计学差异(0.65% vs 0.3%, P = 0.687)[4]. 其长期随访结果已于2016年美国肿瘤学会年会上发表, 结果显示, 临床分期Ⅰ期的胃癌病人中, 腹腔镜辅助远端胃癌手术组5年生存率不劣于传统开腹手术组, 可将腹腔镜辅助根治性远端胃癌切除术作为Ⅰ期胃癌病人的治疗方法[5]. Kitano等[6]报道了一项多中心腹腔镜早期胃癌手术患者的研究, 5年无病生存率ⅠA期99.8%, ⅠB期98.7%, Ⅱ期85.7%. 上述研究证实了腹腔镜早期胃癌手术良好的近远期效果. 目前, 腹腔镜已成为早期胃癌的常规术式或推荐术式.
局部进展期胃癌常有周围组织浸润, 手术范围及淋巴结清扫范围广, 手术难度大. 1997年Goh等[7]首次实施腹腔镜进展期胃癌手术, 初步证实了进展期胃癌腹腔镜手术的可行性. 我国是胃癌高发地区, 且多数处于进展期, 腹腔镜治疗局部进展期胃癌的手术疗效是我国胃癌领域的研究重点和热点. 我国腹腔镜胃肠外科研究组(CLASS)的一项研究回顾性研究分析了1184例行腹腔镜辅助胃癌切除D2淋巴结清扫的进展期胃癌患者的临床资料, 研究结果显示, 术后并发症发生率为10.2%(121/1184), 1例(0.1%)患者死亡, 中位随访日期12 mo, 复发率为16.7%(185/1184), 累积3年总生存率75.5%, 无病生存率69.0%, 证实腹腔镜进展期胃癌手术安全、可行, 并符合短期肿瘤学疗效[8]. 2012年, CLASS"腹腔镜和开腹D2根治术治疗局部进展期远端胃癌肿瘤学疗效的多中心、随机、对照临床研究"(CLASS01)启动, 腹腔镜组及开腹手术组分别纳入528人, 短期结果显示两组术后并发症发生率、死亡率等方面无明显差异, 研究认为由经验丰富的外科医师实施腹腔镜远端胃癌切除D2淋巴结清扫治疗进展期胃癌是安全的[9].
日韩两国同样对腹腔镜进展期胃癌有着较深入的研究. 日本的JLSSG0901研究显示, 腹腔镜进展期胃癌手术吻合口瘘或胰瘘的发生率为4.7%(4/86), 3级及以上并发症发生率为5.8%, 中转开腹1例(1.2%), 无围手术期死亡, 6月内无因手术并发症再入院患者[10]. 韩国的一项前瞻性多中心Ⅱ期临床随机对照研究(COACT 1001)对比了腹腔镜和开腹手术治疗局部进展期远端胃癌的疗效, 近期结果显示, 两组在淋巴结清扫相关并发症发生率(47.0% vs 43.2%), 腹腔镜组和开腹组3年无病生存率无统计学差异(80.1% vs 81.9%, P = 0.448)[11]. 目前, KLASS正在进行一项多中心随机对照临床试验(KALSS-02)[12], 其结果也将成为评价腹腔镜胃癌切除D2淋巴结清扫治疗局部进展期胃癌疗效的重要临床证据.
新辅助化疗联合手术是局部进展期胃癌多模式治疗的重要组成部分, 胃癌新辅助化疗后能否行腹腔镜手术也是目前的热点问题之一. 日本正在进行一项Ⅱ期临床试验(LANDSCOPE), 研究对象为侵犯浆膜宏观评估可切除的局部进展期胃癌患者, 旨在比较新辅助化疗后行腹腔镜辅助远端胃癌切除D2淋巴结清扫和开腹远端胃癌切除D2淋巴结清扫的安全性及疗效[13]. 目前我国已启动CLASS3a研究, 纳入对象为局部进展期胃癌 (cT3~4a, N-/+, M0), 旨在证实腹腔镜远端胃癌根治术 D2淋巴结清扫治疗新辅助化疗后此类患者的手术安全性和肿瘤学疗效[14].
由于腹腔镜胃癌手术的适应证逐步扩大, 我国《腹腔镜胃癌手术操作指南(2016版)》也更新了腹腔镜胃癌的手术适应证, 指南中已被认可并应用于临床实践的手术适应证包括: (1)胃癌探查及分期; (2)胃癌肿瘤浸润深度<T4a期并可达到D2根治性切除术; (3)胃癌术前分期为Ⅰ、Ⅱ、ⅢA期; (4)晚期胃癌短路手术; 可作为临床探索性手术适应证包括: (1)胃癌术前评估肿瘤浸润深度为T4a期并可达到D2根治性切除术; (2)晚期胃癌姑息性胃切除术[15].
腹腔镜胃癌手术消化道重建方式基于传统开腹手术. 腹腔镜辅助胃癌手术是目前主要的方式, 组织游离、血管离断及淋巴结清扫等步骤在腔镜下完成, 后通过腹部小切口辅助直视下完成肿瘤切除及消化道重建. 全腹腔镜下胃癌根治术消化道重建等操作同样在腹腔镜下完成, 是近年来研究的热点之一. 与小切口辅助比, 操作难度大, 但具有创伤更小、视野更好、相对操作空间更大等优点, 并可在腹腔镜下近距离观察吻合口, 判断吻合质量、吻合口大小及有无出血等情况, 更好地防止吻合口相关并发症发生[16].
2.1.1 BillrothⅠ式吻合: Kanaya等[17]首次报道了全腔镜BillrothⅠ式吻合, 即Delta吻合. Delta吻合操作步骤相对简单, 学习曲线短. Kanaya等[18]的研究获得了令人满意的短、长期效果, 8位医生共连续完成100例Delta吻合, 学习曲线陡峭, 平均吻合时间为13 min; 65例患者可于出院时进食1500 kcal/d的软食, 而在平均54.9 mo的随访中, 仅有1例发生倾倒综合征; 70例患者出现胆汁反流, 但是残胃炎发生率较低. Tanimura等[19]报道了另外一种全腹腔镜下BillrothⅠ式吻合, 因吻合后的内腔形态更接近三角形, 故称"三角吻合"(triangulating stapling technique, TST). 传统三角吻合闭合共同开口后存在2个交角和1个盲角, 理论上存在3个薄弱点, 增加了术后吻合口相关并发症发生的风险[20]. 黄昌明等[20]在此基础上改良了三角吻合方式, 即在共同开口对合后, 将十二指肠端缘的盲角置于直线切割闭合器内, 闭合共同开口, 其方向应与胃切缘垂直, 同时将十二指肠断缘一并完整切除, 该技术将传统三角吻合后存在的3个薄弱点变为1个, 吻合后外观呈倒"T"形, 从而避免十二指肠盲端血运不良.
2.1.2 Billroth Ⅱ式吻合: 全腹腔镜下Billroth Ⅱ式吻合通过直线切割闭合器将残胃后壁和空肠吻合, 然后将共同开口闭合. 共同开口的闭合理论上操作更容易, 并可避免远端胃切除过多后吻合口张力过大的问题. 但Billroth Ⅱ式改变了正常解剖关系, 十二指肠残端瘘、胆汁反流性胃炎及吻合口炎并发症发生率高, 加做Braun吻合可在一定程度上降低十二指肠残端瘘及碱性返流等问题的发生. Lee等[21]分析了130例全腹腔镜下远端胃癌切除Billroth Ⅱ式吻合胃癌患者的临床资料, 与同期269例腹腔镜辅助远端胃癌切除Billroth Ⅱ式吻合相比, 全腹腔镜组平均手术时间明显短于前者, 且术后住院时间明显缩短(8.3 ± 3.2 d vs 9.9 ± 5.3 d, P = 0.016), 吻合口相关并发症两组并无显著差异(8.5% vs 7.8%).
2.1.3 Roux-en-Y式吻合: Takaori等[22]2005年报道了全腹腔镜下远端胃切除Roux-en-Y吻合. Roux-en-Y吻合口无张力, 且有效避免了胆汁反流和吻合口炎, 吻合口瘘和吻合口狭窄的发生率较低. 但该吻合方式操作复杂, 且有发生Roux淤滞综合征的可能; 吻合步骤多, 使用直线切割闭合器多, 手术费用高[23]. Roux-en-Y在空肠离断后会引起肠道起步电位的改变, 造成迷走神经切除后胃排空延迟, 从而导致Roux淤滞综合征的发生[24]. Uyama等[25]报道了腹腔镜下非离断式(Uncut)Roux-en-Y 吻合术, 该方式不离断空肠, 理论上可维持肠道肌神经的连续性, 防止空肠壁上出现异位起搏点导致的肠管逆蠕动, 从而减少Roux淤滞的发生.
与小切口辅助腔外食管空肠吻合相比, 全腹腔镜下食管空肠吻合视野更好, 吻合更确切. 镜下手工荷包缝合难度较大, 对团队要求较高, 不易推广. 吻合器吻合是目前主要的吻合方式, 主要的吻合器有圆形吻合器吻合和线形吻合器.
2.2.1 圆形吻合器食管空肠吻合: Jeong等[26]首次报道了全腹腔镜下经口置入砧座装置OrVilTM管形吻合器食管空肠吻合术, 此方法避免了复杂的镜下荷包缝合操作, 并适合于受累较高的胃食管结合部肿瘤, 但存在食管或咽喉部损伤的风险. 倒穿刺法可避免经口置入砧座造成的食管或咽喉部损伤, 并可通过改装的普通砧座完成, 也是目前全腹腔镜下食管空肠吻合常用方法.
2.2.2 线形吻合器食管空肠吻合: Uyama等[27]最早报道了全腹腔镜食管空肠线形吻合(Semi-loop吻合). 线形吻合器可通过常规12 mm trocar进入腹腔, 不受食管管腔直径的限制, 但当吻合部位较高时操纵困难, 同时空肠臂存在牵拉和折叠, 增加了吻合口张力. 为避免因空肠臂造成的吻合口张力, Inaba等[28]报道了"overlap"食管空肠侧侧吻合, 但吻合口易回缩至纵隔, 一旦吻合口瘘将发生严重并发症.
近端胃切除术后消化道重建常用方式为食管残胃吻合, 食管管状胃吻合及间置空肠, 但近端胃切除目前仍有一定争议, 全腹腔镜下近端胃切除消化道重建相关报道偏少, 本文不做详述.
传统腹腔镜为二维成像技术, 缺少水平视差, 因此无法呈现实际的立体感觉[29]. 深度感觉的缺失使术者无法准确辨别腹腔内组织的前后、远近关系. 3D(three-dimensional) 腹腔镜模仿人类双眼观察事物的方式, 通过两套独立的镜头来采集视觉信号, 从而呈现事物在水平和垂直方向之外的深度信息[29-32]. 3D腹腔镜还原了开腹手术的立体层次感, 可减少眼疲劳、头晕等不适, 为术者提供更佳的视觉体验; 并有利于镜下手工缝合等操作, 缩短初学者的学习曲线[33,34]. 3D腹腔镜胃癌手术开展相对较晚, 但发展较快, 近年相关报道逐渐增多, 初步临床效果令人满意. 季福建等[35]的研究纳入了93例全胃切除胃癌患者, 其中3D组48例, 2D组45例, 结果显示, 3D组较2D组总手术时间明显缩短, No. 10和11以及No. 7、8、9和12组淋巴结清扫时间明显缩短, 并可明显减少错抓次数. 彭良群等[36]在3D腹腔镜全胃切除的研究中认为, 3D腹腔镜能减少术中出血量, 并可缩短镜下食管空肠吻合时间、脾门清扫时间及总体手术时间.
目前3D腹腔镜仍存在一些不足. 一般3D腹腔镜的双摄像头位置固定, 当目标术野被其他组织遮挡时, 无法像2D腹腔镜通过旋转镜头切面的角度来改变视角, 其后方的解剖结构就不易显露. 可弯曲高清3D镜头可以弥补此方面的不足, 但镜头弯曲时对空间要求较高, 同时由于镜头属于软镜, 易受操作器械碰撞而造成视野晃动甚至转向. 但我们相信, 随着3D腹腔镜系统不断的完善和改进, 这些不足将很快找到解决方法.
达芬奇机器人手术系统是微创领域中的又一进步, 它除了具有3D高清视野外, 还拥有具有7个自由度的机械臂, 并可消除手部震颤, 更符合人体工学原理. 目前, 国内安装达芬奇手术操作系统的单位越来越多, 达芬奇胃癌根治术也已顺利开展, 并取得了良好的近期手术疗效[37-41]. 达芬奇手术系统同样存在一些不足, 机械臂安装时间较长, 在大出血等严重手术并发症发生时也无法做到第一时间中转开腹; 其触觉反馈体系也存在一定缺陷, 操作力度不易掌握; 同时存在购置、维护费用高等不足. 远期肿瘤学效果也需进一步临床试验加以证明.
20世纪90年代末丹麦Kehlet[42]率先提出加速康复外科理念, 即ERAS(enhanced recovery after surgery)理念, 旨在优化围手术期一系列处理措施, 减少患者创伤应激, 保护器官功能, 维持内环境的稳定, 从而使患者术后快速康复. ERAS理念目前已广泛应用于外科各个领域, ERAS理念下的胃癌手术也是胃癌领域近年的研究热点之一. 2007年南京军区南京总医院在国内较早开展了ERAS理念下的胃癌手术, 并在国内多家中心得到应用, 取得了较满意的临床效果[43]. 腹腔镜胃癌手术因具有创伤小、出血少、术后住院时间短、术后康复快等优点[44-47], 目前已成为ERAS理念下胃癌手术的重要组成部分. 《胃癌胃切除手术加速康复外科专家共识(2016版)》推荐对于肿瘤浸润深度<T4a期并可达到R0根治手术的胃癌患者可施行腹腔镜或机器人微创手术[48]. ERAS理念下的胃癌手术需注意一些问题, 共识指出, 胃癌胃切除手术ERAS的正确实施涉及诊断与治疗活动的各个环节, 提倡建立由外科医师、麻醉医师、护士、营养师、康复理疗师、心理专家共同参与的管理团队, 既要遵循循证医学证据, 也要尊重患者的客观实际, 制订个性化的ERAS方案, 促进开腹、腹腔镜与机器人胃癌术后快速、安全康复[48].
微创外科是胃癌手术发展的大趋势, 其发展离不开科技的进步, 外科医师技术水平的提高, 外科理念的创新以及高质量临床试验的实施. 目前微创外科已成为胃癌治疗中不可缺少的一部分, 并且发挥着越来越重要的作用. 胃癌的微创外科仍存在许多问题, 这些问题也是目前研究的热点, 我们相信, 随着时代的进步, 这些问题将会被一一解决, 胃癌微创外科也将造福更多患者.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑:马亚娟 电编:张砚梁
| 1. | Chen W, Zheng R, Zhang S, Zeng H, Zuo T, Xia C, Yang Z, He J. Cancer incidence and mortality in China in 2013: an analysis based on urbanization level. Chin J Cancer Res. 2017;29:1-10. [PubMed] [DOI] |
| 2. | Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy-assisted Billroth I gastrectomy. Surg Laparosc Endosc. 1994;4:146-148. [PubMed] |
| 3. | Katai H, Mizusawa J, Katayama H, Takagi M, Yoshikawa T, Fukagawa T, Terashima M, Misawa K, Teshima S, Koeda K. Short-term surgical outcomes from a phase III study of laparoscopy-assisted versus open distal gastrectomy with nodal dissection for clinical stage IA/IB gastric cancer: Japan Clinical Oncology Group Study JCOG0912. Gastric Cancer. 2017;20:699-708. [PubMed] [DOI] |
| 4. | Kim W, Kim HH, Han SU, Kim MC, Hyung WJ, Ryu SW, Cho GS, Kim CY, Yang HK, Park DJ, Song KY, Lee SI, Ryu SY, Lee JH, Lee HJ; Korean Laparo-endoscopic Gastrointestinal Surgery Study (KLASS) Group. Decreased Morbidity of Laparoscopic Distal Gastrectomy Compared With Open Distal Gastrectomy for Stage I Gastric Cancer: Short-term Outcomes From a Multicenter Randomized Controlled Trial (KLASS-01). Ann Surg. 2016;263:28-35. [PubMed] [DOI] |
| 6. | Kitano S, Shiraishi N, Uyama I, Sugihara K, Tanigawa N; Japanese Laparoscopic Surgery Study Group. A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan. Ann Surg. 2007;245:68-72. [PubMed] [DOI] |
| 7. | Goh PM, Khan AZ, So JB, Lomanto D, Cheah WK, Muthiah R, Gandhi A. Early experience with laparoscopic radical gastrectomy for advanced gastric cancer. Surg Laparosc Endosc Percutan Tech. 2001;11:83-87. [PubMed] |
| 8. | Hu Y, Ying M, Huang C, Wei H, Jiang Z, Peng X, Hu J, Du X, Wang B, Lin F, Xu J, Dong G, Mou T, Li G; Chinese Laparoscopic Gastrointestinal Surgery Study (CLASS) Group. Oncologic outcomes of laparoscopy-assisted gastrectomy for advanced gastric cancer: a large-scale multicenter retrospective cohort study from China. Surg Endosc. 2014;28:2048-2056. [PubMed] [DOI] |
| 9. | Hu Y, Huang C, Sun Y, Su X, Cao H, Hu J, Xue Y, Suo J, Tao K, He X. Morbidity and Mortality of Laparoscopic Versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer: A Randomized Controlled Trial. J Clin Oncol. 2016;34:1350-1357. [PubMed] [DOI] |
| 10. | Inaki N, Etoh T, Ohyama T, Uchiyama K, Katada N, Koeda K, Yoshida K, Takagane A, Kojima K, Sakuramoto S. A Multi-institutional, Prospective, Phase II Feasibility Study of Laparoscopy-Assisted Distal Gastrectomy with D2 Lymph Node Dissection for Locally Advanced Gastric Cancer (JLSSG0901). World J Surg. 2015;39:2734-2741. [PubMed] [DOI] |
| 11. | Park YK, Yoon HM, Kim YW, Park JY, Ryu KW, Lee YJ, Jeong O, Yoon KY, Lee JH, Lee SE. Laparoscopy-assisted versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer: Results From a Randomized Phase II Multicenter Clinical Trial (COACT 1001). Ann Surg. 2018;267:638-645. [PubMed] [DOI] |
| 12. | Hur H, Lee HY, Lee HJ, Kim MC, Hyung WJ, Park YK, Kim W, Han SU. Efficacy of laparoscopic subtotal gastrectomy with D2 lymphadenectomy for locally advanced gastric cancer: the protocol of the KLASS-02 multicenter randomized controlled clinical trial. BMC Cancer. 2015;15:355. [PubMed] [DOI] |
| 13. | Yoshikawa T, Fukunaga T, Taguri M, Kunisaki C, Sakuramoto S, Ito S, Morita S, Tsuburaya A. Laparoscopic or open distal gastrectomy after neoadjuvant chemotherapy for operable gastric cancer, a randomized Phase II trial (LANDSCOPE trial). Jpn J Clin Oncol. 2012;42:654-657. [PubMed] [DOI] |
| 14. | Hu J, Zhang W, Chen X. Laparoscopic gastrectomy combined with neoadjuvant chemotherapy for gastric cancer patients: from the view of the CLASS-03a trial. Zhonghua Wei Chang Wai Ke Za Zhi. 2018;21:138-142. [PubMed] |
| 15. | 中华医学会外科学分会腹腔镜与内镜外科学组, 中国研究型医院学会机器人与腹腔镜外科专业委员会. 腹腔镜胃癌手术操作指南(2016版). 中华消化外科杂志. 2016;15:851-857. [DOI] |
| 17. | Kanaya S, Gomi T, Momoi H, Tamaki N, Isobe H, Katayama T, Wada Y, Ohtoshi M. Delta-shaped anastomosis in totally laparoscopic Billroth I gastrectomy: new technique of intraabdominal gastroduodenostomy. J Am Coll Surg. 2002;195:284-287. [PubMed] |
| 18. | Kanaya S, Kawamura Y, Kawada H, Iwasaki H, Gomi T, Satoh S, Uyama I. The delta-shaped anastomosis in laparoscopic distal gastrectomy: analysis of the initial 100 consecutive procedures of intracorporeal gastroduodenostomy. Gastric Cancer. 2011;14:365-371. [PubMed] [DOI] |
| 19. | Tanimura S, Higashino M, Fukunaga Y, Takemura M, Nishikawa T, Tanaka Y, Fujiwara Y, Osugi H. Intracorporeal Billroth 1 reconstruction by triangulating stapling technique after laparoscopic distal gastrectomy for gastric cancer. Surg Laparosc Endosc Percutan Tech. 2008;18:54-58. [PubMed] [DOI] |
| 20. | 黄 昌明, 林 密. 腹腔镜下胃十二指肠三角吻合技巧与应用. 中国普外基础与临床杂志. 2015;04:388-390. |
| 21. | Lee J, Kim D, Kim W. Comparison of laparoscopy-assisted and totally laparoscopic Billroth-II distal gastrectomy for gastric cancer. J Korean Surg Soc. 2012;82:135-142. [PubMed] [DOI] |
| 22. | Takaori K, Nomura E, Mabuchi H, Lee SW, Agui T, Miyamoto Y, Iwamoto M, Watanabe H, Tanigawa N. A secure technique of intracorporeal Roux-Y reconstruction after laparoscopic distal gastrectomy. Am J Surg. 2005;189:178-183. [PubMed] [DOI] |
| 23. | An JY, Cho I, Choi YY, Kim YM, Noh SH. Totally laparoscopic Roux-en-Y gastrojejunostomy after laparoscopic distal gastrectomy: analysis of initial 50 consecutive cases of single surgeon in comparison with totally laparoscopic Billroth I reconstruction. Yonsei Med J. 2014;55:162-169. [PubMed] [DOI] |
| 25. | Uyama I, Sakurai Y, Komori Y, Nakamura Y, Syoji M, Tonomura S, Yoshida I, Masui T, Inaba K, Ochiai M. Laparoscopy-assisted uncut Roux-en-Y operation after distal gastrectomy for gastric cancer. Gastric Cancer. 2005;8:253-257. [PubMed] [DOI] |
| 26. | Jeong O, Park YK. Intracorporeal circular stapling esophagojejunostomy using the transorally inserted anvil (OrVil) after laparoscopic total gastrectomy. Surg Endosc. 2009;23:2624-2630. [PubMed] [DOI] |
| 27. | Uyama I, Sugioka A, Fujita J, Komori Y, Matsui H, Hasumi A. Laparoscopic total gastrectomy with distal pancreatosplenectomy and D2 lymphadenectomy for advanced gastric cancer. Gastric Cancer. 1999;2:230-234. [PubMed] [DOI] |
| 28. | Inaba K, Satoh S, Ishida Y, Taniguchi K, Isogaki J, Kanaya S, Uyama I. Overlap method: novel intracorporeal esophagoje-junostomy after laparoscopic total gastrectomy. J Am Coll Surg. 2010;211:e25-e29. [PubMed] [DOI] |
| 29. | Pietrzak P, Arya M, Joseph JV, Patel HR. Three-dimensional visualization in laparoscopic surgery. BJU Int. 2006;98:253-256. [PubMed] |
| 30. | Wagner OJ, Hagen M, Kurmann A, Horgan S, Candinas D, Vorburger SA. Three-dimensional vision enhances task performance independently of the surgical method. Surg Endosc. 2012;26:2961-2968. [PubMed] [DOI] |
| 31. | Bilgen K, Ustün M, Karakahya M, Işik S, Sengül S, Cetinkünar S, Küçükpinar TH. Comparison of 3D imaging and 2D imaging for performance time of laparoscopic cholecystectomy. Surg Laparosc Endosc Percutan Tech. 2013;23:180-183. [PubMed] [DOI] |
| 32. | Byrn JC, Schluender S, Divino CM, Conrad J, Gurland B, Shlasko E, Szold A. Three-dimensional imaging improves surgical performance for both novice and experienced operators using the da Vinci Robot System. Am J Surg. 2007;193:519-522. [PubMed] [DOI] |
| 33. | Velayutham V, Fuks D, Nomi T, Kawaguchi Y, Gayet B. 3D visualization reduces operating time when compared to high-definition 2D in laparoscopic liver resection: a case-matched study. Surg Endosc. 2016;30:147-153. [PubMed] [DOI] |
| 34. | Tanagho YS, Andriole GL, Paradis AG, Madison KM, Sandhu GS, Varela JE, Benway BM. 2D versus 3D visualization: impact on laparoscopic proficiency using the fundamentals of laparoscopic surgery skill set. J Laparoendosc Adv Surg Tech A. 2012;22:865-870. [PubMed] [DOI] |
| 41. | 刘 凤林, 闾 晨涛, 秦 净, 沈 坤堂, 陈 伟东, 沈 振斌, 王 聪, 孙 益红, 秦 新裕. 达芬奇人工智能手术系统辅助胃癌手术. 中华胃肠外科杂志. 2010;13:327-329. [DOI] |
| 42. | Kehlet H. Multimodal approach to control postoperative pathophysiology and rehabilitation. Br J Anaesth. 1997;78:606-617. [PubMed] |
| 43. | Liu XX, Jiang ZW, Wang ZM, Li JS. Multimodal optimization of surgical care shows beneficial outcome in gastrectomy surgery. JPEN J Parenter Enteral Nutr. 2010;34:313-321. [PubMed] [DOI] |
| 44. | Wu WC, Smith TS, Henderson WG, Eaton CB, Poses RM, Uttley G, Mor V, Sharma SC, Vezeridis M, Khuri SF. Operative blood loss, blood transfusion, and 30-day mortality in older patients after major noncardiac surgery. Ann Surg. 2010;252:11-17. [PubMed] [DOI] |
| 45. | Li MZ, Lian L, Xiao LB, Wu WH, He YL, Song XM. Laparoscopic versus open adhesiolysis in patients with adhesive small bowel obstruction: a systematic review and meta-analysis. Am J Surg. 2012;204:779-786. [PubMed] [DOI] |
| 46. | Ohtani H, Tamamori Y, Noguchi K, Azuma T, Fujimoto S, Oba H, Aoki T, Minami M, Hirakawa K. Meta-analysis of laparoscopy-assisted and open distal gastrectomy for gastric cancer. J Surg Res. 2011;171:479-485. [PubMed] [DOI] |