修回日期: 2018-05-17
接受日期: 2018-05-28
在线出版日期: 2018-06-18
肠易激综合征(irritable bowel syndrome, IBS)是世界上最常见的功能性胃肠道紊乱疾病之一, 以慢性间歇性腹痛, 结肠动力障碍及排便习惯改变为特点, 影响着大量患者的生活. 内脏敏感性和消化道通透性增高是IBS中的重要病理生理机制但IBS确切的致病机制仍不清楚, 目前认为涉及多种因素. 精神心理因素尤其是应激在IBS的发生、发展和调节中占重要地位. 本文综述了应激与IBS动物模型的关系以及应激在IBS内脏高敏、消化道高通透性机制中的作用, 以期为进一步研究IBS的发病机制提供参考.
核心提要: 内脏敏感性和消化道通透性增高是肠易激综合征(irritable bowel syndrome, IBS)中的重要病理生理机制. 应激在IBS的发生、发展和调节中占重要地位. 本文综述了应激与IBS动物模型的关系以及应激在IBS内脏高敏、消化道高通透性机制中的作用, 以期为进一步研究IBS的发病机制提供参考.
引文著录: 王玉婷, 许文燮. 应激在肠易激综合征致病机制中的作用. 世界华人消化杂志 2018; 26(17): 1064-1070
Revised: May 17, 2018
Accepted: May 28, 2018
Published online: June 18, 2018
Irritable bowel syndrome (IBS), one of the most common functional gastrointestinal disorders in the world, is characterized by chronic intermittent abdominal discomfort and colon dysmotility with altered bowel habits, significantly impacting patients' quality of life. The pathophysiology of IBS remains incompletely understood although some contributing factors have been identified. Increased visceral sensitivity and intestinal permeability may play an important role in the pathophysiology of IBS. Psychological factors, especially stress, play an important role in the occurrence, development, and regulation of IBS. To facilitate further research of IBS, this review focuses on the relationship between stress and IBS in animal models, as well as the role of stress in increased visceral sensitivity and intestinal permeability in IBS.
- Citation: Wang YT, Xu WX. Role of stress in pathophysiology of irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2018; 26(17): 1064-1070
- URL: https://www.wjgnet.com/1009-3079/full/v26/i17/1064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i17.1064
肠易激综合征(irritable bowel syndrome, IBS)是全球最常见的功能性胃肠道紊乱疾病之一, 世界范围内患病率在1.1%-29.2%, 在发达国家达到12%-20%[1,2]. IBS以慢性间歇性腹痛, 结肠动力障碍及排便习惯改变为特点, 对患者的生活和心理产生了较大影响[3]. 内脏敏感性和消化道通透性增高是IBS重要的病理生理机制, 但确切的致病机制至今仍不清楚, 目前认为有心理因素、肠-脑交流、激素改变和免疫活化等多种因素参与[4]. 应激与内分泌调节轴、肠道免疫、表观遗传等均联系密切, 是IBS致病机制中的重要因素, 能够触发IBS症状出现或使症状恶化, 且IBS的动物研究模型大多通过暴露于应激源建立[5]. 本文就近年来应激在IBS内脏高敏、消化道高通透性机制中的作用进行综述, 以期为进一步研究IBS的发病机制提供依据.
"应激"一词最早由Selye[6]提出, 其定义为生命体对感知到的身体或精神的威胁即应激源的生理适应性反应. 应激反应的中枢位点位于中脑的杏仁核、下丘脑的室旁核以及中脑导水管周围灰质, 它们接收来自内脏及躯体神经的内源刺激信号和来自皮质的外源刺激信号, 并输出信号给垂体和脑桥延髓的神经核从而分别调节神经内分泌功能和自主神经功能[7]. 室旁核激活时释放促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF), CRF与垂体促肾上腺皮质素细胞的CRF1受体结合, 促进促肾上腺皮质激素(adrenocorticotrophic hormone, ACTH)的释放, ACTH促进肾上腺分泌糖皮质激素(灵长类动物以皮质醇为主, 啮齿动物以皮质酮为主), 从而参与应激的生理调节[5]. 皮质酮/皮质醇对下丘脑的室旁核和垂体发挥负反馈作用[8]. 这一神经内分泌调节轴也称为应激反应的HPA轴(the hypothalamic-pituitary-adrenalaxis, HPA axis).
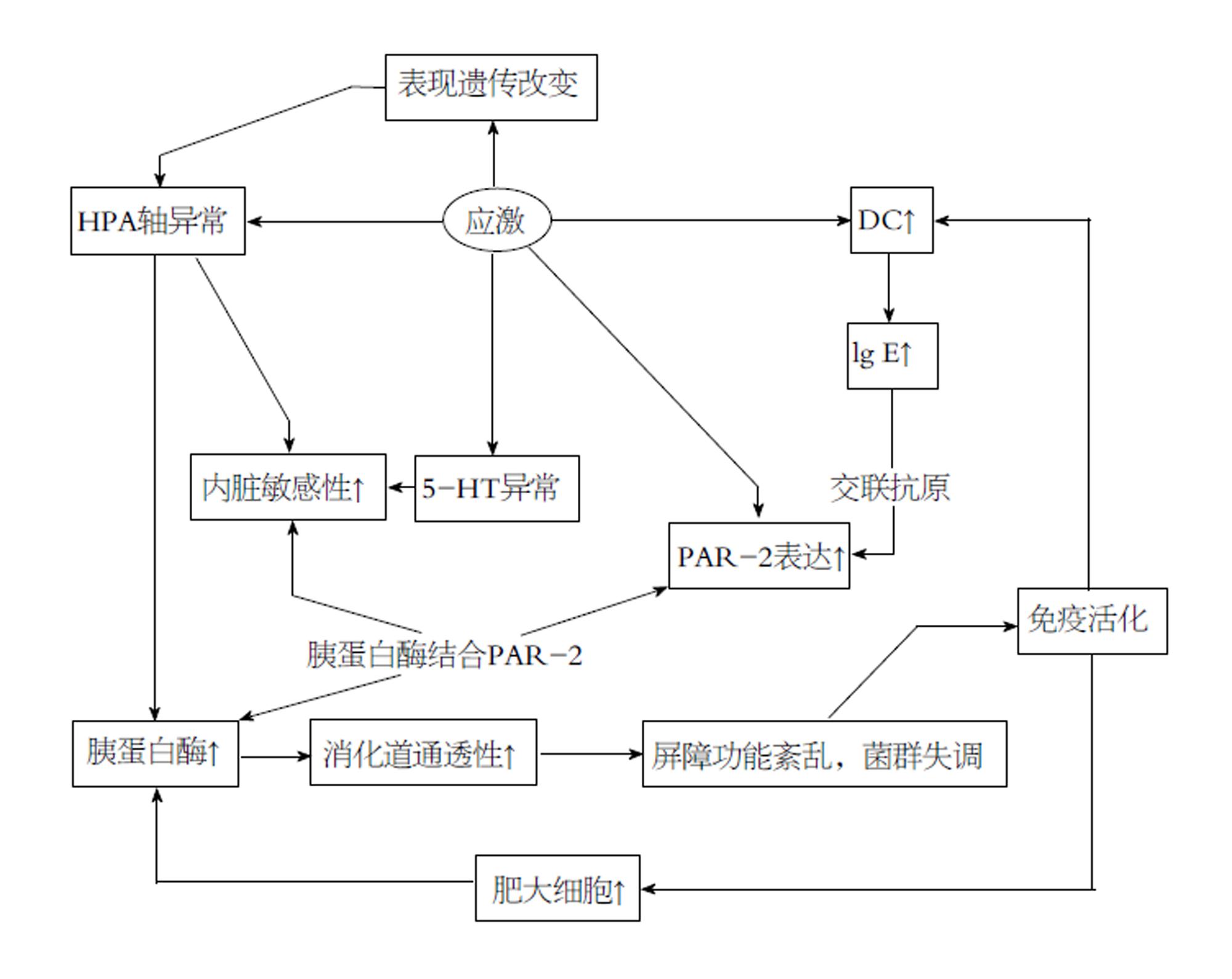
当应激过强或持续过久而超出机体适应的限度时, 会达到非稳态负荷的有害状态, 这便是多种应激相关的疾病的开端[5]. 应激诱导的失调会影响全身, 消化道是其中一个敏感的靶点[9]. 研究显示IBS患者的焦虑、抑郁等心理疾病发生率明显高于非患病人群[10,11], 应激能够触发IBS症状出现并能使症状恶化[5], 且不同类型的应激对IBS症状的发生、发展和调节中具有不同影响[12](图1).
胃肠道是空腔脏器, 其适宜刺激是扩张、牵拉等. 临床检查和实验室研究中最常用的刺激方法是结直肠扩张(colorectal distension, CRD): 将3 cm长的球囊(与外部控压装置连接)从肛门插入人或动物的结直肠腔内, 置于离肛门括约肌1 cm处, 实验时以恒定或阶梯式增大的压力扩张球囊以达到扩张球囊所在处的肠道的目的[1]. 监测和记录内脏运动反应(visceromotor response, VMR)可以反映内脏疼痛程度-应用于大鼠时可通过观测大鼠的血压、心率和腹部肌肉收缩情况衡量[5].
由于一定模式的应激能使动物表现出IBS的特征, 目前的IBS动物实验模型几乎都是通过将大鼠暴露于应激源建立的. IBS模型建立的主要标志为大鼠对CRD具有低的疼痛阈值, 其他标志还包括大鼠行为学(如旷场试验)、粪便性状及排泄率、结肠组织病理学等[5]. 新生期母婴分离(neonatal maternal separation, NMS)应激模型是一种模拟负性早期生活应激(early life stress)的模型, 通过破坏正常的亲代与子代之间的联系对幼鼠中枢神经系统产生持久的影响[13]. 成年后, NMS大鼠对CRD敏感性高, 血清中ACTH、皮质酮水平及杏仁核、蓝斑和下丘脑中CRF过多, 同时也表现出IBS的主要病理特征, 即内脏痛觉过敏和应激时结肠运动加强[14,15]. Wistar-Kyoto(WKY)大鼠具有异常应激反应的遗传易感性, 其结肠形态及生理功能与正常鼠相比发生改变[16]. 通过对不同焦虑水平的大鼠品系包括低焦虑SD和Fisher-344以及高焦虑WKY大鼠的研究, Gunter等[17]发现, 高焦虑WKY大鼠对CRD的反应性比低焦虑组大, 接受应激性刺激时皮质酮水平过高. 束缚应激(wrap restraint stress, WRS)大鼠模型是IBS的急性应激模型, 能表现出IBS的主要症状例如疼痛(CRD测试中痛觉过敏)和结肠动力异常(以粪便为指标), 并存在CRF释放的显著异常[5,8,18]. 动物模型的建立为研究IBS致病机制及IBS与应激的关系提供了广阔的平台.
35%-60%的IBS患者对消化道扩张的敏感性增高, 即存在内脏高敏感性--这个概念最早由Ritchie[19]于1973年提出, 他在进行乙状结肠充气实验时发现IBS患者存在结肠感觉异常. 内脏高敏即对来自肠道的生理信号和/或对实验性的内脏刺激具有更强烈的感觉和过度警觉, 被认为是腹部疼痛、腹部不适的最重要机制[1]. 大量研究表明IBS患者的疼痛阈值显著低于健康人群[20], 且各亚型中没有差异[21], 疼痛阈值与IBS的症状严重程度(腹痛强烈程度等)显著相关[22].
IBS患者被认为存在HPA轴的异常, 许多研究支持IBS患者基础情况下HPA活动性减弱而应激状态下反应却高于常人: IBS患者头发中[23]、唾液中[24]皮质醇浓度显著低; 应激后皮质醇浓度高且HPA轴持续兴奋, 皮质醇浓度下降慢[25]. 许多证据表明CRF的增高与内脏高敏现象息息相关: 腹腔注射选择性的CRFR1激动剂或脑室内注射CRF之后, 大鼠表现出十分明显的水样便和增高的内脏敏感性[26,27]; 而静脉注射非选择性CRF受体的拮抗剂能够减弱甚至预防腹泻型IBS的内脏高敏效应[27,28].
IBS患者血清中IL-6水平高, 且HPA轴高反应性与IL-6水平的升高呈正相关[29]. Buckley等[30]发现IL-6能激活黏膜下神经丛, 刺激胞内Ca2+的增高, 且CRF在促进Ca2+增多上与IL-6有协同作用, 而IL-6R拮抗剂及CRFR1拮抗剂能减少Ca2+通道的表达, 并提高CRD疼痛阈值. 他们还发现IBS患者血清能够活化JAK-STAT、ERK-MAPK胞内信号级联反应. 有证据显示WKY鼠结肠中T型Ca2+通道CaV3.2(该通道与大鼠内脏不适及疼痛有关)密度高, 其结肠组织中也发现了STAT3磷酸化作用增强[30,31]. 这些研究提示CRF和IL-6可能通过活化JAK-STAT、ERK-MAPK级联反应促进转录和蛋白合成, 导致胞膜上Ca2+通道增多, 神经元兴奋性增高从而内脏敏感性增高.
IBS患者中, 结肠[32]、空肠[33]、末端回肠[34]的黏膜存在肥大细胞浸润的现象, 脱颗粒的肥大细胞数目显著增多且释放大量类胰蛋白酶(tryptase, TPS)、组胺和前列腺素E2[32]. 交感节后神经纤维, 肽能和迷走神经纤维及肠神经元的末梢都和肥大细胞距离相近,估计有70%的肠黏膜肥大细胞与神经直接接触, 另有20%肥大细胞与神经的距离不足2 μm[35]. 靠近神经的肥大细胞的数目与腹部不适症状的严重程度和发作频率呈显著相关[20,32]. 注射肥大细胞稳定剂能提高IBS患者的疼痛阈值, 减少腹痛症状[27].
肥大细胞释放的一些介质能够活化或致敏感觉传入神经[27]. 体外试验表明, IBS患者肠肥大细胞释放的介质会使肠系膜神经放电增加, 并能刺激调节伤害性感受的背根神经节Ca2+动员, 且这些效应与充满肥大细胞的结肠固有层的面积呈线性正相关[20]. 蛋白酶激活受体-2(PAR-2)是一种TPS选择性活化受体, WRS大鼠模型中PAR-2表达量显著高[36]. 有证据显示TPS能选择性地激活肠神经和内脏传入神经的PAR-2, 从而引起长时间的神经元超兴奋[36].
WRS大鼠模型中肠固有层的树突状细胞(dendritic cells, DC)数目显著多, 同时血清中及回盲部肠黏膜中IL-4和IL-9水平显著高[36]. 将CD4+T细胞与该模型大鼠肠系膜淋巴结的DC一起培养时, 发现与DC或T细胞单独培养相比, IL-4含量显著高[36]. IL-4的表达上调可以诱导IgE产生, 当多价抗原与IgE结合引起至少两个以上的FcεRI的交联时能够激活肥大细胞释放大量活性物质[35]. 结肠黏膜PDIA3 (protein disulfide-isomerase A3)是一种二硫化物异构酶, 在内生抗原提呈中起重要作用, 能直接插入MHCⅠ的肽结合槽中使MHC和抗原结合更紧密[37]. 研究发现大鼠模型中PDIA3显著增多[38], 且它的敲除会导致大鼠模型排便减少, 内脏敏感性降低, 回盲肠DC数目减少且其刺激IL-4、IL-9分泌的能力也同样减弱[39].
这些证据或许能够串联成一条可能的机制, 即应激导致PDIA3增加, 使得DC数目增多且对抗原的敏感性和反应能力增高, 导致大量T细胞产生过量IL-4, 进一步IgE交联促进肥大细胞生成、致敏、脱颗粒, 所释放的TPS通过PAR-2致敏神经而导致内脏高敏.
人体约95%的5-羟色胺(5-hydroxytryptamine, 5-HT)存在于消化道, 其中90%在肠嗜铬细胞中, 10%在肠神经元中[38]. 慢性外感受性应激会导致局部5-HT释放[40]. 嗜铬细胞释放的5-HT可作为神经递质参与调节消化系统的感觉、运动和分泌功能. 在肠神经系统中, 5-HT与5-HT3受体结合, 经传入纤维传输信号, 成为肠道与中枢应激回路的联络中介, 而IBS患者中有相应脑部区域的改变[40]. 这些研究提示应激可能通过5-HT水平的变化影响消化道感觉.
色氨酸(tryptophan, Trp)是合成5-HT的底物, 在DC功能中起重要作用, 大部分色氨酸被代谢为犬尿氨酸分解, 这个过程由吲哚胺2,3-加双氧酶(indoleamine2, 3-dioxygenase, IDO)调节[40]. IDO可由各种细胞表达, 可被促炎因子IFN-γ诱导表达. 由于大脑色氨酸储存量有限, 若色氨酸减少, 中枢5-HT的合成可能减少, 可导致对精神疾病例如抑郁症的易感性增高[41]. 有研究证明IBS患者黏膜5-HT显著低[41], 血清中犬尿氨酸升高[40], 因此可能的机制为免疫活化中增多的IFN-γ诱导IDO表达增多, 色氨酸代谢增多从而5-HT的合成减少, 导致抑郁及消化道症状.
表观遗传是指环境因素驱动下的基因修饰, 基因表达发生改变但没有DNA序列本身的变化, Labonté等[42]认为表观遗传机制是导致应激对之后的生活有长期效应的原因. 研究者们发现童年创伤等早期生活应激导致成年后IBS患病几率增加, 因而提出观点认为出生后早期HPA轴是低反应性的, 这段时间的环境对应激反应系统的发育有重要影响, 不良应激刺激会对其产生负面影响从而诱导生活后期机体对疾病易感性的增加[43]. 这也能够解释NMS模型的机理, 出生后得到相对良好护理的子代大鼠成年时比NMS大鼠表达更多海马体的皮质酮受体, 且皮质酮反馈敏感性更高[44]. 分子生物学研究也发现NMS模型腰骶神经节(内脏疼痛信号加工的重要部位)组蛋白H4K12乙酰化减少, 组蛋白去乙酰化酶抑制剂SAHA能拮抗这种效应并使得应激诱导的内脏高敏趋于正常, 减弱NMS大鼠旷场试验中的焦虑反应[43]. 另有研究发现组蛋白H3K9乙酰化增多会促进转录因子与海马体外显子的皮质酮受体启动子结合[45]. 表观遗传在IBS中的作用的相关研究较少, 仍存在许多有待探讨的问题.
消化道黏膜屏障是人体与环境的交界, 由肠道菌群、黏液层、上皮细胞和位于它们之间的细胞间连接构成[46], 黏膜屏障选择性摄取机体所需的电解质和营养物质. 上皮通透性由一些蛋白复合体调节, 包含紧密连接(tight junction, TJ)和黏着连接蛋白[4]. IBS患者中12%-50%的人存在消化道通透性增高的现象[47].
应激会增加小肠和结肠细胞旁路的通透性[3], 研究发现急性应激能够增加健康大学生的小肠通透性, 且血清皮质醇浓度增高[48], 另有研究表明CRF能增加人类结肠黏膜对蛋白质抗原的跨膜摄取, 且CRF受体拮抗剂能够抑制这种效应[49], 证明HPA轴与消化道通透性之间可能存在联系. 动物试验中也有相似的结果: 外周注射非选择性CRF拮抗剂能够预防急性应激(避水应激)和慢性应激(母婴分离)下大鼠结肠细胞旁及跨细胞通透性增高现象[48,50].
外源性CRF能使健康人尿中乳果糖-甘露醇比率(lactulose -mannitol ratio, LMR)(反映肠通透性的指标)增加, 而肥大细胞稳定剂能够消除这种效应, 说明CRF增加肠通透性依赖于肥大细胞[48,50]. 关于肥大细胞的研究也得到了相应结果--肥大细胞衍生的TPS是破坏肠黏膜屏障的关键因素之一: IBS患者TPS活性显著高于常人, 将TPS加入到正常直肠活检组织中, 其通透性的增加与TPS浓度的上升成正比[51]; 黏膜肥大细胞数目和肠道通透性呈正相关关系, 肥大细胞产生的TPS黏附于结肠上皮细胞上的PAR2, 从而通过作用于细胞间的顶端连接(apical junction)增加细胞旁通透性[35]; caco-2(人克隆结肠腺癌细胞)单层细胞模型中, TPS破坏上皮完整性并增加细胞旁通透性, 且能减少TJ和黏着连接蛋白的表达[4].
消化道敏感性与通透性二者并不是互相孤立的. 在啮齿动物中, 应激诱导的通透性过高是内脏高敏的原因之一[52], TJ阻断剂能够拮抗结直肠高敏现象[3]. 一项关于真菌的研究显示, IBS患者与健康人相比粪便菌群分布不同, 杀真菌剂能减弱NMS大鼠对CRD的内脏敏感性[53]. 白色念珠菌等真菌被树突状细胞相关C型凝集素-1(Dectin-1)识别后会激活肥大细胞, 使其通过脱颗粒快速释放预先合成的组胺等介质[54]. 正常情况下真菌只存在于肠腔中, Ait-Belgnaoui等[3]的研究认为屏障功能紊乱是应激诱导内脏高敏的先决条件: 应激诱导细胞间紧密连接蛋白开放, 促进了肠腔抗原的摄取, 导致黏膜免疫细胞活化并驱动传入感觉神经致敏, 同时免疫系统的激活会引起系列反应和释放大量物质, 活化感受神经末梢从而影响疼痛感觉. Botschuijver等[53]将应激后内脏高敏概括为两个阶段进程的结果: 第一阶段, 急性应激时外周CRF促进肥大细胞脱颗粒, 导致传入神经纤维活化且屏障功能紊乱; 第二阶段, 屏障功能紊乱促进了真菌抗原例如β-葡聚糖的摄取, 新生成的肥大细胞被活化, 导致"自我循环"--持续的屏障紊乱和内脏高敏. 这个理论也能够解释为什么接受一小时避水应激的大鼠在之后的至少一个月中都会持续内脏高敏状态[53].
随着对应激在IBS致病机制中的研究及应激建立的IBS动物模型的广泛应用, 人们得以不断深入对应激和IBS的认识. 胃肠道是应激反应时重要的外周靶器官, 应激通过CRF、免疫活化的改变导致内脏高敏和肠道高通透性, 还能通过5-HT及表观遗传的改变导致内脏高敏, 成为促进IBS的发生发展的重要机制.
由于种种原因, 部分研究存在一些局限性: (1)由于IBS是功能性消化道疾病, 建立的动物模型难以完整、全面和确切地重复疾病过程, 对研究存在一定的影响; (2)部分研究结果互相矛盾, 如不同研究中IBS患者血清CRF浓度改变趋势结果不一, 可能是由于激素存在节律性及脉冲性分泌特点且受年龄、性别、测定方法等多种因素影响, 而目前相关试验方法缺乏统一的标准; (3)IBS涉及机体消化、神经、内分泌、免疫等多个系统的多相紊乱, 且各系统互相影响和联系, 各因素的互相影响导致难以确定其中的主要矛盾及各因素变化之间的因果关系, 给研究结论的明确带来较大难度.
精神心理因素对IBS发病的影响越来越受到重视, 随着对应激在IBS发病中的不断深入研究, 人们得以深入对二者的认识, 期待进一步的研究将更加系统而清晰地阐释两者关系, 从而为诊断IBS提供更多特异性指标, 为有效治疗IBS提供更多指导.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Keszthelyi D, Troost FJ, Masclee AA. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Methods to assess visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2012;303:G141-G154. [PubMed] [DOI] |
| 2. | Canavan C, West J, Card T. Review article: the economic impact of the irritable bowel syndrome. Aliment Pharmacol Ther. 2014;40:1023-1034. [PubMed] [DOI] |
| 3. | Ait-Belgnaoui A, Bradesi S, Fioramonti J, Theodorou V, Bueno L. Acute stress-induced hypersensitivity to colonic distension depends upon increase in paracellular permeability: role of myosin light chain kinase. Pain. 2005;113:141-147. [PubMed] [DOI] |
| 4. | Wilcz-Villega EM, McClean S, O'Sullivan MA. Mast cell tryptase reduces junctional adhesion molecule-A (JAM-A) expression in intestinal epithelial cells: implications for the mechanisms of barrier dysfunction in irritable bowel syndrome. Am J Gastroenterol. 2013;108:1140-1151. [PubMed] [DOI] |
| 5. | Larauche M, Mulak A, Taché Y. Stress and visceral pain: from animal models to clinical therapies. Exp Neurol. 2012;233:49-67. [PubMed] [DOI] |
| 6. | Selye H. A syndrome produced by diverse nocuous agents. 1936. J Neuropsychiatry Clin Neurosci. 1998;10:230-231. [PubMed] |
| 7. | Bandler R, Price JL, Keay KA. Brain mediation of active and passive emotional coping. Prog Brain Res. 2000;122:333-349. [PubMed] |
| 8. | Vannucchi MG, Evangelista S. Experimental Models of Irritable Bowel Syndrome and the Role of the Enteric Neurotransmission. J Clin Med. 2018;7:4. [PubMed] [DOI] |
| 9. | Stengel A, Taché Y. Corticotropin-releasing factor signaling and visceral response to stress. Exp Biol Med (Maywood). 2010;235:1168-1178. [PubMed] [DOI] |
| 10. | Stasi C, Bellini M, Costa F, Mumolo MG, Ricchiuti A, Grosso M, Duranti E, Metelli MR, Gambaccini D, Bianchi L. Neuroendocrine markers and psychological features in patients with irritable bowel syndrome. Int J Colorectal Dis. 2013;28:1203-1208. [PubMed] [DOI] |
| 12. | Mayer EA, Naliboff BD, Chang L, Coutinho SV. V. Stress and irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2001;280:G519-G524. [PubMed] [DOI] |
| 13. | Szyf M, Weaver I, Meaney M. Maternal care, the epigenome and phenotypic differences in behavior. Reprod Toxicol. 2007;24:9-19. [PubMed] [DOI] |
| 15. | O'Mahony SM, Hyland NP, Dinan TG, Cryan JF. Maternal separation as a model of brain-gut axis dysfunction. Psychopharmacology (Berl). 2011;214:71-88. [PubMed] [DOI] |
| 16. | O'Malley D, Julio-Pieper M, Gibney SM, Dinan TG, Cryan JF. Distinct alterations in colonic morphology and physiology in two rat models of enhanced stress-induced anxiety and depression-like behaviour. Stress. 2010;13:114-122. [PubMed] [DOI] |
| 17. | Rittenhouse PA, López-Rubalcava C, Stanwood GD, Lucki I. Amplified behavioral and endocrine responses to forced swim stress in the Wistar-Kyoto rat. Psychoneuroendocrinology. 2002;27:303-318. [PubMed] |
| 18. | 殷 燕, 任 晓阳, 刘 亚萍, 卢 桂芳, 和 水祥. 以内脏高敏感为靶点的肠易激综合征大鼠模型评价研究. 胃肠病学和肝病学杂志. 2017;26:1263-1267. [DOI] |
| 19. | Ritchie J. Pain from distension of the pelvic colon by inflating a balloon in the irritable colon syndrome. Gut. 1973;14:125-132. [PubMed] |
| 20. | Barbara G, Wang B, Stanghellini V, de Giorgio R, Cremon C, Di Nardo G, Trevisani M, Campi B, Geppetti P, Tonini M. Mast cell-dependent excitation of visceral-nociceptive sensory neurons in irritable bowel syndrome. Gastroenterology. 2007;132:26-37. [PubMed] [DOI] |
| 21. | Kanazawa M, Palsson OS, Thiwan SI, Turner MJ, van Tilburg MA, Gangarosa LM, Chitkara DK, Fukudo S, Drossman DA, Whitehead WE. Contributions of pain sensitivity and colonic motility to IBS symptom severity and predominant bowel habits. Am J Gastroenterol. 2008;103:2550-2561. [PubMed] [DOI] |
| 22. | Kanazawa M, Hongo M, Fukudo S. Visceral hypersensitivity in irritable bowel syndrome. J Gastroenterol Hepatol. 2011;26 Suppl 3:119-121. [PubMed] [DOI] |
| 23. | Norlin AK, Walter S, Theodorsson E, Tegelstrom V, Grodzinsky E, Jones MP, Faresjö Å. Cortisol levels in hair are altered in irritable bowel syndrome - A case control study in primary care. J Psychosom Res. 2017;93:69-75. [PubMed] [DOI] |
| 24. | Markert C, Suarez-Hitz K, Ehlert U, Nater UM. Endocrine dysregulation in women with irritable bowel syndrome according to Rome II criteria. J Behav Med. 2016;39:519-526. [PubMed] [DOI] |
| 25. | Kennedy PJ, Cryan JF, Quigley EM, Dinan TG, Clarke G. A sustained hypothalamic-pituitary-adrenal axis response to acute psychosocial stress in irritable bowel syndrome. Psychol Med. 2014;44:3123-3134. [PubMed] [DOI] |
| 26. | Larauche M, Gourcerol G, Wang L, Pambukchian K, Brunnhuber S, Adelson DW, Rivier J, Million M, Taché Y. Cortagine, a CRF1 agonist, induces stresslike alterations of colonic function and visceral hypersensitivity in rodents primarily through peripheral pathways. Am J Physiol Gastrointest Liver Physiol. 2009;297:G215-G227. [PubMed] [DOI] |
| 27. | van den Wijngaard RM, Klooker TK, de Jonge WJ, Boeckxstaens GE. Peripheral relays in stress-induced activation of visceral afferents in the gut. Auton Neurosci. 2010;153:99-105. [PubMed] [DOI] |
| 28. | Sagami Y, Shimada Y, Tayama J, Nomura T, Satake M, Endo Y, Shoji T, Karahashi K, Hongo M, Fukudo S. Effect of a corticotropin releasing hormone receptor antagonist on colonic sensory and motor function in patients with irritable bowel syndrome. Gut. 2004;53:958-964. [PubMed] |
| 29. | Sung IK. Hypothalamic-pituitary-gut axis dysregulation in irritable bowel syndrome: plasma cytokines as a potential biomarker. Korean J Gastroenterol. 2006;48:140-142. [PubMed] |
| 30. | Buckley MM, O'Halloran KD, Rae MG, Dinan TG, O'Malley D. Modulation of enteric neurons by interleukin-6 and corticotropin-releasing factor contributes to visceral hypersensitivity and altered colonic motility in a rat model of irritable bowel syndrome. J Physiol. 2014;592:5235-5250. [PubMed] [DOI] |
| 31. | Marger F, Gelot A, Alloui A, Matricon J, Ferrer JF, Barrère C, Pizzoccaro A, Muller E, Nargeot J, Snutch TP. T-type calcium channels contribute to colonic hypersensitivity in a rat model of irritable bowel syndrome. Proc Natl Acad Sci USA. 2011;108:11268-11273. [PubMed] [DOI] |
| 32. | Barbara G, Stanghellini V, De Giorgio R, Cremon C, Cottrell GS, Santini D, Pasquinelli G, Morselli-Labate AM, Grady EF, Bunnett NW. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology. 2004;126:693-702. [PubMed] |
| 33. | Guilarte M, Santos J, de Torres I, Alonso C, Vicario M, Ramos L, Martínez C, Casellas F, Saperas E, Malagelada JR. Diarrhoea-predominant IBS patients show mast cell activation and hyperplasia in the jejunum. Gut. 2007;56:203-209. [PubMed] [DOI] |
| 34. | Park JH, Rhee PL, Kim HS, Lee JH, Kim YH, Kim JJ, Rhee JC. Mucosal mast cell counts correlate with visceral hypersensitivity in patients with diarrhea predominant irritable bowel syndrome. J Gastroenterol Hepatol. 2006;21:71-78. [PubMed] [DOI] |
| 35. | Zhang L, Song J, Hou X. Mast Cells and Irritable Bowel Syndrome: From the Bench to the Bedside. J Neurogastroenterol Motil. 2016;22:181-192. [PubMed] [DOI] |
| 36. | Li M, Zhang L, Lu B, Chen Z, Chu L, Meng L, Fan Y. Role of dendritic cell-mediated abnormal immune response in visceral hypersensitivity. Int J Clin Exp Med. 2015;8:13243-13250. [PubMed] |
| 37. | Santos SG, Campbell EC, Lynch S, Wong V, Antoniou AN, Powis SJ. Major histocompatibility complex class I-ERp57-tapasin interactions within the peptide-loading complex. J Biol Chem. 2007;282:17587-17593. [PubMed] [DOI] |
| 38. | Kim DY, Camilleri M. Serotonin: a mediator of the brain-gut connection. Am J Gastroenterol. 2000;95:2698-2709. [PubMed] [DOI] |
| 39. | Zhuang Z, Zhang L, Wang X, Tao L, Lv B. PDIA3 gene induces visceral hypersensitivity in rats with irritable bowel syndrome through the dendritic cell-mediated activation of T cells. Peer J. 2016;4:e2644. [PubMed] [DOI] |
| 40. | Stasi C, Bellini M, Bassotti G, Blandizzi C, Milani S. Serotonin receptors and their role in the pathophysiology and therapy of irritable bowel syndrome. Tech Coloproctol. 2014;18:613-621. [PubMed] [DOI] |
| 41. | Fitzgerald P, Cassidy Eugene M, Clarke G, Scully P, Barry S, Quigley Eamonn MM, Shanahan F, Cryan J, Dinan Timothy G. Tryptophan catabolism in females with irritable bowel syndrome: relationship to interferon-gamma, severity of symptoms and psychiatric co-morbidity. Neurogastroenterol Motil. 2008;20:1291-1297. [PubMed] [DOI] |
| 42. | Labonté B, Suderman M, Maussion G, Navaro L, Yerko V, Mahar I, Bureau A, Mechawar N, Szyf M, Meaney MJ. Genome-wide epigenetic regulation by early-life trauma. Arch Gen Psychiatry. 2012;69:722-731. [PubMed] [DOI] |
| 43. | Moloney RD, Stilling RM, Dinan TG, Cryan JF. Early-life stress-induced visceral hypersensitivity and anxiety behavior is reversed by histone deacetylase inhibition. Neurogastroenterol Motil. 2015;27:1831-1836. [PubMed] [DOI] |
| 44. | Francis D, Diorio J, Liu D, Meaney MJ. Nongenomic transmission across generations of maternal behavior and stress responses in the rat. Science. 1999;286:1155-1158. [PubMed] |
| 45. | Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S, Seckl JR, Dymov S, Szyf M, Meaney MJ. Epigenetic programming by maternal behavior. Nat Neurosci. 2004;7:847-854. [PubMed] [DOI] |
| 46. | Barbara G, Zecchi L, Barbaro R, Cremon C, Bellacosa L, Marcellini M, De Giorgio R, Corinaldesi R, Stanghellini V. Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J Clin Gastroenterol. 2012;46 Suppl:S52-S55. [PubMed] [DOI] |
| 47. | Wilcz-Villega E, McClean S, O'Sullivan M. Reduced E-cadherin expression is associated with abdominal pain and symptom duration in a study of alternating and diarrhea predominant IBS. Neurogastroenterol Motil. 2014;26:316-325. [PubMed] [DOI] |
| 48. | Vanuytsel T, van Wanrooy S, Vanheel H, Vanormelingen C, Verschueren S, Houben E, Salim Rasoel S, Tόth J, Holvoet L, Farré R. Psychological stress and corticotropin-releasing hormone increase intestinal permeability in humans by a mast cell-dependent mechanism. Gut. 2014;63:1293-1299. [PubMed] [DOI] |
| 49. | Wallon C, Yang PC, Keita AV, Ericson AC, McKay DM, Sherman PM, Perdue MH, Söderholm JD. Corticotropin-releasing hormone (CRH) regulates macromolecular permeability via mast cells in normal human colonic biopsies in vitro. Gut. 2008;57:50-58. [PubMed] [DOI] |
| 50. | Barreau F, Cartier C, Leveque M, Ferrier L, Moriez R, Laroute V, Rosztoczy A, Fioramonti J, Bueno L. Pathways involved in gut mucosal barrier dysfunction induced in adult rats by maternal deprivation: corticotrophin-releasing factor and nerve growth factor interplay. J Physiol. 2007;580:347-356. [PubMed] [DOI] |
| 51. | Lee JW, Park JH, Park DI, Park JH, Kim HJ, Cho YK, Sohn CI, Jeon WK, Kim BI. Subjects with diarrhea-predominant IBS have increased rectal permeability responsive to tryptase. Dig Dis Sci. 2010;55:2922-2928. [PubMed] [DOI] |
| 52. | Da Silva S, Robbe-Masselot C, Ait-Belgnaoui A, Mancuso A, Mercade-Loubière M, Salvador-Cartier C, Gillet M, Ferrier L, Loubière P, Dague E. Stress disrupts intestinal mucus barrier in rats via mucin O-glycosylation shift: prevention by a probiotic treatment. Am J Physiol Gastrointest Liver Physiol. 2014;307:G420-G429. [PubMed] [DOI] |
| 53. | Botschuijver S, Roeselers G, Levin E, Jonkers DM, Welting O, HeinsbroekSE , de Weerd HH, Boekhout T, Fornai M, Masclee AA. RM, Intestinal Fungal Dysbiosis Associates With Visceral Hypersensitivity in Patients WithIrritable Bowel Syndrome and Rats. Gastroenterology. 2017;153:1026-1039. [DOI] |
| 54. | Nieto-Patlán A, Campillo-Navarro M, Rodríguez-Cortés O, Muñoz-Cruz S, Wong-Baeza I, Estrada-Parra S, Estrada-García I, Serafín-López J, Chacón-Salinas R. Recognition of Candida albicans by Dectin-1 induces mast cell activation. Immunobiology. 2015;220:1093-1100. [PubMed] [DOI] |