修回日期: 2015-11-01
接受日期: 2015-11-09
在线出版日期: 2015-12-08
目的: 探讨燕窝在手术绝经大鼠肝细胞氧化应激中的抗氧化作用, 揭示燕窝抗氧化作用的机制.
方法: 手术摘除大鼠双侧卵巢制备手术绝经大鼠模型, 并通过观察大鼠动情周期确定模型是否成立; 大鼠被随机分为5组(每组8只): 卵巢切除组、假手术组、1.5%燕窝处理组、6%燕窝处理组及正常对照组. 用不同浓度燕窝干预处理手术绝经大鼠12 wk后, 检测大鼠肝功能[谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)和谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)]; ELISA试剂盒检测不同实验组的超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性, 丙二醛(malonaldehyde, MDA)法检测肝组织脂质过氧化水平; 采用实时定量PCR检测(real-time quantitative PCR, qRT-PCR)方法检测抗氧化通路中关键基因SOD1/2/3和多(ADP-核糖)聚合酶1[poly (ADP-ribose) polymerase 1, PARP1]的mRNA表达水平.
结果: 肝功能结果显示, 绝经后ALT和GGT与绝经前无明显变化, 但是ALP水平明显高于假手术组. 手术对照组SOD表达量低于假手术组表达量(5.43±0.50 vs 9.96±0.39), 手术对照组CAT表达量也低于假手术组表达量(3.93±0.33 vs 6.06±0.79), 但是经过燕窝干预12 wk后, 可以显著提高SOD和CAT表达水平, 并能够显著提高SOD/CAT的比值. 并且燕窝干预处理可以削弱绝经后引起的脂质过氧化损伤, 6%燕窝处理组与1.5%燕窝处理组相比, MDA水平明显下降(1.37±0.03 vs 1.45±0.04). qRT-PCR结果显示, 与手术对照组比较, 6%燕窝处理组和1.5%燕窝处理组均可上调SOD1 mRNA相对表达量(3.99±0.27 vs 3.21±0.17); SOD2 mRNA相对表达量(3.56±0.21 vs 3.23±0.16); SOD3 mRNA相对表达量(9.45±0.81 vs 8.02±0.92)和PARP1 mRNA的相对表达量(4.31±0.53 vs 3.11±0.36).
结论: 本研究揭示手术摘除大鼠卵巢可诱导肝脏氧化应激的产生, 而燕窝可通过调节肝细胞抗氧化通路中相关基因的表达发挥抗氧化作用, 从而发挥肝细胞保护作用.
核心提示: 肝脏疾病在老年人中的致死率最高, 绝经期后由于雌激素的缺失使女性饱受肝脏相关疾病的困扰. 燕窝自唐朝就被国人用作抗衰老之补品, 现代研究报道其具有改善氧化应激功能, 因此本文旨在探讨燕窝在手术绝经大鼠肝细胞中的抗氧化作用.
引文著录: 何培元, 马立新, 何文静, 李文萍, 李炳庆, 侯志平. 燕窝对手术绝经大鼠肝脏抗氧化能力的影响. 世界华人消化杂志 2015; 23(34): 5513-5520
Revised: November 1, 2015
Accepted: November 9, 2015
Published online: December 8, 2015
AIM: To evaluate the anti-oxidant effect of edible bird's nest in the liver of ovariectomized rats and the underlying mechanism.
METHODS: A rat model of surgical menopause rat model was developed by bilateral ovariectomy. The rats were randomly divided into five experimental groups (n = 8); an ovariectomy (OVX) group had the ovaries surgically removed, a sham group underwent a sham operation, edible bird's nest treatment groups received 6% and 1.5% edible bird's nest, respectively, and a control group did not undergo ovariectomy. After 12 wk of intervention, alanine aminotransferase (ALT), alkaline phosphatase (ALP), and gamma-glutamyl transpeptidase (GGT) were measured. ELISA was performed to detect the presence of superoxide dismutase (SOD) and catalase (CAT). The level of malonaldehyde (MDA) was measured by thiobarbituric acid-reactive substance (TBARS) method. Real-time quantitative PCR (qRT-PCR) was performed to detect the mRNA expression levels of SOD1/2/3 and poly ADP-ribose polymerase 1, which are key genes involved in the anti-oxidation pathway.
RESULTS: There were no significant differences in ALT or GGT between rats after menopause and before menopause, but ALP was significantly increased in the OVX group. SOD and CAT levels were significantly lower in the OVX group than in the sham group (5.43 ± 0.50 vs 9.96 ± 0.39, 3.93 ± 0.33 vs 6.06 ± 0.79, respectively). Edible bird's nest intervention significantly improved redox status as evidenced by the levels of oxidative damage (malondaldehyde content) and enzymatic antioxidants (superoxide dismutase and catalase). Furthermore, expression of genes associated with anti-oxidation was upregulated in the liver homogenate after edible bird's nest intervention.
CONCLUSION: Surgical menopause induces liver oxidative stress and edible bird's nest plays a role as an antioxidant by regulating the expression of genes involved in anti-oxidant pathways.
- Citation: He PY, Ma LX, He WJ, Li WP, Li BQ, Hou ZP. Anti-oxidant effect of edible bird's nest in the liver of ovariectomized rats. Shijie Huaren Xiaohua Zazhi 2015; 23(34): 5513-5520
- URL: https://www.wjgnet.com/1009-3079/full/v23/i34/5513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i34.5513
慢性肝病大多会逐渐发展到不可逆的肝硬化阶段, 这是困扰全世界健康的一大难题[1]. 目前肝硬化已成为世界范围内排名第12的致死凶手, 并且致死人数随着时间的推移迅速增加, 据统计, 在2010年肝硬化导致的死亡人数比1990年增加了33%[2]. 更值得关注的是, 肝脏相关性疾病和肝硬化在老年人中的致死率最高, 45-54岁年龄段死亡率位居第4位, 在55-64岁年龄段死亡率位居第7位[3]. 文献报道[1], 雌激素的缺失使绝经女性饱受肝脏相关疾病的困扰. 自然绝经的年龄在45-55岁, 美国平均绝经年龄为51岁, 据估计到2020年每天都会有约6000位女性进入绝经期, 从而失去雌激素的保护[4]. 因此, 如何在更年期这一自然的历史过程中保护肝脏功能变得尤为重要.
燕窝为雨燕科金丝燕属分泌出的唾液与其羽绒混合凝结于悬崖峭壁上的窝. 自唐朝燕窝就被中国人用作抗衰老、增强免疫力之补品[5-7], 并且现在还被西方人评为"东方鱼子酱"[8]. 但是燕窝的使用依然沿袭着传统方法而缺少科学实验的支持. 前期实验证实, 燕窝水提物具有较强的抗氧化活性[9], 并且燕窝在更年期衰老大鼠模型中, 通过调节脑组织氧化应激状态, 抑制神经细胞凋亡发挥延缓和减轻神经系统退行性变的保护作用[10]. 我们继续从肝组织氧化还原状态角度探讨燕窝对肝组织的保护作用.
SD大鼠40只, ♀, 12周龄, 体质量160-180 g, 河北医科大学实验动物中心提供. 模型制备过程中使用的营养补充剂-燕窝, 由马来西亚婆罗洲友情赠送. 全自动生化检测仪(日本OLYMPUS640), 实时定量PCR检测仪(real-time quantitative PCR, qRT-PCR)(德国Eppendorf Realplex)总RNA和蛋白提取试剂盒、反转录试剂盒及qRT-PCR购自德国凯杰公司(分类号: 80004、205311、204054). qRT-PCR反应中所需上下游引物由上海生工合成, 引物序列如表1所列.
| 基因 | GenBank | 上游引物序列 | 下游引物序列 |
| GAPDH | NM_017008 | CTGAGGACCAGGTTGTCTCC | GAGGGCCTCTCTCTTGCTCT |
| SOD1 | NM_017050 | TCAATATGGGGACAATACAC | TACTTTCTTCATTTCCACCTT |
| SOD2 | NM_017051 | TGTATGAAAGTGCTCAAGAT | GCCCTCTTGTGAGTATAAGT |
| SOD3 | NM_012880 | CGAACTACTTTATGCCC | GAAGACAAACGAGGTCTCTA |
| PARP1 | NM_001618 | TATCGAGTCGAGTACGCCAA | GTGTGGGACTTTTCCATCAAA |
1.2.1 手术绝经大鼠模型制备与处理: 大鼠饲养于标准环境中(12 h灯光照射/12 h黑暗, 20 ℃-22 ℃, 40%-50%湿度), 前2 wk自由饮食水以适应环境. 动物使用已通过承德医学院动物伦理委员会论证, 并且动物饲养标准完全按照伦理委员会的要求进行干预处理. 手术绝经大鼠模型的制作按照参考文献操作, 具体方法如下: 大鼠双侧腹部备皮, 10 mg/60(mg•kg)甲苯噻嗪/氯胺酮腹腔注射麻醉手术大鼠, 双侧腹部切开, 输卵管处结扎, 切除卵巢, 关闭腹腔.
1.2.2 分组: 实验大鼠根据随机对照表随机分为5组, 每组8只. 正常对照组, 给予基础饲料喂养, 不施加任何干预因素; 假手术组, 麻醉后大鼠只切开双侧腹部, 找到卵巢后即关闭腹腔, 给予基础饲料喂养; 手术对照组: 切除双侧卵巢后, 给予基础饲料喂养; 燕窝处理组: 切除双侧卵巢后, 以含有6%和1.5%燕窝的基础饲料喂养12 wk. 以手术对照组前1 d的食量为参照而控制燕窝组食量, 并且记录各组食物摄取量. 每周记录体质量. 各组大鼠食物组成如表2.
| 动物分组 | 食物组成(计1000 g) | ||
| 鼠粮 | 淀粉 | 燕窝 | |
| 正常对照组 | 1000 | 50 | - |
| 假手术组 | 950 | 50 | - |
| 手术对照组 | 950 | 50 | - |
| 6%燕窝处理组 | 890 | 50 | 60 |
| 1.5%燕窝处理组 | 935 | 50 | 15 |
1.2.3 标本采集与预处理: 燕窝干预12 wk后, 各组大鼠均以腹腔注射10 mg/60(mg•kg)甲苯噻嗪/氯胺酮麻醉, 心脏取血, 置于EDTA抗凝管, 离心后取上层血浆, 分离后置于-20 ℃冰箱保存. 大鼠处死后腹腔内迅速取出大鼠肝组织, 生理盐水冲洗后, 投入液氮中暂存, 操作结束后置于-80 ℃冰箱冷冻保存, 用于分子生物学检测.
1.2.4 发情周期的观察: 在处死大鼠前7-8 d通过阴道拭子涂片法观察大鼠发情周期, 以确定假手术组大鼠处于动情期. 观察周期包括: 动情间期(大约2 d), 主要以白细胞为主, 少量有核细胞和黏液; 动情前期(大约1 d), 只出现有核细胞; 动情期(大约1 d), 只有角化细胞; 动情后期(大约1-2 d), 可观察到白细胞、角化细胞和有核细胞. 以上观察结果与报道[10]相一致.
1.2.5 大鼠肝功能检测: 各组大鼠冷冻血浆室温解冻后, 于全自动生化仪中测定血浆中谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)、谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)活性, 并比较各大鼠组间差异.
1.2.6 肝细胞抗氧化能力检测: 商品化ELISA试剂盒(武汉华美生物工程有限公司)检测肝组织超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性. 操作步骤严格按照说明书进行, 最后荧光酶标仪在490 nm处读取SOD和CAT数值, 根据标准曲线计算各组大鼠SOD和CAT浓度.
1.2.7 肝细胞脂质过氧化水平检测: 取20 mg肝组织溶于50 μL PBS中制作裂解液, 分别加入0.25 mol/L盐酸, 15% 2,4,6-三氯苯甲醚(2,4,6-trichloroanisaole, TCA)和0.375% 2,4,6-三溴苯甲醚(2,4,6-tribromoanisole, TBA), 100 ℃孵育10 min, 3000 g离心15 min, 最后荧光酶标仪在540 nm处读数, 根据标准曲线计算各实验组丙二醛(malonaldehyde, MDA)浓度[10].
1.2.8 总RNA提取、反转录及qRT-PCR检测SOD1/2/3和PARP1表达水平: 按照试剂盒说明书步骤提取肝脏总RNA, 用紫外分光光度计检测RNA的纯度及浓度, 所得RNA保存于-80 ℃冰箱. 每次反转录以1 μg总RNA为模版, 反应体系20 μL, 步骤完全按照试剂盒说明书进行, 所得1 μg cDNA保存于-20 ℃冰箱. qRT-PCR反应于96孔板中进行, 以GAPDH为内参基因, 每个样本设3个复孔, 每孔中依次加入2×SYBR Green PCR Master Mix 12.5 μL, cDNA 1 μL, 上下游引物各1 μL, 双蒸水9.5 μL, 总体积25 μL. PCR仪参数设定: 95 ℃预变性5 min, 再于95 ℃变性10 s, 复性温度60 ℃, 延伸30 s, 循环35次, 最终温度于20 min内匀速上升至95 ℃以绘制溶解曲线. 所得结果由△△Ct算法得出.
统计学处理 采用SPSS20.1软件进行分析, 统计结果以mean±SD表示, 计量资料采用方差分析. P<0.05为差异有统计学意义.
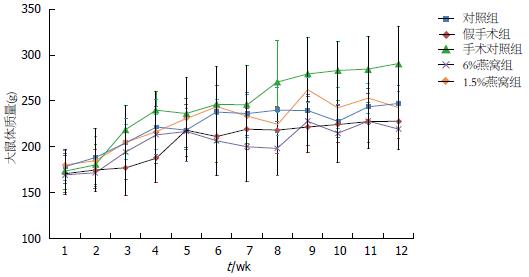
如图1所示, 实验开始前, 所有实验组大鼠具有相同的体质量, 干预处理的12 wk内各组大鼠体质量呈持续增长, 第3周后, 各组大鼠体质量出现差异, 但在第5周又趋于一致. 但是, 手术对照组自第8周后增长速度明显高于假手术组, 在第12周(处死前)两组间差异具有统计学差异(t = 2.653, P = 0.0189). 6%燕窝处理组在第12周与手术对照组比较, 体质量明显减轻(t = 4.269, P = 0.0008); 1.5%燕窝处理组体质量也明显轻于手术对照组(t =2.981, P = 0.0099). 然而, 与假手术组相比, 燕窝处理组大鼠体质量与其无统计学差异(F = 2.874, P = 0.0788).
ALT水平在手术绝经后及燕窝干预后与假手术组或正常对照组比较没有明显差异(F = 2.343, P = 0.0739, 表3). 手术对照组大鼠ALP水平明显高于假手术组(t = 3.423, P = 0.0041); 同样, 6%燕窝处理组ALP水平也高于假手术组(t = 4.714, P = 0.0003). GGT水平各组间无统计学差异, 均处于正常范围(<2).
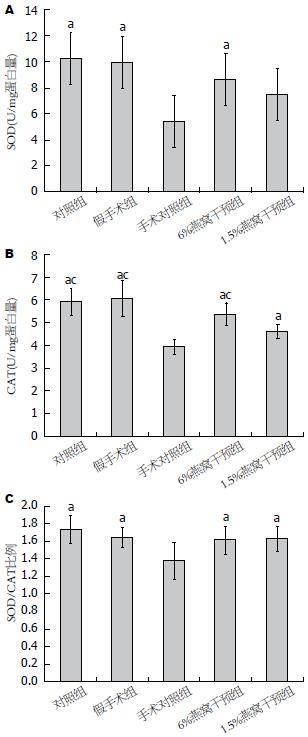
除了1.5%燕窝处理组外, 其他实验组SOD活性明显高于手术对照组(R2 = 0.9302, P<0.0001, 图2A), 其他实验组CAT活性也明显高于手术对照组(R2 = 0.7278, P<0.0001, 图3). 1.5%燕窝处理组CAT活性低于假手术组和6%燕窝处理组(P<0.05, 图2B). 然而, 通过计算SOD/CAT比例发现, 所有实验组与假手术组比较, 其抗氧化活性均明显增加(R2 = 0.3813, P = 0.0017, 图2C).
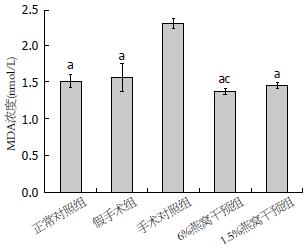
各实验组MDA表达水平如图3所示, 手术对照组明显高于其他实验组(F = 114.5, P<0.0001); 6%燕窝处理组低于假手术组(P = 0.0043).
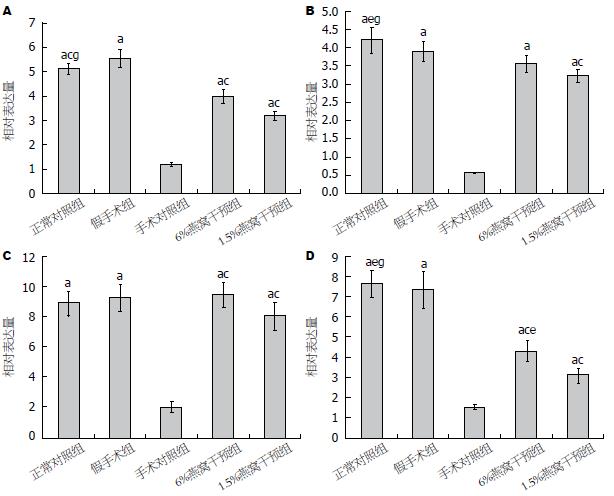
与假手术组相比, 手术对照组中SOD1(t = 33.24), SOD2(t = 36.12), SOD3(t = 21.94)及PARP1(t = 17.96)mRNA表达量均显著下降(P<0.0001). 6%燕窝处理组和1.5%燕窝处理组的SOD1表达量均低于假手术组(P<0.001). 6%燕窝处理组SOD2和SOD3表达量与假手术组间相比, 差异无统计学意义(P>0.0572), 但1.5%燕窝处理组SOD2和SOD3表达量低于假手术组(P<0.05). 6%燕窝处理组和1.5%燕窝处理组的PARP1表达量均低于假手术组, 差异有统计学意义(P<0.0001)(图4).
手术摘除大鼠双侧卵巢使大鼠性激素分泌减少或消失从而使大鼠进入绝经期这一模型是被研究者广泛接受和应用于更年期及更年期相关疾病的研究中[11]. 我们在卵巢摘除术后通过阴道拭子涂片观察阴道脱落上皮细胞而证实了模型制备的成功并保证对照组和假手术组大鼠在处死前处于低雌激素水平. 同时通过体质量观察, 发现手术对照组体质量增加明显高于其他组, 这一特征符合绝经后女性体质量的改变.
已有研究[12-14]表明, 在更年期转换阶段或绝经期后, 女性罹患非酒精性肝病率大大提升, 在更年期前, 男性非酒精性肝病患病率明显高于女性, 但是在女性进入更年期后, 肝脏相关性疾病患病率高于同年龄段男性[15,16]. 临床问卷调查结果显示更年期女性非酒精性肝病患病率比更年期前妇女患病率高33%[17], 同样的, 横断面调查研究也同样支持以上结论[18]. 我们对手术绝经大鼠肝功能检测中, ALT、GGT各实验组均处于正常值范围, 虽然手术对照组中ALP水平与假手术组比较具有统计学意义, 但是各组ALP水平均处于正常范围内[19]. 由于肝脏代偿能力很强, 目前尚无特异性强、敏感性高、包括范围广的肝功能检测方法, 因此即使肝功能检查结果正常也不能排除肝脏功能的减退. 特别是在肝脏损害早期, 肝功能往往表现为正常值.
肝脏是人体的"加工厂", 承担着解毒、代谢、分泌胆汁、免疫防御等功能, 是最易受氧化应激损伤的脏器, 因此在肝脏疾病早期就可表现为氧化还原状态的失衡[20]. 我们同时检测影响氧化还原"天平"的两侧: 氧化损伤与抗氧化水平. 抗氧化物SOD和CAT可以清除自由基的产生避免氧化损伤[21], 在实验中我们发现, 手术对照组大鼠抗氧化物SOD和CAT水平明显低于假手术组的对照组, 表明绝经后抗氧化酶减少, 自由基清除能力下降, 肝脏的氧化损伤加强. 而肝脏的氧化损伤是引起肝脏相关性疾病的主要发病机制之一, 比如肝硬化、肝癌[22-24]. 另一方面, MDA作为脂质过氧化标志物, 在手术对照组中明显升高, 意味着绝经后肝脏脂质过氧化水平过高. 高反应活性的脂自由基可破坏DNA和分子结构, 导致机体损伤, 细胞破坏, 人体衰老等[25].
燕窝主要成分为蛋白质和糖蛋白, 总量达到67%[26], Yida等[27]报道燕窝水提物及酶解产物具有很强的抗氧化能力. 其他实验小组也提供了一些证据, 表明燕窝不但具有抗氧化能力, 还具有激素样功能[28]. 我们继往研究发现燕窝在更年期衰老大鼠模型中, 通过抑制晚期糖基化终末产物调节脑组织氧化应激状态, 抑制神经细胞凋亡发挥神经退行性保护作用; 并且报道了燕窝水提物及其生物标志物乳铁蛋白、唾液酸、卵转铁蛋白均具有较强的抗氧化活性[9]. 根据我们前期的研究, 研究采用2种剂量燕窝(6%和1.5%)干预处理手术绝经大鼠12 wk, 通过对其氧化应激状态的观察发现, 燕窝可以削弱绝经引起的氧化应激失衡, 维护肝脏的氧化还原状态. 一方面, 高浓度和低浓度燕窝均可提高肝脏抗氧化酶活性, 尤其是6%燕窝处理组表现了更高的抗氧化酶活性. 脂质过氧化反应标志物(MDA)结果证明了燕窝具有抗指质过氧化能力, 这与以前的报道相一致.
同时, 为了进一步研究燕窝抗肝脏氧化的机制, 我们检测了与抗氧化相关基因的mRNA水平. SOD1/2/3及PARP1四个抗氧化基因在燕窝组均表现为升高, 可以抵抗绝经引起的抗氧化酶表达量低的现象, 并且燕窝的抗氧化作用表现为剂量依赖性表现, 即高剂量燕窝抗氧化活性高, 较低剂量燕窝抗氧化水平低于高剂量燕窝抗氧化能力.
总之, 燕窝干预处理手术绝经大鼠12 wk后, 可明显改善绝经后大鼠肝脏的氧化损伤状态, 并且在转录水平探讨了其相关机制. 但是, 因为氧化应激状态的复杂性, 我们仍然需要进一步研究燕窝通过哪种通路影响的氧化还原水平, 以及燕窝中的哪种成分发挥了主要作用.
燕窝是一种药食同源之传统补品, 其抗衰老增强免疫力之功效已被收录进《本草逢源》, 现代医学研究发现燕窝具有较强的抗氧化功效; 肝功能减退与衰老密切相关, 同时也是氧化应激敏感器官, 因此本文想通过燕窝调节衰老肝组织的氧化还原状态发挥抗衰老功效.
王江滨, 教授, 主任医师, 吉林大学中日联谊医院消化内科, 吉林大学白求恩医学部内科学系; 刘正稳, 教授, 西安交通大学医学院第一附属医院
氧化应激是导致肝细胞损伤的重要发病机制, 多种自由基和抗氧化系统参与构成了一个较为复杂的网络式反应体系, 各种不同的组分在整个氧化应激体系中的地位及其相互关系成为研究的热点. 如何应用药物对抗氧化应激保护肝细胞是研究的重点.
燕窝作为传统中药材其应用都沿袭民族传统使用方法, 近几年, 随着燕窝的广泛应用, 已有科学数据证实燕窝水提物具有较强的抗氧化活性, 并且证实在手术去卵巢衰老大鼠中, 燕窝具有骨保护作用和神经退行性保护作用.
本文用燕窝喂食去卵巢大鼠12 wk后, 首次检测并报道了肝功能及肝细胞氧化还原状态, 并应用实时定量PCR检测技术检测了相关基因水平, 从而对燕窝抗衰老的作用及机制有了新的认识, 并为后续的科研工作提供了有价值的参考.
本研究通过燕窝干预处理手术绝经大鼠12 wk后, 检测肝肾, 氧化应激和抗氧化活性, 证实了燕窝可以显明改善绝经后大鼠肝脏的氧化损伤, 提供了一种有潜在研发价值的老年性肝功能减退的治疗药物, 并为其可能的临床应用提供理论基础.
氧化应激: 指因氧化作用强于抗氧化作用而出现的失衡状态, 分为氧化和抗氧化两大方面. 人体在新陈代谢过程中及遇到各种有害刺激时产生多种有氧化作用的高活性分子称为自由基, 其中包括超氧阴离子, 羟自由基和过氧化氢等多种分子, 这些分子可氧化脂质等多种重要机体组分而造成细胞损伤. 人体内抗氧化系统包括酶类(超氧化物歧化酶, 过氧化氢酶)和非酶类抗氧化物(还原型谷光甘肽).
本研究具有 一定的创新点, 实验结果对提示燕窝作为肝病特别是绝经后肝脏相关疾病的辅助治疗提供了一定的实验依据, 有一定的可读性和科学性.
编辑: 于明茜 电编: 闫晋利
| 1. | Brady CW. Liver disease in menopause. World J Gastroenterol. 2015;21:7613-7620. [PubMed] [DOI] |
| 2. | Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2095-2128. [PubMed] [DOI] |
| 3. | Asrani SK, Larson JJ, Yawn B, Therneau TM, Kim WR. Underestimation of liver-related mortality in the United States. Gastroenterology. 2013;145:375-82.e1-2. [PubMed] [DOI] |
| 4. | The American Congress of Obstetricians and Gynecologists. Women's health stats and facts 2011. Available from: http: //www.acog.org/-/media/NewsRoom/MediaKit.pdf. |
| 5. | Guo CT, Takahashi T, Bukawa W, Takahashi N, Yagi H, Kato K, Hidari KI, Miyamoto D, Suzuki T, Suzuki Y. Edible bird's nest extract inhibits influenza virus infection. Antiviral Res. 2006;70:140-146. [PubMed] |
| 6. | Wong RS. Edible bird's nest: food or medicine? Chin J Integr Med. 2013;19:643-649. [PubMed] [DOI] |
| 7. | Matsukawa N, Matsumoto M, Bukawa W, Chiji H, Nakayama K, Hara H, Tsukahara T. Improvement of bone strength and dermal thickness due to dietary edible bird's nest extract in ovariectomized rats. Biosci Biotechnol Biochem. 2011;75:590-592. [PubMed] |
| 8. | Marcone MF. Characterization of the Edible bird's nest the "Caviar of the East". Food research international. 2005;38:1125-1134. [DOI] |
| 9. | Hou Z, Imam MU, Ismail M, Azmi NH, Ismail N, Ideris A, Mahmud R. Lactoferrin and ovotransferrin contribute toward antioxidative effects of Edible Bird's Nest against hydrogen peroxide-induced oxidative stress in human SH-SY5Y cells. Biosci Biotechnol Biochem. 2015;79:1570-1578. [PubMed] [DOI] |
| 10. | Zhiping H, Imam MU, Ismail M, Ismail N, Yida Z, Ideris A, Sarega N, Mahmud R. Effects of edible bird's nest on hippocampal and cortical neurodegeneration in ovariectomized rats. Food Funct. 2015;6:1701-1711. [PubMed] |
| 11. | Høegh-Andersen P, Tankó LB, Andersen TL, Lundberg CV, Mo JA, Heegaard AM, Delaissé JM, Christgau S. Ovariectomized rats as a model of postmenopausal osteoarthritis: validation and application. Arthritis Res Ther. 2004;6:R169-R180. [PubMed] |
| 12. | Park SH, Jeon WK, Kim SH, Kim HJ, Park DI, Cho YK, Sung IK, Sohn CI, Keum DK, Kim BI. Prevalence and risk factors of non-alcoholic fatty liver disease among Korean adults. J Gastroenterol Hepatol. 2006;21:138-143. [PubMed] |
| 13. | Fraser A, Longnecker MP, Lawlor DA. Prevalence of elevated alanine aminotransferase among US adolescents and associated factors: NHANES 1999-2004. Gastroenterology. 2007;133:1814-1820. [PubMed] |
| 14. | Zelber-Sagi S, Nitzan-Kaluski D, Halpern Z, Oren R. Prevalence of primary non-alcoholic fatty liver disease in a population-based study and its association with biochemical and anthropometric measures. Liver Int. 2006;26:856-863. [PubMed] |
| 15. | Zhou YJ, Li YY, Nie YQ, Ma JX, Lu LG, Shi SL, Chen MH, Hu PJ. Prevalence of fatty liver disease and its risk factors in the population of South China. World J Gastroenterol. 2007;13:6419-6424. [PubMed] |
| 16. | Kojima S, Watanabe N, Numata M, Ogawa T, Matsuzaki S. Increase in the prevalence of fatty liver in Japan over the past 12 years: analysis of clinical background. J Gastroenterol. 2003;38:954-961. [PubMed] |
| 17. | Völzke H, Schwarz S, Baumeister SE, Wallaschofski H, Schwahn C, Grabe HJ, Kohlmann T, John U, Dören M. Menopausal status and hepatic steatosis in a general female population. Gut. 2007;56:594-595. [PubMed] |
| 18. | Gutierrez-Grobe Y, Ponciano-Rodríguez G, Ramos MH, Uribe M, Méndez-Sánchez N. Prevalence of non alcoholic fatty liver disease in premenopausal, posmenopausal and polycystic ovary syndrome women. The role of estrogens. Ann Hepatol. 2010;9:402-409. [PubMed] |
| 20. | Lee J, Giordano S, Zhang J. Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling. Biochem J. 2012;441:523-540. [PubMed] [DOI] |
| 21. | Reiter RJ. Oxidative processes and antioxidative defense mechanisms in the aging brain. FASEB J. 1995;9:526-533. [PubMed] |
| 22. | Khansari N, Shakiba Y, Mahmoudi M. Chronic inflammation and oxidative stress as a major cause of age-related diseases and cancer. Recent Pat Inflamm Allergy Drug Discov. 2009;3:73-80. [PubMed] |
| 23. | Jüngst C, Cheng B, Gehrke R, Schmitz V, Nischalke HD, Ramakers J, Schramel P, Schirmacher P, Sauerbruch T, Caselmann WH. Oxidative damage is increased in human liver tissue adjacent to hepatocellular carcinoma. Hepatology. 2004;39:1663-1672. [PubMed] |
| 24. | Rua RM, Ojeda ML, Nogales F, Rubio JM, Romero-Gómez M, Funuyet J, Murillo ML, Carreras O. Serum selenium levels and oxidative balance as differential markers in hepatic damage caused by alcohol. Life Sci. 2014;94:158-163. [PubMed] [DOI] |
| 25. | Sawada M, Carlson JC. Changes in superoxide radical and lipid peroxide formation in the brain, heart and liver during the lifetime of the rat. Mech Ageing Dev. 1987;41:125-137. [PubMed] |
| 26. | Wu Y, Chen Y, Wang B, Bai L, Ge Y, Yuan F. Application of SYBR green PCR and 2DGE methods to authenticate Edible bird's nest food. Food research international. 2010;43:2020-2026. [DOI] |
| 27. | Yida Z, Imam MU, Ismail M. In vitro bioaccessibility and antioxidant properties of edible bird's nest following simulated human gastro-intestinal digestion. BMC Complement Altern Med. 2014;14:468. [PubMed] [DOI] |
| 28. | MA F, LIU D, DAI M. The effects of the Edible bird's nest on sexual function of male castrated rats. African Journal of Pharmacy and Pharmacology. 2012;6:2875-2879. [DOI] |