修回日期: 2015-03-17
接受日期: 2015-03-23
在线出版日期: 2015-04-28
目的: 比较英夫利昔(infliximab, IFX)与硫唑嘌呤(azathioprine, AZA)联合用药与单药治疗中重度炎症性肠病(inflammatory bowel disease, IBD)的疗效及安全性, 用以指导IBD药物方案的选择.
方法: 从MEDLINE、EMBASE、PubMed、Ovid、谷歌、万方数据库、中国维普数据库、中国知网数据库以及中国生物医学文献数据库检索有关IFX与AZA联用及单药治疗IBD的随机对照试验. 并对纳入文献进行质量评价和数据提取进行Meta分析.
结果: 按照入选标准, 共纳入6篇随机对照试验文献, Meta分析结果显示: IFX与AZA联合用药治疗IBD的临床症状缓解率(RR = 1.33, 95%CI: 1.13-1.56, Z = 3.40, P = 0.0007)、内镜检测有效率(RR = 1.29, 95%CI: 1.05-1.58, Z = 2.43, P = 0.02)均优于IFX单药, 但两组间总体不良反应(RR = 1.01, 95%CI: 0.91-1.10, Z = 0.11, P = 0.91)差异无统计学意义. 联合用药治疗IBD临床症状缓解率(RR = 1.84, 95%CI: 1.53-2.20, Z = 6.54, P<0.001)、内镜检测有效率(RR = 2.06, 95%CI: 1.65-2.62, Z = 5.96, P<0.0001)均优于AZA单药, 但两组间总体不良反应(RR = 0.94, 95%CI: 0.86-1.03, Z = 1.34, P = 0.18)差异无统计学意义.
结论: 对于一线治疗无效的中重度IBD, IFX与AZA联合用药优于IFX或AZA单药治疗. 联合用药对临床缓解、内镜黏膜愈合均有明显的疗效, 且总不良反应与单药治疗比较差异无统计学意义.
核心提示: 本文研究结果表明英夫利昔联合硫唑嘌呤与单用英夫利昔或者硫唑嘌呤治疗炎症性肠病(inflammatory bowel disease, IBD)比较, 在临床缓解、内镜下黏膜愈合情况均有更好疗效, 且联合用药的总不良反应与英夫利昔或硫唑嘌呤单药治疗IBD差异无统计学意义.
引文著录: 石云华, 何松. 英夫利昔与硫唑嘌呤联用与单药治疗炎症性肠病的Meta分析. 世界华人消化杂志 2015; 23(12): 2003-2010
Revised: March 17, 2015
Accepted: March 23, 2015
Published online: April 28, 2015
AIM: To compare the efficacy and safety of infliximab (IFX) and azathioprine (AZA) combination therapy vs monotherapy in moderate to severe inflammatory bowel disease (IBD).
METHODS: A comprehensive literature search was performed in MEDLINE, EMBASE, PubMed, Ovid, Google, Wanfang database, Vip database, China National Knowledge Infrastructure database (CNKI) and the Chinese biomedical literature database of randomized controlled clinical trials about IFX and AZA in IBD. Data of the included studies were extracted and their quality was evaluated to conduct a meta-analysis.
RESULTS: Based on the inclusion criteria, 6 prospective randomized controlled clinical studies were included in this study. Clinical remission rate and endoscopic remission rate were significantly improved in the combination group when compared with IFX or AZA monotherapy. However, there was no significant statistical difference in overall adverse reactions between the two groups.
CONCLUSION: For patients with moderate to severe IBD who failed the first-line treatment, combination of IFX and AZA is superior to monotherapy. Combination therapy can improve clinical remission and endoscopic mucosal healing efficacy, although overall adverse reactions show no significant difference compared with monotherapy.
- Citation: Shi YH, He S. Infliximab and azathioprine combination therapy vs monotherapy for inflammatory bowel disease: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 2003-2010
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/2003.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.2003
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)与克罗恩病(Crohn's disease, CD)[1-3]. 这两种肠道炎症性疾病的病因迄今均未完全明确, 而发病率在我国乃至亚洲地区呈增高趋势[4]. 由于其IBD反复发作, 部分患者可以伴随终身, 严重影响生活质量, 故其治疗备受重视.
在既往的若干年中, IBD传统药物(5-ASA、SASP)治疗的疗效仍不十分理想, 对于中至重度的患者, 糖皮质激素无论在UC还是CD都不能维持其长期缓解[5]. 对于激素依赖或无效的患者, 仅半数应用免疫抑制类药物有效[6]. IBD发病的具体机制尚不清楚, 遗传、环境及免疫因素共同发挥了作用, 其中, 炎性因子过度表达是造成组织损伤的直接原因[7-9]. 多项研究[10-13]表明, 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)在IBD患者局部及全身表达异常, 在其发病中发挥了关键作用. 因此, 抗TNF-α治疗可能是阻断发病的一条理想途径. 英夫利昔(infliximab, IFX)是一种基因重组的人鼠嵌合的TNF-α的免疫球蛋白G1亚类单克隆抗体, 可直接中和TNF-α, 与巨噬细胞和T细胞表面表达的TNF-α高亲和力结合, 并通过抗体依赖性细胞毒作用(antibody-dependent cellular cytotoxicity, ADCC)及补体依赖性细胞毒作用(complement-dependent cytotoxicity, CDC)机制发挥药理作用[14-16]. 目前IFX单抗已被多项研究证实对IBD的诱导缓解和维持治疗有明显的效果. 硫唑嘌呤(azathioprine, AZA)为常用的免疫抑制剂, 是6-巯基嘌呤的咪唑衍生物, 目前较多用于IBD的治疗. 对于临床上传统治疗效果不佳的中重度IBD患者, 关于IFX联合AZA治疗IBD的报道越来越多, 本篇文章通过Meta分析的方法对先前研究结果进行统计合并后再综合评价, 克服单个研究样本量小结果变异大的缺陷, 使结果分析更客观, 从而对有争议的研究结果得出一个较为明确的结论.
查阅IFX与AZA治疗IBD的相关文献, 检索外文数据库检索式包括: IBD相关关键词"inflammatory bowel disease"、"ulcerative colitis"、"Crohn's disease", 结合以下关键词"infliximab"、"azathioprine"、"anti-tumor necrosis factor"以及"randomized", "double-blind", "placebo-controlled"关键词进行英文检索. 检索中文数据库检索式包括: "炎症性肠病"、"溃疡性结肠炎"、"克罗恩病", 以及结合英夫利昔单抗、硫唑嘌呤的关键词进行中文检索. 查阅所有检出论文的参考文献作为补充.
1.2.1 纳入标准: (1)研究类型为原始研究; (2)采用IFX及AZA联用治疗IBD的文献; (3)文献内容符合随机对照试验; (4)结果数据为计量资料的文章.
1.2.2 排除标准: (1)研究样本中每组低于5人; (2)结果数据仅以中位数及间距方式提供者; (3)非随机对照试验文献、会议摘要、综述、Letter to editor述评、病例报道等类型的文献. 对于怀疑存在同一组数据多次发表的文献, 仅选择其中样本量最大者进行纳入.
1.2.3 文献质量评价: 因本研究所纳入文献属于随机对照研究, 故文献质量评价依据JADAD量表(牛津评分系统)标准进行.
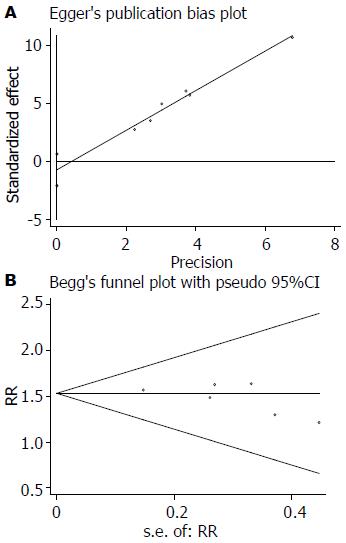
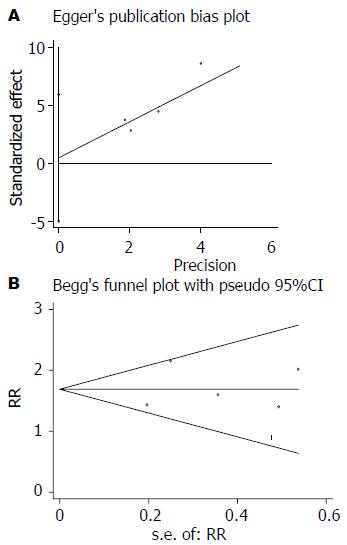
统计学处理 所有统计分析过程在RevMan 5.1和STATA 12.0中完成, 比较结果以森林图表示. 主要结局指标为临床缓解、内镜下黏膜修复. 所有结果中计数资料统计结果采用优势比(odds ratio, OR)及其95%可信区间(confidence interval, CI)表示, 计量资料采用标准均数差(standard mean difference, SMD)及其95%CI表示. 各文献之间的异质性采用Q检验, 并以I2表示, 若I2>50%, 则采用随机效应模型(random effects model, REM)对其合并量进行计算, 否则采用固定效应模型(fixed effect model, FEM)进行计算. 我们采用敏感性分析以寻找纳入文献中对结果具有潜在显著影响的文献, 为评价纳入文献的代表性, 我们采用发表性偏倚对所纳入文献进行计算, 并采用常用的Egger检验和Begg检验进行评价. 异质性检验以P<0.10视为差异具有统计学意义, 其余所有统计推断以P<0.05视为差异具有统计学意义.
共检索到192篇与IFX单抗或AZA治疗IBD潜在可能有关的文献, 按照入选标准, 共有6篇纳入, 其中5篇文献JADAD评分≥3分, 属于高质量文献, 文献特征如表1.
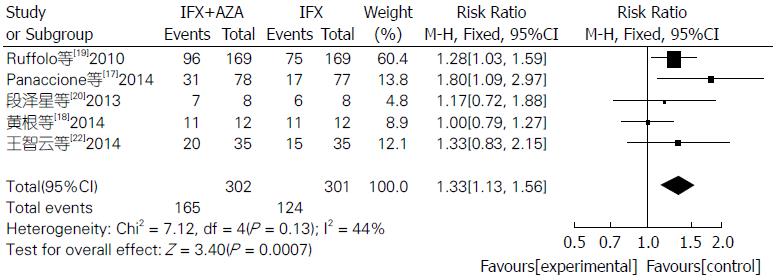
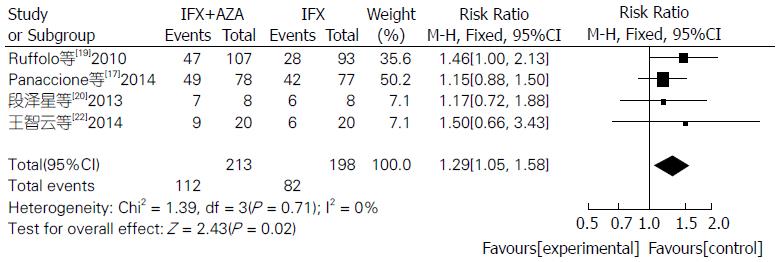
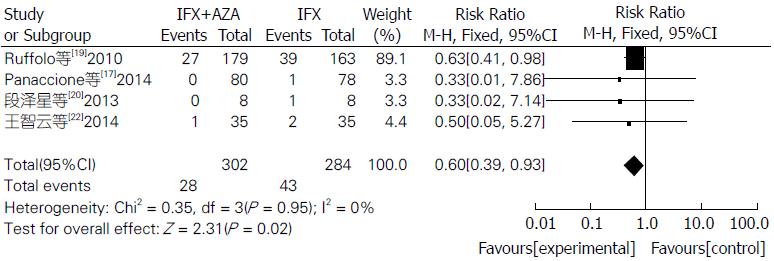
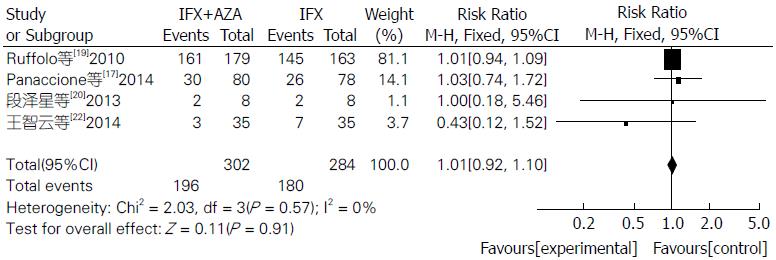
Meta分析表明联合用药组比单用IFX组临床症状缓解率明显较高(RR = 1.33, 95%CI: 1.13-1.56, Z = 3.40, P = 0.0007)(图1). 联合用药治疗IBD在内镜下检测治疗效果明显比单用IFX单抗更有效, 差异具有统计学意义(RR = 1.29, 95%CI: 1.05-1.58, Z = 2.43, P = 0.02)(图2). 联合用药的严重不良反应发生率明显低于单用IFX单抗, 差异具有统计学意义(RR = 0.60, 95%CI: 0.39-0.93, Z = 2.31, P = 0.02)(图3). 联合用药的总体不良反应发生率与单用IFX单抗之间未见明显统计学差异(RR = 1.01, 95%CI: 0.92-1.10, Z = 0.11, P = 0.91)(图4).
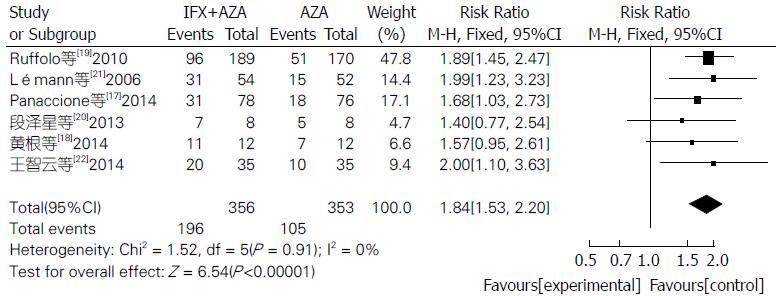
联合用药组比单用AZA组临床症状缓解率明显较高(RR = 1.84, 95%CI: 1.53-2.20, Z = 6.54, P<0.00001)(图5).
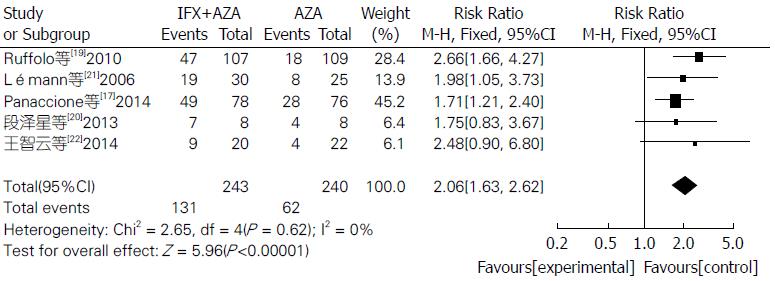
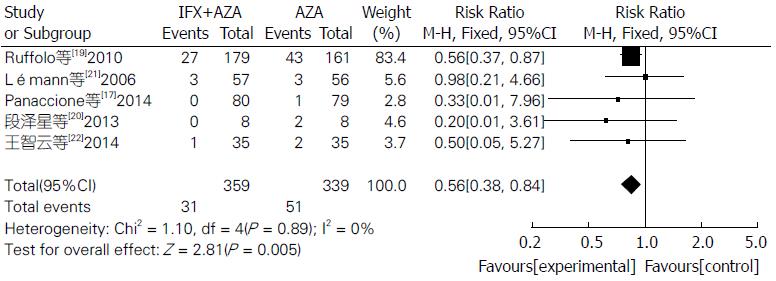
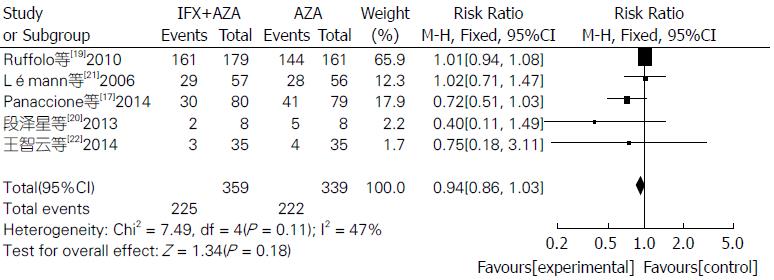
联合用药治疗IBD在内镜下检测治疗效果明显比单用AZA更有效, 差异具有统计学意义(RR = 2.06, 95%CI: 1.63-2.62, Z = 5.96, P<0.00001)(图6). 联合用药的严重不良反应发生率明显低于单用AZA, 差异具有统计学意义(RR = 0.56, 95%CI: 0.38-0.84, Z = 2.81, P = 0.005)(图7). 联合用药的总体不良反应发生率与单用AZA之间差异无统计学意义(RR = 0.94, 95%CI: 0.86-1.03, Z = 1.34, P = 0.18)(图8).
本研究旨在分析IFX联合AZA治疗IBD的有效性. 对纳入的有关比较疗效的6篇文献进行系统评价, 其中2篇[17,18]关于UC疗效(共273例患者), 4篇[19-22]关于CD的疗效(共750例患者), 结果显示, IFX联合AZA比单用此两种药物其中任何一种治疗IBD更有效, 对患者腹痛、血便等临床症状缓解率较为明显, 可不同程度的减轻全身症状, 减少手术治疗的机会, 降低IBD的活动指数, 提高生活质量, 降低IBD的死亡率和降低病变恶性变. 目前尚无足够资料明确何时可停止IFX联合AZA维持治疗. 最近有共识意见提出, IFX维持治疗达1年, 保持无糖皮质激素临床缓解、黏膜愈合及C反应蛋白水平正常者, 可考虑停用IFX, 继以免疫抑制剂维持治疗.
本研究中有些因素可能影响IFX联合AZA的疗效, 如患者年龄、疾病严重度、应用指征及药物剂量等, 而未进一步进行分层分析及亚组分析[23-25]. 纳入的文献中, 且均以第1次临床缓解作为疗效的判断, 以全面评估其疗效. 近年研究显示, IFX联合AZA治疗活动性IBD疗效优于单用IFX. IBD治疗的理想的终点目标是病情控制和防止复发, 而本Meta分析所检索到的和所纳入的研究, 其观察的结果都是大多为其临床活动指数的改变和内镜下改善的情况, 均为中间指标. 因此, 需要更多大型临床前瞻性的随机对照试验以评估其中长期疗效及肠外表现方面的疗效. 目前内镜随访评估IBD患者黏膜愈合情况已成为IBD药物治疗临床研究及日常临床实践的客观指标[26-29]. 寻找影响黏膜愈合的预测因素有助于选择最可能由生物制剂治疗获益的患者.
IBD患者经治疗后达到内镜下病变肠黏膜愈合与IBD预后改善的关系近年备受重视. 并有主张应将内镜下肠黏膜愈合列为IBD疗效的评估标指标. Colombel一项随机双盲对照研究[19]显示, 26 wk疗程AZA、IFX、IFX+AZA组的内镜下肠黏膜愈合率分别为16.5%、30.1%及43.9%. 虽然生物制剂促进肠黏膜愈合的疗效更快、更高, 但AZA作为广泛应用的传统治疗药物, 其黏膜愈合的作用及意义仍值得进一步研究.
总之, IFX联合AZA与单用IFX或者AZA比较, 对于常规药物治疗无效及对激素依赖或抵抗的中、重度UC及CD有更好的治疗效果, 在临床缓解、内镜下黏膜愈合情况均有肯定疗效, 且联合用药的总不良反应与IFX或AZA单药治疗差异无统计学意义. 因此本研究为IBD治疗用药提供一定指导意义, 但此结论还有待于组织大规模、多中心的临床研究来进一步论证. 在临床应用上, IFX及AZA的剂量与病情严重程度之间的关系、其对于肠外表现方面的疗效、远期预后的研究、与免疫抑制剂的疗效比较现均较少, 需进一步研究.
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性系统性疾病, 本病发病病因尚不明确. 其治疗标准是针对炎症的非特异性抑制, 然而, 有相当一部分患者因非特异性治疗伴随严重不良反应而无法服用. 英夫利昔和其他针对肿瘤坏死因子的单克隆抗体在克罗恩患者临床缓解率方面已经体现出疗效. 近年来, 越来越多的学者针对IBD治疗方案的选择作出研究.
万军, 教授, 中国人民解放军总医院南楼老年消化科; 钟良, 主任医师, 上海市乌鲁木齐中路12号, 上海复旦大学附属华山医院; 潘秀珍, 教授, 主任医师, 福建省立医院消化科
近年来, 众多学者研究证实英夫利昔与硫唑嘌呤联用比单药治疗IBD临床疗效好, 不良反应相当, 本研究为IBD治疗用药提供一定指导意义, 但此结论还有待于组织大规模、多中心的临床研究来进一步论证.
既往已有大量研究证实硫唑嘌呤对IBD的疗效, Van Assche等学者研究亦证实英夫利昔对IBD的治疗有较好的效果. 近年来Lémann等研究证实英夫利昔与硫唑嘌呤联用治疗IBD疗效更佳.
本文研究提示英夫利昔与硫唑嘌呤联用较单药治疗IBD达到临床缓解率及内镜下黏膜修复率高, 既往国内外该类文章仅研究单用英夫利昔或硫唑嘌呤治疗IBD的疗效, 本文研究为IBD治疗方案提供更多选择.
该研究结果表明, 英夫利昔联合硫唑嘌呤与单用该两药比较, 对于常规药物治疗无效及对激素依赖或抵抗的中、重度IBD有更好的治疗效果, 且联合用药的总不良反应与英夫利昔或硫唑嘌呤单药治疗差异无统计学意义. 因此本研究为IBD治疗用药提供一定指导意义.
本研究立题有依据, 研究设计严谨, 查阅中高质量文献, 纳入和排除病例要求严格, 疗效判断统一, 统计分析科学, 结论可信. 对IBD的治疗有参考意义.
编辑: 韦元涛 电编:闫晋利
| 1. | El-Matary W. Patient-reported outcome measures in inflammatory bowel disease. Can J Gastroenterol Hepatol. 2014;28:536-542. [PubMed] |
| 2. | Ghosh S. Are patient-reported outcome measures the way to go in inflammatory bowel disease? Can J Gastroenterol Hepatol. 2014;28:535. [PubMed] |
| 3. | Komatsu YC, Capareli GC, Boin MF, Lellis R, Freitas TH, Simone K. Skin gangrene as an extraintestinal manifestation of inflammatory bowel disease. An Bras Dermatol. 2014;89:967-969. [PubMed] [DOI] |
| 4. | Ben Musa R, Gampa A, Basu S, Keshavarzian A, Swanson G, Brown M, Abraham R, Bruninga K, Losurdo J, DeMeo M. Hepatitis B vaccination in patients with inflammatory bowel disease. World J Gastroenterol. 2014;20:15358-15366. [PubMed] [DOI] |
| 5. | Kelly ME, Dodd J, Barry M. Triad of emboli in acute flare of ulcerative colitis. Ir Med J. 2014;107:152-153. [PubMed] |
| 6. | [No authors listed]. [Pulmonary lesion in a female patient with hormone-dependent ulcerative colitis]. Ter Arkh. 2012;84:52-55. [PubMed] |
| 7. | Elian SD, Souza EL, Vieira AT, Teixeira MM, Arantes RM, Nicoli JR, Martins FS. Bifidobacterium longum subsp. infantis BB-02 attenuates acute murine experimental model of inflammatory bowel disease. Benef Microbes. 2014; Nov 12. [Epub ahead of print]. [PubMed] |
| 8. | Kaniewska M, Bartnik W, Gonciarz M, Kłopocka M, Linke K, Małecka-Panas E, Radwan P, Reguła J, Rydzewska G. Iron deficiency anaemia in patients with inflammatory bowel disease: National Consultant for Gastroenterology Working Group Recommendations. Prz Gastroenterol. 2014;9:259-263. [PubMed] [DOI] |
| 9. | Santana EF, Araujo EJ, Campanharo FF, Sarmento SG, Saito CS, Moron FA. Tuberculosis in pregnancy: a challenging differential diagnosisfor inflammatory bowel disease. Ceska Gynekol. 2014;79:305-308. [PubMed] |
| 10. | Bressler B, Siegel CA. Beware of the swinging pendulum: anti-tumor necrosis factor monotherapy vs combination therapy for inflammatory bowel disease. Gastroenterology. 2014;146:884-887. [PubMed] [DOI] |
| 11. | Beigel F, Steinborn A, Schnitzler F, Tillack C, Breiteneicher S, John JM, Van Steen K, Laubender RP, Göke B, Seiderer J. Risk of malignancies in patients with inflammatory bowel disease treated with thiopurines or anti-TNF alpha antibodies. Pharmacoepidemiol Drug Saf. 2014;23:735-744. [PubMed] [DOI] |
| 12. | Dulai PS, Thompson KD, Blunt HB, Dubinsky MC, Siegel CA. Risks of serious infection or lymphoma with anti-tumor necrosis factor therapy for pediatric inflammatory bowel disease: a systematic review. Clin Gastroenterol Hepatol. 2014;12:1443-1451; quiz e88-89. [PubMed] [DOI] |
| 13. | Desai RJ, Rao JK, Hansen RA, Fang G, Maciejewski ML, Farley JF. Predictors of treatment initiation with tumor necrosis factor-α inhibitors in patients with rheumatoid arthritis. J Manag Care Pharm. 2014;20:1110-1120. [PubMed] |
| 14. | Guicciardi ME, Werneburg NW, Bronk SF, Franke A, Yagita H, Thomas G, Gores GJ. Cellular inhibitor of apoptosis (cIAP)-mediated ubiquitination of phosphofurin acidic cluster sorting protein 2 (PACS-2) negatively regulates tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) cytotoxicity. PLoS One. 2014;9:e92124. [PubMed] [DOI] |
| 15. | Lee SH, Kim MJ, Kim DW, Kang CD, Kim SH. Amurensin G enhances the susceptibility to tumor necrosis factor-related apoptosis-inducing ligand-mediated cytotoxicity of cancer stem-like cells of HCT-15 cells. Cancer Sci. 2013;104:1632-1639. [PubMed] [DOI] |
| 16. | Shyu PT, Oyong GG, Cabrera EC. Cytotoxicity of probiotics from Philippine commercial dairy products on cancer cells and the effect on expression of cfos and cjun early apoptotic-promoting genes and Interleukin-1 β and Tumor Necrosis Factor-α proinflammatory cytokine genes. Biomed Res Int. 2014;2014:491740. [PubMed] [DOI] |
| 17. | Panaccione R, Ghosh S, Middleton S, Márquez JR, Scott BB, Flint L, van Hoogstraten HJ, Chen AC, Zheng H, Danese S. Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology. 2014;146:392-400.e3. [PubMed] [DOI] |
| 19. | Ruffolo C, Scarpa M, Bassi N. Infliximab, azathioprine, or combination therapy for Crohn's disease. N Engl J Med. 2010;363:1086-1087; author reply 1087-1088. [PubMed] [DOI] |
| 21. | Lémann M, Mary JY, Duclos B, Veyrac M, Dupas JL, Delchier JC, Laharie D, Moreau J, Cadiot G, Picon L. Infliximab plus azathioprine for steroid-dependent Crohn's disease patients: a randomized placebo-controlled trial. Gastroenterology. 2006;130:1054-1061. [PubMed] [DOI] |
| 23. | O'Meara S, Nanda KS, Moss AC. Antibodies to infliximab and risk of infusion reactions in patients with inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis. 2014;20:1-6. [PubMed] [DOI] |
| 24. | Schneeweiss S, Korzenik J, Solomon DH, Canning C, Lee J, Bressler B. Infliximab and other immunomodulating drugs in patients with inflammatory bowel disease and the risk of serious bacterial infections. Aliment Pharmacol Ther. 2009;30:253-264. [PubMed] [DOI] |
| 25. | Steenholdt C, Svenson M, Bendtzen K, Thomsen OØ, Brynskov J, Ainsworth MA. Severe infusion reactions to infliximab: aetiology, immunogenicity and risk factors in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2011;34:51-58. [PubMed] [DOI] |
| 26. | Camus M, Pariente B, Dray X, Allez M, Marteau P. Endoscopy as a prognostic marker in inflammatory bowel disease. Dig Dis. 2013;31:351-356. [PubMed] [DOI] |
| 27. | Carter D, Eliakim R. Current role of endoscopy in inflammatory bowel disease diagnosis and management. Curr Opin Gastroenterol. 2014;30:370-377. [PubMed] [DOI] |
| 28. | Kim DH, Park SJ, Park JJ, Yun YH, Hong SP, Kim TI, Kim WH, Cheon JH. Effect of follow-up endoscopy on the outcomes of patients with inflammatory bowel disease. Dig Dis Sci. 2014;59:2514-2522. [PubMed] [DOI] |