修回日期: 2014-03-26
接受日期: 2014-04-09
在线出版日期: 2014-05-08
目的: 探讨直接肾素抑制剂(阿利吉仑)抑制肾素-血管紧张素系统(renin-angiotensin system, RAS)首位环节对大鼠急性胰腺炎(acute pancreatitis, AP)的保护作用及机制.
方法: 72只SD大鼠随机分为假手术组(SO组)、急性胰腺炎组(AP组)、阿利吉仑治疗组(R组). 采用3.5%牛磺胆酸钠(0.1 mL/100 g)逆行胰胆管注射制备AP组和R组大鼠急性胰腺炎模型; 而SO组仅开腹并轻轻触动十二指肠和胰腺后关腹. R组于造模成功后给予阿利吉仑溶液灌胃(20 mg/kg); SO组及AP组给予同等剂量的生理盐水灌胃. 各组大鼠于术后6、12、24 h, 分批次等数量[8只/(组•批)]下腔静脉抽血后处死. 取胰腺组织观察胰腺病理变化及进行病理学评分, 并检测大鼠血清淀粉酶(serum amylase, AMY)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)、血浆肾素活性(plasma enin activity, PRA)的变化. 免疫组织化学方法观察胰腺组织血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor, AT1R)血管紧张素Ⅱ 1型受体(AT1R)和核因子-kB(nuclear factor kappa-B, NF-kB)的表达情况.
结果: 与AP组比较, R组各时间点(6、12、24 h)的病理学评分(7.25±0.80、9.57±1.54、12.75±1.22)、AMY(2230.87 U/L±224.71 U/L、2137.41 U/L±193.31 U/L、2457.01 U/L±188.81 U/L)、TNF-α(26.28 ng/L±2.45 ng/L、27.51 ng/L±1.91 ng/L、27.17 ng/L±2.02 ng/L), PRA[7.31 ng/(mL·h)±1.94 ng/(mL·h)、8.69 ng/(mL·h)±1.78 ng/(mL·h)、9.04 ng/(mL·h)±1.78 ng/(mL·h)]和AngⅡ(755.47 ng/L±121.33 ng/L、871.17 ng/L±129.43 ng/L、878.39 ng/L±81.29 ng/L)明显降低(P<0.05), AT1受体阳性表达率(48.60%±6.28%、49.62%±7.19%、51.20%±7.04%)下降(P<0.05),以及NF-kB的阳性表达率(65.66%±4.93%、68.66%±5.23%、68.13%±7.14%)亦下降(P<0.05).
结论: 肾素抑制剂(阿利吉仑)对大鼠急性胰腺炎的炎症病变及损伤具有一定保护作用.
核心提示: 阿利吉仑可以通过抑制肾素-血管紧张素系统(renin-angiotensin system, RAS)减少血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)的生成, 弱化AngⅡ在急性胰腺炎的病理生理作用, 同时可抑制炎症信号通路核因子-κB(nuclear factor kappa-B)所致的炎症反应不断放大失控, 减少下游肿瘤坏死因子-α(tumor necrosis factor-α)等炎症因子的产生, 对大鼠急性胰腺炎的炎症病变及损伤具有保护作用.
引文著录: 黄元龙, 尹青, 颜琼, 邓明明. 直接肾素抑制剂对大鼠急性胰腺炎的保护作用及机制. 世界华人消化杂志 2014; 22(13): 1841-1847
Revised: March 26, 2014
Accepted: April 9, 2014
Published online: May 8, 2014
AIM: To investigate the inhibitory effects of aliskiren on the renin angiotensin system (RAS) in rats with acute pancreatitis (AP) and to explore the mechanisms involved.
METHODS: Seventy-two SD rats were randomly divided into a sham operation group, an acute AP model group, and an aliskiren therapy group. AP was induced by retrograde injection of 3.5% sodium taurocholate (0.1 mL/100 g) into the biliopancreatic duct. Aliskiren solution was administered in rats of the aliskiren therapy group by gavage at a dose of 20 mg/kg, and equivalent volume of normal saline (NS) was given in the other two groups. Rats in each group were further divided into three subgroups for taking inferior vena cava blood samples at 6, 12 and 24 h, respectively. The rats were then killed to observe pancreatic pathological changes and measure serum amylase (AMY), tumor necrosis factor-α (TNF-α), angiotensin Ⅱ (Ang Ⅱ), and plasma renin activity (PRA). The expression of nuclear factor kappa-B (NF-kB) and angiotensin Ⅱ type 1 receptor (AT1R) in the pancreas was determined by immunohistochemistry.
RESULTS: Compared with the AP group, pancreatic histopathological score (7.25 ± 0.80, 9.57 ± 1.54, 12.75 ± 1.22), AMY (2230.87 U/L ± 224.71 U/L, 2137.41 U/L ± 193.31 U/L, 2457.01 U/L ± 188.81 U/L), TNF-α (26.28 ng/L ± 2.45 ng/L, 27.51 ng/L ± 1.91 ng/L, 27.17 ng/L ± 2.02 ng/L), PRA [7.31 ng/(mL•h) ± 1.94 ng/(mL•h), 8.69 ng/(mL•h) ± 1.78 ng/(mL•h), 9.04 ng/(mL•h) ± 1.78 ng/(mL•h)], Ang Ⅱ (755.47 ng/L ± 121.33 ng/L, 871.17 ng/L ± 129.43 ng/L, 878.39 ng/L ± 81.29 ng/L), positive rates of AT1R (48.60 ± 6.28, 49.62 ± 7.19, 51.20 ± 7.04) and NF-κB (65.66 ± 4.93, 68.66 ± 5.23, 68.13 ± 7.14) at each time point (6, 12, 24 h) were decreased significantly (P < 0.05 for all) in the aliskiren therapy group.
CONCLUSION: Aliskiren can protect from pancreatic inflammation and injury in AP rats.
- Citation: Huang YL, Yin Q, Yan Q, Deng MM. Protective effects of aliskiren, a direct renin inhibitor, in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1841-1847
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1841.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1841
肾素-血管紧张素系统(renin-angiotensin system, RAS)为一神经内分泌系统, 且有着复杂的酶促反应链. 随着对其的深入研究, 新成员的不断发现, RAS形成了一多元系统, 其不同分支点在RAS的不同位点发挥着不同作用. 急性胰腺炎时RAS的激活与胰腺的病理损伤及全身炎症反应综合征和多器官功能障碍有密切关系[1]. 通过对RAS不同位点的调控可以减轻炎症反应以及炎症持续放大所致的远隔器官的损伤. RAS不同位点的抑制剂如血管紧张素转换酶抑制(angiotensin converting enzyme inhibition, ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor blocker, ARB)在动物急性胰腺炎模型中具有一定的保护作用[2,3]. 本实验中阿利吉仑为一小分子量非肽类肾素抑制, 其作为RAS的首步限速酶抑制剂, 对肾素具有很高的亲和力, 能与肾素活性位点结合阻断其催化活性[4], 从而降低血管紧张素Ⅰ(angiotensin, AngⅠ)和血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)的水平. 另在相关实验中发现阿利吉仑有减少炎症细胞浸润、减轻氧化应激、抑制促炎信号丝裂原活化蛋白激酶的激活以及抗纤维化等作用[5-7], 从而发挥对组织器官的保护作用. 然而关于阿利吉仑在急性胰腺炎时是否发挥保护作用目前尚缺乏相关研究报道. 本文通过建立急性胰腺炎模型, 观察肾素抑制剂(阿利吉仑)在急性胰腺炎时所发挥的作用, 为急性胰腺炎的治疗提供新的理论基础和实验依据.
阿利吉仑(瑞士诺华医药公司); 牛黄胆酸钠(Sigma, 美国); 血管紧张素Ⅰ、Ⅱ放射免疫试剂盒(北京北方生物技术研究所); TNF-α ELISA试剂盒(武汉博士德生物工程公司); AT1受体兔抗大鼠多克隆抗体(Biworld, 美国)、大鼠NF-κB p65抗体(Biworld, 美国); SD大鼠, 雌雄不限, 72只(泸州医学院实验动物中心提供).
1.2.1 实验动物分组及模型制作: 将72只SD大鼠随机分为假手术组(SO组)、急性胰腺炎模型组(AP组)、阿利吉仑治疗组(R组), 每组24只. 造模前大鼠禁食12 h, 不禁水. 参照Aho等[8]的方法复制大鼠急性胰腺炎模型. 1%戊巴比妥钠(30 mg/kg)腹腔麻醉, 采用上腹正中切口开腹, 寻及十二指肠及胰胆管, 用一小动脉夹夹闭胆管近肝门端, 以1 mL磨钝针头经肠壁从十二指肠乳头刺入胰管约0.8 cm, 以0.1 mL/100 g剂量向胰管内逆行推注3.5%牛黄胆酸钠, 压迫5 min后去除小动脉夹关腹. 假手术组仅开腹并轻轻触动十二指肠和胰腺后关腹. R组于造模成功后给予2.0 g/L阿利吉仑溶液灌胃(20 mg/kg); SO及AP组给予同等剂量的生理盐水灌胃. 术后各组动物分笼饲养, 自由进水. 各组大鼠在造模后6、12、24 h分3批(每批8只/组)下腔静脉取血后处死, 快速切取胰腺组织以多聚甲醛固定, 测定各项指标.
1.2.2 检测指标及方法: (1)胰腺HE染色及病理学评分: 胰腺组织标本以4%中性甲醛固定, 常规石蜡包埋、HE染色, 于光镜下观察, 采用Schmidt[9]评分标准对胰腺组织进行病理学评分; (2)血清淀粉酶(serum amylase, AMY)的测定: 经大鼠下腔静脉抽取2 mL, 2000 r/min离心10 min后留取血清, 保存于-70 ℃冰箱备测. 采用全自动生化分析仪检测血清淀粉酶, 单位为U/L; (3)血清TNF-α的测定: 严格按照ELISA试剂盒说明, 取上述血清后, 采用双抗体夹心法测定血清TNF-α含量; (4)AngⅡ、PRA: 下腔静脉取血2 mL注入酶抑制剂抗凝管, 轻轻混匀, 置于冰水浴中2 h, 取出后4 ℃低温离心机2500 r/min离心7 min, 分离血浆低温冰箱内保存备测, 按照放射免疫试剂盒说明, 测定各样本放射性, 联机电脑得出待测样品结果; (5)NF-κB及AT1受体在胰腺组织的表达情况: 采用二步免疫组织化学方法(PV法)染色, 参照AT1受体兔抗大鼠多克隆抗体、大鼠NF-κB p65抗体试剂盒进行, 显色采用DAB试剂盒进行, 光镜观察胞质和(或)胞核中有棕黄色颗粒者为阳性细胞, 且计算阳性表达率, 计算方法: 数5个高倍视野, 分别计算阳性细胞和总细胞数, 阳性率 = 阳性细胞数/总细胞数×100%.
统计学处理 应用SPSS13.0统计软件, 计量资料用均数mean±SD表示. 多组样本均数之间比较采用单因素方差分析. 各组间的两两比较采用多个均数间的多重比较(Dunnett-t检验). P<0.05为差异有统计学意义.
2.1.1 大体观察: SO组大鼠胰腺肉眼观呈均匀一致的粉红色, 质软, 薄片状, 光泽度好, 且随着时间延长未见明显水肿、出血坏死, 腹腔内无腹水及皂化斑, 3个时间点大鼠胰腺未见明显变化. AP组在造模后随即可见沿胰胆管周围腺体组织出现充血, 水肿, 范围逐渐加大, 颜色逐渐加深. 随着时间延长, 6 h大鼠胰腺肿胀明显, 色泽变淡, 呈暗红色, 无光泽, 少量腹水及胰腺表面皂化斑的形成. 12 h可见大鼠胰腺出血坏死, 呈暗褐色, 胰腺及网膜皂化斑的增多, 且胰腺与相邻脏器粘连明显, 胃肠胀气亦明显, 同时可见较多血性腹水形成; 24 h大鼠胰腺呈暗褐色, 广泛的坏死出血及钙化灶形成, 与周围脏器大量黏连, 胃肠淤张胀气更为明显, 可见大量血性腹水. R组各时间点与AP组同一时间点相比, 胰腺水肿、出血、坏死、皂化斑的形成及腹水量均减轻.
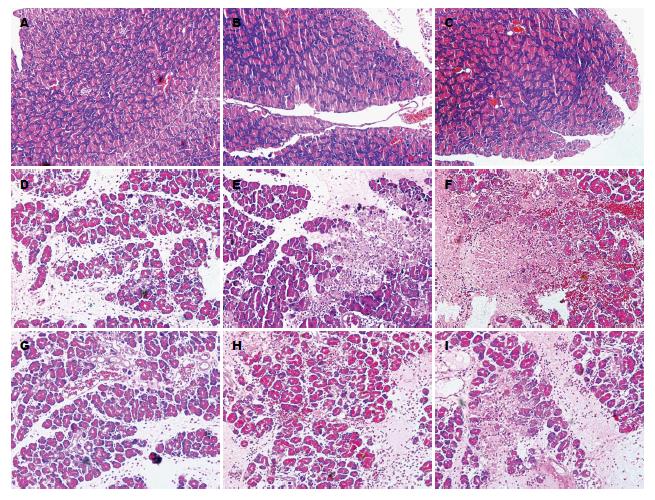
2.1.2 光镜观察: SO组胰腺组织镜下胰腺小叶结构完整, 间质轻度水肿, 少量炎性细胞浸润, 且三个时间点胰腺组织镜下所见无明显差异. AP组病程6 h, 胰腺间质水肿, 小叶间隔稍增宽, 有炎症细胞浸润; 12 h可见胰腺间质明显水肿, 小叶间隙明显增宽, 部分小叶结构破坏, 片状坏死、出血, 大量炎症细胞浸润; 24 h可见胰腺病理损伤程度加重, 小叶结构消失, 大量炎细胞浸润, 呈现大片状出血、坏死, 部分见脂肪液化坏死及腺泡细胞固缩, 崩解, 部分小叶甚至成为一片红染的无结构区; R组与AP 组同一时间点相比, 胰腺小叶水肿、间隔增宽、炎细胞浸润、出血、坏死等病变程度均减轻(图1).
2.1.3 胰腺组织病理学评分: 采用Schmidt评分标准对胰腺组织进行病理学评分, 可见AP组3个时间点胰腺组织病理学评分较SO组明显升高(P<0.05); R组3个时间点胰腺组织病理学评分较AP组明显减低(P<0.05), 但仍高于SO组(P<0.05)(表1).
急性胰腺炎造模成功后, AP组3个时间点的AMY、TNF-α、Ang Ⅱ、PRA较SO组明显升高(P<0.05); 和AP组比较, R组3个时间点的AMY、TNF-α、Ang Ⅱ、PRA较SO组明显下降(P<0.05), 但仍高于SO组(P<0.05)(表2).
| 分组 | 时间(h) | 血清淀粉酶(U/L) | TNF-α(ng/L) | Ang II(ng/L) | PRA[ng/(mL•h)] |
| SO组 | 6 | 1148.91±145.32 | 12.65±3.14 | 466.62±93.51 | 2.38±1.08 |
| 12 | 1222.13±180.33 | 13.37±2.86 | 502.96±104.92 | 2.59±1.10 | |
| 24 | 1241.66±127.90 | 13.01±2.88 | 522.83±116.78 | 2.98±1.22 | |
| AP组 | 6 | 3166.14±155.82a | 32.30±3.64a | 908.94±110.73a | 10.45±2.39a |
| 12 | 3336.87±149.76a | 34.28±3.99a | 1128.12±196.76a | 12.30±1.92a | |
| 24 | 3402.97±118.48a | 34.08±4.41a | 1205.11±214.18a | 13.00±2.15a | |
| R组 | 6 | 2230.87±224.71ac | 26.28±2.45ac | 755.47±121.33ac | 7.31±1.94ac |
| 12 | 2137.41±193.31ac | 27.51±1.91ac | 871.17±129.43ac | 8.69±1.78ac | |
| 24 | 2457.01±188.81ac | 27.17±2.02ac | 878.39±81.29ac | 9.04±1.78ac |
2.3.1 AT1受体在胰腺组织中的表达: AT1受体主要表达于胰腺组织的血管壁, 在胰管壁也有表达, 腺泡基本不表达, 阳性细胞呈棕黄色染色. 其中AT1受体在SO组各时间点表达很少; 在AP组各时间点AT1受体表达较SO组明显增多(P<0.05); 阿利吉仑干预的R组在各时间点AT1受体表达均弱于同时间点AP组(P<0.05), 但仍较同时间点的SO组高(P<0.05). 在5个高倍视野下观察阳性细胞数Nl, 总细胞数N, 计算各组阳性率 = N1/N×l00%(表3).
2.3.2 NF-κB在胰腺组织中的表达: NF-κB主要在胰腺腺泡胞核和胞浆中表达, 阳性细胞为胞核和/或胞浆呈棕黄色染色. 其中在SO组各时间点胰腺细胞NF-κB少量表达; 在AP组各时间点胰腺细胞NF-κB活化明显, 阳性表达率较SO组明显增多(P<0.05); 在阿利吉仑干预的R组胰腺细胞的阳性表达率均弱于同时间点AP组(P<0.05), 但仍较同时间点的SO组高(P<0.05). 在5个高倍视野下观察阳性细胞数N1, 总细胞数N, 计算各组阳性率 = N1/N×l00%(表4).
AP是以胰腺组织水肿、腺泡细胞变性、坏死以及受损腺体的出血和炎细胞浸润为特点的一种炎症性疾病, 其总体死亡率为5%-10%[10]. 若病情进行性发展为重症急性胰腺炎(severe acute pancreatitis, SAP), 其死亡率可高达30%以上[11]. AP的病因及发病机制众多, 有多种学说和观点, 包括胰腺自身消化学说、炎症介质学说、氧化应激学说、肠道细菌移位学说、胰腺腺泡细胞凋亡及钙超载学说等[12]. 传统意义上, RAS被视为一种调节血压、维持水电解质平衡的神经内分泌系统, 且有着复杂的酶促反应链. 近年来研究发现, RAS除了存在于传统意义的循环系统中, 在胰腺等局部组织器官也存在RAS[13], 且随着对RAS的深入研究和RAS组分的新发现, RAS与AP关系亦得到重视.
急性胰腺炎时的炎症病变及损伤结局与RAS 活化密切相关, RAS可能在以下几个方面参与AP的发病机制: (1)微循环障碍. AngⅡ为RAS的主要活性分子, 急性胰腺炎时RAS激活, AngⅡ水平明显上调, 与其受体结合后对胰腺小叶内血管产生强烈的缩血管作用, 引起胰腺组织缺血和局部微循环淤滞, 持续的微血管痉挛将促进胰腺炎变由水肿性向出血坏死性发展; (2)抗炎-促炎介质失衡. 急性胰腺炎时, 胰腺的损伤会启动抗炎与促炎两大系统. RAS参与了细胞因子、黏附分子、转化因子等炎症因子的产生[14]. 其中AngⅡ可作为一种较强的致炎因子,他可以诱导单核细胞活化,促进巨噬细胞分泌表达TNF-α、IL-6、IL-1等细胞因子, 还可以诱导血管内皮细胞和平滑肌细胞表达多种黏附分子, 促进单核细胞和中性粒细胞与血管内皮细胞的黏附, 这些炎症因子的产生对炎症反应的放大及损伤加重有重要作用[15-17]. 此过程可能与Ang Ⅱ激活NF-κB信号转导通路[18,19], 继而激活其他炎症因子和细胞因子的合成和释放有关. 相关研究发现在使用NF-κB特异性抑制剂PDTC后, 抑制NF-κB的激活可减弱了Ang Ⅱ介导的炎症反应[20]. 炎症细胞在产生促炎介质时, 也产生抗炎介质, 启动抗炎系统, 有助于控制炎症, 恢复内环境稳定. 当抗炎-促炎介质的失衡, 炎症失控, 炎症介质泛滥, 可发展为全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 导致胰腺炎变和受损进行性加重; (3)氧自由基损伤. Schieffer等[21]发现Ang Ⅱ可增加氧自由基, 活化炎症信号转到通路JAKs和STAT. Leung等[1]通过研究证实, Ang Ⅱ可通过增加还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶或黄嘌呤氧化酶(xanthineoxidase, XOD)的活性刺激血管内皮细胞和平滑肌细胞大量合成活性氧(reactive oxygen species, ROS). 大量氧自可引起细胞膜脂质过氧化而导致细胞稳定性降低、卵磷脂分解、细胞蜕变, 形成细胞毒效应[22].
在RAS介导的炎症性病变中, 可以通过对RAS不同位点的调控减轻炎症反应和病理损伤. 因此可以从2个位点对RAS的病理生理作用进行调控: (1)ACEI减少AngⅠ向AngⅡ转化. 国内外已有学者在大鼠急性胰腺炎模型中运用ACEI(卡托普利)可以起到一定保护作用[2,23]; (2)ARB阻断AngⅡ的生物学活性. Abramowich等[24]在大鼠急性胰腺炎模型中应用AT1受体亚型拮抗剂Losartan, 可改善胰腺微循环障碍, 减轻胰腺损伤, 亦可以减少活性氧的产生; (3)肾素抑制剂(阿利吉仑)则从源头上阻断RAS,有效减少AngⅠ、AngⅡ的生成. 阿利吉仑是近年来合成的第一个口服、非肽类、直接肾素抑制剂. 其从源头阻断RAS活性, 在与肾素结合, 进入肾素分子的裂隙占据肾素的酶活性部位后, 肾素再也无法接纳和水解血管紧张素原. 这种情况下, 即使肾素分泌增多, 但血浆肾素活性仍然降低, 低水平活性肾素在单位时间内作用于血管紧张素原生成AngⅠ的速率减低, 进而生成的AngⅡ亦减少; 阿利吉仑除了通过减少AngⅡ生成抑制其生物学效应外, 其自身亦有抗炎、抗氧化、抑制炎症信号通路等作用. Lee等[25]用阿利吉仑干预CCl4诱导的慢性肝损伤小鼠, 发现阿利吉仑能够减轻肝脏炎症和肝纤维化; Dong等[26]研究发现阿利吉仑通过减轻氧化应激对2型糖尿病小鼠的胰腺损伤及心血管并发症起到保护作用; Goldenberg等[27]在2型糖尿病KK-Ay/Ta小鼠实验中, 发现阿利吉仑可抑制2型糖尿病KK-Ay/Ta小鼠NF-κB的活性及有丝分裂原激活蛋白激酶(mitogen activated protein kinase, MAPK)ERKl的磷酸化.
本实验以RAS首位起始环节肾素作为研究点, 造模成功后给以肾素抑制剂阿利吉仑予以灌胃治疗, 模型组和假手术组给予同等剂量的生理盐水. 术后观察到模型组各时间点胰腺病理组织评分, AMY、TNF-α、PRA、AngⅡ及胰腺组织NF-κB和AT1R的阳性表达率较假手术组组明显升高(P<0.05); 而同时间点的阿利吉仑治疗组大鼠各检测指标较模型组有明显减轻(P<0.05), 免疫组织化学显示NF-κB和AT1R的阳性表达率较模型组亦明显减少(P<0.05). 本研究结果表明阿利吉仑在急性胰腺炎时对胰腺的炎症病变和损伤有一定的保护作用, 其原因可能为两方面: (1)AngⅡ作为RAS重要的炎症活化因子, 其生成减少, 作用亦减弱. 阿利吉仑作为RAS系统的首步限速酶抑制剂, 对RAS的阻断作用更为完全, 可显著、持续地降低PRA水平, 阻止AngⅠ和AngⅡ的生成, 抑制了AngⅡ的病理生理作用, 如加重胰腺微循环障碍, 激活NF-κB等炎症信号通路及大量氧自由基的产生, 且不会像ACEI和ARB反馈性引起PRA水平上调及AngⅡ的反跳逃逸; (2)阿利吉仑的抗炎、抗氧化、抑制炎症信号通路的作用. NF-κB作为炎症反应持续放大的重要信号通路, 在急性胰腺炎模型组可看到NF-κB的活性增加,胰腺细胞阳性表达率明显升高, 同时炎症因子TNF-α的水平也明显升高, 而阿利吉仑干预组NF-κB阳性表达率却较模型组明显减少(P<0.05), 且TNF-α的水平亦降低, 从而减轻AP的病理损害. 但阿利吉仑具体通过怎样的方式和途径抑制NF-κB的活性尚不明确, 值得进一步深入研究.
急性胰腺炎(acute pancreatitis, AP)的病因和发病机制众多. 近年来, 随着对RAS的研究, 其在炎症性病变中起着重要作用. 本文用阿利吉仑从肾素-血管紧张素系统(renin-angiotensin system, RAS)起始部位抑制其活性, 观察阿利吉仑对大鼠AP的作用, 为AP的治疗提供一种新的理论基础和实验依据.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科; 陈海龙, 教授, 大连医科大学附属第一医院院办
阿利吉仑在心血管系统疾病已有很多研究报道, 且也证实其可抑制肾素活性减少Ang血管紧张素Ⅱ (angiotensin, AngⅡ)生成, 同时具有抗炎、减轻氧化应激、抑制炎症信号通路等作用. 随着对阿利吉仑的深入研究, 其在胰腺炎等炎症性病变中亦可能起到一定保护作用.
Dong等报道阿利吉仑可以减轻氧化应激对2型糖尿病大鼠的胰腺损伤及心血管系统并发症有保护作用.
本研究以RAS起始部位作为切入点,通过阿利吉仑对肾素活性的抑制, 可以减少RAS主要活性物质AngⅡ的生成, 减弱其生物学活性, 同时阿利吉仑抑制核因子-κB(nuclear factor kappa-B, NF-κB)炎症信号通路, 减少肿瘤坏死因子-a(tumor necrosis factor-a)的生成, 减轻炎症反应. 但目前阿利吉仑在急性胰腺方面的研究尚不多见, 通过对其的实验研究, 可为AP的治疗寻找一种新的途径和治疗方法.
国外目前已有多种规格的阿利吉仑上市(如锐思力), 其整体临床应用价值得到肯定. 本研究以RAS在急性胰腺炎的发病机制着手, 以阿利吉仑干预RAS的其中一位点, 从而在急性胰腺炎中发挥一定的保护作用.
本文具有一定的探索和创新性, 有一定科学意义和临床应用价值.
编辑 田滢 电编 鲁亚静
| 1. | Leung PS. Local renin-angiotensin system in the pancreas: the significance of changes by chronic hypoxia and acute pancreatitis. JOP. 2001;2:3-8. [PubMed] |
| 2. | Ip SP, Kwan PC, Williams CH, Pang S, Hooper NM, Leung PS. Changes of angiotensin-converting enzyme activity in the pancreas of chronic hypoxia and acute pancreatitis. Int J Biochem Cell Biol. 2003;35:944-954. [PubMed] |
| 3. | Chan YC, Leung PS. AT1 receptor antagonism ameliorates acute pancreatitis-associated pulmonary injury. Regul Pept. 2006;134:46-53. [PubMed] |
| 4. | Rahuel J, Rasetti V, Maibaum J, Rüeger H, Göschke R, Cohen NC, Stutz S, Cumin F, Fuhrer W, Wood JM. Structure-based drug design: the discovery of novel nonpeptide orally active inhibitors of human renin. Chem Biol. 2000;7:493-504. [PubMed] |
| 5. | Kukkar A, Singh N, Jaggi AS. Neuropathic pain-attenuating potential of aliskiren in chronic constriction injury model in rats. J Renin Angiotensin Aldosterone Syst. 2013;14:116-123. [PubMed] [DOI] |
| 6. | Swanson MW. Association of antibody titer and chorioretinal scarring in toxoplasmosis retinochoroiditis. J Am Optom Assoc. 1989;60:735-740. [PubMed] [DOI] |
| 7. | Kavvadas P, Weis L, Abed AB, Feldman DL, Dussaule JC, Chatziantoniou C. Renin inhibition reverses renal disease in transgenic mice by shifting the balance between profibrotic and antifibrotic agents. Hypertension. 2013;61:901-907. [PubMed] [DOI] |
| 8. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 9. | Saackel LR, Heuck F. [A practicable method for measuring volume employing the x-ray image and a microcalculator (author's transl)]. Biomed Tech (Berl). 1975;20:95-98. [PubMed] |
| 10. | Banks PA. Practice guidelines in acute pancreatitis. Am J Gastroenterol. 1997;92:377-386. [PubMed] |
| 11. | Abu-Zidan FM, Bonham MJ, Windsor JA. Severity of acute pancreatitis: a multivariate analysis of oxidative stress markers and modified Glasgow criteria. Br J Surg. 2000;87:1019-1023. [PubMed] [DOI] |
| 13. | Leung PS, Chappell MC. A local pancreatic renin-angiotensin system: endocrine and exocrine roles. Int J Biochem Cell Biol. 2003;35:838-846. [PubMed] |
| 14. | Suzuki Y, Ruiz-Ortega M, Lorenzo O, Ruperez M, Esteban V, Egido J. Inflammation and angiotensin II. Int J Biochem Cell Biol. 2003;35:881-900. [PubMed] |
| 15. | Dörffel Y, Lätsch C, Stuhlmüller B, Schreiber S, Scholze S, Burmester GR, Scholze J. Preactivated peripheral blood monocytes in patients with essential hypertension. Hypertension. 1999;34:113-117. [PubMed] |
| 16. | Nakamura A, Johns EJ, Imaizumi A, Yanagawa Y, Kohsaka T. Effect of beta(2)-adrenoceptor activation and angiotensin II on tumour necrosis factor and interleukin 6 gene transcription in the rat renal resident macrophage cells. Cytokine. 1999;11:759-765. [PubMed] [DOI] |
| 17. | Mervaala EM, Müller DN, Park JK, Schmidt F, Löhn M, Breu V, Dragun D, Ganten D, Haller H, Luft FC. Monocyte infiltration and adhesion molecules in a rat model of high human renin hypertension. Hypertension. 1999;33:389-395. [PubMed] |
| 18. | Moon JY, Tanimoto M, Gohda T, Hagiwara S, Yamazaki T, Ohara I, Murakoshi M, Aoki T, Ishikawa Y, Lee SH. Attenuating effect of angiotensin-(1-7) on angiotensin II-mediated NAD(P)H oxidase activation in type 2 diabetic nephropathy of KK-A(y)/Ta mice. Am J Physiol Renal Physiol. 2011;300:F1271-F1282. [PubMed] [DOI] |
| 19. | Ruiz-Ortega M, Lorenzo O, Rupérez M, Suzuki Y, Egido J. Angiotensin II activates nuclear transcription factor-kappaB in aorta of normal rats and in vascular smooth muscle cells of AT1 knockout mice. Nephrol Dial Transplant. 2001;16 Suppl 1:27-33. [PubMed] |
| 20. | Muller DN, Dechend R, Mervaala EM, Park JK, Schmidt F, Fiebeler A, Theuer J, Breu V, Ganten D, Haller H. NF-kappaB inhibition ameliorates angiotensin II-induced inflammatory damage in rats. Hypertension. 2000;35:193-201. [PubMed] |
| 21. | Schieffer B, Luchtefeld M, Braun S, Hilfiker A, Hilfiker-Kleiner D, Drexler H. Role of NAD(P)H oxidase in angiotensin II-induced JAK/STAT signaling and cytokine induction. Circ Res. 2000;87:1195-1201. [PubMed] |
| 22. | Yasar M, Yildiz S, Mas R, Dundar K, Yildirim A, Korkmaz A, Akay C, Kaymakcioglu N, Ozisik T, Sen D. The effect of hyperbaric oxygen treatment on oxidative stress in experimental acute necrotizing pancreatitis. Physiol Res. 2003;52:111-116. [PubMed] |
| 24. | Abramowich D, Scapa E, Eshchar J. [Serologic diagnosis of hepatitis viruses--update]. Harefuah. 1992;123:403-406. [PubMed] |
| 25. | Lee KC, Chan CC, Yang YY, Hsieh YC, Huang YH, Lin HC. Aliskiren attenuates chronic carbon tetrachloride-induced liver injury in mice. Eur J Clin Invest. 2012;42:1261-1271. [PubMed] [DOI] |
| 26. | Dong YF, Liu L, Kataoka K, Nakamura T, Fukuda M, Tokutomi Y, Nako H, Ogawa H, Kim-Mitsuyama S. Aliskiren prevents cardiovascular complications and pancreatic injury in a mouse model of obesity and type 2 diabetes. Diabetologia. 2010;53:180-191. [PubMed] [DOI] |
| 27. | Goldenberg RL, Foster JM, Cutter GR, Nelson KG. Fetal deaths in Alabama, 1974-1983: a birth weight-specific analysis. Obstet Gynecol. 1987;70:831-835. [PubMed] [DOI] |