修回日期: 2014-03-21
接受日期: 2014-03-28
在线出版日期: 2014-05-08
目的: 研究辅助性T细胞17(T helper cells 17, Th17)和Ⅰ型辅助性T细胞(typeⅠhelper T cells, Th1)及其相关因子白介素-17(interleukin-17, IL-17)、干扰素-γ(interferon-γ, IFN-γ)在四氯化碳(carbon tetrachloride, CCl4)诱导肝纤维化小鼠模型中的表达及相互关系.
方法: 将50只♂Balb/c小鼠按随机数字表法分为5组: 正常对照组(n)、4 wk对照组(C4)、8 wk对照组(C8)、4 wk肝纤维化组(F4)、8 wk肝纤维化组(F8), 每组10只. 采用腹腔内注射CCl4以复制肝纤维化小鼠模型. HE和Masson染色观察小鼠肝脏病理改变; 免疫组织化学染色检测肝脏组织中α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达; 流式细胞检测小鼠脾脏中CD4+IL-17+ T(Th17)细胞、CD4+IFN-γ+ T(Th1)细胞的比例; 酶联免疫吸附试验(ELISA)测定外周血IL-17、IFN-γ的含量, 并分析这些指标的相关性.
结果: (1) 肝组织病理切片HE染色和Masson染色显示, CCl4腹腔注射成功诱导小鼠肝纤维化模型; (2)α-SMA免疫组织化学显示: 模型组α-SMA表达增加, 在门静脉、汇管区及纤维间隔区域内可见α-SMA大量表达, 且随肝纤维化程度加重而增加; (3)F4组和F8组小鼠脾脏Th17细胞、Th1细胞比例明显高于N组、C4组和C8组, 且以F8组增高更为明显, 差异均有统计学意义(均P<0.05); (4)F4组和F8组外周血IL-17、IFN-γ的含量较N组、C4组和C8组明显增高, 差异均有统计学意义(均P<0.05); (5)模型组脾脏Th17细胞、Th1细胞与肝脏α-SMA含量密切正相关(均P<0.01), 脾脏Th17细胞分别与Th1细胞、外周血IL-17水平密切正相关(均P<0.01).
结论: CCl4致肝纤维化小鼠模型中脾脏Th17和Th1细胞及外周血IL-17、IFN-γ水平明显升高, Th17细胞通过分泌IL-17参与肝纤维化过程.
核心提示: 辅助性T细胞17(T helper cells 17)与Ⅰ型辅助性T细胞(typeⅠhelper T cells)细胞的免疫调节作用可能在肝纤维化的发病机制中发挥关键的作用; 同时与其相关的细胞因子也参与了疾病的免疫过程.
引文著录: 黄小丽, 郭晓云, 姜海行, 覃山羽, 罗薇, 马诗家, 卢东红, 陈梅, 王家旭, 杨显文. Th17及Th1细胞在四氯化碳致肝纤维化小鼠模型中的表达及关系. 世界华人消化杂志 2014; 22(13): 1826-1833
Revised: March 21, 2014
Accepted: March 28, 2014
Published online: May 8, 2014
AIM: To investigate the expression of T helper cells 17 (Th17) and type I helper T cells (Th1) as well as their cytokines interleukin-17 (IL-17) and interferon-γ (IFN-γ) in a murine model of carbon tetrachloride (CCl4)-induced liver fibrosis.
METHODS: Fifty male Balb/c mice were randomly divided into five groups, including a normal control group (n), two liver fibrosis groups (F4 and F8; induced for 4 and 8 weeks, respectively) and two control groups (C4 and C8), with 10 mice in each group. Liver fibrosis was induced by intraperitoneal injection of CCl4. HE staining and Masson's staining were used to detect hepatic pathological changes. The expression of α-smooth muscle actin (α-SMA) in the liver of mice was determined by immunohistochemical staining. The proportions of CD4+IL-17+ T (Th17) cells and CD4+IFN-γ+ T (Th1) cells in the murine spleen were detected by flow cytometric analysis. Enzyme linked immunosorbent assay (ELISA) was used to measure the levels of IL-17 and IFN-γ in murine peripheral blood. The correlation analyses between all the above parameters were conducted.
RESULTS: HE staining and Masson's staining showed that hepatic fibrosis was successfully induced by CCl4 injection. After CCl4 administration, increased expression of α-SMA was detected in the hepatic fibrosis groups. The α-SMA spread to the portal, portal area and fibrous septa. Continuous CCl4 injection led to enlarged fibrosis area in the hepatic fibrosis groups. The percentages of Th17 and Th1 cells in the spleen in the F4 and F8 groups were significantly increased as compared with those in the N, C4 and C8 groups, particularly in F8 (P < 0.05 for all). The levels of IL-17 and IFN-γ in the F4 and F8 groups were significantly increased as compared with those in the N, C4 and C8 groups (P < 0.05 for all). Th17 cells and Th1 cells in the spleen in the hepatic fibrosis groups had a positive correlation with α-SMA expression (P < 0.01 for all). Th17 cells had a positive correlation with Th1 cells and the levels of IL-17 (P < 0.01 for both).
CONCLUSION: Th17 and Th1 cells in the spleen as well as the levels of IL-17 and IFN-γ in peripheral blood are significantly increased in the murine model of CCl40-induced liver fibrosis. Th17 cells may be involved in the pathogenesis of liver fibrosis through producing IL-17.
- Citation: Huang XL, Guo XY, Jiang HX, Qin SY, Luo W, Ma SJ, Lu DH, Chen M, Wang JX, Yang XW. Expression of Th17 and Th1 cells in a murine model of carbon tetrachloride-induced liver fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1826-1833
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1826.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1826
肝纤维化是由于各种致病因素引起的肝损伤, 在组织修复过程中导致肝脏细胞外基质(extracellular matrix, ECM)代谢失衡, 发生异常增多和过度沉积的病理过程, 是肝组织修复过程中的代偿反应[1]. ECM主要来源于活化的肝星状细胞(hepatocyte stellate cell, HSC), 而表达α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)是HSC活化的标志. 辅助性T淋巴细胞是机体重要的免疫调节细胞, 根据其产生细胞因子的不同, 辅助性CD4+T细胞可分为调节性T细胞(regulatory T cells, Treg)、辅助性T细胞17(T helper cells 17, Th17)、Th1及Th2等细胞亚群, 他们之间相互调节, 在分化发育上相互制约, 在功能上存在着拮抗或协同的复杂关系, 影响免疫应答的格局. 其中, Th1细胞分泌白介素-2(interleukin-2, IL-2)、干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等, 主要效应是增强吞噬细胞功能, 介导机体细胞免疫反应; Th1细胞功能低下是乙型肝炎病毒(hepatitis B virus, HBV)相关肝硬化、原发性肝癌发生的重要危险因素. IFN-γ是典型的Th1型细胞因子, 可通过抑制肝星状细胞的增殖、胶原的合成, 同时增强自然杀伤细胞(natural killer cell, NK)清除激活的HSC的活性, 发挥抗纤维化作用[2]. 然而, Th1细胞的作用并不能完全解释肝纤维化的发病机制, 多种因素和机制参与肝纤维化的发生和发展. 随着对肝纤维化免疫发病机制研究的深入, 一种新型的CD4+T细胞-Th17细胞被发现. Th17细胞通过特征性分泌IL-17, 同时分泌IL-21、IL-22等炎症性细胞因子, 参与了病毒性肝炎、自身免疫性肝病及脂肪性肝病等多种肝病的发病过程[3]. Th17细胞和Th1细胞均参与肝纤维化发病[4], 但二者在肝纤维化发病过程中的相互作用却少见报道. 本研究通过腹腔内注射CCl4复制肝纤维化小鼠模型, 并观察Th17、Th1细胞表达及其相互作用, 为认识肝纤维化发病机制及寻找新的有效治疗靶点提供理论依据.
♂Balb/c小鼠50只, SPF级, 6-8周龄, 体质量约25 g, 由广西医科大学实验动物中心提供, 自由饮水和进食. CCl4及橄榄油购自上海国药集团化学试剂有限公司. RPMI 1640培养基及胎牛血清购自美国Hyclone公司; 乙酸肉豆蔻佛波酯(phorbol myristate acetate, PMA)、离子霉素、α-SMA一抗购自Sigma-Aldrich公司; 免疫组织化学试剂盒购自北京中杉生物技术有限公司; 红细胞裂解液、蛋白质转运抑制剂莫能霉素、破膜剂购自美国BD公司; 流式细胞检测抗体: 大鼠抗小鼠单克隆流式抗体AF488-IFN-γ mAb、PE-Cy5-CD4 mAb、PE-IL-17 mAb及相应抗体的同型对照IgG购自美国BD公司; 小鼠IL-17、IFN-γ酶联免疫吸附试验(ELISA)法检测试剂盒购自美国eBioscience公司.
1.2.1 动物分组及模型的建立: 将50只♂Balb/c小鼠按随机数字表法分为5组: 正常对照组(n)、4 wk对照组(C4)、8 wk对照组(C8)、4 wk肝纤维化组(F4)、8 wk肝纤维化组(F8), 每组10只, CCl4腹腔注射法建立小鼠肝纤维化模型. C4组和C8组腹腔内注射橄榄油, 2 mg/kg体质量, 2次/wk; 模型组腹腔内注射CCl4溶液(橄榄油配制), 浓度20%, 2 mg/kg体质量, 2次/wk. 各组小鼠分别于对应时间点处死, 处死时距最后一次注射时间为72 h.
1.2.2 外周血采集: 小鼠通过眶后动脉放血处死, 收集血液1 mL, 以3000 r/min离心20 min, 吸取上层血清, 于-80 ℃冰箱中保存备检. 分别使用IL-17、IFN-γ ELISA试剂盒检测血清中IL-17、IFN-γ的水平. 操作过程严格按照试剂盒说明进行, 采用EXCEL软件绘制标准曲线, 计算血清中IL-17、IFN-γ的含量.
1.2.3 肝脏组织病理学检查: 打开腹腔, 取肝脏左叶, 投入40 g/L中性甲醛溶液中固定、脱水、石蜡包埋, 制取4 μm切片, 行HE染色及Masson染色, 显微镜下观察肝组织炎性反应及纤维化程度. 由两位病理科医生进行盲法阅片.
1.2.4 免疫组织化学染色检测肝脏组织中α-SMA的表达: 用SP法作α-SMA免疫组织化学染色. 肝脏组织石蜡切片常规脱蜡、水化、PBS洗、抗原修复、PBS洗、加正常山羊血清封闭液、依次滴加一抗和二抗、DAB显色, 苏木精复染, 自来水冲洗、脱水、透明、封片、镜检. 用已知阳性表达的肝组织切片作为阳性对照, 以PBS代替一抗作阴性对照. 肝脏组织α-SMA免疫组织化学阳性染色是胞浆呈棕黄色, 每张切片随机选取10个高倍镜视野(×400), 使用Image proplus6.0图像分析系统半定量测定α-SMA的表达, 计算平均光密度值, 同一标本三张切片测量值取均值.
1.2.5 流式细胞术检测小鼠脾脏Th17、Th1细胞: 在各时间点取小鼠脾脏, PBS中剪碎, 玻璃皿研磨组织, 100、200、400目不锈钢细网依次过滤, 制成脾单细胞悬液. 用红细胞裂解液裂解红细胞, 用含10%胎牛血清的RPMI 1640培养基调整淋巴细胞浓度为1×106/mL接种于24孔板, 同时每孔加入PMA(25 ng/mL)、离子霉素(1 μg/mL)和莫能霉素(1.7 μg/mL), 37 ℃、5%CO2培养5 h, 收集细胞, 进行细胞表面CD4分子染色, 破膜剂破膜后进行胞内IL-17因子及相应同型对照抗体染色, 利用BD公司FACS Calibur流式细胞仪进行检测. 结果用Flowjo7.6.1软件分析. 以前向散射角(forward-scattering angle, FSC)和侧向散射角(side scatter, SSC)圈定淋巴细胞, 以CD4+设门, CD4荧光以及IL-17荧光双阳性细胞表示Th17细胞亚群, CD4荧光以及IFN-γ荧光双阳性细胞表示Th1细胞亚群. CD4荧光以及IgG荧光双阳性为非特异性结合细胞. Th17细胞占CD4+细胞比例 = (CD4及IL-17双阳性细胞数-CD4及IgG双阳性细胞数)/CD4阳性细胞总数×100%; Th1细胞占CD4+细胞比例 = (CD4及IFN-γ双阳性细胞数-CD4及IgG双阳性细胞数)/CD4阳性细胞总数×100%.
统计学处理 采用SPSS16.0软件进行统计学分析. 正态分布的计量资料用mean±SD表示, 多组间均数的比较采用单因素方差分析(one-way ANOVA), 组间比较采用SNK检验. 采用Pearson相关分析法进行相关性检验, P<0.05为差异有统计学意义.
在整个实验期间, 对照组及模型组小鼠全部存活, CCl4造模后小鼠饮食及活动逐渐减少, 体质量减轻, 反应稍迟钝, 被毛杂乱无光泽. 对照组小鼠肝脏色鲜红, 有光泽, 质软, 表面光滑细腻, 边缘锐利. 4 wk肝纤维化组小鼠的肝脏呈暗红色, 表面呈细颗粒状. 8 wk肝纤维化组的肝脏呈灰白色; 边缘钝圆, 表面可见大小不一的细小结节, 质地稍硬.
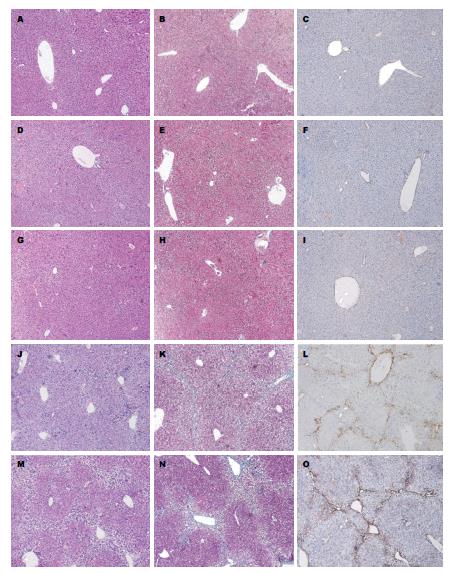
HE染色显示: 对照组小鼠肝脏标本肝小叶结构完整, 界限清晰. 模型组肝细胞索排列紊乱, 肝小叶结构破坏或消失, 汇管区小胆管增生, 增生小胆管周围有纤维组织生成, 随着造模时间的延长, 中央静脉周围及汇管区纤维沉积逐渐增多, 纤维隔内有大量炎性细胞及成纤维细胞浸润. Masson染色镜下观察, 所见与HE染色中纤维化基本一致, 纤维沉积显色为淡绿色. 对照组肝组织仅见少许纤细纤维分布于血管壁. 模型组肝组织汇管区、中央静脉可见大量胶原纤维, 肝小叶被宽窄不一的纤维间隔分割(图1), 提示肝纤维化模型成功建立.
对照组小鼠α-SMA表达较少, 主要分布于血管壁. 在肝纤维化时α-SMA表达增加, 在门静脉、汇管区及纤维间隔区域内可见有α-SMA大量表达, 且随肝纤维化程度加重而增加(图1). 与对照组比较, 模型组各时间段的肝组织α-SMA的表达均增强(均P<0.05)(表1).
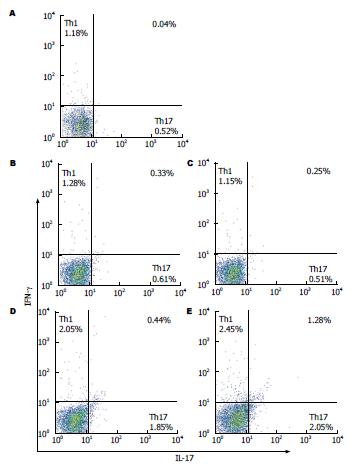
CD4+IL-17+ T细胞被定义为Th17细胞, CD4+ IFN-γ+ T细胞被定义为Th1细胞. 本实验结果显示: 与N组、C4组和C8组比较, 模型组F4组和F8组小鼠Th17、Th1细胞比例明显增高, 且8 wk模型组增高更为显著(均P<0.05)(表2, 图2). 模型组F4、F8组血清IL-17、IFN-γ的水平较对照组N组、C4组、C8组明显增高(均P<0.05)(表2).
本实验结果显示, 4 wk模型组和8 wk模型组小鼠脾脏Th17细胞、Th1细胞比例与肝脏α-SMA均呈显著正相关关系(r = 0.716, 0.778, 均P<0.01). 脾脏Th17细胞与Th1细胞呈正相关(r = 0.874, P<0.01). 脾脏Th17细胞与外周血IL-17水平呈显著正相关(r = 0.892, P<0.01). 然而Th1细胞与IFN-g、IL-17均无显著相关性(P>0.05).
肝纤维化是肝脏对慢性损伤的修复反应, 以ECM异常增生和过度沉积为特征, 是多种慢性肝病的共同病理过程, 慢性乙型病毒性肝炎引起的肝纤维化最常见, 是疾病进展为肝硬化、肝癌的关键环节, 而机体的免疫系统在其中扮演着重要角色. 在肝纤维化过程中发挥中心作用的是HSC, HSC的活化、增殖是肝纤维化形成的中心环节[5]. 因此, 要阐明Th17、Th1细胞与肝纤维化的关系, 就必须了解纤维化过程中Th17、Th1细胞与HSC之间的联系及对其活化增殖的影响. 本研究采用经典的CCl4复制肝纤维化模型, 其在病理生理方面与人体肝纤维化的过程比较相似, 同时具有制模方便、时间短和成模率高的特点, 造模过程中未出现小鼠死亡, 表明肝纤维化模型制备有效, 成功模拟了肝纤维化发生发展过程.
过度的和非特异性Th17和Th1效应细胞的反应可能参与了乙型肝炎病毒相关的肝脏炎症及肝细胞损害的发病机制. 特别是Th17细胞效应, 可能加剧炎症过程并导致肝衰竭[6]. CD4+T细胞按其所产生的细胞因子谱, 最初被分为Th1和Th2细胞亚群. Th1细胞主要分泌IFN-γ, T-bet是其特异性转录因子, 胞内细菌感染时, Th1细胞优先分化并引发吞噬细胞介导的宿主防御应答. IFN-γ信号通过信号转导转录激活子1(signal transducer and activator of transcription 1, STAT1)转导, 激活下游转录因子T-bet, 进而上调Th1细胞特定基因的表达. 随后一类新的以大量分泌IL-17为特征的Th17细胞亚群被发现, 在转化生长因子-β(transforming growth factor β, TGF-β)与IL-6共同作用下, CD4+T细胞大量分化形成Th17细胞[7]. 维甲酸孤独核相关受体RORγt(在人类中称为RORC)是调节初始CD4+细胞分化为Th17细胞的主要转录因子[8]. 目前的证据显示, Th17细胞参与了各种肝脏疾病的炎症进程, 包括酒精性肝损伤、非酒精性肝炎、病毒性肝炎、原发性胆汁性肝硬化和自身免疫性肝炎等[9-11].
Yang等[12]研究发现, Th17和Th1细胞在分化时具有相互拮抗的作用. 但在一些自身免疫性疾病的炎性病变中, Th17和Th1细胞之间并不总是处于相互拮抗的关系, 两者可以共存[13]. 甚至在有些时候Th17和Th1细胞之间存在着协同效应, 在某些病理反应中相互依赖, 通过合作来完成一定的生物学功能. 本组资料显示模型组小鼠Th17、Th1细胞比例增高, 且以8 wk模型组增高尤为显著. 并且模型组小鼠脾脏Th17、Th1细胞比例均与肝脏α-SMA含量密切正相关, 提示肝纤维化环境有利于这两个细胞亚群的分化扩增. 大量研究已证实TGF-β在肝纤维化中发挥重要作用, 在肝纤维化动物模型及患者肝组织中TGF-β表达明显增高, TGF-β/Smad信号通路在肝纤维化中起着重要作用, 通过激活HSC, 促进HSC分泌胶原及纤维连接蛋白等, 促进肝纤维化的发生[14]. 同样, 增高的TGF-β在IL-6存在的情况下, 可促进Th17细胞大量分化增殖, 分泌IL-17[15]. 本研究显示与对照组比较, 模型组外周血IL-17水平增高, IL-17的水平与小鼠肝脏a-SMA含量及脾脏Th17细胞比例密切正相关, 提示Th17细胞通过分泌IL-17参与肝纤维化的进展, 促进肝星状细胞的活化及肝脏胶原纤维的沉积. 生理状态下, 静止的HSC不表达a-SMA; 肝纤维化时, HSC在细胞因子、炎症介质、乙醛、氧自由基等作用下由静止状态活化为表达a-SMA的肌成纤维样细胞, 并在肝损伤部位移行、增殖, 表达各种信号转导蛋白, 产生大量以胶原为主的细胞外间质成分和细胞因子[16]. 本实验结果显示对照组小鼠仅有少量a-SMA表达于血管平滑肌细胞, 随着肝纤维化程度的加重, 模型组小鼠肝组织中a-SMA阳性细胞逐渐增多, 即活化HSC逐渐增多. Tan等[17]研究发现从C57BL/6小鼠中分离的肝星状细胞在IL-17的作用下引起IL-6、a-SMA、胶原蛋白和TGF-β mRNA表达的增高, 提示IL-17促进肝纤维化的发展. 此外, Meng等[18]研究发现IL-17通过两种途径发挥强大的促纤维化作用: 一是激活枯否细胞表达促炎因子IL-6、IL-1b、TNF-a及主要的纤维化因子TGF-β; 二是IL-17直接通过激活信号转导子和转录活化子纤维细胞表达I型胶原蛋白, 造成细胞外胶原沉积. 由此可见, 应用抑制剂对Th17/IL-17的靶向治疗可能是一种有效的治疗肝纤维化的方法.
Th17细胞及Th1细胞在许多炎症性疾病和自身免疫性疾病中往往同时存在, 并通过产生特异性的细胞因子调节免疫反应的不同阶段[19-21]. 我们在肝纤维化模型组中均检测到Th17和Th1细胞的比例增高, 提示在肝纤维化的发病过程中Th17和Th1可能发挥协同作用. 此外, 肝纤维化小鼠外周血中IFN-g浓度较正常对照组明显增高, 且Th1细胞比例与Th17细胞比例均呈显著正相关关系, 提示在肝纤维化环境中, 活化的Th1细胞通过分泌IFN-g促进小鼠体内Th17细胞上调, 当然直接的证据有待于我们的体外细胞功能实验进一步证实.
总之, Th17与Th1细胞的免疫调节作用可能在肝纤维化的发病机制中发挥关键的作用; 同时与其相关的细胞因子也参与了疾病的免疫过程. 但Th17细胞在肝纤维化中的具体作用、Th1细胞可能的协同作用机制及这两种细胞之间存在着怎样的具体联系还需要大量的研究, 进一步阐明他们的相互作用、免疫调节功能, 从而为治疗肝纤维化开辟新的道路.
肝纤维化是各种原因引起的慢性肝损伤所共有的病理改变, 也是进一步向肝硬化发展的中间环节. 固有免疫系统和适应性免疫系统在肝纤维化过程中发挥重要作用. 辅助性T淋巴细胞是机体重要的免疫调节细胞, 其在肝病中的作用引起人们的广泛关注, 明确辅助性T细胞(T helper cells 17, Th)17和Th1细胞在肝纤维化进展中的相互作用, 可为治疗提供新的研究方向.
李涛, 副主任医师, 北京大学人民医院肝胆外科
由于CD4+T细胞具有分化为不同的效应T细胞亚群的潜能, 所以被认为是临床预防和治疗肝纤维化的潜在靶细细, 尤其是其对基质金属蛋白酶系统的调控、与肝纤维化相关细胞因子之间的关系以及在肝星状细胞增殖、迁移中等方面的作用是肝纤维化研究的热点.
既往研究显示Th17细胞及Th1细胞在许多炎症性疾病和自身免疫性疾病中往往同时存在, 并通过产生特异性的细胞因子调节免疫反应的不同阶段, Th17细胞和Th1细胞均参与肝纤维化发病, 二者在肝纤维化发病过程中的相互作用却少见报道.
由于肝纤维化患者从发病到就诊的时间不一, 难以反映Th17、Th1细胞实际分化的时间规律, 本实验通过CCl4腹腔注射建立肝纤维化动物模型, 研究肝纤维化不同时期Th17、Th1细胞表达情况, 初步探讨Th17、Th1细胞及其主要效应因子IL-17、IFN-γ在肝纤维化过程的变化规律, 对于研究肝纤维化的发病机制有重要意义.
本研究结果表明在肝纤维化的发病过程中Th1和Th17可能同时发挥协同作用, 完善T细胞亚群在肝纤维化发病机制的理论, 有望在不远的将来生产出针对Th17/IL-17的靶向治疗的生物制剂为疾病的诊断治疗开辟新途径.
本文探讨Th17、Th1及相关因子IL-17、IFN-γ在肝纤维化小鼠模型中的表达及相互关系, 有一定的创新性, 研究设计较合理, 有一定的学术价值.
编辑 田滢 电编 鲁亚静
| 1. | Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol. 2011;6:425-456. [PubMed] [DOI] |
| 2. | Melhem A, Muhanna N, Bishara A, Alvarez CE, Ilan Y, Bishara T, Horani A, Nassar M, Friedman SL, Safadi R. Anti-fibrotic activity of NK cells in experimental liver injury through killing of activated HSC. J Hepatol. 2006;45:60-71. [PubMed] [DOI] |
| 4. | Li J, Qiu SJ, She WM, Wang FP, Gao H, Li L, Tu CT, Wang JY, Shen XZ, Jiang W. Significance of the balance between regulatory T (Treg) and T helper 17 (Th17) cells during hepatitis B virus related liver fibrosis. PLoS One. 2012;7:e39307. [PubMed] [DOI] |
| 5. | Sarem M, Znaidak R, Macías M, Rey R. [Hepatic stellate cells: it's role in normal and pathological conditions]. Gastroenterol Hepatol. 2006;29:93-101. [PubMed] [DOI] |
| 6. | Ye Y, Xie X, Yu J, Zhou L, Xie H, Jiang G, Yu X, Zhang W, Wu J, Zheng S. Involvement of Th17 and Th1 effector responses in patients with Hepatitis B. J Clin Immunol. 2010;30:546-555. [PubMed] [DOI] |
| 7. | Mangan PR, Harrington LE, O'Quinn DB, Helms WS, Bullard DC, Elson CO, Hatton RD, Wahl SM, Schoeb TR, Weaver CT. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature. 2006;441:231-234. [PubMed] [DOI] |
| 8. | Yang XO, Pappu BP, Nurieva R, Akimzhanov A, Kang HS, Chung Y, Ma L, Shah B, Panopoulos AD, Schluns KS. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 2008;28:29-39. [PubMed] [DOI] |
| 9. | Zhang JY, Zhang Z, Lin F, Zou ZS, Xu RN, Jin L, Fu JL, Shi F, Shi M, Wang HF. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B. Hepatology. 2010;51:81-91. [PubMed] [DOI] |
| 10. | O'Quinn DB, Palmer MT, Lee YK, Weaver CT. Emergence of the Th17 pathway and its role in host defense. Adv Immunol. 2008;99:115-163. [PubMed] [DOI] |
| 11. | Tang Y, Bian Z, Zhao L, Liu Y, Liang S, Wang Q, Han X, Peng Y, Chen X, Shen L. Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease. Clin Exp Immunol. 2011;166:281-290. [PubMed] [DOI] |
| 12. | Yang Y, Xu J, Niu Y, Bromberg JS, Ding Y. T-bet and eomesodermin play critical roles in directing T cell differentiation to Th1 versus Th17. J Immunol. 2008;181:8700-8710. [PubMed] |
| 13. | Pène J, Chevalier S, Preisser L, Vénéreau E, Guilleux MH, Ghannam S, Molès JP, Danger Y, Ravon E, Lesaux S. Chronically inflamed human tissues are infiltrated by highly differentiated Th17 lymphocytes. J Immunol. 2008;180:7423-7430. [PubMed] |
| 14. | Wells RG. Fibrogenesis. V. TGF-beta signaling pathways. Am J Physiol Gastrointest Liver Physiol. 2000;279:G845-G850. [PubMed] |
| 15. | Veldhoen M, Hocking RJ, Atkins CJ, Locksley RM, Stockinger B. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity. 2006;24:179-189. [PubMed] [DOI] |
| 16. | Urtasun R, Nieto N. [Hepatic stellate cells and oxidative stress]. Rev Esp Enferm Dig. 2007;99:223-230. [PubMed] |
| 17. | Tan Z, Qian X, Jiang R, Liu Q, Wang Y, Chen C, Wang X, Ryffel B, Sun B. IL-17A plays a critical role in the pathogenesis of liver fibrosis through hepatic stellate cell activation. J Immunol. 2013;191:1835-1844. [PubMed] [DOI] |
| 18. | Meng F, Wang K, Aoyama T, Grivennikov SI, Paik Y, Scholten D, Cong M, Iwaisako K, Liu X, Zhang M. Interleukin-17 signaling in inflammatory, Kupffer cells, and hepatic stellate cells exacerbates liver fibrosis in mice. Gastroenterology. 2012;143:765-776. e1-e3. [PubMed] [DOI] |
| 19. | Luger D, Silver PB, Tang J, Cua D, Chen Z, Iwakura Y, Bowman EP, Sgambellone NM, Chan CC, Caspi RR. Either a Th17 or a Th1 effector response can drive autoimmunity: conditions of disease induction affect dominant effector category. J Exp Med. 2008;205:799-810. [PubMed] [DOI] |