修回日期: 2013-01-19
接受日期: 2013-01-25
在线出版日期: 2013-03-18
目的: 探讨自身免疫性胰腺炎(autoimmune pancreatitis, AIP)患者胰腺外器官受累时的超声表现.
方法: 回顾性分析16例AIP患者的胰外组织器官超声表现, 包括胰管、胆管、胆囊、胰腺周围淋巴结、肾脏、腮腺、颌下腺及泪腺, 对声像图特点进行分析. 观察胰管及胆管有无扩张, 胰腺周围是否存在肿大淋巴结, 肾脏回声是否均匀, 腮腺、颌下腺及泪腺是否存在类似干燥综合征样超声改变.
结果: 16例AIP患者均进行了胰管、胆管、胆囊、胰腺周围淋巴结、肾脏的检查, 分别有6、8、6、3、0例出现了超声异常, 10例进行了腮腺、颌下腺、泪腺检查, 分别有1、3、7例出现了超声异常.
结论: AIP患者泪腺改变的发生率高, 有可能在AIP与胰腺癌的鉴别诊断中具有重要的意义.
引文著录: 张云飞, 欧国成, 王学梅. 自身免疫性胰腺炎患者胰腺外器官受累时的超声表现. 世界华人消化杂志 2013; 21(8): 705-708
Revised: January 19, 2013
Accepted: January 25, 2013
Published online: March 18, 2013
AIM: To summarize ultrasononographic findings of extrapancreatic lesions associated with autoimmune pancreatitis (AIP).
METHODS: Sixteen patients with AIP underwent ultrasound examination of the pancreatic duct, bile duct, gall bladder, peripancreatic lymph nodes, kidneys, parotid glands, submandibular glands, and lacrimal glands to observe whether the pancreatic duct and bile duct were dilated, the gall bladder wall was thickened, parapancreatic lymph nodes were enlarged, echoes of the kidneys were evenly distributed, and the parotid glands, submandibular glands and lacrimal glands mimicked symptoms associated with Sjogren's syndrome.
RESULTS: Of 16 patients, 6 had dilated pancreatic ducts, 8 had dilated bile ducts, 6 had thickening of the gall bladder wall, and 3 had enlarged peripancreatic lymph nodes. Of 10 patients who underwent examination of the parotid glands, submandibular glands, and lacrimal glands, one had abnormalities in the parotid glands, 3 in the submandibular glands, and 7 in the lacrimal glands.
CONCLUSION: Lacrimal gland abnormalities occur more usually in AIP patients, which may be useful for the differentiation of AIP from pancreatic cancer.
- Citation: Zhang YF, Ou GC, Wang XM. Ultrasonographic findings of extrapancreatic lesions associated with autoimmune pancreatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 705-708
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/705.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.705
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是一种自身免疫性疾病, 其超声表现作者已进行了总结[1], 单纯从胰腺的超声表现上很难与胰腺肿瘤进行鉴别. 但作为一种系统疾病, 其受累部位除胰腺外, 还可累及胆管、胆囊、肾脏、腹后壁以及涎腺等. 本文旨在通过对多器官组织的超声观察, 探讨AIP与肿瘤可能的鉴别诊断方法.
1.1 材料
回顾性分析2003-07/2011-01于我院就诊的AIP患者16例的胰外超声表现临床资料, 其中女5例, 年龄18-68岁, 平均50.20岁±19.84岁, 男11例, 年龄33-85岁, 平均59.27岁±18.12岁.
1.2 方法
AIP的诊断采用亚洲标准[2], 即: Ⅰ影像学(两条必备): (1)胰腺实质影像学: 腺体弥漫性/节段性/局灶性肿大, 有时伴有包块和/或低密度带; (2)胰胆管影像学: 弥漫性/节段性/局灶性胰管狭窄, 常伴有胆管狭窄. Ⅱ血清学(可仅具备1条): (1)血清高水平的IgG或IgG4; (2)自身抗体阳性. Ⅲ胰腺病变组织活检病理学: 淋巴浆细胞浸润伴纤维化, 有大量IgG4阳性细胞浸润. 其中影像学两条为必备条件, 血清学和组织学可仅具备其一; 当手术切除的胰腺标本组织学表现为淋巴浆细胞浸润伴纤维化时, 也可作出AIP的诊断. Ⅳ可选择标准: 对激素治疗的反应. 当患者仅满足条件Ⅰ, 且胰胆肿瘤检查指标均为阴性时, 可在胰腺专家的指导下谨慎进行激素试验性治疗. 本次研究中13例经Ⅰ+Ⅱ确诊, 2例经Ⅰ+Ⅲ确诊, 1例经Ⅰ+Ⅳ确诊.
16例患者的超声图片由超声工作站中导出, 主要观察胰管及胆管是否有扩张, 胆囊壁是否增厚, 肾脏的形态结构及血流情况, 腹后壁是否有肿大淋巴结, 腮腺、颌下腺及泪腺是否肿大, 回声是否均匀, 是否存在网状回声. 所用彩色超声仪器包括Aloka α10, Philips IU22, Philips HDI5000, Toshiba aplio80, 均为中高档彩色超声诊断仪, 图像质量各仪器间无明显差别. 腹部检查应用凸阵探头, 频率3.5-5.0 MHz, 浅表部位检查应用线阵探头, 频率7.5-13.0 MHz. 图像分析由2-3名副主任医师以上级别人员共同确认.
由于为回顾性分析, 早期对此疾病认识不足, 部分病例并未进行所有器官组织检查, 有6例未进行腮腺、颌下腺及泪腺的检查(表1).
| 受累部位 | 受检患者 | 阳性患者 |
| 单纯胰管 | 16 | 3 |
| 单纯胆管 | 16 | 5 |
| 胰胆管 | 16 | 3 |
| 胆囊 | 16 | 6 |
| 胰周淋巴结 | 16 | 3 |
| 腮腺 | 10 | 1 |
| 颌下腺 | 10 | 3 |
| 泪腺 | 10 | 7 |
当疾病累及胰管及胆管时表现为胰管、胆管的扩张, 其既可表现为单纯的胰管或胆管扩张, 也可表现为胰管与胆管同时扩张, 胆管的胰头段及胰管的胰头段无扩张, 间接反映了胰管和/或胆管狭窄的部位. 疾病累及胆囊时表现为胆囊壁增厚, 增厚较均匀, 同时伴有胆囊壁的回声减低.
16例患者的肾脏均无明显增大, 被膜光滑, 皮髓质界限清晰, 无明显回声增强或减低区, 彩色血流显示良好, 二维及彩色多普勒超声均未发现异常改变.
当疾病累及胰腺周围时表现为胰周淋巴结肿大, 肿大之淋巴结呈椭圆形, 形态规则, 由于为低频超声扫查, 淋巴结内部结构显示不清晰.
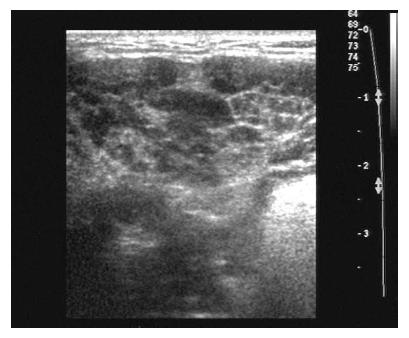
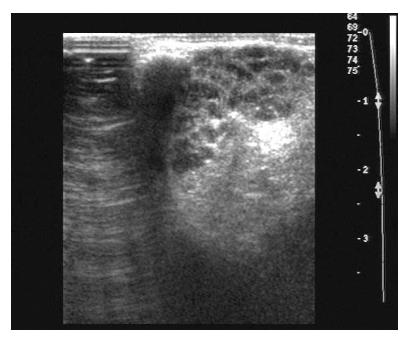
当疾病累及腮腺、颌下腺和/或泪腺时表现为腺体肿大, 回声减低不均匀, 呈网格样改变, 酷似干燥综合征超声表现(表1, 图1, 图2), 腺体均为双侧受累.
目前认为AIP不是局限于胰腺的病变, 而是全身自身免疫性病变在胰腺的表现, 20%-50%的AIP伴有其他自身免疫性疾病, 如干燥综合征、类风湿关节炎、炎症性肠病等, 还可累及胰周腹膜后、肝外胆道、胆囊、肝脏、胃黏膜、淋巴结、肾脏、肺等组织脏器[3].
AIP患者自身免疫性疾病累及胆管者约占68%-88%[4-10], 肝内外胆管均可受累, 胆总管下段为好发部位, CT表现为肝内胆管多发性狭窄, 胆总管上段狭窄或胆管壁增厚、增强, 类似于原发性硬化性胆管炎表现, 胆囊壁可增厚. 本组16例患者中11例出现胰管和/或胆管扩张, 占68.75%, 6例出现胆囊壁增厚, 占37.50%, 超声并不能对狭窄做出直接的诊断, 而只能通过胆管的扩张间接判断狭窄的存在.
AIP患者自身免疫性疾病累及肾脏约占35%[11], 实质占30%, 肾窦或肾盂壁占10%. 双侧多发, 主要累及肾皮质. CT表现分为4种类型: 圆形病灶、局限楔形病灶、小的外周皮质结节和弥漫斑片状受累. 本组16例患者均未发现肾脏结构有所改变, 这可能与二维及彩色超声的局限性有关, CT多在增强后发现这些病灶, 因而常规超声的诊断意义不大, 超声造影则有望在AIP患者自身免疫性疾病累及肾脏时有所帮助.
AIP被误诊为胰腺肿瘤的患者手术时约一半会出现腹腔淋巴结肿大[9], 但本组只有3例发现胰周淋巴结肿大. 这与淋巴结的大小, 超声的分辨率、穿透力以及腹腔气体的干扰有关, 大部分存在淋巴结肿大的患者可能都出现了漏诊.
AIP患者自身免疫性疾病累及涎腺约占12%-16%[12], 会出现类似于干燥综合征的表现. 本组受检的10例患者中仅1例腮腺出现此表现, 占10%, 3例颌下腺出现了此种表现, 占30%. 受检的10例患者中7例泪腺内出现了干燥综合征样超声表现, 占70%, 发生率较高, 这在既往的文献中少有提及, 可能对AIP与胰腺癌的鉴别诊断具有重要意义.
自身免疫性胰腺炎与胰腺肿瘤的鉴别有一定的难度[13-16], 通过对多个器官系统的观察, 作者认为AIP患者泪腺的改变的发生率高, 有可能在AIP与胰腺癌的鉴别诊断中具有重要的意义. 胆管的改变虽发生率高, 但胰腺肿瘤时也可出现, 对于AIP的鉴别诊断帮助不大. 此外, AIP作为一种全身系统疾病的胰腺局部表现, 还可累及到肺、胃肠道、关节等多个器官系统, 由于为回顾性研究, 又受到超声局限性的影响, 此次研究中未能对上述部位进行系统观察, 以后的工作还需与多个科室合作完成.
自身免疫性胰腺炎(AIP)是一种特殊类型的胰腺炎症, 是一种少见的疾病, 其概念由Yoshida于1995年首次提出, 国外报道占慢性胰腺炎患者的5%-6%. 在我国, AIP没有具体的流行病学调查报告, 仅有个案报道, 这意味着绝大多数AIP 被误诊和误治. 许多临床医生对该病的认识不足, 常误诊为胰腺癌而采取不必要的手术治疗.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
自身免疫性胰腺炎的诊断需要多方面的资料支持, 甚至单纯的穿刺活检都不能单独进行确诊, 其与胰腺癌的鉴别诊断一直是研究的重点与热点.
自身免疫性胰腺炎的诊断标准有很多, 其中主要有美国标准、日本标准、韩国标准、意大利标准以及亚洲标准, 其中亚洲标准是在2008年最新完善制定的, 也是本文所采用的标准.
干燥综合征: 英文名为Sjögren's Syndrome(SS), 以此纪念首先报道此病的Henrik Sjögren's瑞典医生. 此病是一种以侵犯涎腺(包括腮腺、颌下腺、舌下腺)、泪腺等外分泌腺为主的慢性自身免疫性疾病, 其主要表现为口干、眼干.
本文对于自身免疫性胰腺炎的胰腺外器官组织受累情况的超声表现进行了回顾性分析, 得出了一些初步结论, 出发点值得肯定.
编辑: 李军亮 电编: 闫晋利
| 2. | Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T, Kawa S, Park SW, Shimosegawa T, Lee K, Ito T. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symposium on Autoimmune Pancreatitis. J Gastroenterol. 2008;43:403-408. [PubMed] [DOI] |
| 3. | Bodily KD, Takahashi N, Fletcher JG, Fidler JL, Hough DM, Kawashima A, Chari ST. Autoimmune pancreatitis: pancreatic and extrapancreatic imaging findings. AJR Am J Roentgenol. 2009;192:431-437. [PubMed] [DOI] |
| 4. | Sahani DV, Kalva SP, Farrell J, Maher MM, Saini S, Mueller PR, Lauwers GY, Fernandez CD, Warshaw AL, Simeone JF. Autoimmune pancreatitis: imaging features. Radiology. 2004;233:345-352. [PubMed] [DOI] |
| 5. | Kamisawa T, Funata N, Hayashi Y, Eishi Y, Koike M, Tsuruta K, Okamoto A, Egawa N, Nakajima H. A new clinicopathological entity of IgG4-related autoimmune disease. J Gastroenterol. 2003;38:982-984. [PubMed] [DOI] |
| 6. | Eerens I, Vanbeckevoort D, Vansteenbergen W, Van Hoe L. Autoimmune pancreatitis associated with primary sclerosing cholangitis: MR imaging findings. Eur Radiol. 2001;11:1401-1404. [PubMed] [DOI] |
| 7. | Ichimura T, Kondo S, Ambo Y, Hirano S, Ohmi M, Okushiba S, Morikawa T, Shimizu M, Katoh H. Primary sclerosing cholangitis associated with autoimmune pancreatitis. Hepatogastroenterology. 2002;49:1221-1224. [PubMed] |
| 8. | Kamisawa T, Egawa N, Nakajima H, Tsuruta K, Okamoto A. Morphological changes after steroid therapy in autoimmune pancreatitis. Scand J Gastroenterol. 2004;39:1154-1158. [PubMed] [DOI] |
| 9. | Kamisawa T, Egawa N, Nakajima H, Tsuruta K, Okamoto A. Extrapancreatic lesions in autoimmune pancreatitis. J Clin Gastroenterol. 2005;39:904-907. [PubMed] [DOI] |
| 10. | Nishino T, Toki F, Oyama H, Oi I, Kobayashi M, Takasaki K, Shiratori K. Biliary tract involvement in autoimmune pancreatitis. Pancreas. 2005;30:76-82. [PubMed] |
| 11. | Takahashi N, Kawashima A, Fletcher JG, Chari ST. Renal involvement in patients with autoimmune pancreatitis: CT and MR imaging findings. Radiology. 2007;242:791-801. [PubMed] [DOI] |
| 12. | Kamisawa T, Tu Y, Egawa N, Sakaki N, Inokuma S, Kamata N. Salivary gland involvement in chronic pancreatitis of various etiologies. Am J Gastroenterol. 2003;98:323-326. [PubMed] [DOI] |