修回日期: 2013-06-02
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 探讨PTD-NBD多肽对体外大鼠胰腺腺泡细胞核因子-κB(nuclear factor κB, NF-κB) p65的表达影响.
方法: 分离培养大鼠胰腺腺泡细胞, 分为正常对照组、急性胰腺炎(acute pancreatitis, AP)组和PTD-NBD多肽组, 用脂多糖(10 mg/L)诱导体外细胞AP模型, 分别于建模6和12 h观察细胞形态学变化, 培养液中淀粉酶(amylase, AMY)、超氧化物歧化酶(superoxide dismutase, SOD)和白介素(interleukin, IL)-1β含量, RT-PCR和免疫印迹法检测细胞中NF-κB p65 RNA及其蛋白表达.
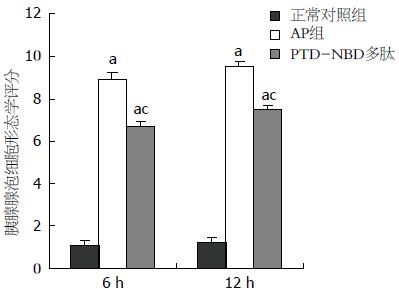
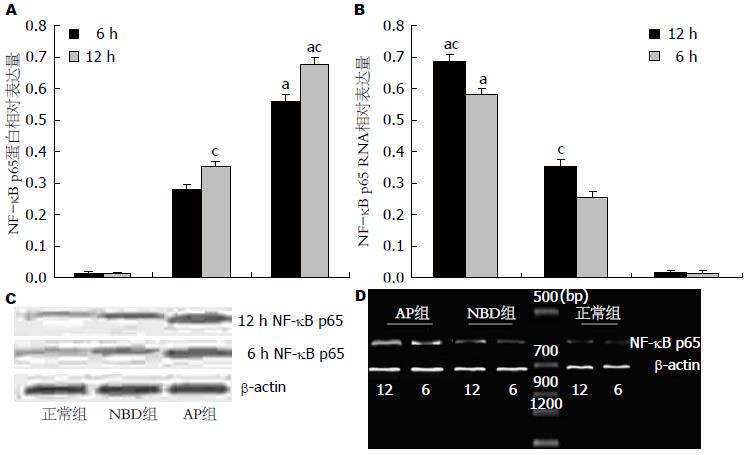
结果: 与对照组相比, AP组各时间点腺泡细胞发生肿胀和死亡增多(细胞形态学评分: 6 h: 8.90±0.34 vs 1.10±0.13; 12 h: 9.40±0.26 vs 1.20±0.15, P<0.05), 培养液中AMY升高(6 h: 2135.8±347.2 vs 873.5±91.6; 12 h: 3299.6±217.7 vs 917.7±101.9, P<0.05), IL-1β含量升高(6 h: 84.9±15.7 vs 39.3±7.9; 12 h: 95.6±17.1 vs 38.9±5.2, P<0.05), SOD含量降低(6 h: 116.3±30.3 vs 176.2±21.6; 12 h: 101.5±25.6 vs 173.6±27.9, P<0.05), 细胞中NF-κB p65 RNA及其蛋白表达量增多(P<0.05); 与AP组比较, 经PAT-NBD多肽预处理后腺泡细胞出现肿胀和死亡减少(细胞形态学评分: 6 h: 6.80±0.23 vs 8.90±0.34; 12 h: 7.50±0.19 vs 9.40±0.26, P<0.05), 培养液中SOD上升(6 h: 137.6±27.4 vs 116.3±30.3; 12 h: 144.3±23.6 vs 101.5±25.6, P<0.05), AMY下降(6 h: 1951.5±211.7 vs 2135.8±347.2; 12 h: 1761.3±231.5 vs 3299.6±217.7, P<0.05), IL-1β含量明显下降(6 h: 66.8±11.6 vs 84.9±15.7; 12 h: 54.8±21.2 vs 95.6±17.1, P<0.05), NF-κB p65蛋白表达降低(P<0.05).
结论: PTD-NBD多肽透过大鼠胰腺腺泡细胞膜抑制脂多糖刺激的NF-κB p65活化及其活性, 下调IL-1β表达, 上调SOD含量, 从而减轻胰腺腺泡细胞的炎症损伤.
核心提示: 核因子-κB(nuclear factor-κB, NF-κB)参与胰腺腺泡细胞炎症损伤是急性胰腺炎(acute pancreatitis)的早期事件, PTD-NBD多肽可有效透过大鼠胰腺腺泡细胞膜, 并与细胞中NF-κB活化通路上游IκB激酶抑制物(inhibition of IκB kinase)复合物中NBD区域结合, 减少下游炎症介质的生成和释放, 减轻胰腺腺泡细胞炎症损伤.
引文著录: 谢文瑞, 杨元生, 杨新魁, 陈垦, 陈婧华, 崔淑兰, 王晖. PTD-NBD多肽对大鼠胰腺腺泡细胞炎症损伤中NF-κB表达的影响. 世界华人消化杂志 2013; 21(22): 2136-2142
Revised: June 2, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To examine the effect of PTD-NBD polypeptide on the expression of nuclear factor κB (NF-κB) p65 in inflammatory pancreatic acinar cell injury in rats.
METHODS: Rat pancreatic acinar cells were isolated, cultured, and divided into a normal control group, an acute pancreatitis (AP) group and a PTD-NBD polypeptides group. An in vitro model of AP was induced by treating rat pancreatic acinar cells with lipopolysaccharide (10 mg/L). Cell morphological changes were observed, and the contents of amylase, superoxide dismutase (SOD) and IL-1β in culture medium were tested. Expression of NF-κB p65 mRNA and protein in cells was detected by RT-PCR and Western blot 6 and 12 h after modeling, respectively.
RESULTS: Compared to the control group, pancreatic acinar cell swelling and death were increased (6 h: 8.9 ± 0.34 vs 1.1 ± 0.13; 12 h: 9.4 ± 0.26 vs 1.2 ± 0.15, both P < 0.05), the contents of amylase (6 h: 2135.8 ± 347.2 vs 873.5 ± 91.6; 12 h: 3299.6 ± 217.7 vs 917.7 ± 101.9, both P < 0.05) and IL-1β (6 h: 84.9 ± 15.7 vs 39.3 ± 7.9; 12 h: 95.6 ± 17.1 vs 38.9 ± 5.2, both P < 0.05) were increased and the contents of SOD were decreased in culture medium (6 h: 116.3 ± 30.3 vs 176.2 ± 21.6; 12 h: 101.5 ± 25.6 vs 173.6 ± 27.9, P < 0.05), and the expression of NF-κB p65 in pancreatic acinar cells was increased (P < 0.05) in the AP group at 6 and 12 h after modeling. Compared to the AP group, pancreatic acinar cell swelling and death were lessened (6 h: 6.8 ± 0.23 vs 8.9 ± 0.34; 12 h: 7.5 ± 0.19 vs 9.4 ± 0.26, both P < 0.05), the contents of SOD were raised (6 h: 137.6 ± 27.4 vs 116.3 ± 30.3; 12 h: 144.3 ± 23.6 vs 101.5 ± 25.6, both P < 0.05) and the contents of amylase (6 h: 1951.5 ± 211.7 vs 2135.8 ± 347.2; 12 h: 1761.3 ± 231.5 vs 3299.6 ± 217.7, both P < 0.05) and IL-1β (6 h: 66.8 ± 11.6 vs 84.9 ± 15.7; 12 h: 54.8 ± 21.2 vs 95.6 ± 17.1, both P < 0.05) were decreased in culture medium, and the expression of NF-κB p65 mRNA and protein was down-regulated in the PAT-NBD polypeptide group (P < 0.05).
CONCLUSION: PTD-NBD polypeptide can inhibit LPS-induced activation of NF-κB p65, down-regulate IL-1β expression and up-regulate SOD content, thereby reducing inflammatory pancreatic acinar cell injury.
- Citation: Xie WR, Yang YS, Yang XK, Chen K, Chen JH, Cui SL, Wang H. PTD-NBD polypeptide down-regulates expression of NF-κB p65 in inflammatory pancreatic acinar cell injury in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2136-2142
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2136.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2136
急性胰腺炎(acute pancreatitis, AP)是以胰腺腺泡细胞内的胰酶被激活、并发炎症反应介导腺泡细胞损伤为特征的临床常见急腹症, 左上腹痛是其临床特征, 早期全身炎症反应综合征和晚期感染并发的多器官功能衰竭是AP主要死因[1-4]. 核因子-κB(nuclear factor κB, NF-κB)在各种炎症反应过程中均有重要作用, NF-κB被过度活化导致炎症扩大, 产生大量促炎因子并释放入血, 导致胰腺组织损伤加剧, 但最直接的细胞学证据尚未见有报道[5]. NBD多肽可与IκB激酶抑制物(inhibition of IκB kinase, IKK)NBD区域结合, 从而抑制其磷酸化, 最终抑制NF-κB活化及其介导的炎症损伤[6]. 本文基于以上理论观察PTD-NBD多肽对体外大鼠胰腺腺泡细胞炎症损伤及其NF-κB表达的影响.
激光共聚焦显微细胞仪和Image-pro PLUS6.0(Meridian In. USA), 倒置相差显微镜(Olympus, In. Japan), CO2培养箱(Biotech In. British), H-2050R-1低温超速离心机(California In. USA), 脂多糖(lipopolysaccharide, LPS)和Ⅰ型胶原酶(Sigma In. USA), Nikon Spot图像采集处理系统(Nikon & Spot In. USA), 琼脂糖(西班牙), DMEM/F12细胞培养基和小牛血清(Gibico In. USA), TRIzol kit(Invitrogen In.), RT-PCR kits、胰蛋白酶抑制剂、链霉素、青霉素、Percoll细胞分离液和山羊抗兔二抗(鼎国)、一抗NF-κB P65(兔抗大鼠、Santa cruz), 内参β-actin(兔抗大鼠、博奥森)细胞裂解液, 胰蛋白酶和IL-1β Elisa kits(威佳)、AMS和SOD kits(南京建成), PAT-NBD多肽(西安美联生物), 其余设备和试剂均为国产.
1.2.1胰腺腺泡细胞的制备与培养: SD大鼠[购自广东省医学实验动物中心, 合格证号: SCXK(粤)2008-2002]术前禁食12 h, 不禁水. 戊巴比妥钠麻醉大鼠后开腹取胰腺组织用D-Hanks液(37 ℃)洗去血液, 剃除血管、脂肪及淋巴组织, 移入细胞分离液(37 ℃, 5 mL)中, 剪碎(0.5-1.0 mm), CO2孵箱(37 ℃, 50 mL/L)中孵育30 min, 依次过100和200目尼龙筛网, D-Hanks液洗涤2-3次收集细胞悬液, 1000 r/min离心5 min, 弃去上清液, 重复洗涤2次, 利用差速黏附法(Percoll液)分离纯化胰腺腺泡细胞, 加入D-MEM/F12组织培养液(5 mL, pH 7.35-7.45), 重悬细胞后移入培养基(200 mL/L胎牛血清、100 kU/L青霉素、100 mg/L链霉素), 调整细胞密度为1×107至5×107, 置入CO2孵箱(37 ℃、50 mL/L)中培养, 每3 d换1次液, 用0.125%胰酶+0.02%EDTA消化, 以1:3-1:4传代1次[7].
1.2.2 实验分组: 实验使用第20-25代对数生长期细胞, 以1×107-2×107细胞/孔(1.8 mL)接种至6孔培养板, CO2培养箱(50 mL/L, 37 ℃)孵育6 h, 细胞贴壁后, 细胞随机分成3组: 正常对照组、AP组和PTD-NBD组. 胰腺腺泡细胞炎症(AP)模型的诱导参照文献[8]: 即向正常胰腺腺泡细胞培养孔中分别加入0.2 mL的无血清无双抗的培养基F12及100 mg/L浓度(终浓度10 mg/L)的LPS溶液, 刺激诱导胰腺腺泡细胞炎症模型(AP). PTD-NBD多肽为蛋白转导多肽PTD与NBD多肽的融合性多肽其序列参考文献设计[8]为YGRKKRRQR-RR-G-TTLDWSWLQME, 由西安美联生物合成(编号: 1311450137). PTD-NBD组腺泡细胞在被诱导AP模型之前先予PTD-NBD多肽(10 mg/L)预处理2 h后再分别加入0.2 mL的无血清无双抗的培养基F12及100 mg/L浓度(终浓度10 mg/L)的LPS溶液建模. 模型组细胞加入LPS后再与正常组一起放入CO2培养箱(50 mL/L, 37 ℃)分别孵育6和12 h后, 收集细胞和培养液上清备用, 提取细胞总蛋白, 置-20 ℃备用, 每组设3个平行孔.
1.2.3 培养液淀粉酶、SOD和IL-1β含量测定: 收集齐各组细胞培养基上清液后统一按淀粉酶(amylase, AMY)和SOD检测参照试剂盒说明书操作进行, 上清液IL-1β含量测定严格按照双抗体夹心ELASA法试剂盒说明书操作进行, 所有实验操作均重复2次.
1.2.4 胰腺腺泡细胞活力测定与形态学观察: 观察3组大鼠胰腺腺泡细胞在不同培养条件下其形态学变化及其生长情况, 具体观察细胞水肿、变形、死亡、固缩、裂解、细胞密度等方面进行评分, 每份标本分别取3个视野观察, 由两个实验员进行双盲评分取均值进行统计分析(表1).
| 细胞形态/评分标准 | 0分 | 1分 | 2分 | 3分 | 4分 |
| 细胞水肿、变形 | <1 | 1-10 | 11-25 | 26-50 | >51 |
| 细胞死亡、固缩裂解 | <1 | 1-5 | 6-10 | 11-25 | >26 |
| 细胞传代分布密度 | >51 | 26-50 | 11-25 | 6-10 | <5 |
1.2.5 RT-PCR检测NF-κB p65 RNA表达: 将细胞培养基转移至10 mL离心管中, 低温低速(4 ℃, 800 r/min)离心收集细胞(20 μL PCV = 107 cells), 将细胞转移至玻璃匀浆器中匀浆, 每20 μL PCV加入1000 μL细胞裂解液, 常温反应5 min, 离心(4 ℃, 12000 r/min)10 min后去上清液, 具体操作按TRIzol试剂盒说明书提取细胞总RNA, 紫外分光光度计测定样品A260值和A280值, 计算RNA的纯度和含量, 1%琼脂糖凝胶电泳检测总RNA完整性. 引物设计参考文献[9], NF-κB p65: 上游5'-CAAAGACCCACCTCACCG-3', 下游5'-ATCAGAAGGCCGCCGAA-3'(Gene Number: 40538869), 产物长度598 bp; β-actin: 上游5'-GCCAACCGTGAAAAGATGA-3', 下游5'-GCCAGGATAGAGCCACCAAT-3'(Gene Number: 424759362), 产物701 bp. 采用两步法进行反转录扩增目的基因, 具体操作按照RT-PCR试剂盒说明书进行, RT反应条件: 30 ℃, 10 min, 42 ℃ RT 60 min, 95 ℃(变性) 5 min, 4 ℃终止RT反应5 min, -20 ℃冰箱冻存备用或立即PCR; PCR反应条件: NF-κB p65: 94 ℃, 5 min, 94 ℃, 35 s, 56 ℃, 45 s, 72 ℃, 50 s共35个循环, 72 ℃延长10 min; β-actin: 94 ℃, 5 min, 94 ℃, 35 s, 55 ℃, 50 s, 72 ℃, 55 s共35个循环, 72 ℃延长10 min, PCR产物用1.5%琼脂糖凝胶电泳分离. Quantity 4.5.1软件分析, 结果以待测样品及其对应内参的相对值表示.
1.2.6 Western blot检测NF-κB p65蛋白表达: 将细胞培养基转移至10 mL离心管中, 低温低速(4 ℃, 800 r/min)离心收集细胞(20 μL PCV = 107 cells), 将细胞转移至玻璃匀浆器中匀浆, 每50 μL PCV加入400 μL细胞裂解液, 冰上反应10 min, 离心(4 ℃, 12000 r/min)10 min后取上清液, 具体操作按蛋白提取试剂盒说明书进行. BCA法蛋白定量并计算出样品蛋白浓度, 取40 μg蛋白为上样量, 6%浓缩胶和10%分离胶电泳分离蛋白质, 湿胶电转移凝胶蛋白至PVDF膜上, 5%脱脂奶粉液封闭PVDF膜(RT, 2 h), 一抗NF-κB p65(1:300), 孵育(RT, 2 h), TBST洗膜3次, 二抗(1:8000)孵育(RT, 1.5 h), TBST洗膜3次, ECL法发光, 暗盒曝光、显影、定影, 采用美国Nikon Spot图像采集处理系统, 用Image-pro PLUS6.0专业图像工具进行图像灰度分析, 计算平均光密度(A)值. 内参β-actin(1:500)Western blot步骤同上, 以上操作均重复2次.
统计学处理 实验数据用SPSS16.0统计软件处理分析, 计量资料分析采用t检验, 数据用mean±SD表示; 采用单因素方差分析(ANOVA), 预先进行正态性检验和方差齐性检验, 如方差齐用LSD检验, 非正态分布或方差不齐者, 以lg(X+1)进行变量代换, 检验水准α = 0.05, P<0.05表示有统计学意义.
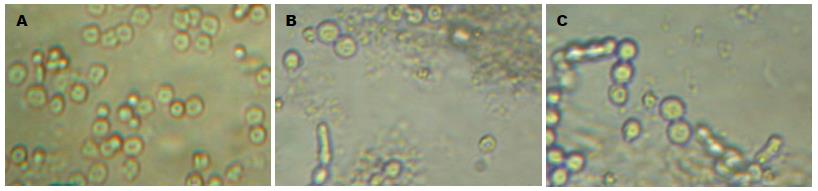
正常胰腺腺泡细胞多呈圆形或椭圆形, 悬浮生长较旺盛, 细胞密度高, 培养液中可见散在少许细胞凋亡固缩、裂解成碎片(图1A); 而AP组见多数胰腺腺泡细胞肿胀、变大, 呈球形, 可见大量细胞肿胀坏死而裂解成碎片, 部分细胞核固缩, 细胞生长传代差, 正常细胞密度低(图1B); 经PTD-NBD预处理后细胞肿胀较AP组细胞减轻, 细胞坏死裂解数量和核固缩现象减少, 细胞生长呈串珠状较AP组好, 细胞密度较AP组高(图1C), 与AP组比较有显著差异(表2, 图1, 2, P<0.05).
正常组培养液中AMY和IL-1β含量较低, 而SOD水平较高, 但在AP组和PTD-NBD多肽组各时间点培养液中AMY和IL-1β含量均明显升高, 同组12 h点的AMY水平均较6 h点高(P<0.05), 而培养液中SOD含量在AP组和PTD-NBD组均明显下降, AP组下降更显著, 与正常组比较有统计学差异(P<0.05); 胰腺腺泡细胞经PTD-NBD预处理后大鼠腺泡细胞损伤减轻, 与AP组比较, 培养液中AMY和IL-1β含量下降, 而SOD水平上升, 12 h点结果较6 h更明显(P<0.05, 表3).
正常组胰腺腺泡细胞中可见有极少量NF-κB p65 RNA和蛋白表达, 随着培养时间延长, 其表达量稍有增多, 但两个时间点间无统计学差异; AP组和PTD-NBD多肽组胰腺腺泡细胞受LPS刺激后NF-κB p65 RNA和蛋白表达水平均有不同程度上调, 而且12 h点比6 h点升高明显(P<0.05); 与AP组比较, PTD-NBD处理后胰腺腺泡细胞中NF-κB p65 RNA和蛋白表达被抑制, 二者表达量下降, 在12 h时最为明显(P<0.05, 图3).
AP是以各种胰酶被激活引起胰腺局部炎症反应为特征的炎症性疾病[10]. 炎症损伤胰腺腺泡细胞是AP的早期事件, 细胞死亡解体后释放出各种消化酶和更多炎症因子、氧化应激因子及氧自由基等, 最终使疾病恶化发展[11]. 大约10%-15%可能进展为重症急性胰腺炎(severe acute pancreatitis, SAP), 并且其中有约10%-30%可能死于SAP相关并发症, 如胰腺出血、坏死, 伴发全身炎症反应综合征和多器官功能障碍综合征[12,13]. 炎症损伤是引起其严重并发症和高死亡率的重要因素, 早期控制炎症反应是治疗的关键.
NF-κB参与众多炎症性疾病的发生发展, NF-κB参与调节众多炎症因子[肿瘤坏死因子(tumor necrosis factor α, TNF-α)、IL-1β及ICAM-1等]的基因转录、分泌[14-17]. LPS可直接作用于胰腺腺泡细胞使细胞水肿, 出现膜空泡化及胞质膜的断裂, 核改变, 腺细胞和溶酶体的破坏, 使胰腺炎相关蛋白、炎性因子和AMY表达增加, 可触发全身炎症反应和多器官功能衰竭的发生. 随着胰腺腺泡细胞炎症的加重, NF-κB被激活逐渐增多, 我们的前期实验表明LPS刺激肿瘤株胰腺腺泡细胞(AR42J)后, NF-κB被活化上调ICAM-1表达, 而ICAM-1的表达又正反馈调节继续激活NF-κB, 使炎症信号和细胞因子反应得以持续放大, 导致病情加重[9]. 我们将LPS(10 mg/L)加入培养基中诱导大鼠胰腺腺泡细胞体外AP模型, 显微镜下观察发现加入LPS 6 h后腺泡细胞出现肿胀、空泡化, 12 h时大量腺泡细胞出现肿胀, 部分出现死亡裂解, 细胞传代明显减少, 检测培养液发现AMS和IL-1β升高明显, 而SOD下降显著, 进一步检测发现腺泡细胞中NF-κB p65表达量增多, 与正常对照组比较有统计学差异, 结果提示胰腺腺泡细胞出现了严重的损伤(图1, 3, 表2, 3).
在NF-κB活化通路上游的激酶IKK复合物中存在一个氨基酸序列调节亚基即NBD区, 是ATP水解部位, 能与NBD多肽氨基酸序列相结合, 从而干扰细胞内IKK复合物的形成, 抑制IKK复合物对IκBα的磷酸化降解, 选择性负性调控NF-κB激活及其下游细胞因子(TNF-α、IL-1β、ICAM-1等)的表达[18-20]. PTD是一类能将其他生物大分子导入多种哺乳动物细胞的小分子阳离子多肽, 能够将与之共价连接的多肽、蛋白、核酸等生物大分子快速而高效地转导入细胞内部, 且对细胞无不良反应, 在药物转运及疾病治疗等领域有着广阔的应用前景[21-23]. 通过PTD介导转运一种IL-1β诱导的IκB酶(IKK)多肽抑制剂, 即IKKβ(NBD), 并完全阻断IL-1β对胰岛功能的有害作用和NF-κB的活性[24]. 导入外源性NBD多肽封闭IKK复合物NBD区, 抑制催化亚基IKKα和IKKβ的κB位点激活, 使IKK激酶的活性下降, 从而阻断炎症性疾病的发展, NBD多肽可轻度上调NF-κB的基础生理功能[25]. 我们前期的研究显示NBD多肽经PTD修饰后(PTD-NBD, 0.1 mg/L)可直接作用肿瘤株胰腺腺泡细胞(AR42J)呈疗效依赖性抑制LPS诱导的IL-1β和ICAM-1升高介导的细胞炎症损伤, 而NBD多肽突变型经PTD修饰后仍无此作用[8], 表明NBD多肽发挥抗炎作用依赖其特异的氨基酸序列, 这为AP早期细胞事件的研究及治疗药物的研发开启了新的思路. 氧自由基(oxygen free radical, OFR)促进胰腺腺泡细胞凋亡, 然而抑制OFR产生又导致ATP减少并发胰腺坏死增加[26], 大鼠SAP胰腺组织中NF-κB过度激活, OFR生成增加, NBD多肽预处理可抑制NF-κB过度活化, 减少OFR产生, 从而减轻胰腺局部炎症和氧化损伤[27-29], 抗氧化应激治疗对AP是有益的, 但目前尚无充足的临床数据可以证明[30]. 本实验结果显示NBD多肽可有效提高细胞抗氧化应激能力, 稳定细胞膜, 减轻细胞损伤. 由于AR42J为肿瘤株与正常细胞株存在差异, 本实验应用大鼠胰腺腺泡细胞, 经过PTD-NBD多肽预处理后再与LPS诱导AP模型, 结果显示培养液中AMS、IL-1β含量下降, SOD含量升高, 细胞中NF-κB p65蛋白表达减少, 细胞的炎症和氧化损伤减轻, 细胞肿胀和坏死数量减少, 细胞传代成活率较AP组好, 与AP组比较有统计学差异.
总之, 预先给予PTD-NBD多肽干预可有效透过大鼠胰腺腺泡细胞膜, 并与细胞中NF-κB活化通路上游IKK复合物中NBD区域结合, 从而抑制IκBα的磷酸化及NF-κB的活化, 减少下游炎症介质IL-1β的生成和释放, 从而减轻细胞炎症损伤, 降低SOD的消耗和减少AMS的释放, 最终缩短病程和减少并发症, 然而PTD-NBD多肽对AP事后效应及其远期疗效尚需进一步实验研究.
急性胰腺炎(acute pancreatitis, AP)为临床常见的急腹症, 起病急、病情重、病死率较高, 且其发病机制目前尚未完全阐明, 对AP的早期事件认识不够深入, 诱导体外AP模型是研究的关键点. 目前科研使用较多的胰腺腺泡细胞株为ARJ45细胞, 与正常胰腺腺泡细胞存在一定差异, 脂多糖和鱼蛙肽可用于诱导体外AP模型, 体外胰腺腺泡细胞的获得是研究的关键. 研究体外AP模型并予药物干预可为疾病的防治研究提供新的视窗.
谭晓冬, 教授, 中国医科大学附属盛京医院
AP的研究多使用动物模型, 体外研究较少, 体外AP模型的建立依赖于胰腺腺泡细胞的成功分离培养, 而胰腺腺泡细胞与间质和胰岛细胞紧密相连, 分离提取胰腺腺泡细胞的方法有很多种, 但腺泡细胞易自身消化, 应用脂多糖诱导胰腺腺泡细胞体外AP模型存在一定难度.
已有研究表明NBD多肽的氨基酸序列可有效结合到NF-κB上游IKK复合物的NBD区域, 抑制IκBa的磷酸化及被降解, 从而阻止了NF-κB的活化及其通路的激活, 减少下游炎症介质的产生和释放, 最终减轻了细胞的炎症损伤, 减少AP并发症和改善预后.
本文应用脂多糖诱导体外分离培养的大鼠胰腺腺泡细胞AP模型进行AP早期事件研究具有一定的创新性; 构建体外AP模型对AP治疗药物的研发有重要意义.
本文成功建立体外AP模型对研究AP发病机制有重要作用, 应用PDT-NBD多肽透过细胞膜选择性抑制IκB的磷酸化从而为抑制NF-κB的活化, 减轻炎症反应和减少细胞损伤具有一定的现实意义, 为临床治疗AP药物的研发提供了思路.
编辑:田滢 电编:闫晋利
| 1. | Boone B, Zureikat A, Hughes SJ, Moser AJ, Yadav D, Zeh HJ, Lee KK. Abdominal compartment syndrome is an early, lethal complication of acute pancreatitis. Am Surg. 2013;79:601-607. [PubMed] |
| 2. | Bollen TL, Singh VK, Maurer R, Repas K, van Es HW, Banks PA, Mortele KJ. A comparative evaluation of radiologic and clinical scoring systems in the early prediction of severity in acute pancreatitis. Am J Gastroenterol. 2012;107:612-619. [PubMed] [DOI] |
| 3. | Arabul M, Celik M, Aslan O, Torun S, Beyazit Y, Alper E, Kandemir A, Dcnsal B. Hepcidin as a predictor of disease severity in acute pancreatitis: a single center prospective study. Hepatogastroenterology. 2013;60:595-600. [PubMed] |
| 4. | Pavlidis P, Crichton S, Lemmich Smith J, Morrison D, Atkinson S, Wyncoll D, Ostermann M. Improved outcome of severe acute pancreatitis in the intensive care unit. Crit Care Res Pract. 2013;2013:897107. [PubMed] [DOI] |
| 5. | Rakonczay Z, Hegyi P, Takács T, McCarroll J, Saluja AK. The role of NF-kappaB activation in the pathogenesis of acute pancreatitis. Gut. 2008;57:259-267. [PubMed] [DOI] |
| 6. | Long YM, Chen K, Liu XJ, Xie WR, Wang H. Cell-permeable Tat-NBD peptide attenuates rat pancreatitis and acinus cell inflammation response. World J Gastroenterol. 2009;15:561-569. [PubMed] [DOI] |
| 10. | Ma B, Wu L, Lu M, Gao B, Qiao X, Sun B, Xue D, Zhang W. Differentially expressed kinase genes associated with trypsinogen activation in rat pancreatic acinar cells treated with taurolithocholic acid 3-sulfate. Mol Med Rep. 2013;7:1591-1596. [PubMed] [DOI] |
| 11. | Yenicerioglu A, Cetinkaya Z, Girgin M, Ustundag B, Ozercan IH, Ayten R, Kanat BH. Effects of trimetazidine in acute pancreatitis induced by L-arginine. Can J Surg. 2013;56:175-179. [PubMed] [DOI] |
| 12. | Vaz J, Akbarshahi H, Andersson R. Controversial role of toll-like receptors in acute pancreatitis. World J Gastroenterol. 2013;19:616-630. [PubMed] [DOI] |
| 13. | Zhao G, Zhang JG, Wu HS, Tao J, Qin Q, Deng SC, Liu Y, Liu L, Wang B, Tian K. Effects of different resuscitation fluid on severe acute pancreatitis. World J Gastroenterol. 2013;19:2044-2052. [PubMed] [DOI] |
| 14. | Wen CL, Chang CC, Huang SS, Kuo CL, Hsu SL, Deng JS, Huang GJ. Anti-inflammatory effects of methanol extract of Antrodia cinnamomea mycelia both in vitro and in vivo. J Ethnopharmacol. 2011;137:575-584. [PubMed] [DOI] |
| 15. | Santos SH, Andrade JM, Fernandes LR, Sinisterra RD, Sousa FB, Feltenberger JD, Alvarez-Leite JI, Santos RA. Oral Angiotensin-(1-7) prevented obesity and hepatic inflammation by inhibition of resistin/TLR4/MAPK/NF-κB in rats fed with high-fat diet. Peptides. 2013;46C:47-52. [PubMed] [DOI] |
| 16. | Wullaert A, Bonnet MC, Pasparakis M. NF-κB in the regulation of epithelial homeostasis and inflammation. Cell Res. 2011;21:146-158. [PubMed] [DOI] |
| 17. | Tieri P, Termanini A, Bellavista E, Salvioli S, Capri M, Franceschi C. Charting the NF-κB pathway interactome map. PLoS One. 2012;7:e32678. [PubMed] [DOI] |
| 18. | Baima ET, Guzova JA, Mathialagan S, Nagiec EE, Hardy MM, Song LR, Bonar SL, Weinberg RA, Selness SR, Woodard SS. Novel insights into the cellular mechanisms of the anti-inflammatory effects of NF-kappaB essential modulator binding domain peptides. J Biol Chem. 2010;285:13498-13506. [PubMed] [DOI] |
| 19. | Madge LA, May MJ. Inhibiting proinflammatory NF-kappaB signaling using cell-penetrating NEMO binding domain peptides. Methods Mol Biol. 2009;512:209-232. [PubMed] [DOI] |
| 20. | Desai A, Singh N, Raghubir R. Neuroprotective potential of the NF-κB inhibitor peptide IKK-NBD in cerebral ischemia-reperfusion injury. Neurochem Int. 2010;57:876-883. [PubMed] [DOI] |
| 21. | Trabulo S, Cardoso AL, Cardoso AM, Morais CM, Jurado AS, Pedroso de Lima MC. Cell-penetrating peptides as nucleic acid delivery systems: from biophysics to biological applications. Curr Pharm Des. 2013;19:2895-2923. [PubMed] [DOI] |
| 22. | Nasrollahi SA, Taghibiglou C, Azizi E, Farboud ES. Cell-penetrating peptides as a novel transdermal drug delivery system. Chem Biol Drug Des. 2012;80:639-646. [PubMed] [DOI] |
| 24. | Rehman KK, Bertera S, Bottino R, Balamurugan AN, Mai JC, Mi Z, Trucco M, Robbins PD. Protection of islets by in situ peptide-mediated transduction of the Ikappa B kinase inhibitor Nemo-binding domain peptide. J Biol Chem. 2003;278:9862-9868. [PubMed] [DOI] |
| 25. | Solt LA, Madge LA, May MJ. NEMO-binding domains of both IKKalpha and IKKbeta regulate IkappaB kinase complex assembly and classical NF-kappaB activation. J Biol Chem. 2009;284:27596-27608. [PubMed] [DOI] |
| 26. | Booth DM, Murphy JA, Mukherjee R, Awais M, Neoptolemos JP, Gerasimenko OV, Tepikin AV, Petersen OH, Sutton R, Criddle DN. Reactive oxygen species induced by bile acid induce apoptosis and protect against necrosis in pancreatic acinar cells. Gastroenterology. 2011;140:2116-2125. [PubMed] [DOI] |
| 27. | 谢 文瑞, 陈 垦, 阳 小雅, 龙 友明, 王 晖, 刘 君君, 杨 剑. 核因子-κB在急性胰腺炎中的激活及NBD多肽的干预作用. 世界华人消化杂志. 2008;18:1980-1984. [DOI] |
| 28. | Giakoustidis A, Mudan SS, Giakoustidis D. Dissecting the stress activating signaling pathways in acute pancreatitis. Hepatogastroenterology. 2010;57:653-656. [PubMed] |
| 29. | Hackert T, Werner J. Antioxidant therapy in acute pancreatitis: experimental and clinical evidence. Antioxid Redox Signal. 2011;15:2767-2777. [PubMed] [DOI] |
| 30. | Esrefoglu M. Experimental and clinical evidence of antioxidant therapy in acute pancreatitis. World J Gastroenterol. 2012;18:5533-5541. [PubMed] [DOI] |