修回日期: 2013-06-27
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 研究血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体2(kinase insert domain-containing receptor, KDR)在疣状胃炎(verrucose gastritis, VG)与胃癌中的表达的关系.
方法: 用免疫组织化学方法检测30例慢性浅表性胃炎、80例VG和30例胃癌组织中VEGF和KDR的表达; 通过13C呼气试验判断所有入组患者有无幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染.
结果: VG、胃癌患者的H. pylori感染率显著高于慢性浅表性胃炎患者(χ2 = 26.4, 29.697; P<0.01), 而两者之间比较差异无统计学意义(χ2 = 2.229, P>0.05). VG和胃癌组织中VEGF和KDR的表达与慢性浅表性胃炎组比较差异有统计学意义(χ2 = 20.008, 29.697; 15.428, 24.300, P<0.01); VEGF和KDR在疣状胃炎及胃癌组织中的表达差异无统计学(χ2 = 3.461, 3.793; P>0.05); 成熟型的疣状胃炎组织中VEGF和KDR的表达与非成熟型的疣状胃炎比较差异有统计学意义(χ2 = 6.084, 10.026; P<0.05), 而与胃癌组织比较差异无统计学意义(χ2 = 0.728, 0.080; P>0.05); H. pylori+的疣状胃炎组织中VEGF和KDR的表达与H. pylori-的疣状胃炎组比较差异有统计学意义(χ2 = 5.637, 5.398; P<0.05), 而与胃癌组织比较差异无统计学意义(χ2 = 0.839, 1.006; P>0.05).
结论: H. pylori参与了VG的形成过程. VEGF和KDR在疣状胃炎中的表达与在胃癌中的表达相似, 提示VG与胃癌之间可能存在相关性, VEGF和KDR可能参与了疣状胃炎癌变的过程. VEGF和KDR在成熟型和H. pylori+的疣状胃炎中的高表达提示成熟型的VG和H. pylori感染可能存在增加VG癌变的风险.
核心提示: 疣状胃炎(verrucose gastritis, VG)是胃癌的癌前病变之一, 具有癌变的潜能. 成熟型的VG更易癌变. 幽门螺旋杆菌(Helicobacter pylori)感染是形成疣状胃炎的重要因素之一, 并且可能是诱发其癌变的诱因之一. 血管内皮生长因子(vascular endothelial growth factor)和血管内皮生长因子受体2(kinase insert domain-containing receptor)的异常表达, 新生血管的异常增生可能是其癌变的分子机制之一.
引文著录: 陈洁, 朱海杭, 徐永居, 顾湘, 朱萍. 血管内皮生长因子及其受体KDR在疣状胃炎及胃癌组织中的表达及意义. 世界华人消化杂志 2013; 21(21): 2031-2037
Revised: June 27, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To investigate the relationship between verrucose gastritis and gastric cancer.
METHODS: The expression of vascular endothelial growth factor (VEGF) and kinase insert domain-containing receptor (KDR) in chronic superficial gastritis, verrucose gastritis and gastric cancer was detected by immunohistochemistry. Helicobacter pylori (H. pylori) infection was detected by the 13C breath test.
RESULTS: The rates of H. pylori infection in patients with verrucose gastritis and gastric cancer were both higher than that in patients with chronic superficial gastritis (χ2 = 26.4, 29.697, both P < 0.01), but there was no significant difference in the rate of H. pylori infection between patients with verrucose gastritis and those with gastric cancer (χ2 = 2.229, P > 0.05). The positive rates of VEGF and KDR expression in verrucose gastritis and gastric cancer were significantly higher than those in chronic superficial gastritis (χ2 = 20.008, 29.697; 15.428, 24.300, all P < 0.01), but there were no significant differences in the positive rates of VEGF and KDR expression between verrucose gastritis and gastric cancer (χ2 = 3.461, 3.793, both P > 0.05). The positive rates of VEGF and KDR expression in mature verrucose gastritis were significantly higher than those in non-mature verrucose gastritis (χ2 = 6.084, 10.026, both P < 0.05), but there were no significant differences between matured verrucose gastritis and gastric cancer (χ2 = 0.728, 0.080, both P > 0.05). The positive rates of VEGF and KDR expression were significantly higher in verrucose gastritis patients with H. pylori infection than in those without H. pylori infection (χ2 = 5.637, 5.398, both P < 0.05), but there were no significant differences between verrucose gastritis patients with H. pylori infection and patients with gastric cancer (χ2 = 0.839, 1.006, both P > 0.05).
CONCLUSION: H. pylori infection is involved in the formation of verrucous gastritis. Expression of VEGF and KDR in verrucose gastritis is similar to that in gastric cancer, suggesting that both VEGF and KDR may be involved in the evolution of verrucose gastritis to gastric cancer. The observation that expression of VEGF and KDR in mature verrucose gastritis and patients with H. pylori infection was higher may imply that mature verrucose gastritis and H. pylori infection increase the risk of malignant transformation of verrucose gastritis.
- Citation: Chen J, Zhu HH, Xu YJ, Gu X, Zhu P. Expression of vascular endothelial growth factor and its receptor KDR in verrucose gastritis and gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2031-2037
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2031.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2031
疣状胃炎(verrucose gastritis, VG)又称痘疹状胃炎(varioliform gastritis)、慢性糜烂性胃炎(chronic erosive gastritis), 是胃炎的一种特殊类型, 内镜下分为成熟型和未成熟型两型. 尽管在第十届世界胃肠病大会上, VG已被列为具有高度癌变倾向的疾病之一[1], 但临床上确切观察到疣状胃炎转化为胃癌的病例相对较少, 缺乏相关基因改变的基础研究证据, 其癌变的诱因及分子机制尚不明确, 未能引起广大临床医师的重视. 本实验通过研究血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体2(kinase insert domain-containing receptor, KDR)在疣状胃炎和胃癌组织中的表达, 探讨疣状胃炎和胃癌的关系.
选取2012-01/2012-03我院内镜中心收集的慢性浅表性胃炎标本30例, 成熟型和未成熟型疣状胃炎标本各40例, 胃癌组织标本30例. 所有病例均为首次发现, 未经过质子泵抑制剂及抗幽门螺旋杆菌(Helicobacter pylori, H. pylori)治疗. 主要试剂为即用型血管内皮生长因子兔抗人多克隆抗体, 购自福建迈新生物技术开发有限公司; KDR兔抗人多克隆抗体, 购自武汉博士德生物工程有限公司; 即用型快速免疫组织化学MaxVisionTM试剂盒(兔)和DAB显色试剂盒均购自福建迈新生物技术开发有限公司.
1.2.1 实验: 所有入组患者行13C呼气试验, 所有标本均经过4%甲醛固定, 石蜡包埋, 4 μm厚连续切片, 免疫组织化学法采用EliVision法. 操作步骤严格按照试剂盒说明书进行. DAB显色, 苏木精复染, PBS代替一抗做阴性对照.
1.2.2 结果判定: (1)H. pylori的诊断, 通常以30 min时样品中所测13C-CO2的δ‰减去零时的呼气样品的δ‰值的差表示, 即检测值 = δ‰(30 min)-δ‰(0 min). 阳性判断值≥4.0±0.4时, 可判定受试者为H. pylori+; (2)VEGF和KDR均表达于均表达于血管内皮细胞和腺上皮细胞的胞浆中和细胞膜上. 免疫组织化学染色结果判定采用Remmele和Stegner提出的免疫反应积分(immune response scores, IRS)打分法, 是染色强度(staining intensity, SI)和阳性细胞百分比(percentage of positive cells, PP)的乘积, 即IRS = SI×PP. SI可分为4级, 即0级为未见阳性细胞, 1级为弱阳性, 2级为中等阳性, 3级为强阳性. PP可分为5级, 即0级为阴性, 1级≤10%, 2级11%-50%; 3级51%-80%, 4级>80%. 当SI与PP的乘积>3分才算免疫反应(+)[2].
统计学处理 采用一般描述性统计分析、χ2检验、Spearman等级相关性分析. 数据库构建及数据分析均在SPSS17.0统计软件包上实现, 检验标准为P<0.05有统计学意义.
慢性浅表性胃炎、疣状胃炎、胃癌患者H. pylori感染率分别为10%、65%、80%, 比例依次增高. 疣状胃炎患者的H. pylori感染率与慢性浅表性胃炎患者比较有显著差异(P<0.01), 与胃癌患者相比无明显差异(P>0.05)(表1).
疣状胃炎组及胃癌组VEGF和KDR的表达阳性率与慢性浅表性胃炎组比较差异有统计学意义(P<0.01); 疣状胃炎组和胃癌组VEGF和KDR的表达阳性率比较差异无统计学意义(P>0.05)(表2).
未成熟型疣状胃炎中VEGF和KDR的表达阳性率与成熟型疣状胃炎及胃癌组比较差异有统计学意义(P<0.05), 而成熟型疣状胃炎中VEGF和KDR的表达阳性率与胃癌组比较差异无统计学意义(P>0.05), 未成熟型疣状胃炎中VEGF和KDR的表达阳性率与胃癌组比较差异有统计学意义(P<0.05)(表3).
H. pylori-疣状胃炎中VEGF和KDR的表达阳性率与H. pylori+疣状胃炎及胃癌组比较差异有统计学意义(P<0.05), 而H. pylori+疣状胃炎中VEGF和KDR的表达阳性率与胃癌组比较差异无统计学意义(P>0.05), H. pylori-疣状胃炎中VEGF和KDR的表达阳性率与胃癌组比较差异有统计学意义(P<0.05). 疣状胃炎中H. pylori的感染与VEGF的表达呈正相关(r = 0.265, P<0.05), 与KDR的表达呈正相关(r = 0.26, P<0.05)(表3).
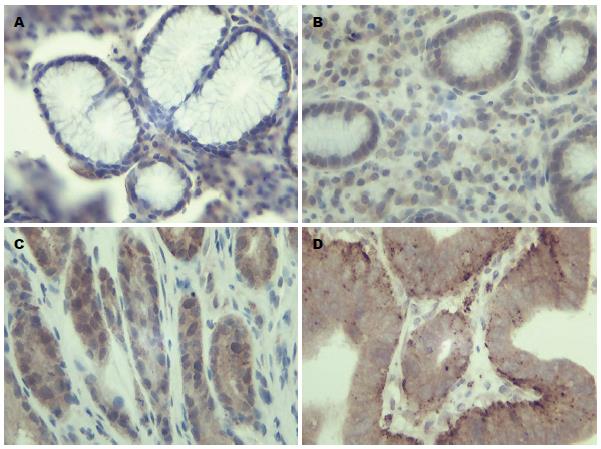
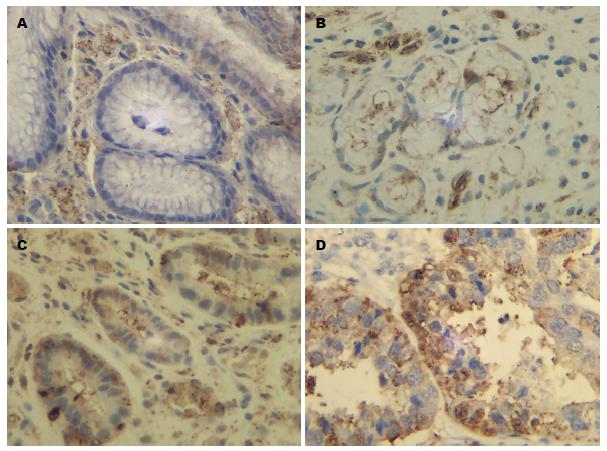
VEGF和KDR主要表达于腺上皮细胞及血管内皮细胞的胞浆及细胞膜中. VEGF分别在慢性浅表性胃炎、未成熟型疣状胃炎、成熟型疣状胃炎、胃癌中的表达阳性率依次为: 6.7%、40%、67.5%、73.3%, 比例依次增高(图1); KDR分别在慢性浅表性胃炎、未成熟型疣状胃炎、成熟型疣状胃炎、胃癌中的表达阳性率依次为: 3.33%、42.5%、60%、63.3%, 比例依次增高(图2).
胃癌的形成和发展是多病因、多基因作用的共同结果, 过程复杂, 至今未能完全明了. 早在1994年世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)已经将H. pylori感染作为胃癌的Ⅰ类致病因子, 很多研究已经证明其H. pylori感染与胃癌的发生密切相关[3-7]. 随着对疣状胃炎关注的增加, 陆续出现针对VG和H. pylori关系的报道. 如周殿元等[8]报道VG患者的H. pylori感染率为51.7%-92.5%, 说明疣状胃炎多数伴有H. pylori感染. 白歌等[9]观察到大部分病例经抗H. pylori治疗, 临床症状消失, 说明疣状胃炎治疗效果与清除H. pylori呈正相关, 同时也进一步支持H. pylori与疣状胃炎关系密切的观点. 并且李庭赞等[10]提出疣状胃炎尤其是成熟型疣状胃炎的胃黏膜肠上皮化生的发生率及上皮内瘤变的发生率高于对照组, 说明疣状胃炎有癌变倾向.
基于以上基础, 本研究观察到疣状胃炎的H. pylori感染率为65%, 较慢性浅表性胃炎H. pylori感染显著升高, 提示与慢性浅表性胃炎相比, H. pylori感染在疣状胃炎的形成过程中起重要作用, 是其发病的一个重要致病因素. 其机制可能是H. pylori在胃内定植后, 由于其具有螺旋状的体形以及多根鞭毛产生动力, 穿过胃表面黏液屏障, 定居在胃黏膜上皮细胞的表面, 通过释放一些致病因子, 使胃黏膜发生损伤、充血、水肿、局部隆起增生、点状坏死、片状糜烂等病理改变, 亦可能使胃黏膜对H. pylori产生免疫反应进一步引起糜烂处的黏膜腺管及腺体数增加和腺颈部延长, 从而形成周边隆起中央脐样糜烂坏死凹陷的疣状物. 但其确切的机制有待进一步研究. 与胃癌的H. pylori感染率比较无显著差异性, 得出两点推论: (1)是否能够因此推断疣状胃炎具有癌变的潜能, 是癌前的一种病理形态; (2)除了H. pylori感染, 尚有其他未知因素促使疣状胃炎进展为胃癌.
但作为实体瘤, 与肿瘤的血管生成关系密切是毋庸置疑的[11]. VEGF是目前公认的最强力、最能够直接刺激血管内皮细胞产生增殖效应及促进新生血管生成的因子[12]. 其生物学效应的实现主要通过与其受体KDR结合后产生[13]. 二者结合后通过一系列的调节机制, 启动新生血管的生成, 促使血管内皮细胞大量增殖, 诱导新生血管的形成, 并且增加血管通透性, 导致肿瘤细胞逐渐生长、渗出及扩散转移[14,15].
VEGF又称血管通透因子, 他是内皮细胞具有显著特异性的有丝分裂源, 也是一种有效的促进新生血管形成和通透性增加的诱导因子. 与受体结合后, 可增加细胞内Ca2+浓度, 通过磷酸肌醇特异性的磷脂酶C途径, 使细胞内的IP3水平增高从而传导细胞内信号, 进而改变细胞形态、促进细胞进行有丝分裂、进一步构建迁移新生血管[16]. 还能增强血浆酶原活化因子的生物学活性, 从而使血浆酶原活化因子以及血浆酶原活化因子抑制因子的水平发生增长, 通过这两个因子的活化, 诱导基质胶原酶、蛋白水解酶和组织因子在血管内皮细胞中充分表达, 从而逐步出现细胞外基质降解, 内皮细胞发生迁移和浸润, 新生血管逐渐形成[17]. KDR是VEGF发挥其促血管生成作用的高亲和力的特异性膜受体, 具有明显的趋化性和促分裂活性. KDR主要分布在血管内皮细胞上, 起着趋化细胞分裂、诱导内皮细胞增殖和迁移的作用. 并能通过阻止内皮细胞的凋亡, 维持内皮细胞的存活. VEGF/KDR对肿瘤新生血管的生成影响极为重要, 大量研究均证实这一观点[18-23]. 其在胃癌组织中的表达也得到了较多关注[24-27], 认为VEGF及其受体KDR的异常表达在促使胃癌的形成、浸润和扩散转移的过程中起重要作用. 国外研究[28,29]甚至提出VEGF不仅能促进肿瘤的新生血管形成, 还能通过旁分泌和胃癌细胞自分泌两种途径来实现促进胃癌的形成和转移的作用. 另外Boocock等[16]还发现VEGF可以通过激活肿瘤细胞上的KDR受体, 直接促进肿瘤的生长. 高岩等[30]研究发现KDR在维持癌细胞生长过程中发挥重要作用.
本研究显示: VEGF和KDR在慢性浅表性胃炎、未成熟型疣状胃炎、成熟型疣状胃炎、胃癌中的表达阳性率比例依次增高. VEGF和KDR在慢性浅表性胃炎中已有表达, 在疣状胃炎和胃癌中表达呈现递增趋势, 说明在胃癌形成之前, 已有新生血管的形成, 随着新生血管的增加, 细胞癌变的几率越高, 癌变与血管形成有显著关系. 因此血管生成可以作为判断疣状胃炎发生发展及癌变的重要因素之一. VEGF和KDR在疣状胃炎及胃癌组织中的阳性表达率差异无统计学意义(P>0.05), 但与慢性浅表性胃炎比较差异有统计学意义(P<0.01). 表明疣状胃炎中已经有VEGF和KDR的高表达, 具有发展为胃癌的可能. 本实验还发现: VEGF及KDR在成熟型疣状胃炎中阳性表达率显著高于未成熟型疣状胃炎(P<0.05), 而与胃癌比较差异无统计学意义(P>0.05). 同时, 其在伴随H. pylori感染的疣状胃炎中阳性表达率显著高于无H. pylori感染的疣状胃炎(P<0.05), 而与胃癌比较差异无统计学意义(P>0.05). 提示成熟型疣状胃炎及伴随H. pylori感染的疣状胃炎可能更易转化为胃癌. H. pylori感染可能为疣状胃炎转变为胃癌的诱发因素. 研究结果还表明, H. pylori的感染与VEGF及KDR表达呈明显正相关(r = 0.265, 0.26, P<0.05), 说明在疣状胃炎的癌变过程中, 血管生成与H. pylori感染起协同作用, 共同促进疣状胃炎的发生发展及癌变, 其具体机制有待进一步研究.
总之, 通过本实验, 可以认为疣状胃炎是胃癌的癌前病变, 具有癌变的潜能. 而成熟型及H. pylori的疣状胃炎可能更易转化为胃癌. H. pylori感染可能是疣状胃炎癌变的诱因之一. VEGF和KDR的高表达可能是其分子机制之一. 故而在针对疣状胃炎的治疗时需要加强抗H. pylori治疗的意识, 加强动态内镜随访观察.
疣状胃炎(verrucose gastritis, VG)是临床上较为常见的一种特殊类型的慢性胃炎, 尽管在第十届世界胃肠病大会上, VG已被列为具有高度癌变倾向的疾病之一, 但临床上确切观察到疣状胃炎转化为胃癌的病例相对较少, 仅见个案报道, 缺乏大规模的动态随访观察, 缺乏相关基因改变的基础研究证据, 其癌变诱因及分子机制尚不明确.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科
目前针对VG的研究和报道主要局限在临床治疗方面, 尽管已经有临床报道观察到其癌变的过程, 但由于缺乏大规模的随访观察及分子生物学的基础研究支持, 对于其癌变的可能并没有引起广大临床医师的重视.
本实验通过研究幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染以及VEGF和KDR在VG和胃癌组织中的表达, 对照慢性浅表性胃炎比较, 探讨VG、胃癌之间的关系及其可能存在的癌变的分子机制, 为将来VG的研究提供方向, 为VG及胃癌的预防与治疗提供更多的依据.
本文旨在加强临床医生对疣状胃炎治疗时抗H. pylori治疗的意识, 加强动态内镜随访观察.
本文对内镜工作者及临床医生针对VG的治疗有较好的借鉴意义.
编辑:田滢 电编:鲁亚静
| 2. | Friedrichs K, Gluba S, Eidtmann H, Jonat W. Overexpression of p53 and prognosis in breast cancer. Cancer. 1993;72:3641-3647. [PubMed] [DOI] |
| 3. | Conteduca V, Sansonno D, Lauletta G, Russi S, Ingravallo G, Dammacco F. H. pylori infection and gastric cancer: state of the art (review). Int J Oncol. 2013;42:5-18. [PubMed] [DOI] |
| 4. | Pimentel-Nunes P, Gonçalves N, Boal-Carvalho I, Afonso L, Lopes P, Roncon-Albuquerque R, Henrique R, Moreira-Dias L, Leite-Moreira AF, Dinis-Ribeiro M. Helicobacter pylori induces increased expression of Toll-like receptors and decreased Toll-interacting protein in gastric mucosa that persists throughout gastric carcinogenesis. Helicobacter. 2013;18:22-32. [PubMed] [DOI] |
| 5. | Uehara T, Ma D, Yao Y, Lynch JP, Morales K, Ziober A, Feldman M, Ota H, Sepulveda AR. H. pylori infection is associated with DNA damage of Lgr5-positive epithelial stem cells in the stomach of patients with gastric cancer. Dig Dis Sci. 2013;58:140-149. [PubMed] [DOI] |
| 6. | Huang LM, Cheng Y, Yu DK, Zhai K, Tan W, Lin DX. [Association between HLA-DQA1 gene copy number polymorphisms and susceptibility to gastric cancer]. Zhonghua Zhongliu Zazhi. 2012;34:269-271. [PubMed] |
| 7. | Ly SY, Yoo SD, Chun SK. Detection of Helicobacter pylori DNA in preliminary stage gastric cancer cells. Pathology. 2012;44:251-254. [PubMed] [DOI] |
| 11. | Gunningham SP, Currie MJ, Han C, Robinson BA, Scott PA, Harris AL, Fox SB. The short form of the alternatively spliced flt-4 but not its ligand vascular endothelial growth factor C is related to lymph node metastasis in human breast cancers. Clin Cancer Res. 2000;6:4278-4286. [PubMed] |
| 12. | Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature. 2000;407:249-257. [PubMed] [DOI] |
| 13. | Zolota V, Tsamandas AC, Aroukatos P, Panagiotopoulos V, Maraziotis T, Poulos C, Scopa CD. Expression of cell cycle inhibitors p21, p27, p14 and p16 in gliomas. Correlation with classic prognostic factors and patients' outcome. Neuropathology. 2008;28:35-42. [PubMed] [DOI] |
| 14. | Du JR, Jiang Y, Zhang YM, Fu H. Vascular endothelial growth factor and microvascular density in esophageal and gastric carcinomas. World J Gastroenterol. 2003;9:1604-1606. [PubMed] |
| 15. | Ren J, Dong L, Xu CB, Pan BR. The role of KDR in the interactions between human gastric carcinoma cell and vascular endothelial cell. World J Gastroenterol. 2002;8:596-601. [PubMed] |
| 16. | Boocock CA, Charnock-Jones DS, Sharkey AM, McLaren J, Barker PJ, Wright KA, Twentyman PR, Smith SK. Expression of vascular endothelial growth factor and its receptors flt and KDR in ovarian carcinoma. J Natl Cancer Inst. 1995;87:506-516. [PubMed] [DOI] |
| 17. | Iruela-Arispe ML, Dvorak HF. Angiogenesis: a dynamic balance of stimulators and inhibitors. Thromb Haemost. 1997;78:672-677. [PubMed] |
| 18. | Hayashibara T, Yamada Y, Miyanishi T, Mori H, Joh T, Maeda T, Mori N, Maita T, Kamihira S, Tomonaga M. Vascular endothelial growth factor and cellular chemotaxis: a possible autocrine pathway in adult T-cell leukemia cell invasion. Clin Cancer Res. 2001;7:2719-2726. [PubMed] |
| 19. | von Marschall Z, Cramer T, Höcker M, Burde R, Plath T, Schirner M, Heidenreich R, Breier G, Riecken EO, Wiedenmann B. De novo expression of vascular endothelial growth factor in human pancreatic cancer: evidence for an autocrine mitogenic loop. Gastroenterology. 2000;119:1358-1372. [PubMed] [DOI] |
| 20. | de Jong JS, van Diest PJ, van der Valk P, Baak JP. Expression of growth factors, growth inhibiting factors, and their receptors in invasive breast cancer. I: An inventory in search of autocrine and paracrine loops. J Pathol. 1998;184:44-52. [PubMed] [DOI] |
| 21. | Meister B, Grünebach F, Bautz F, Brugger W, Fink FM, Kanz L, Möhle R. Expression of vascular endothelial growth factor (VEGF) and its receptors in human neuroblastoma. Eur J Cancer. 1999;35:445-449. [PubMed] [DOI] |
| 22. | Masood R, Cai J, Zheng T, Smith DL, Hinton DR, Gill PS. Vascular endothelial growth factor (VEGF) is an autocrine growth factor for VEGF receptor-positive human tumors. Blood. 2001;98:1904-1913. [PubMed] [DOI] |
| 23. | Takahama M, Tsutsumi M, Tsujiuchi T, Kido A, Sakitani H, Iki K, Taniguchi S, Kitamura S, Konishi Y. Expression of vascular endothelial growth factor and its receptors during lung carcinogenesis by N-nitrosobis(2-hydroxypropyl)amine in rats. Mol Carcinog. 1999;24:287-293. [PubMed] [DOI] |
| 26. | Ding S, Lin S, Dong X, Yang X, Qu H, Huang S, Liu W, Zhou L, Liu D. Potential prognostic value of circulating levels of vascular endothelial growth factor-A in patients with gastric cancer. In Vivo. 2005;19:793-795. [PubMed] |
| 27. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] |
| 28. | Liu DP, Wang BY, Jiang RL. Expression of VEGF and its receptors Flt and KDR in gastric cancer. Chinese Journal of Digestive Diseases. 2001;2:171-173. [DOI] |
| 29. | Tian X, Song S, Wu J, Meng L, Dong Z, Shou C. Vascular endothelial growth factor: acting as an autocrine growth factor for human gastric adenocarcinoma cell MGC803. Biochem Biophys Res Commun. 2001;286:505-512. [PubMed] [DOI] |