修回日期: 2013-06-09
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 构建乙型肝炎病毒(hepatitis B virus, HBV)-X蛋白(hepatitis B virus x protein, HBx)和增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)真核融合蛋白表达载体(pHBx-EGFP), 转染肝癌Bel 7402细胞, 观察其表达和定位, 为进一步研究HBx功能提供工具.
方法: 以pcDNA3.1-HBx为模板, 应用PCR和DNA重组技术构建增强型绿色荧光蛋白HBx-EGFP融合蛋白表达载体pHBx-EGFP, 经脂质体转染Bel 7402细胞, 应用倒置荧光显微镜观察融合蛋白表达和定位; 同时提取转染pHBx-EGFP 24 h后的Bel 7402细胞总蛋白, 应用Western blot技术, 鉴定HBx在细胞的表达情况.
结果: 成功扩增HBx片段插入pEGFP载体, 经酶切验证后测序正确; pHBx-EGFP转染Bel 7402细胞24 h后, 荧光显微镜下观察显示HBx-EGFP存在于细胞核周区域, 而EGFP则弥散分布于整个细胞; Western blot得到HBx-EGFP、EGFP和HBx目的条带.
结论: 成功构建pHBx-EGFP真核重组蛋白表达载体, 通过检测绿色荧光蛋白标记显示其在Bel 7402细胞中表达及定位, 并证实pHBx-EGFP载体能在Bel 7402细胞正确表达.
核心提示: 本研究成功构建pHBx-EGFP真核重组蛋白表达载体, 通过检测绿色荧光蛋白标记显示其在Bel 7402细胞中表达及定位, 并通过Western blot证实pHBx-EGFP载体能在Bel 7402细胞内正确表达. 将为研究HBx在肝癌发生过程中的作用机制奠定前期的工作基础.
引文著录: 李伟, 朱明月, 鲁琰, 朱丽琴, 董栩, 陈栘, 李孟森. pHBx-EGFP载体构建及其在肝癌Bel 7402细胞中的表达. 世界华人消化杂志 2013; 21(21): 2016-2022
Revised: June 9, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To construct an eukaryotic expression vector carrying hepatitis B virus X (HBx) gene and enhanced green fluorescent protein gene (pHBx-EGFP), and to express it transiently in hepatocellular carcinoma (HCC) Bel 7402 cells for observing the expression and cellular localization of HBx-EGFP fusion protein and providing an experimental tool for investigating the function of HBx gene.
METHODS: pcDNA3.1-HBx was used to amplify the HBx gene fragment by polymerase chain reaction (PCR). Recombinant DNA technology was used to insert the HBx gene into the eukaryotic expression vector pEGFP to obtain a recombinant vector pHBx-EGFP. After the recombinant vector or pEGFP was transfected into Bel 7402 cells for 24 h, the expression and subcellular location of HBx-EGFP was detected under an inverted fluorescence microscope, and the expression of HBx protein in total cellular proteins was detected by Western blot.
RESULTS: Restriction digestion and DNA sequence analyses verified that the recombinant plasmid was constructed successfully. After the HBx-EGFP recombinant plasmid was transfected into Bel 7402 cells, it was found that HBx-EGFP was present in the perinuclear region, while EGFP was distributed throughout the cells. Western blot analysis demonstrated that EGFP and HBx were expressed efficiently.
CONCLUSION: A recombinant eukaryotic fluorescent expression vector carrying the HBx gene (pHBx-EGFP) has been constructed successfully, which could express EGFP and HBx in Bel 7402 cells.
- Citation: Li W, Zhu MY, Lu Y, Zhu LQ, Dong X, Chen Y, Li MS. Construction and identification of a green fluorescent protein expression vector carrying the HBx gene (pHBx-EGFP) and its expression in hepatocellular carcinoma cell line Bel 7402. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2016-2022
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2016.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2016
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是导致肝细胞癌(hepatocellular carcinoma, HCC)发生的主要危险因素之一, 据统计HCC中有55%的病例与HBV感染相关, 并且发病呈逐年上升趋势[1]. 虽然HBV的确切致癌机制尚未完全阐明, 但目前认为HBV-X基因及其产物X蛋白(hepatitis B virus X, HBx)在HCC的发生过程中起着至关重要的作用[2,3]. 在慢性HBV感染携带者的肝细胞中经常可检测到HBV DNA整合宿主染色体中[4], 但是HBV没有直接诱导肝细胞恶变的功能, 其可通过HBx转录本的积累诱导多种与肿瘤相关基因的异常表达, 这些基因涉及细胞信号转导、细胞周期控制以及细胞迁徙和转移等功能[5-7], 提示HBx在肝癌发生过程中扮演重要角色. 为了简单直观的明确HBx在肝细胞中的表达定位, 更加深入的了解HBx在HCC发生发展中的生物学功能, 本研究根据EGFP蛋白的特殊性质, 将HBx与EGFP构建融合蛋白, 导入肝癌细胞中观察HBx在细胞中的表达和定位, 为进一步研究HBx在HCC发生过程中的作用机制提供基础.
肝癌细胞系Bel 7402细胞和pcDNA3.1-HBx质粒本实验室保存; pEGFP质粒购自长沙赢润生物技术有限公司; DH5α感受态细胞购自北京全式金生物技术有限公司; 限制性内切酶Hind Ⅲ和EcoRⅠ购自New England Biolabs公司; pMD18-T Simlpe载体和PCR TaqTM购自TaKaRa公司; GFP单克隆抗体购自碧云天生物技术研究所; 细胞培养基DMEM为GIBCO干粉, 胎牛血清购自索莱宝科技有限公司; 转染试剂LIPOFECTAMINETM 2000购自Invitrogen公司; HBx单克隆抗体购自Abcom公司.
1.2.1 pHBx-EGFP载体构建: 设计包含有酶切位点的引物, 上游引物含有Hind Ⅲ酶切位点5'-AAGCTTATGGCTGCTAGGCTGTGCTG-3', 下游引物含有EcoRⅠ酶切位点5'-GAATTCGGGCAGAGGTGAAAAAGTTG-3'. 将HBx基因开放读码框(open read frame, ORF)中的TAA终止密码子去除, 保持pEGFP载体中的三联密码子阅读框不发生移位. 引物由上海生工生物工程有限公司合成. PCR体系为50 μL, 以pcDNA3.1-HBx质粒1 μL为模板, PCR反应条件95 ℃预变性5 min, 循环开始于95 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s, 共30个循环, 72 ℃延伸5 min. PCR产物胶回收, 插入pMD18-simple载体构建TA克隆, PCR验证. 构建好的TA克隆和pEGFP质粒各自以Hind Ⅲ和EcoRⅠ双酶切, 分别将胶回收的小片段和大片段进行连接, 连接产物转化大肠杆菌DH5α感受态细胞. 菌落PCR验证插入片段, 挑选3株扩增出目的片段的菌株, 摇菌扩增提取质粒Hind Ⅲ和EcoRⅠ双酶切, 产物电泳出现目的片段的菌株, 扩增送上海生工生物工程有限公司测序. 将测序结果进行BLAST比对. 将已鉴定质粒在DH5α中扩增, 并用无内毒素质粒大提试剂盒制备转染用重组载体.
1.2.2 Bel 7402细胞的培养及重组载体的脂质体转染: Bel 7402细胞在含10%FBS的DMEM培养液(高糖)(10万U/L的青霉素和链霉素)中, 置于37 ℃、5%CO2培养箱中培养, 每2-3 d换液或传代1次. 转染前24 h, 以3×105细胞接种6孔板. 转染步骤参照LipofectamineTM 2000说明书进行, 每孔DNA用量为4 μg, LipofectamineTM 2000用10 μL. 以不转染载体细胞组为对照, 分别转染pEGFP空载体和pHBx-EGFP融合载体, 转染后培养24 h.
1.2.3 倒置荧光显微镜观察: 将消化后Bel 7402细胞悬液接种至6孔板, 待转染pEGFP或pHBx-EGFP的Bel 7402细胞在6孔板中培养24 h, 以倒置荧光显微镜进行细胞观察, 激发光的波长488 nm. 将细胞产生的荧光以冷CCD成像, 并以彩色(绿色)显示荧光.
1.2.4 Western blot: 预冷的PBS洗细胞, 1 mL PBS刮下收集细胞, 离心收集, 使用RIPA裂解液提取转染24 h细胞总蛋白, Bradford法定量, 取60 μg蛋白上样, 8%SDS-PAGE胶电泳, 40 V转膜3 h, PBS洗膜10 min, 洗3次, 5%脱脂奶粉封闭2 h, PBST洗膜3次, 每次10 min, HBx或GFP一抗4 ℃过夜孵育, 同样方法洗膜, 二抗室温孵育2 h, PBST洗膜3次, ECL发光仪成像.
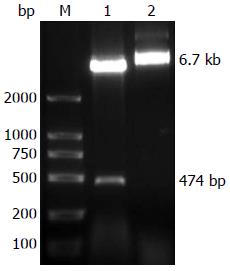
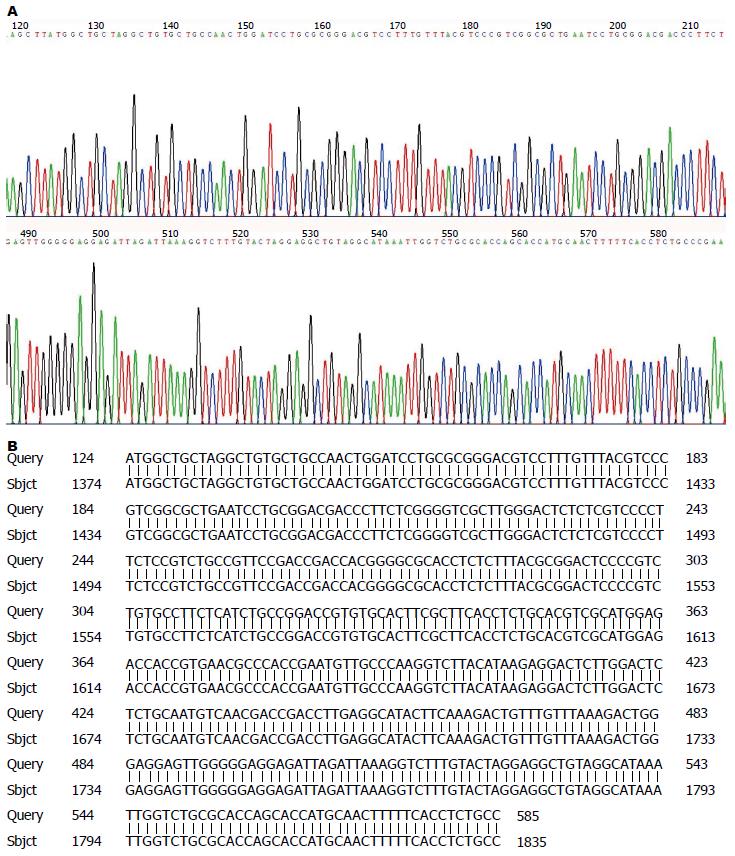
从转化pHBx-EGFP的DH5α菌液中提取重组子质粒, 通过Hind Ⅲ+EcoRⅠ双酶切后, 0.8%琼脂糖TBE电泳可见线性化质粒约为6.7 kb的质粒条带和474 bp的目的条带(图1). 选取酶切鉴定出现目的片段的转化子进行测序, 对测序结果进行BLAST, 序列分析证实, 所克隆的DNA序列为已去除TAA终止密码子的HBx基因编码区全长序列(图2), 该基因GenBank登录号为AB210819, 结果显示成功构建了pHBx-EGFP重组质粒.
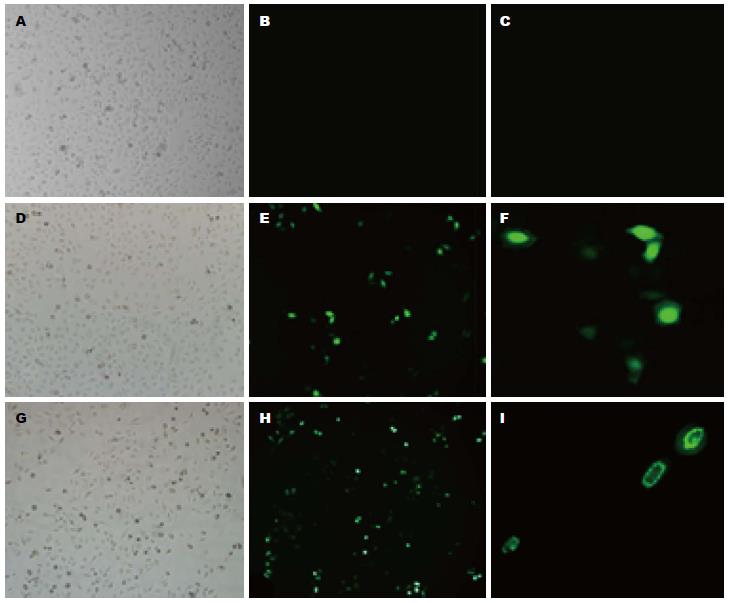
将空质粒pEGFP和重组质粒pHBx-EGFP分别转染人肝癌Bel 7402细胞, 转染24 h后倒置荧光显微镜观察转染情况, 并以未转染的细胞做空白对照. 如图3E和H所示, 转染空质粒pEGFP和重组质粒pHBx-EGFP的细胞中均出现绿色荧光蛋白表达, 可见pEGFP空载体转染表达的绿色荧光蛋白在Bel 7402细胞中弥散、均匀分布(图3F), 而重组载体pHBx-EGFP表达的融和蛋白在Bel 7402细胞中主要分布于细胞核区域, 并在核周(膜)边缘上有不连续分布现象(图3I).
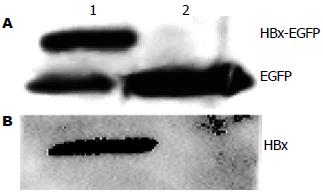
融合蛋白分子量约44 kDa, EGFP分子量为27 kDa. 应用GFP抗体检测的结果如图 4A所示, 转染HBx-EGFP融合载体的条带明显与对照EGFP的条带大小不同, 与预期结果相同; 应用HBx抗体结果如图4B所示, 只有转染HBx-EGFP融合载体的细胞蛋白有条带出现, 大小与预期相同.
HCC的发生在世界性多发肿瘤中排第5位, 其致死率仅次于肺癌和胃癌, 居致死性肿瘤的第3位[8]. HBV感染在肝癌的发生发展过程中发挥重要作用[9-11]. 其基因组编码产物之一HBx蛋白, 在HCC患者血清和组织中检测到抗HBx抗体和抗原, 表明其与HCC的发生发展密切相关[12]. HBx直接导致HCC的实验证据较少, 只有少数实验证实在转基因鼠研究中, 导入HBx基因可直接诱导HCC的发生[13]. 新近研究报道, HBx与aflatoxin B1转基因斑马鱼模型中协同导致肝炎、脂肪样变性和过度增生[14]. 多数研究认为, HBx是一种多功能蛋白, 可以通过多种途径诱导肝癌形成, 通过蛋白间的相互作用影响目的蛋白在细胞内的正常功能[15,16], 或者通过反式激活功能影响基因表达而作用于宿主细胞的增殖、凋亡、侵袭和转移等[5-7]. HBx除了对蛋白功能及基因表达的影响, 近期报道发现HBx还可以影响小RNA( miRNA)的表达, 进而导致其下游靶分子功能异常, 如HBx能够介导miRNA-21的上调从而抑制抑癌因子的功能[17], 而HBx通过表观修饰抑制miR-132的表达介导肝癌的发生[18], 因此, 影响miRNA表达调控可能是HBx参与HCC发生的又一途径. 虽然, HBx与肝癌的发生密切相关, HBV X基因及其产物HBx在HCC的发生过程中起着至关重要的作用, 但是, 其具体的作用机制还不十分明确. 因此, 进一步研究HBx的功能及在肝癌细胞中的作用, 有助于理解HBV影响肝癌发生发展的机制, 为HBV相关性肝癌的预防和治疗提供线索.
HBx蛋白不同的细胞定位可能使它具有不同的功能[19,20]. HBx低表达时, HBx主要定位于核内, 在核内起着辅助反式激活转录因子的作用; 高水平表达时聚集在胞质中, 与蛋白质相互作用激活信号传导通路. 绿色荧光蛋白(green fluorescent protein, GFP)是最早发现并应用的荧光蛋白, 其突变体荧光强度比野生型GFP强, 增强型绿色荧光蛋白EGFP就是其突变体的一种[21], 其荧光强度强, 表达稳定, 构建载体和检测方便, 表达调控简单, 生物安全性好, 是目前应用最广泛的荧光蛋白之一. HBx是一种由154氨基酸组成的约有17 kDa大小的小分子病毒基因产物, 在分子检测方面存在一定的困难, 为更方便快捷的明确HBx在细胞中的表达和定位, 在本研究中, 我们根据EGFP的特点, 将HBx插入EGFP之前, 保证不发生移码突变, 构建HBx-EGFP融合蛋白, 酶切结果和测序结果显示在构建的融合表达载体中, 确实有HBx基因序列的存在; 在Bel 7402细胞转染pHBx-EGFP载体后, 发现转染重组质粒的细胞中有绿色荧光, 说明质粒成功转入细胞并有蛋白质的表达. 本研究结果显示, HBx-EGFP定位明显与EGFP不同, 融合蛋白24 h多表达于核周, 与彭亮等[22]的研究结果相一致, 但48 h后趋向于全细胞不连续点状分布(结果未提供). 应用Western blot的方法进一步验证HBx-EGFP表达, 我们先用可识别EGFP抗原的GFP抗体杂交, 得到分子量不同的目的条带, 显示在EGFP的位置不仅能检测到EGFP条带, 也能检测到融合蛋白发生断裂的EGFP条带; 但使用HBx特异性抗体识别融合蛋白中的HBx结果中, 显示只有HBx蛋白条带出现, 说明构建的载体不仅有融合蛋白表达, 更重要的是HBx蛋白的表达能单独、完整的出现, 提示构建的载体能准确的表达HBx.
HBx对肝细胞的增殖和凋亡存在双向作用[23,24]. HBx可通过抑制细胞凋亡导致HCC发生[25,26], 但其他多项研究也表明HBx能诱导和促进细胞凋亡[27,28], 并且凋亡率与HBx表达量呈正相关[29]. HBx基因在肝细胞凋亡方面发挥着不同的作用[30,31]. 在早期阶段, 可能抑制凋亡, 促进肝细胞的增生; 在后期, 促进凋亡, 加速病毒的复制与播散. 在本实验中我们发现, 与转染空载体的细胞相比, 转染HBx-EGFP融合质粒的细胞折光增强, 变圆变小, 随时间增加转入融合质粒的细胞生长状态更差, 说明HBx-EGFP融合蛋白对细胞存在一定的毒性作用, 但这种机制是否由于HBx自身的作用导致并不清楚, 这是值得进一步探讨的问题. 本研究结果显示我们构建的载体能准确的表达HBx, 由于HBx在HBV相关性肝癌中发挥重要作用, 而且HBV感染后通过HBx诱导肝细胞恶性转化, 所以本研究成功构建的融合载体, 不仅在探索HBV诱导肝癌发生过程中可应用载体分析HBx对肝细胞恶性转化的作用, 而且携带EGFP载体对细胞转染效率和表达带来很大的方便和直观; 目前研究发现, 微生物有诱导成熟体细胞自然重编程现象, 乙型肝炎病毒也有诱导肝细胞重编程促使细胞向恶性方向转化的可能, 所以成功构建pHBx-EGFP融合载体将为研究HBx在肝癌发生过程中的作用机制奠定了前期的工作基础.
肝细胞癌(hepatocellular carcinoma, HCC)的发生在世界性多发肿瘤中排第5位, 其致死率居致死性肿瘤的第3位. 乙型肝炎病毒(hepatitis B virus, HBV)感染在肝癌的发生发展过程中发挥重要作用, 但是HBV没有直接诱导肝细胞恶变的功能, 目前, 认为HBV基因组编码产物HBx蛋白与HCC发生密切相关.
于颖彦, 教授, 瑞金医院消化外科研究所与器官移植中心
HBV基因组编码产物HBx蛋白与HCC的发生发展密切相关. HBx是一种多功能蛋白, 通过蛋白间的相互作用或反式激活功能而作用于宿主细胞的增殖、凋亡、侵袭和转移等. 但其参与HCC发生的具体机制还有待进一步阐明.
本文在保证不发生移码突变的前提下, 将HBx基因插入EGFP的前端, 因HBx紧靠启动子, 后接绿色荧光蛋白(enhance green fluorescent protein, EGFP), 只要观察到绿色荧光, 说明插入EGFP前端的HBx一定已经表达; 为进一步验证HBx蛋白表达正确, 我们又应用两种抗体通过Western blot检测出现正确的目的条带.
本研究成功构建的融合载体, 不仅在探索HBV诱导肝癌发生过程中可应用载体分析HBx对肝细胞恶性转化的作用, 而且携带EGFP载体对细胞转染效率和表达带来很大的方便, 成功构建pHBx-EGFP融合载体将为研究HBx在肝癌发生过程中的作用机制奠定了前期的工作基础.
本文思路清晰, 研究步骤详尽, 对于从事肝脏疾病研究、病毒研究以及肿瘤基础研究具有一定的参考价值.
| 1. | Kew MC. Epidemiology of chronic hepatitis B virus infection, hepatocellular carcinoma, and hepatitis B virus-induced hepatocellular carcinoma. Pathol Biol (Paris). 2010;58:273-277. [PubMed] [DOI] |
| 2. | Benhenda S, Cougot D, Buendia MA, Neuveut C. Hepatitis B virus X protein molecular functions and its role in virus life cycle and pathogenesis. Adv Cancer Res. 2009;103:75-109. [PubMed] [DOI] |
| 3. | Kew MC. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma. J Gastroenterol Hepatol. 2011;26 Suppl 1:144-152. [PubMed] [DOI] |
| 4. | Ng RK, Lau CY, Lee SM, Tsui SK, Fung KP, Waye MM. cDNA microarray analysis of early gene expression profiles associated with hepatitis B virus X protein-mediated hepatocarcinogenesis. Biochem Biophys Res Commun. 2004;322:827-835. [PubMed] [DOI] |
| 6. | Ng SA, Lee C. Hepatitis B virus X gene and hepatocarcinogenesis. J Gastroenterol. 2011;46:974-990. [PubMed] [DOI] |
| 7. | Matsuda Y, Ichida T. Impact of hepatitis B virus X protein on the DNA damage response during hepatocarcinogenesis. Med Mol Morphol. 2009;42:138-142. [PubMed] [DOI] |
| 8. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 9. | Pan CQ, Zhang JX. Natural History and Clinical Consequences of Hepatitis B Virus Infection. Int J Med Sci. 2005;2:36-40. [PubMed] [DOI] |
| 10. | Kim BK, Han KH, Ahn SH. Prevention of hepatocellular carcinoma in patients with chronic hepatitis B virus infection. Oncology. 2011;81 Suppl 1:41-49. [PubMed] [DOI] |
| 11. | Fallot G, Neuveut C, Buendia MA. Diverse roles of hepatitis B virus in liver cancer. Curr Opin Virol. 2012;2:467-473. [PubMed] [DOI] |
| 12. | Hwang GY, Lin CY, Huang LM, Wang YH, Wang JC, Hsu CT, Yang SS, Wu CC. Detection of the hepatitis B virus X protein (HBx) antigen and anti-HBx antibodies in cases of human hepatocellular carcinoma. J Clin Microbiol. 2003;41:5598-5603. [PubMed] [DOI] |
| 13. | Kim CM, Koike K, Saito I, Miyamura T, Jay G. HBx gene of hepatitis B virus induces liver cancer in transgenic mice. Nature. 1991;351:317-320. [PubMed] [DOI] |
| 14. | Lu JW, Yang WY, Lin YM, Jin SL, Yuh CH. Hepatitis B virus X antigen and aflatoxin B1 synergistically cause hepatitis, steatosis and liver hyperplasia in transgenic zebrafish. Acta Histochem. 2013; Mar 14. [Epub ahead of print]. [PubMed] [DOI] |
| 15. | Lim KH, Choi HS, Park YK, Park ES, Shin GC, Kim DH, Ahn SH, Kim KH. HBx-induced NF-κB signaling in liver cells is potentially mediated by the ternary complex of HBx with p22-FLIP and NEMO. PLoS One. 2013;8:e57331. [PubMed] [DOI] |
| 16. | Song K, Han C, Zhang J, Lu D, Dash S, Feitelson M, Lim K, Wu T. Epigenetic regulation of miR-122 by PPARγ and hepatitis B virus X protein in hepatocellular carcinoma cells. Hepatology. 2013; May 23. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Qiu X, Dong S, Qiao F, Lu S, Song Y, Lao Y, Li Y, Zeng T, Hu J, Zhang L. HBx-mediated miR-21 upregulation represses tumor-suppressor function of PDCD4 in hepatocellular carcinoma. Oncogene. 2013;32:3296-3305. [PubMed] [DOI] |
| 18. | Wei X, Tan C, Tang C, Ren G, Xiang T, Qiu Z, Liu R, Wu Z. Epigenetic repression of miR-132 expression by the hepatitis B virus x protein in hepatitis B virus-related hepatocellular carcinoma. Cell Signal. 2013;25:1037-1043. [PubMed] [DOI] |
| 19. | Henkler F, Hoare J, Waseem N, Goldin RD, McGarvey MJ, Koshy R, King IA. Intracellular localization of the hepatitis B virus HBx protein. J Gen Virol. 2001;82:871-882. [PubMed] |
| 20. | Ma J, Sun T, Park S, Shen G, Liu J. The role of hepatitis B virus X protein is related to its differential intracellular localization. Acta Biochim Biophys Sin (Shanghai). 2011;43:583-588. [PubMed] [DOI] |
| 22. | 彭 亮, 张 瑞, 赵 晶, 闵 婕, 蒲 长宇, 周 后龙, 杨 安钢, 冯 英明. 不同结构形式的HBX蛋白对其在肝细胞癌HepG2中分布的影响. 细胞与分子免疫学杂志. 2011;27:611-614. |
| 23. | Assrir N, Soussan P, Kremsdorf D, Rossignol JM. Role of the hepatitis B virus proteins in pro- and anti-apoptotic processes. Front Biosci. 2010;15:12-24. [PubMed] [DOI] |
| 24. | Lee WP, Lan KH, Li CP, Chao Y, Lin HC, Lee SD. Pro-apoptotic or anti-apoptotic property of X protein of hepatitis B virus is determined by phosphorylation at Ser31 by Akt. Arch Biochem Biophys. 2012;528:156-162. [PubMed] [DOI] |
| 25. | Liu H, Yuan Y, Guo H, Mitchelson K, Zhang K, Xie L, Qin W, Lu Y, Wang J, Guo Y. Hepatitis B virus encoded X protein suppresses apoptosis by inhibition of the caspase-independent pathway. J Proteome Res. 2012;11:4803-4813. [PubMed] [DOI] |
| 26. | Wang X, Yang L, She JJ, Fan HM, Zhang FC, Chen YM, Xie QF. [Hepatitis B virus X protein suppresses adriamycin-induced apoptosis of hepatocellular carcinoma cells and expression of p53 and PTEN]. Nanfang Yike Daxue Xuebao. 2010;30:1775-1778. [PubMed] |
| 27. | 张 生君, 王 小众. HBx对肝细胞凋亡的双向调控及机制. 世界华人消化杂志. 2004;12:2424-2428 Available from: http://www.wjgnet.com/1009-3079/12/2424.pdf. |
| 28. | He P, Zhang D, Li H, Yang X, Li D, Zhai Y, Ma L, Feng G. Hepatitis B virus X protein modulates apoptosis in human renal proximal tubular epithelial cells by activating the JAK2/STAT3 signaling pathway. Int J Mol Med. 2013;31:1017-1029. [PubMed] [DOI] |
| 29. | Yang CH, Cho M. Hepatitis B virus X gene differentially modulates cell cycle progression and apoptotic protein expression in hepatocyte versus hepatoma cell lines. J Viral Hepat. 2013;20:50-58. [PubMed] [DOI] |
| 30. | Rawat S, Clippinger AJ, Bouchard MJ. Modulation of apoptotic signaling by the hepatitis B virus X protein. Viruses. 2012;4:2945-2972. [PubMed] [DOI] |
| 31. | Wei Y, Neuveut C, Tiollais P, Buendia MA. Molecular biology of the hepatitis B virus and role of the X gene. Pathol Biol (Paris). 2010;58:267-272. [PubMed] [DOI] |