修回日期: 2012-12-26
接受日期: 2013-01-05
在线出版日期: 2013-01-18
目的: 筛选与鉴定胰腺癌干细胞相关的差异表达蛋白质.
方法: 以MIA-PaCa2(TIChigh)与BxPc-3(TIClow)为研究胰腺癌干细胞的工具细胞, 采用荧光差异双向凝胶电泳技术分离并筛选上述细胞差异表达蛋白, 反射式基质辅助激光解吸附电离串联飞行时间质谱鉴定差异蛋白, 免疫印迹验证差异表达的TRIM28.
结果: 获得了MIA-PaCa2(TIChigh)与BxPc-3(TIClow)荧光差异蛋白表达图谱, 经DeCyder v6.5软件分析, 共有23个差异在1.5倍以上的蛋白质点, 经质谱鉴定得到19个蛋白质, 相对于BxPc-3(TIClow), 在MIA-PaCa2(TIChigh)细胞组中高表达者有8个, 低表达者有11个, 包括参与细胞通讯和信号传导蛋白、免疫反应蛋白、转录因子与细胞周期调控蛋白、调节脂肪细胞分化和脂滴形成蛋白、细胞骨架蛋白、细胞黏附分子、差向异构酶、转运活性蛋白及参与翻译调节相关蛋白. 免疫印迹结果显示TRIM28在BxPc-3(TIClow)没有表达, 在MIA-PaCa2(TIChigh)高表达.
结论: 筛选得到的TRIM28等胰腺癌干细胞相关差异表达蛋白可能与胰腺癌干细胞的发生、发展和调控机制相关, 有望成为胰腺癌新的治疗靶点.
引文著录: 江建新, 高珊, 潘耀振, 孙诚谊. 蛋白组学分析胰腺癌干细胞相关差异蛋白的表达. 世界华人消化杂志 2013; 21(2): 145-152
Revised: December 26, 2012
Accepted: January 5, 2013
Published online: January 18, 2013
AIM: To screen and identify differentially expressed proteins in pancreatic cancer stem cells.
METHODS: MIA-PaCa2 (TIChigh) and BxPc-3 (TIClow) were used in the study. Differentially expressed proteins between MIA-PaCa2 (TIChigh) and BxPc-3 (TIClow) cells were isolated and screened by 2D-DIGE analysis. Protein identification was performed by peptide mass fingerprinting with matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF/TOF). Western blot was performed to verify the differential expression of TRIM28.
RESULTS: Fluorescent differential protein expression patterns were obtained between MIA-PaCa2 (TIChigh) and BxPc-3 (TIClow) cells. Analyses with DeCyder v6.5 software showed a total of 23 differentially expressed protein spots (>1.5 folds), and these protein spots were identified by mass spectrometry as 19 proteins, which are involved in cell communication and signal transduction, immune response, transcription and cell cycle regulation, adipocyte differentiation and lipid droplet formation, cytoskeletal formation, cell adhesion, transport, and translation. Western blot analysis revealed that TRIM28 was highly expressed in MIA-PaCa2 (TIChigh) cells but not expressed in BxPc-3 (TIClow) cells. Among the 19 identified proteins, 8 were up-regulated and 11 down-regulated in MIA-PaCa2 (TIChigh) cells.
CONCLUSION: The identified differentially expressed proteins, such as TRIM28, are associated with the genesis, development and regulation of pancreatic cancer stem cells. They may become new therapeutic targets for pancreatic cancer.
- Citation: Jiang JX, Gao S, Pan YZ, Sun CY. Quantitative proteomic analysis of differentially expressed proteins in pancreatic cancer stem cells. Shijie Huaren Xiaohua Zazhi 2013; 21(2): 145-152
- URL: https://www.wjgnet.com/1009-3079/full/v21/i2/145.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i2.145
胰腺癌是高度恶性、预后最差的恶性肿瘤之一, 5年生存率不到5%[1]. 大多数患者因确诊时伴有局部和/或远处的侵袭、转移而丧失手术时机[2], 即使临床手术根治性切除的胰腺癌患者术后也大多数因出现复发和远处转移预后极差, 其原因为术前就有微转移灶形成及化疗抵抗[3]; 胰腺癌的早期转移、对传统的治疗抵抗以及较易复发是其致死的关键因素. 肿瘤干细胞理论解释了上述现象. 研究表明[4]: 在原发肿瘤里存在一个亚群细胞, 这群细胞具有自我更新、分化潜能以及在异位重新成瘤能力. 同时, 这群细胞还具有侵袭转移和化疗抵抗特性. 最新的研究表明: 胰腺癌在形成之前通过上皮-间质转化(epithelial-to-mesenchymal transition, EMT)形成胰腺癌干细胞, 是其早期发生转移, 治疗抵抗, 复发的根本原因[5]. 已有的研究表明: 具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性, 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率95.5%, 而BxPc-3的表达率17.5%. 因此, MIA-PaCa2(TIChigh)与BxPc-3(TIClow)可以直接作为研究胰腺癌干细胞的工具细胞, 不需要进一步富集[6]. 近年来, 许多方法学包括基因组学、转录组学、蛋白质组学、代谢组学等被用来研究肿瘤性疾病的诊断或发生机制. 蛋白质是最根本的功能生物学分子, 他是细胞的各种生物过程或参与调节的终端执行者. 蛋白质组学, 特别是定量蛋白组学可以从一个细胞或组织的整体角度, 动态、定量地检测差异蛋白的变化, 从而有助于进一步研究这种差异变化的原因, 揭示其发生机制[7]. 本研究采用双向荧光差异蛋白组学(2-D fluorescence difference gel electrophoresis, 2-D DIGE)技术, 以MIA-PaCa2(TIChigh)和BxPc-3(TIClow)为研究对象, 筛选胰腺癌干细胞相关差异蛋白, 并对其生物学功能进行数据库分析, 为进一步研究胰腺癌干细胞的发生和调控机制, 寻找新的治疗靶点奠定基础.
人胰腺癌细胞株BxPc-3(TIClow)和MIA-PaCa2(TIChigh)由本室保存; 细胞培养按照文献[8,9]采用DMEM培养基(Gibico公司), 含10%的56 ℃热灭活胎牛血清, 25 mmol/L HEPES, 2 mmol/L-谷氨酰胺, 青霉素50 U/mL及链霉素50 µg/mL.
1.2.1 蛋白提取: 在上述细胞中加入l mL蛋白裂解液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS、30 mmol/L的Tris、蛋白酶抑制剂pH 8.5), 静置15 min, 冰浴超声15 s(超声0.2 s, 间隔2 s)后混旋40 min, 40 000 g、4 ℃离心30 min, 取上清, Bradford蛋白定量, 分装样品冻存于-70 ℃.
1.2.2 双向荧光差异凝胶电泳(2D-DIGE): 将Cy2、Cy3、Cy5用DMF溶解成1 nmol/L的母液. 每单个样本50 μg蛋白用400 pmol Cy3或Cy5标志, 等量混合2组样本用Cy2作为内标标志, 避光, 冰上放置30 min, 然后用1 μL 10 mol/L赖氨酸终止反应. 将Cy3、Cy5标志的2组细胞蛋白两两混合成2个样本, 均加入内标, 再加入等体积的2×样品缓冲液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS、2%IPG Buffer、2%DTT), 加入水化液(8 mol/L尿素、4%CHAPS、1%IPG Buffer、0.5%DTT)混匀, 分别行2D-DIGE. 第一向等电聚焦电泳温度控制在17 ℃. 程序设置为水化: 50V、13 h, 主动水化; S1: 200 V、线性、2 h、除盐; S2: 500 V、快速、1.5 h、除盐; S3: 1000 V、快速、1.5 h、升压; S4: 10000 V、线性、4 h、升压; S5: 10000 V、快速、60000 V/h、聚焦; S6: 500 V、快速、任意时间、保持. 聚焦结束将IPG胶条放入SDS平衡液和0.5%DTT中10 min, 再放入SDS平衡液和4.5%碘乙酰胺中10 min. 然后放于12%SDS-PAGE上方, 行第二向电泳. 待溴酚蓝指示剂达到底部边缘时停止电泳.
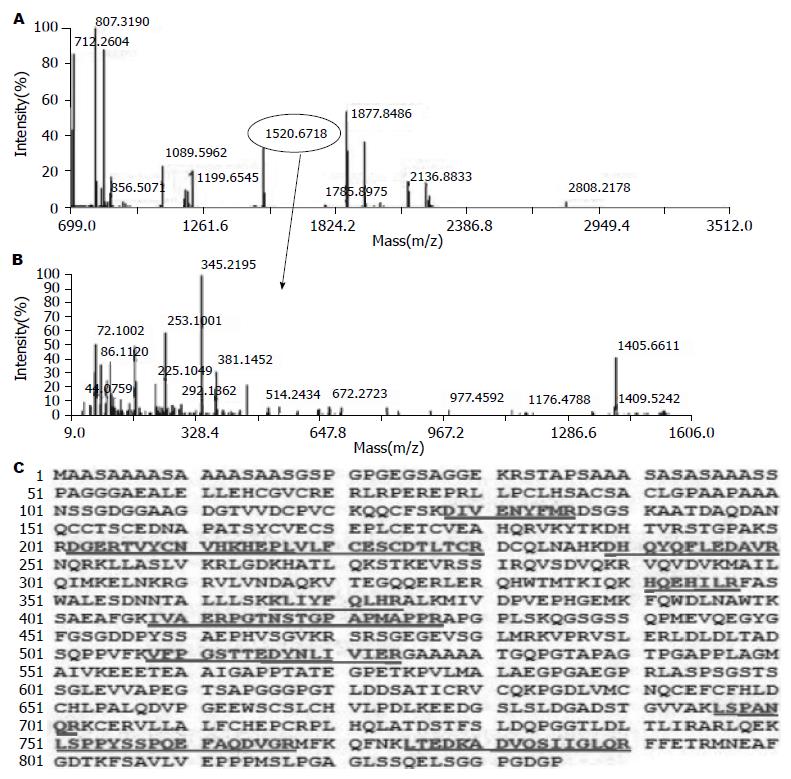
1.2.3 图像采集分析及质谱鉴定: 在Typhoon 9410TM荧光扫描仪上用不同波长激光对凝胶内的Cy2(488/520 nm)、Cy3(532/580 nm)、Cy5(633/670 rim)进行扫描, 并采用DeCyder v6.5软件进行分析. 每一张胶扫描后得到3张扫描胶图(共6张胶图), 对每一张胶图上的所有蛋白点扫描进行胶内分析, 然后对不同胶上的同一个蛋白点与内标匹配, 进行胶间分析. 对匹配后的每个蛋白点的相对量比较(Cy3/Cy2或Cy5/Cy2)后确定差异蛋白. 用1 mg样品重新进行2D, 电泳结束后凝胶行考马斯蓝染色, 与扫描胶图匹配后手动切胶切取相匹配的蛋白质点. 参见Li等[10]的方法进行脱色、还原、烷基化、酶解、样本回收及脱盐处理. 回收样品用反射式基质辅助激光解吸附电离串联飞行时间质谱(MALDI-TOWTOF)技术进行检测. 扫描方式: 反射式; 扫描范围: 700-3500 kDa; 激光能量: MS 4500, MSMS 5000; GPS软件检索: 误差MS 0.2 kDa, MS/MS 0.3 kDa. 获取的多肽质谱指纹图(peptide mass finger print, PMF)在人的数据库IPI HUMAN 3.23检索. 数据取舍标准: 蛋白质>61分, 置信水平>95%.
1.2.4 Western blot检测TRIM28蛋白的表达: 分别提取BxPc-3(TIClow)和MIA-PaCa2(TIChigh)总蛋白; 将提取的蛋白质样本按每孔30 μg上样于12%SDS-PAGE后进行电泳. 用电转移法转移蛋白质至PVDF膜, 然后用5%脱脂奶粉封闭膜1 h. 加入兔抗人TIF1β单克隆抗体(1:200)(购自Cell Signaling公司)后4 ℃孵育过夜, 辣根过氧化物酶(HRP)标志的羊抗兔IgG孵育1 h. 参照免疫印迹化学发光(ECL)试剂盒说明进行化学发光法显示结果, X线胶片曝光. 实验重复3次, 条带密度采用Quantity One Program(Bio-Rad)软件进行分析. 目的蛋白的相对表达水平 = 目的蛋白的灰度值/β-actin蛋白的灰度值, 取3次平均值.
统计学处理 采用DeCyder v6.5软件自带的统计学数据处理系统, 设置P<0.05, 采用t检验进行定量比较(P<0.05).
分别用不同波长激光对Cy2(488/520 nm), Cy3(532/580 nm)和Cy5(633/670 nm)进行扫描, 合并获得的扫描图见图1. 选择其中效果好, 点数多的一块胶作为参考胶, 进行胶内分析及胶间的匹配, 获得重复性较好的MIA-PaCa2(TIChigh)和BxPc-3(TIClow)荧光差异蛋白表达图谱. 经DeCyder v6.5软件分析, 筛选出差异1.5倍以上、有统计学意义的差异点23个. 相对于BxPc-3(TIClow), 在MIA-PaCa2(TIChigh)细胞组中高表达者有12个, 低表达者有11个.
对23个差异蛋白点进行鉴定, 共获得19个差异表达蛋白, 有4个蛋白点未能鉴定. 在人的数据库IPI HUMAN 3.23检索结果见表1. 差异倍数最大的蛋白点被鉴定为TRIM28, 其质谱鉴定图见图2.
| IPI ID | 蛋白名称 | Mra/pIb | 差异倍数c | 分子功能d |
| IPI00307155 | ROCK2 | 16.09/5.75 | -1.77 | 丝氨酸/苏氨酸激酶, 参与细胞通讯和信号传导 |
| IPI00879279 | RAB2B | 24.21/6.97 | 3.56 | GTPase活性蛋白, 参与细胞通讯和信号传导 |
| IPI00018146 | YWHAQ | 27.76/4.68 | -1.71 | 受体信号转导衔接分子, 参与细胞通讯和信号传导 |
| IPI00981244 | EEF1D | 71.41/6.84 | 2.94 | 鸟嘌呤核苷酸交换因子,参与细胞通讯和信号传导 |
| IPI00926719 | CAMK1 | 42.34/7.68 | 2.06 | 丝氨酸/苏氨酸激酶, 参与细胞通讯和信号传导 |
| IPI00926953 | SORBS2 | 124.11/10.00 | -4.12 | 受体信号转导衔接分子, 参与细胞通讯和信号传导 |
| IPI00385355 | BST2 | 19.77/10.28 | 1.68 | 嵌膜蛋白质, 参与免疫应答 |
| IPI00976345 | GLYCAM1 | 5.02/9.56 | -1.61 | 调节免疫应答 |
| IPI00879037 | Seipin | 51.16/4.73 | 2.92 | 调节脂肪细胞分化和脂滴形成 |
| IPI00893466 | MAD1L1 | 83.074.92 | 2.70 | 转录调节因子, 调节细胞周期 |
| IPI00894536 | RFX5 | 65.32/8.51 | -2.00 | 转录因子 |
| IPI00908961 | THG1L | 34.83/5.64 | 2.18 | 细胞周期控制蛋白, 参与细胞生存和生长 |
| IPI00977381 | KRT18 | 48.06/9.19 | 3.24 | 细胞骨架蛋白, 参与细胞生存和生长 |
| IPI00384120 | ISM2 | 63.91/10.00 | -2.06 | 细胞黏附分子 |
| IPI00878432 | CSNK1E | 47.32/11.44 | 3.82 | 丝氨酸/苏氨酸激酶, 参与DNA修复和信号转导 |
| IPI01009493 | MCEE | 18.75/6.81 | 2.08 | 差向异构酶, 参与能量代谢 |
| IPI00514053 | ARCN1 | 57.21/5.89 | -1.61 | 转运活性蛋白, 参与细胞内物质运输 |
| IPI00215884 | SFRS1 | 27.75/10.37 | 1.76 | RNA结合蛋白, 参与蛋白质代谢 |
| IPI00438229 | TRIM28 | 88.49/5.52 | -10.73 | 翻译调节蛋白 |
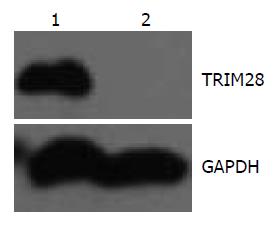
结果显示KAP-1在BxPc-3(TIClow)没有表达, 在和MIA-PaCa2(TIChigh)高表达, 与蛋白质组学实验结果基本一致(图3).
肿瘤发起细胞, 又称肿瘤干细胞, 具有成瘤、侵袭转移及治疗抵抗作用[11]. Kallifatidis等[6]从胰腺癌细胞标志分子CD44(+)/CD24(-), CD44(+)/CD24(+)或CD44(+)/CD133(+)的表达与裸鼠成瘤能力、分化程度、克隆性生长、肿瘤微球体形成、ALDH活性以及治疗抵抗等肿瘤干细胞特性的关系进行系列研究, 认为具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性; 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率95.5%, 而BxPc-3的表达率17.5%, 并认为MIA-PaCa2(TIChigh)与BxPc-3(TIClow)可以直接作为研究胰腺癌干细胞的工具细胞, 不需要进一步富集. 因此, 本研究基于上述研究基础, 直接以MIA-PaCa2(TIChigh)与BxPc-3(TIClow)作为研究胰腺癌干细胞的工具细胞, 未做CD44(+)/CD24(-)标志物筛选.
本实验应用2D-DIGE共筛选并经质谱鉴定出19个差异表达蛋白质. 根据这些蛋白质功能的不同, 可以分为9类: (1)参与细胞通讯和信号传导: ROCK2、RAB2B、YWHAQ、EEF1D、CAMK1、SORBS2、CSNK1E. 其中ROCK2是细胞内一类具GTP酶活性的小分子G蛋白Rho下游的效应分子, 是丝氨酸/苏氨酸蛋白激酶家族的成员. ROCK2主要在心血管、脑组织中表达[12]. 近来研究发现ROCK2可以在多种肿瘤中高表达, 如肝癌[13]、肺癌[14]、卵巢癌[15]等. ROCK2在多种恶性肿瘤组织中高表达, 提示ROCK2在肿瘤发生发展中起重要的作用. 大多数肿瘤的研究都集中在ROCK2与侵袭转移的关系方面, 我们的研究表明ROCK2在MIA-PaCa2(TIChigh)高表达, 提示其可能在维持胰腺癌干细胞的"干性"方面起一定的作用. EEF1D催化氨酰基tRNA转移到核糖体上, 为鸟嘌呤核苷酸交换因子, 其在肿瘤中高表达, 表明与肿瘤的蛋白质合成相适应. 此外, 研究表明, 其高表达与肿瘤的淋巴结转移、分期、预后、分化相关[16,17]. 本研究提示EEF1D在MIA-PaCa2(TIChigh)低表达, 提示其可能促进胰腺癌干细胞的分化; (2)免疫反应蛋白: BST2、GLYCAM1; BST2也被称作PDCA-1, CD137和HM1.24, 是细胞表面膜蛋白, 在许多肿瘤中高表达, 如肾癌[18]、子宫内膜癌[19]、肺癌[20]以及胰腺癌等[21]. 尚未见文献报道BST2在这些肿瘤的作用报道, BST2在MIA-PaCa2(TIChigh)低表达, 其作用亦需进一步研究; (3)转录因子与细胞周期调控蛋白: MAD1L1、RFX5、THG1L. MAD1L1是一种有丝分裂关卡元件, 在有丝分裂染色体赤道板对齐前, 阻止其进入有丝分裂后期. 在胃癌中, 其表达下调[22], 推测与肿瘤细胞不对称分裂相关. 在MIA-PaCa2(TIChigh)高表达, 推测与胰腺癌干细胞周期相对静止, 阻止进入有丝分裂后期相关; (4)调节脂肪细胞分化和脂滴形成: Seipin; (5)细胞骨架蛋白: KRT18、KRT18是上皮细胞标志蛋白, 其在肿瘤细胞中高表达提示该肿瘤细胞的侵袭转移能力弱, 裸鼠致瘤性差, 肿瘤细胞分化程度高, 外源性KRT18过表达可以使肿瘤细胞再分化, 逆转其恶性表型[23-25]. KRT18在MIA-PaCa2(TIChigh)表达较BxPc-3(TIClow)下调3.24倍, 提示其与MIA-PaCa2(TIChigh)的侵袭转移能力强、恶性程度高、分化低相关, 也可能与胰腺癌干细胞的特性相关, 研究KRT18在胰腺癌细胞的发生发展过程中的表达调控机制或能从一个侧面揭示胰腺癌从干细胞到癌细胞的形成; (6)细胞黏附分子: ISM2、ISM2在胎盘中高表达, 在胰腺、肝脏、脑组织等中表达[26], ISM2是一种分泌型蛋白, 最近研究表明其作为血管生成抑制因子能抑制肿瘤生长[27,28]. ISM2在MIA-PaCa2(TIChigh)表达较BxPc-3(TIClow)上调2.06倍, 其在胰腺癌干细胞中的作用需进一步研究; (7)差向异构酶, 参与能量代谢: 甲基丙二酸单酰-coA表异构酶(MCEE)为丙酸代谢通路中的基因, 参与能量代谢, 其在肿瘤和干细胞的中的作用未见报道; (8)转运活性蛋白, 参与细胞内物质运输: ARCN1; (9)参与蛋白质代谢: SFRS1、TRIM28.
差异倍数最大TRIM28(又称TIF1β, KAP-1等)是一种转录中介因子, 在诸多转录调控复合体中起桥梁作用[29]. TRIM28是维持干细胞的"干性"关键基因之一. 研究表明[30], TRIM28在胚胎干细胞(embryonic stem, ES)和胚胎组织中高表达, 在ES分化组织中表达下调, 在胰腺组织中表达极低. RNAi抑制TRIM28的表达能增加分化细胞的百分率. 采用Trim28 ChIP证实TRIM28通过靶向具有多向分化潜能性基因Cnot3、Nanog、Sox2、Tcf3、Il6st和Lefty2启动子区域调节其表达(Trim28-binding sites: GCCGCGXX), 从而维持干细胞的自我更新能力, 是ES自我更新的关键基因之一. 其他研究也证实了TRIM28在ES的"干性"维持方面发挥重要作用[31]. Wolf等[32]研究表明: F9胚胎癌细胞(embryonal carcinoma, EC)发生分化时, KAP-1的表达水平下调, RNAi抑制TRIM28的表达, F9 EC和JM1 ES生长抑制, 细胞发生分化. Seki等[33]研究证实: KAP-1能改变ES的多向分化潜能或是分化状态, 是这两种状态的临界关卡点. TRIM28在具有多向分化潜能的鼠ES高表达, RNAi抑制KAP-1的表达, 鼠ES显示分化状态. 磷酸化的TRIM28和特异性多向分化潜能转录因子Oct3/4形成复合物, 能抑制ES的分化, 维持其多向分化潜能, 诱导iPS细胞(诱导多能干细胞iPS Cell). Cammas等[34]也证实了TRIM28在F9 EC分化中的作用. 此外, KAP-1与肿瘤的侵袭转移、化疗耐药相关. Ho等[35]采用蛋白质组学技术筛选TRIM28与乳腺癌的侵袭转移相关, 并在正常乳腺组织、原位乳腺癌组织以及淋巴结转移组织片中证实. Yokoe等[36]证实TRIM28在胃癌中高表达, 且和胃癌的腹腔播散及不良预后相关. Han等[37]比较结肠癌细胞株HCT-116(具有结肠癌干细胞特性, 对化疗药NSC 724998不敏感)和恶性黑色素瘤细胞株A375(对化疗药NSC 724998敏感)NSC 724998处理前后不同蛋白质表达的变化, 发现TRIM28在治疗后的表达上调, 且TRIM28的Ser824发生磷酸化. TRIM28参与EMT发生[38]. 我们的研究表明: 在MIA-PaCa2(TIChigh)表达较BxPc-3(TIClow)上调10.73倍, Western blot检测表明前者高表达TRIM28, 而后者无表达. 上述研究表明TRIM28可能也参与胰腺癌干细胞的发生, 并发挥重要作用.
总之, 定量蛋白质组学技术是研究肿瘤的一种重要手段. 我们利用该技术初步筛选、鉴定了MIA-PaCa2(TIChigh)和BxPc-3(TIClow)细胞部分差异蛋白, 并对其生物学功能进行数据库分析和文献复习, 这些差异蛋白, 特别是TRIM28可能与胰腺癌干细胞的发生、发展和调控机制相关, 对他们进一步深入研究, 有可能揭示胰腺癌干细胞的发生机制, 为寻找新的治疗靶点奠定基础.
胰腺癌进展快、预后差的主要原因是其早期转移、对传统的治疗抵抗以及较易复发. 当前的研究表明胰腺癌干细胞是上述现象的理论基础. 蛋白质组学, 特别是定量蛋白组学可以从一个细胞或组织的整体角度, 动态、定量地检测差异蛋白的变化, 从而有助于进一步研究这种差异变化的原因, 揭示其发生机制, 寻找新的治疗靶点.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
目前关于胰腺癌干细胞相关差异表达蛋白组学的研究未见文献报道, 主要原因与蛋白质组学研究需要的细胞量大有关, 该文依据新近发表的2篇高质量文献, 采用差异凝胶电泳(DIGE)技术筛选、鉴定胰腺癌干细胞相关差异表达蛋白, 为后续的分子机制的研究奠定基础. DIGE技术在定量差异蛋白筛选方面具有独特的优势.
Kallifatidis等研究,认为具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性; 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率为95.5%, 而BxPc-3的表达率为17.5%; 并认为MIA-PaCa2(TIChigh)与BxPc-3(TIClow)可以直接作为研究胰腺癌干细胞的工具细胞.
目前关于采用胰腺癌细胞系MIA-PaCa2(TIChigh)与BxPc-3(TIClow)作为研究胰腺癌干细胞的工具细胞, 采用DIGE技术筛选、鉴定胰腺癌干细胞相关差异表达蛋白尚未见报道. 本研究发现新的与胰腺癌干细胞发生、发展及调控机制相关的蛋白.
本文筛选的TRIM28是维持干细胞"干性"的关键基因之一, 在胚胎干细胞(ES)和胚胎组织中高表达, 且与肿瘤的侵袭转移、化疗抵抗等特性相关, 深入研究TRIM28在胰腺癌干细胞中的作用和调控机制具有一定价值.
2D-DIGE技术: 是经典2D(双向)电泳技术的成熟与完善, 通过三色荧光染料分别对内标和生物样本进行标志, 能够在一张2D胶上对两个样本的多种蛋白质进行分离, 并分别单独成像, 应用DeCyder 2D软件分析图像, 得到蛋白表达量的丰度变化, 根据数据分析结果准确地发现差异蛋白.
本文选题较为新颖, 研究方法合理, 对胰腺癌干细胞相关差异表达蛋白的探讨具有一定的创新, 有重大科研意义.
编辑: 田滢 电编: 闫晋利
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Tuveson DA, Neoptolemos JP. Understanding metastasis in pancreatic cancer: a call for new clinical approaches. Cell. 2012;148:21-23. [PubMed] [DOI] |
| 3. | Lim KH, Chung E, Khan A, Cao D, Linehan D, Ben-Josef E, Wang-Gillam A. Neoadjuvant therapy of pancreatic cancer: the emerging paradigm? Oncologist. 2012;17:192-200. [PubMed] [DOI] |
| 4. | Rasheed ZA, Matsui W. Biological and clinical relevance of stem cells in pancreatic adenocarcinoma. J Gastroenterol Hepatol. 2012;27 Suppl 2:15-18. [PubMed] [DOI] |
| 5. | Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349-361. [PubMed] [DOI] |
| 6. | Kallifatidis G, Rausch V, Baumann B, Apel A, Beckermann BM, Groth A, Mattern J, Li Z, Kolb A, Moldenhauer G. Sulforaphane targets pancreatic tumour-initiating cells by NF-kappaB-induced antiapoptotic signalling. Gut. 2009;58:949-963. [PubMed] [DOI] |
| 7. | Pan S, Brentnall TA, Kelly K, Chen R. Tissue proteomics in pancreatic cancer study: Discovery, emerging technologies, and challenges. Proteomics. 2012; Nov 2. [Epub ahead of print]. [PubMed] [DOI] |
| 8. | Rausch V, Liu L, Kallifatidis G, Baumann B, Mattern J, Gladkich J, Wirth T, Schemmer P, Büchler MW, Zöller M. Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics. Cancer Res. 2010;70:5004-5013. [PubMed] [DOI] |
| 9. | Zhang C, Kolb A, Büchler P, Cato AC, Mattern J, Rittgen W, Edler L, Debatin KM, Büchler MW, Friess H. Corticosteroid co-treatment induces resistance to chemotherapy in surgical resections, xenografts and established cell lines of pancreatic cancer. BMC Cancer. 2006;6:61. [PubMed] [DOI] |
| 10. | Li C, Chen Z, Xiao Z, Wu X, Zhan X, Zhang X, Li M, Li J, Feng X, Liang S. Comparative proteomics analysis of human lung squamous carcinoma. Biochem Biophys Res Commun. 2003;309:253-260. [PubMed] [DOI] |
| 11. | Cioffi M, Dorado J, Baeuerle PA, Heeschen C. EpCAM/CD3-Bispecific T-cell engaging antibody MT110 eliminates primary human pancreatic cancer stem cells. Clin Cancer Res. 2012;18:465-474. [PubMed] [DOI] |
| 12. | Bryan BA, Dennstedt E, Mitchell DC, Walshe TE, Noma K, Loureiro R, Saint-Geniez M, Campaigniac JP, Liao JK, D'Amore PA. RhoA/ROCK signaling is essential for multiple aspects of VEGF-mediated angiogenesis. FASEB J. 2010;24:3186-3195. [PubMed] [DOI] |
| 13. | Wong CC, Wong CM, Tung EK, Man K, Ng IO. Rho-kinase 2 is frequently overexpressed in hepatocellular carcinoma and involved in tumor invasion. Hepatology. 2009;49:1583-1594. [PubMed] [DOI] |
| 14. | Vigil D, Kim TY, Plachco A, Garton AJ, Castaldo L, Pachter JA, Dong H, Chen X, Tokar B, Campbell SL. ROCK1 and ROCK2 are required for non-small cell lung cancer anchorage-independent growth and invasion. Cancer Res. 2012;72:5338-5347. [PubMed] [DOI] |
| 15. | Ohta T, Takahashi T, Shibuya T, Amita M, Henmi N, Takahashi K, Kurachi H. Inhibition of the Rho/ROCK pathway enhances the efficacy of cisplatin through the blockage of hypoxia-inducible factor-1α in human ovarian cancer cells. Cancer Biol Ther. 2012;13:25-33. [PubMed] [DOI] |
| 16. | Ogawa K, Utsunomiya T, Mimori K, Tanaka Y, Tanaka F, Inoue H, Murayama S, Mori M. Clinical significance of elongation factor-1 delta mRNA expression in oesophageal carcinoma. Br J Cancer. 2004;91:282-286. [PubMed] [DOI] |
| 17. | Shuda M, Kondoh N, Tanaka K, Ryo A, Wakatsuki T, Hada A, Goseki N, Igari T, Hatsuse K, Aihara T. Enhanced expression of translation factor mRNAs in hepatocellular carcinoma. Anticancer Res. 2000;20:2489-2494. [PubMed] |
| 18. | Kawai S, Azuma Y, Fujii E, Furugaki K, Ozaki S, Matsumoto T, Kosaka M, Yamada-Okabe H. Interferon-alpha enhances CD317 expression and the antitumor activity of anti-CD317 monoclonal antibody in renal cell carcinoma xenograft models. Cancer Sci. 2008;99:2461-2466. [PubMed] [DOI] |
| 19. | Wong YF, Cheung TH, Lo KW, Yim SF, Siu NS, Chan SC, Ho TW, Wong KW, Yu MY, Wang VW. Identification of molecular markers and signaling pathway in endometrial cancer in Hong Kong Chinese women by genome-wide gene expression profiling. Oncogene. 2007;26:1971-1982. [PubMed] [DOI] |
| 20. | Wang W, Nishioka Y, Ozaki S, Jalili A, Abe S, Kakiuchi S, Kishuku M, Minakuchi K, Matsumoto T, Sone S. HM1.24 (CD317) is a novel target against lung cancer for immunotherapy using anti-HM1.24 antibody. Cancer Immunol Immunother. 2009;58:967-976. [PubMed] [DOI] |
| 21. | Grützmann R, Boriss H, Ammerpohl O, Lüttges J, Kalthoff H, Schackert HK, Klöppel G, Saeger HD, Pilarsky C. Meta-analysis of microarray data on pancreatic cancer defines a set of commonly dysregulated genes. Oncogene. 2005;24:5079-5088. [PubMed] [DOI] |
| 22. | Nishigaki R, Osaki M, Hiratsuka M, Toda T, Murakami K, Jeang KT, Ito H, Inoue T, Oshimura M. Proteomic identification of differentially-expressed genes in human gastric carcinomas. Proteomics. 2005;5:3205-3213. [PubMed] [DOI] |
| 23. | Bühler H, Schaller G. Transfection of keratin 18 gene in human breast cancer cells causes induction of adhesion proteins and dramatic regression of malignancy in vitro and in vivo. Mol Cancer Res. 2005;3:365-371. [PubMed] [DOI] |
| 24. | Walsh N, O'Donovan N, Kennedy S, Henry M, Meleady P, Clynes M, Dowling P. Identification of pancreatic cancer invasion-related proteins by proteomic analysis. Proteome Sci. 2009;7:3. [PubMed] [DOI] |
| 25. | Song HY, Liu YK, Feng JT, Cui JF, Dai Z, Zhang LJ, Feng JX, Shen HL, Tang ZY. Proteomic analysis on metastasis-associated proteins of human hepatocellular carcinoma tissues. J Cancer Res Clin Oncol. 2006;132:92-98. [PubMed] [DOI] |
| 26. | Rossi V, Beffagna G, Rampazzo A, Bauce B, Danieli GA. TAIL1: an isthmin-like gene, containing type 1 thrombospondin-repeat and AMOP domain, mapped to ARVD1 critical region. Gene. 2004;335:101-108. [PubMed] [DOI] |
| 27. | Xiang W, Ke Z, Zhang Y, Cheng GH, Irwan ID, Sulochana KN, Potturi P, Wang Z, Yang H, Wang J. Isthmin is a novel secreted angiogenesis inhibitor that inhibits tumour growth in mice. J Cell Mol Med. 2011;15:359-374. [PubMed] [DOI] |
| 28. | Yuan B, Xian R, Ma J, Chen Y, Lin C, Song Y. Isthmin inhibits glioma growth through antiangiogenesis in vivo. J Neurooncol. 2012;109:245-252. [PubMed] [DOI] |
| 29. | Yang D, Jiang Y, He FC. [KAP-1, a scaffold protein in transcription regulation]. Yi Chuan. 2007;29:131-136. [PubMed] |
| 30. | Hu G, Kim J, Xu Q, Leng Y, Orkin SH, Elledge SJ. A genome-wide RNAi screen identifies a new transcriptional module required for self-renewal. Genes Dev. 2009;23:837-848. [PubMed] [DOI] |
| 31. | Fazzio TG, Huff JT, Panning B. An RNAi screen of chromatin proteins identifies Tip60-p400 as a regulator of embryonic stem cell identity. Cell. 2008;134:162-174. [PubMed] [DOI] |
| 32. | Wolf D, Goff SP. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 2007;131:46-57. [PubMed] [DOI] |
| 33. | Seki Y, Kurisaki A, Watanabe-Susaki K, Nakajima Y, Nakanishi M, Arai Y, Shiota K, Sugino H, Asashima M. TIF1beta regulates the pluripotency of embryonic stem cells in a phosphorylation-dependent manner. Proc Natl Acad Sci USA. 2010;107:10926-10931. [PubMed] [DOI] |
| 34. | Cammas F, Herzog M, Lerouge T, Chambon P, Losson R. Association of the transcriptional corepressor TIF1beta with heterochromatin protein 1 (HP1): an essential role for progression through differentiation. Genes Dev. 2004;18:2147-2160. [PubMed] [DOI] |
| 35. | Ho J, Kong JW, Choong LY, Loh MC, Toy W, Chong PK, Wong CH, Wong CY, Shah N, Lim YP. Novel breast cancer metastasis-associated proteins. J Proteome Res. 2009;8:583-594. [PubMed] [DOI] |
| 36. | Yokoe T, Toiyama Y, Okugawa Y, Tanaka K, Ohi M, Inoue Y, Mohri Y, Miki C, Kusunoki M. KAP1 is associated with peritoneal carcinomatosis in gastric cancer. Ann Surg Oncol. 2010;17:821-828. [PubMed] [DOI] |
| 37. | Han B, Stockwin LH, Hancock C, Yu SX, Hollingshead MG, Newton DL. Proteomic analysis of nuclei isolated from cancer cell lines treated with indenoisoquinoline NSC 724998, a novel topoisomerase I inhibitor. J Proteome Res. 2010;9:4016-4027. [PubMed] [DOI] |
| 38. | Venkov CD, Link AJ, Jennings JL, Plieth D, Inoue T, Nagai K, Xu C, Dimitrova YN, Rauscher FJ, Neilson EG. A proximal activator of transcription in epithelial-mesenchymal transition. J Clin Invest. 2007;117:482-491. [PubMed] [DOI] |