修回日期: 2012-12-31
接受日期: 2013-01-05
在线出版日期: 2013-01-18
目的: 观察培菲康对高脂饮食诱导大鼠非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)肠道菌群的干预作用及紧密连接蛋白occludin、白介素(interleukin, IL)-17在回肠黏膜上表达的影响.
方法: ♂SD大鼠34只分为高脂饮食组(Ⅰ组, n = 12), 高脂饮食+培菲康干预组(Ⅱ组, n = 12), 普通饮食组(Ⅲ组, n = 10). Ⅱ组予培菲康灌胃, 余下两组分别给予相同剂量生理盐水灌胃. 于喂养17 wk处死各组大鼠, 肝脏组织病理表现提示NAFLD模型成功建立. 采用16S RNA方法检测3组大鼠肠道3种主要细菌数量; 采用透射电镜观察回肠组织超微结构; 免疫组织化学方法观察回肠黏膜occludin蛋白及IL-17量的表达变化.
结果: (1)Ⅰ组、Ⅱ组较Ⅲ组: 肠道3种细菌数量及紧密连接蛋白occludin表达差异均有显著性(P<0.05); (2)Ⅰ组较Ⅱ组: 乳酸杆菌数量、蛋白occludin表达量差异无显著性; (3)IL-17表达在3组间差异有显著性(36.289±30.540 vs 9.646±14.530 vs 2.609±5.850); 此外, 透射电镜下观察到Ⅰ组大鼠肠上皮细胞水肿, 绒毛排列紊乱, 线粒体肿胀、疏松化明显, 并出现坏死细胞, 而经培菲康干预后的大鼠肠上皮损伤减轻.
结论: 培菲康对高脂饮食诱导大鼠NAFLD有一定预防作用, 其作用可能与保护高脂饮食引起的肠黏膜屏障损伤有关.
引文著录: 张智, 单庆文, 王琳琳, 吕自力, 江玲, 黄永二. 培菲康对高脂饮食诱导脂肪肝病大鼠肠黏膜屏障的保护作用. 世界华人消化杂志 2013; 21(2): 130-137
Revised: December 31, 2012
Accepted: January 5, 2013
Published online: January 18, 2013
AIM: To investigate the potential preventive effect of Bifidobacterium triple viable capsule (Bifico) on intestinal microflora and the expression of IL-17 and occludin proteins in ileum mucosa in rats with non-alcoholic fatty liver disease NAFLD induced by a high-fat diet.
METHODS: Thirty-four male Sprague-Dawley rats were divided into three groups and were given a high-fat diet (group Ⅰ, n = 12), a high-fat diet and Bifico (group Ⅱ, n = 12), and an ordinary diet (group Ⅲ, n = 10). Rats of group Ⅱ were given Bifico gavage, while the other two groups were given the same amount of normal saline. Seventeen weeks later, the rats were killed for having a liver biopsy to confirm whether NAFLD was successfully induced. The 16S RNA method was used to detect the numbers of three main types of bacteria in the intestinal tract. The ultrastructure of ileum tissue was observed by electron microscopy, and the expression of occludin and IL-17 proteins was detected by immunohistochemistry.
RESULTS: Compared to group Ⅲ, there was a significant increase in the number of Escherichia coli, Lactobacillus, and Bifidobacteria, and expression of occludin in groups Ⅰ and Ⅱ (all P < 0.05). There was no significant difference in the number of Lactobacillus and expression of occludin between groups Ⅰ and Ⅱ. The expression of IL-17 differed significantly between the three groups (all P < 0.05). Electron microscopy indicated that intestinal epithelial cells in rats given a high-fat diet showed a series of pathological injuries (e.g., hydropsia and necrosis), and the use of Bifico could relieve intestinal epithelial injury.
CONCLUSION: Bifico exerts a preventive effect on non-alcoholic fatty liver disease induced by a high-fat in rats possibly by protecting the intestinal mucosal barrier.
- Citation: Zhang Z, Shan QW, Wang LL, lv ZL, Jiang L, Huang YE. Effect of Bifidobacterium triple viable capsule on intestinal mucosal barrier function in rats with fatty liver induced by a high-fat diet. Shijie Huaren Xiaohua Zazhi 2013; 21(2): 130-137
- URL: https://www.wjgnet.com/1009-3079/full/v21/i2/130.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i2.130
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是我国乃至世界范围内普遍的肝脏性疾病之一, 也是造成慢性肝功能异常的重要原因[1], 其具体机制不明. 大量实验研究表明, NAFLD与肠道菌群之间存在密切联系[2]. 本研究以预防为起点, 通过观察双歧杆菌三联活菌胶囊(培菲康)对NAFLD大鼠肠道菌群的调节作用及对肠道炎症变化的影响, 探讨NAFLD与肠道菌群、肠道黏膜occludin蛋白及肠道炎性因子白介素(interleukin, IL)-17表达之间的关系和相互作用, 为今后的研究提供一定思路.
♂SPF级SD大鼠34只, 体质量130-160 g, 由广西医科大学实验动物中心提供. 高脂饲料由82.5%普通饲料、2%胆固醇、10%猪油、5%蛋黄粉、0.5%三号胆盐组成[3]. 培菲康(上海信谊制药厂)、胆固醇(上海国药集团化学试剂有限公司)、三号胆盐(北京奥博星生物技术有限责任公司)、猪油、蛋黄粉自制; 荧光染料SYBR GreenⅠ(美国罗氏公司)、粪便细菌基因组DNA提取试剂盒离心柱型(北京天根); 兔抗大鼠IL-17单克隆抗体、兔抗occludin多克隆抗体(美国abcam公司); SP试剂盒(北京中杉金桥).
1.2.1 脂肪肝动物模型制备: 适应性喂养1 wk后, 大鼠完全随机分成3组, 高脂饮食组(Ⅰ组, n = 12), 高脂饮食+培菲康灌胃组(Ⅱ组, n = 12), 普通饮食组(Ⅲ组, n = 10). Ⅲ组继续喂予普通饲料, Ⅰ、Ⅱ组均予以高脂饲料喂养, 同时Ⅱ组给予双歧杆菌三联活菌胶囊(商品名培菲康, 含双歧杆菌、乳酸杆菌和肠球菌, 规格每粒210 mg, 含活菌量1亿以上)灌胃, 剂量为280 mg/kg, Ⅰ、Ⅲ组大鼠予以相同剂量生理盐水灌胃. 大鼠每周称体质量一次, 共喂养17 wk.
1.2.2 动物处理: 于造模第17 wk处死各组大鼠. 大鼠隔夜禁食, 次日称体质量后, 以2%戊巴比妥钠0.5 mL/100 g腹腔注射麻醉, 迅速取出肝脏, 称质量后于肝右叶中部切取小块组织, 以10%多聚甲醛固定, 行HE染色和masson染色观察基本组织学变化, 余下组织置于液氮罐内备用. 取盲肠内容物5 g置于2 mL无菌离心管内, 用于细菌定量检测; 在回肠末端2 cm处切取一段1.5 cm肠管, 分成两段, 一段1 cm置于10%多聚甲醛中固定, 用于HE染色和免疫组织化学染色, 另一段0.5 cm置于戊二醛溶液中固定, 用于电镜标本制作.
1.2.3 观察指标及方法: (1)每日观察记录大鼠基本行为学及摄食、饮水变化. 麻醉后, 迅速取出肝脏, 称湿质量, 计算肝指数(肝湿质量/体质量×100%); (2)肝功能及血清脂质变化: 腹主动脉采血2 mL, 分离血清检测谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、胆固醇(cholesterol, CHO)、低密度脂蛋白(low-density lipoprotein, LDL)等, 采用全自动生化分析仪测定; (3)肝、肠组织病理学检测: 将取下的肝、肠组织标本用10%多聚甲醛溶液固定后, 常规脱水, 包埋, 制作成4 μm厚切片, 肝、肠组织行HE染色; 同时对肝脏行masson染色, 光镜下评估脂肪变性、炎症活动和纤维化情况. 肝细胞脂肪变性的程度判断标准炎症活动度计分参照Kleiner等[4]提出的脂肪变性和脂肪肝炎评分标准; (4)肠组织超微结构观察: 取肠组织块切成约1 mm3后, 用2.5%戊二醛前固定, 1%锇酸后固定, 漂洗, 逐级脱水、浸透、固化, 超薄切片机切片70 nm, 枸橼酸铅染色, 在H-7650透射电镜下观察肠黏膜上皮细胞及细胞外基质的超微结构变化; (5)肠组织occludin蛋白、IL-17检测: 紧密连接蛋白occludin蛋白及IL-17免疫组织化学染色采用二步法: 石蜡切片常规脱蜡水化, 蛋白酶K 37 ℃消化10 min, PBS冲洗, 一抗4 ℃过夜, PBS冲洗, 二抗抗体37 ℃ 30 min, PBS冲洗. DAB显色, 镜下控制显色时间, PBS代替一抗作空白对照. 最后结果利用Image-Pro Plus 6.0病理图像分析仪, 采用光密度值法对其进行计数, 求得平均值; (6)3种细菌荧光定量检测: 粪便细菌基因组DNA提取试剂盒(离心柱型)提取大便DNA, 采用SYBR GreenⅠ荧光染料嵌合法检测各组大鼠肠道3种主要细菌. 利用引物设计软件设计双歧杆菌引物, 大肠、乳酸杆菌序列参考国外文献[5,6]. 所选用引物序列分别与全序列在BLAST数据库(http://www.ncbi.nlm.nih.gov/blast)进行比对, 核实其特异性后由上海生工生物工程技术服务有限公司合成. 引物序列(5'-3'): 双歧杆菌上游GGCTCGTAGGCGGTTCGTC, 下游GCCTTCGCCATTGGTGTTCTTC, 157 bp; 大肠杆菌上游GTTAATACCTTTGCTCATTGA[5], 下游ACCAGGGTATCTAATCCTGTT, 340 bp; 乳酸杆菌上游AGCAGTAGGGAATCTTCCA[6], 下游CACCGCTACACATGGAG, 341 bp. PCR反应体系: 荧光染料9 μL, 上、下游引物各0.5 μL, 模板1 μL, 加水至20 μL, 每次试验同时设标准品校正和阴性对照, 每管均设2个副管. 分别提取3种标准菌株(上海信谊药厂有限公司提供)DNA, 换算各标准品1 L的拷贝数, 做10倍系列稀释后分别行实时荧光定量PCR扩增, 生成标准曲线. 每份粪便标本所含3种细菌的拷贝数可通过循环数与标准曲线比较得到, 结果以每克湿便的细菌拷贝数的对数(以10为底数)表示. 反应条件: 95 ℃预变性5 min, 95 ℃变性30 s, 双歧杆菌、大肠杆菌退火温度为59 ℃, 乳酸杆菌61 ℃退火, 72 ℃延伸, 循环40次.
统计学处理 所有资料采用SPSS13.0软件分析. 结果以用mean±SD表示, 均数比较采用单因素方差分析(one-way ANOVA), 两两比较采用LSD法, 线性比较采用相关分析法. 结果以P<0.05为差异有统计学意义.
实验前3组大鼠体质量无显著性差异, 喂养17 wk后, Ⅰ组、Ⅱ组大鼠体质量及肝脏脂肪变性程度均较Ⅲ组大鼠体质量显著升高, 其中Ⅰ组和Ⅱ组大鼠两者比较差异无显著性; 炎症程度比较, 3组之间两两比较差异均显著; 生化结果显示, 与Ⅲ组相比, Ⅰ、Ⅱ组大鼠血清AST、ALT、CHO、LDL、肝指数显著升高; 与Ⅱ组相比, Ⅰ组大鼠血清AST、ALT差异无显著性, 但CHO、LDL及肝指数升高, 差异显著(表1, 2).
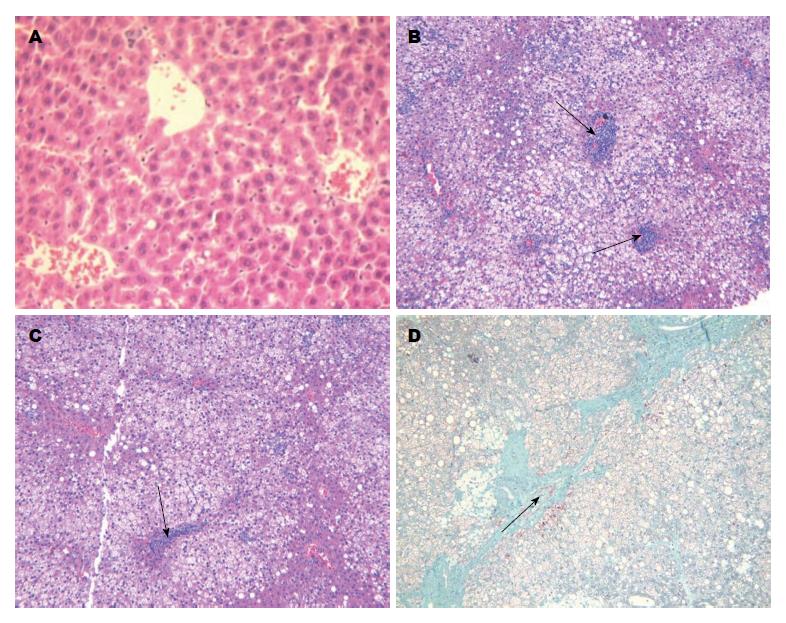
肉眼观察, Ⅲ组大鼠肝脏大体色泽红润, 边缘锐利, 质地柔韧; 与Ⅲ组比, Ⅰ组大鼠肝体积明显增大, 边缘圆钝, 薄膜紧张, 可见大片黄色脂肪样变, 局部切面油腻; Ⅱ组大鼠肝脏与Ⅰ组相比, 可见局部黄色脂肪样变. 光镜下, Ⅲ组大鼠肝脏基本正常(图1A), Ⅰ组大鼠肝脏弥漫性大泡脂肪变性, 肝小叶和汇管区炎性变化显著(图1B). Ⅱ组大鼠肝脏同样出现脂肪变性, 但其炎性变化相比Ⅰ组减轻, 差异显著(图1C). 其中, Ⅰ组大鼠有3例汇管区出现纤维化病变(图1D), Ⅱ、Ⅲ组未见.
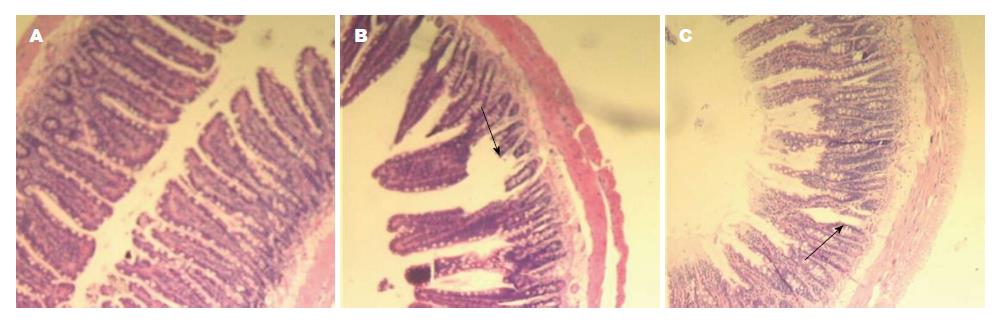
光镜下, Ⅲ组大鼠小肠黏膜绒毛细长, 排列整齐, 紧凑, 表面结构完整, 无充血、水肿等变化(图2A); Ⅰ组大鼠小肠绒毛出现断裂, 缺失, 间隙增宽, 上皮细胞坏死、脱落(图2B); 而Ⅱ组大鼠经培菲康干预后, 绒毛排列较为整齐, 缺失断裂减少(图2C). 电镜下, Ⅲ组大鼠小肠黏膜绒毛排列整齐, 线粒体、内质网、形态正常, 上皮细胞无水肿、空泡变, 细胞结构正常(图3A, D); Ⅰ组大鼠小肠绒毛变短、缺失, 线粒体水肿, 内质网扩张, 细胞正常结构破坏(图3B, E); Ⅱ组在小肠绒毛、线粒体、内质网等细胞器结构方面较为完整(图3C, F).
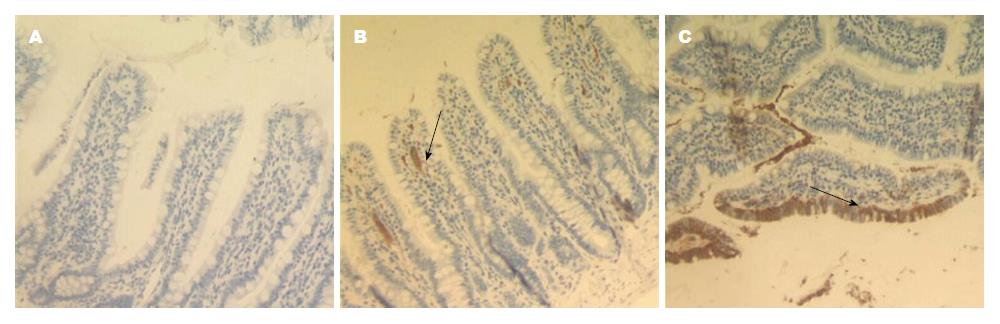
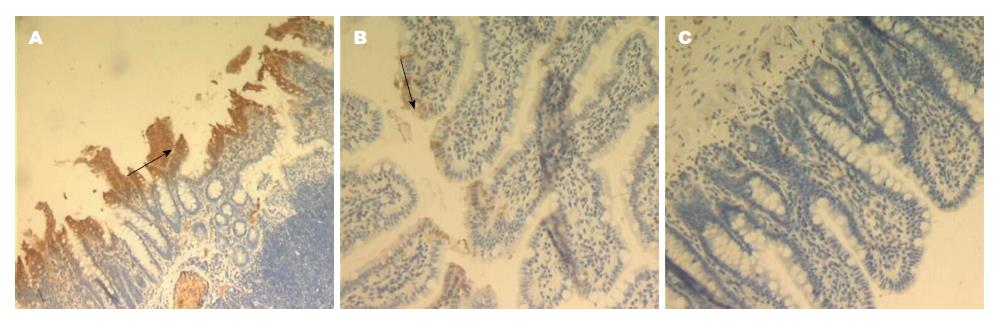
Ⅲ组大鼠回肠黏膜occludin蛋白主要连续分布于黏膜上皮细胞, 为棕黄色染色颗粒(图4C); Ⅰ组occludin蛋白染色散乱, 较 Ⅲ组明显减少(图4A), 两组比较差异显著; 与Ⅰ组相比, Ⅱ组occludin蛋白表达差异无显著性(图4B). IL-17表达方面, Ⅲ组IL-17基本不表达(图5C); Ⅰ组 IL-17主要连续分布于肠黏膜上皮细胞边缘, 主要表达与细胞膜和细胞质, 呈强阳性表达(图5A), 与Ⅲ组比, 阳性表达差异呈显著性; Ⅱ组IL-17呈散在分布表达, 棕褐色染色强度及范围均弱于单纯高脂组(图5B), 两组比较, 差异无显著性(表3).
Ⅰ组、Ⅱ组均和Ⅲ组在双歧杆菌、大肠杆菌和乳酸杆菌表达量上呈显著差异, 其中Ⅰ组、Ⅱ组大肠杆菌数量明显增加, 而双歧杆菌、乳酸杆菌数量则显著减少; 同时, Ⅱ组较Ⅰ组, 大肠杆菌数量减少, 而双歧杆菌数量增加, 但乳酸杆菌量的改变无明显差异. 3组大鼠3种主要细菌数(拷贝数/g湿便)的对数值(表4).
occludin蛋白与肝脏炎症相关性不大(r = 0.089, P = 0.629), 差异无显著性; 而炎症表达因子IL-17与肝脏炎症程度密切相关(r = 0.875, P = 0.000), 差异呈显著性.
肠黏膜屏障是存在于肠道内具有高效选择性功能的屏障系统[7]. 广义的肠黏膜屏障包括机械屏障、生物屏障、免疫屏障和化学屏障, 其主要作用是防止致病物质的入侵和阻止肠腔内细菌及内毒素的移位, 在保持机体内环境稳定方面起重要作用[8-10]. 随着对NAFLD机制的深入探索, 越来越多的研究表明, 这种慢性肝脏性疾病与肠道生物屏障及机械屏障之间存在密切联系, 但其作用机制尚不明确. 本研究旨在探讨培菲康对高脂饮食诱导肪肝病大鼠肠黏膜屏障的影响.
肠生物屏障由肠道常驻菌群中99%左右的专性厌氧菌与其他细菌构成, 组成一个相互依赖又相互作用的微生态系统[11]. 大量肠道细菌主要位居于结肠和远端小肠, 胃、十二直肠、空肠及回肠上端细菌较少[12]. 肠道内常驻菌具有吸收和分解代谢物的功能, 对维持机体生理功能发挥和新陈代谢具有关键作用[13]. 肠道菌群功能的发挥主要包括3个方面, 即营养肠上皮细胞、分解代谢物质和抵抗外来致病菌[14]. 一项研究[15]显示, 肠道菌群的改变可引起肠道通透性的增加, 此时大量炎性物质释放入肠腔, 引起肠道产生炎症反应. IL-17作为一种前炎性细胞因子, 主要由一种新型的CD+效应T细胞Thl7细胞亚群特异性产生, 且主要表达于肠道固有层, 并进一步介导肠道炎症的发展[16-18]. 有研究显示, IL-17有强大的招募中性粒细胞及促进多种细胞因子释放的作用, 被认为参与了机体多种炎性疾病的发生[19-21]. 本研究中, 高脂饮食喂养的两组大鼠肠黏膜上皮细胞IL-17表达均高于普通饮食组大鼠, 且肠黏膜上皮细胞IL-17表达与肝脏炎症程度呈正相关关系. Federico等[22]研究同样显示, 在NAFLD中, Thl7对肝脏损伤起促进作用, 同时与肝脏潜在的脂肪变性有关. 这表明IL-17可能参与了非酒精性脂肪肝炎的发病过程, 同时与肠道黏膜屏障的损伤有关; 而予培菲康干预的大鼠, 肝脏虽然同样出现脂肪炎症改变, 但其肠道黏膜IL-17表达下调, 同时肝脏炎症损伤减轻, 肝脂肪含量减少, 表明益生菌制剂培菲康可减缓大鼠肠道炎症进程, 这可能是培菲康减少嗜中性粒细胞的募集, 降低前炎症反应, 进而保护肝细胞. 机械屏障主要由肠上皮细胞及细胞间连接和黏液层组成, 是肠黏膜屏障最重要的部分. 肠上皮结构的完整能对其所围绕的细胞造成膜质的区域性差异, 使这些区域可进行专一的功能活动, 如离子的定向转运等[23]. 机体在遭受严重感染、炎症及营养障碍等情况时, 机械屏障将受到破坏, 主要表现为肠上皮细胞顶侧的紧密连接的中断. 目前研究认为occludin蛋白是最主要的紧密连接蛋白之一[24], occludin作为一种整体膜蛋白, 是紧密连接的重要组成部分, 对维持肠道上皮细胞之间的连接至关重要, 而肠黏膜屏障功能的发挥则需要依赖完整的上皮细胞屏障[25,26]. 本研究中, 采用免疫组织化学染色观察肠上皮细胞间连接, 可见普通饮食喂养组大鼠小肠上皮occludin蛋白密集表达, 而高脂饮食喂养组分布稀少; 电镜下观察, 普通饮食喂养组其肠绒毛排列紧密, 无断裂、缺失; 高脂饮食喂养组其肠绒毛出现短小、缺失. 这提示非酒精性脂肪肝状态下的大鼠其肠道黏膜机械屏障遭到破坏, 与Miele等[27]和许腊梅等[28]研究结果一致.
本研究采用的益生菌制剂培菲康是双歧杆菌、乳酸杆菌和肠球菌的三联活菌制剂, 通过磷壁酸与肠黏膜上皮细胞紧密结合形成天然的生物屏障. 并定植于肠道, 与致病菌竞争上皮细胞的位点, 可刺激上皮细胞分泌黏液素在黏膜和微生物之间形成保护层, 防止栖生菌异位[29]. 本研究中, 单纯高脂饮食喂养的大鼠肠道内对宿主有益的双歧杆菌、乳酸杆菌数量较普通饮食喂养的大鼠显著性减少, 而致病性大肠杆菌数量显著增多, 同时肝指数明显升高、肝脏炎症变化显著; 经培菲康干预后的大鼠, 其肠道内双歧杆菌数量较单纯高脂饮食喂养大鼠增加, 大肠杆菌数量减少, 肝指数下降, 肝脏炎症反应减轻. 表明益生菌制剂培菲康可通过黏附于肠道上皮或在肠道内形成暂时细菌集落来保护肠黏膜屏障[30], 进而对大鼠脂肪肝起到一定的预防作用. 但本研究中, 经培菲康干预后的大鼠其小肠上皮occludin蛋白表达较单纯高脂组表达量增加不显著. 原因可能在于: 一方面, 培菲康并不能阻止或完全逆转NAFLD的形成, 其主要作用是调整肠道菌群来改善生物屏障; 另一方面, 可能与灌胃剂量不够且干预疗程不足有关. 因此, 在今后的实验中可能要加大灌胃剂量, 同时进一步从分子水平探讨益生菌作用于肠黏膜机械屏障的机制.
非酒精性脂肪性肝病(NAFLD)是目前世界上最为普遍的肝脏疾病之一, 国内外发病率呈明显上升趋势. NAFLD临床上包括单纯性脂肪肝、脂肪性肝炎(NASH)和脂肪性肝硬化3种类型. 其中, NASH可能进展为肝纤维化甚至肝硬化, 发生机制尚不明确.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
益生菌制剂可通过调整肠道菌群减轻肠道炎症反应, 进一步减轻肝脏炎症反应. 这一发现为临床预防和治疗NAFLD提供了一种可能的途径.
Hawrelak等发现, 高脂饮食诱导的脂肪肝小鼠经口服8 wk的乳杆菌PL60治疗后, 小鼠表现出明显的抗肥胖效应, 同时肝脏炎性评分标准显著降低, 肝功能得到有效改善.
本研究中培菲康与高脂饮食造模同时进行, 与既往脂肪肝造模成功后再给予益生菌处理有所不同.
本研究中, 单纯高脂饮食脂肪肝大鼠肠道益生菌减少, 致病菌增多, 肠上皮细胞间紧密连接蛋白occludin表达下降, 同时炎症因子IL-17表达显著升高, 而经培菲康干预后的高脂饮食脂肪肝大鼠体内益生菌数量增加, 致病菌减少, 同时炎症因子IL-17表达减少, 提示NAFLD大鼠炎症表达因子IL-17与肝脏炎症程度密切相关. 益生菌制剂可通过调整肠道菌群抑制或减缓NAFLD的发生及发展.
紧密连接蛋白occludin: 相对分子质量为65 kDa, 由2个细胞外环和2个细胞内环组成, 相邻细胞就是通过外环以拉链状结合而封闭细胞旁间隙. 机体病理情况下可引起occludin分布异常、表达减少, 导致紧密连接结构和功能异常, 细胞间隙增宽, 从而导致内皮间通透性升高.
本文设计合理, 图片翔实, 具有一定学术意义.
编辑: 田滢 电编: 闫晋利
| 1. | Sanyal AJ. NASH: A global health problem. Hepatol Res. 2011;41:670-674. [PubMed] [DOI] |
| 2. | Solga SF, Diehl AM. Non-alcoholic fatty liver disease: lumen-liver interactions and possible role for probiotics. J Hepatol. 2003;38:681-687. [PubMed] [DOI] |
| 3. | 孙 林林, 石 军, 郝 菁华, 任 万华, 阎 春英, 张 捷, 林 晓燕, 崔 彬. 高脂饮食致大鼠非酒精性脂肪性肝炎肝纤维化模型的建立. 临床肝胆病杂志. 2011;27:254-257, 272. |
| 4. | Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41:1313-1321. [PubMed] [DOI] |
| 5. | Malinen E, Kassinen A, Rinttilä T, Palva A. Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology. 2003;149:269-277. [PubMed] [DOI] |
| 6. | Walter J, Hertel C, Tannock GW, Lis CM, Munro K, Hammes WP. Detection of Lactobacillus, Pediococcus, Leuconostoc, and Weissella species in human feces by using group-specific PCR primers and denaturing gradient gel electrophoresis. Appl Environ Microbiol. 2001;67:2578-2585. [PubMed] [DOI] |
| 7. | Kraehenbuhl JP, Pringault E, Neutra MR. Review article: Intestinal epithelia and barrier functions. Aliment Pharmacol Ther. 1997;11 Suppl 3:3-8; discussion 8-9. [PubMed] [DOI] |
| 9. | Harari Y, Weisbrodt NW, Moody FG. Ileal mucosal response to bacterial toxin challenge. J Trauma. 2000;49:306-313. [PubMed] [DOI] |
| 10. | Kiyono H, Kweon MN, Hiroi T, Takahashi I. The mucosal immune system: from specialized immune defense to inflammation and allergy. Acta Odontol Scand. 2001;59:145-153. [PubMed] [DOI] |
| 11. | Fooks LJ, Gibson GR. Probiotics as modulators of the gut flora. Br J Nutr. 2002;88 Suppl 1:S39-S49. [PubMed] [DOI] |
| 12. | Suau A, Bonnet R, Sutren M, Godon JJ, Gibson GR, Collins MD, Doré J. Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut. Appl Environ Microbiol. 1999;65:4799-4807. [PubMed] |
| 13. | Musso G, Gambino R, Cassader M. Gut microbiota as a regulator of energy homeostasis and ectopic fat deposition: mechanisms and implications for metabolic disorders. Curr Opin Lipidol. 2010;21:76-83. [PubMed] [DOI] |
| 14. | Son G, Kremer M, Hines IN. Contribution of gut bacteria to liver pathobiology. Gastroenterol Res Pract. 2010;2010. [PubMed] |
| 15. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 16. | Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, Weaver CT. Interleukin 17-producing CD4 effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol. 2005;6:1123-1132. [PubMed] [DOI] |
| 17. | Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell. 2006;126:1121-1133. [PubMed] [DOI] |
| 18. | Mudter J, Neurath MF. Il-6 signaling in inflammatory bowel disease: pathophysiological role and clinical relevance. Inflamm Bowel Dis. 2007;13:1016-1023. [PubMed] [DOI] |
| 19. | Lindén A, Laan M, Anderson GP. Neutrophils, interleukin-17A and lung disease. Eur Respir J. 2005;25:159-172. [PubMed] [DOI] |
| 20. | Lubberts E, Koenders MI, van den Berg WB. The role of T-cell interleukin-17 in conducting destructive arthritis: lessons from animal models. Arthritis Res Ther. 2005;7:29-37. [PubMed] [DOI] |
| 21. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] [DOI] |
| 22. | Federico A, D'Aiuto E, Borriello F, Barra G, Gravina AG, Romano M, De Palma R. Fat: a matter of disturbance for the immune system. World J Gastroenterol. 2010;16:4762-4772. [PubMed] [DOI] |
| 23. | Nusrat A, Parkos CA, Verkade P, Foley CS, Liang TW, Innis-Whitehouse W, Eastburn KK, Madara JL. Tight junctions are membrane microdomains. J Cell Sci. 2000;113:1771-1781. [PubMed] |
| 24. | Costantini TW, Deree J, Loomis W, Putnam JG, Choi S, Baird A, Eliceiri BP, Bansal V, Coimbra R. Phosphodiesterase inhibition attenuates alterations to the tight junction proteins occludin and ZO-1 in immunostimulated Caco-2 intestinal monolayers. Life Sci. 2009;84:18-22. [PubMed] [DOI] |
| 25. | Guo X, Rao JN, Liu L, Zou T, Keledjian KM, Boneva D, Marasa BS, Wang JY. Polyamines are necessary for synthesis and stability of occludin protein in intestinal epithelial cells. Am J Physiol Gastrointest Liver Physiol. 2005;288:G1159-G1169. [PubMed] [DOI] |
| 26. | Fava F, Danese S. Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol. 2011;17:557-566. [PubMed] [DOI] |
| 27. | Miele L, Valenza V, La Torre G, Montalto M, Cammarota G, Ricci R, Mascianà R, Forgione A, Gabrieli ML, Perotti G. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease. Hepatology. 2009;49:1877-1887. [PubMed] [DOI] |
| 28. | 许 腊梅, 孙 丹莉, 张 予蜀, 张 振玉, 李 晓翠. 紧密连接蛋白occludin在非酒精性脂肪肝大鼠肠上皮细胞中的表达及其与TNF-α的关系. 世界华人消化杂志. 2010;18:981-986. [DOI] |
| 29. | Di Caro S, Tao H, Grillo A, Elia C, Gasbarrini G, Sepulveda AR, Gasbarrini A. Effects of Lactobacillus GG on genes expression pattern in small bowel mucosa. Dig Liver Dis. 2005;37:320-329. [PubMed] [DOI] |
| 30. | Teitelbaum JE, Walker WA. Nutritional impact of pre- and probiotics as protective gastrointestinal organisms. Annu Rev Nutr. 2002;22:107-138. [PubMed] [DOI] |