修回日期: 2010-08-04
接受日期: 2010-08-10
在线出版日期: 2010-09-18
目的: 观察β-胡萝卜素防治肝纤维化的临床疗效.
方法: 63例肝纤维化患者, 按病理分期S0-S1期31例, S2-S4期32例. 口服β-胡萝卜素, 放射免疫分析法测定治疗前后血清透明质酸(HA)、层粘蛋白(LN)、Ⅳ型前胶原(Ⅳ-C), Ⅲ型前胶原肽(PCⅢ), ELISA法测定血清结缔组织生长因子(CTGF)、血小板衍生生长因子-BB(PDGF-BB)、金属蛋白酶抑制剂-1(TIMP-1)、转化生长因子-β1(TGF-β1), 免疫组织化学检查Ⅳ型胶原及Ⅱ型胶原, 并与60例正常人对照分析.
结果: β胡萝卜素治疗前后, 肝纤维化S0-S1、S2-S4期患者HA、LN、Ⅳ-C、PCⅢ有统计学差异(S0-S1: t = 4.917, 2.120, 3.138, 3.583, P<0.01或0.05; S2-S4: t = 5.963, 5.563, 9.162, 4.972, 均P<0.01). S2-S4期患者与正常人比较HA、Ⅳ-C有统计学差异(均P<0.01). 治疗前后肝纤维化S0-S1、S2-S4期患者CTGF、PDGF-BB、TIMP-1、TGF-β1均有统计学差异(S0-S1: t = 4.176, 2.683, 2.098, 2.045, P<0.01或0.05; S2-S4: t = 4.792, 7.519, 2.877, 2.305, 均P<0.01). S2-S4期患者与正常人比较CTGF、PDGF-BB有统计学差异(均P<0.01). 免疫组织化学检测结果表明, 免疫组织化学检查口服β-胡萝卜素后S4期患者病情有所改善.
结论: 口服β-胡萝卜素, 通过调节肝星状细胞的功能, 对S0-S1、S2-S4期患者均有逆转肝纤维化的作用, 是一种很有前景的抗肝纤维化药物.
引文著录: 徐开武, 万德芬, 黄和赞, 刘雄飞, 胡江敏, 刘飞, 罗明, 潘洁, 胡红丁, 冯耀, 万莉萍. β-胡萝卜素对肝纤维化的防治作用. 世界华人消化杂志 2010; 18(26): 2768-2774
Revised: August 4, 2010
Accepted: August 10, 2010
Published online: September 18, 2010
AIM: To observe the clinical efficacy of β-carotene in the treatment of patients with liver fibrosis.
METHODS: Sixty-three patients with liver fibrosis were divided into two groups according to pathological stage: patients with S0-S1 liver fibrosis (n = 31) and those with S2-S4 disease (n = 32). Oral β-carotene was given to all the patients. Sixty healthy volunteers were used as controls. Serum hyaluronic acid (HA), laminin (LN), type IV collagen (IV-C), procollagen III (PCIII), connective tissue growth factor (CTGF), platelet-derived growth factor-BB (PDGF-BB), tissue inhibitor of metalloproteinase-1 (TIMP-1), and transforming growth factor-β1 (TGF-β1) in these subjects were measured by radioimmunoassay and enzyme-linked immunosorbent assay. Immunohistochemistry for IV-C was also performed.
RESULTS: Serum HA, LN, IV-C and PC III showed significant differences in patients with both S0-S1 and S2-S4 liver fibrosis between before and after β-carotene treatment (S0-S1: t = 4.917, 2.120, 3.138, 3.583, P < 0.01 or 0.05; S2-S4: t = 5.963, 5.563, 9.162, 4.972, all P < 0.01). Serum HA and IV-C were statistically significant between patients with S2-S4 liver fibrosis after β-carotene treatment and normal controls (both P < 0.01) Serum CTGF, PDGF-BB, TIMP-1 and TGF-β1 showed significant differences between in patients with both S0-S1 and S2-S4 liver fibrosis between before and after β-carotene treatment (S0-S1: t = 4.176, 2.683, 2.098, 2.045, P < 0.01 or 0.05; S2-S4: t = 4.792, 7.519, 2.877, 2.305, all P < 0.01). Serum CTGF and PDGF-BB were statistically significant between patients with S2-S4 liver fibrosis after β-carotene treatment and normal controls (both P < 0.01). Immunohistochemistry analysis showed that oral β-carotene could improve hepatic fibrosis even in patients with S4 disease.
CONCLUSION: Oral β-carotene can reverse human hepatic fibrosis by regulating the function of hepatic stellate cells and represents a promising anti-hepatic fibrosis drug.
- Citation: Xu KW, Wan DF, Huang HZ, Liu XF, Hu JM, Liu F, Luo M, Pan J, Hu HD, Feng Y, Wan LP. Oral β-carotene can reverse human liver fibrosis. Shijie Huaren Xiaohua Zazhi 2010; 18(26): 2768-2774
- URL: https://www.wjgnet.com/1009-3079/full/v18/i26/2768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i26.2768
肝纤维化是病毒性肝炎、酒精性肝病、非酒精性脂肪肝、中毒性肝病、自身免疫性肝病、胆道阻塞等生物、化学、物理因素导致肝脏损害后的一种修复过程, 胞外基质过度积累而造成肝功能障碍.其中肝星状细胞(hepatic stellate cell, HSC)激活、转化为肌成纤维细胞, 合成大量的细胞外基质(extracellular matrix, ECM), 从而使ECM降解减少, 以致其在肝内大量沉积, 肝纤维化逐渐形成[1]. Safadi等[2]研究表明, 肝纤维化在去除损伤因素后尚有逆转的可能, 这大大激发了人们对肝纤维化诊治的研究. 维生素A(vitA)类在细胞的生长、分化、胚胎形成和个体发育过程中发挥着重要作用. 根据HSC和肝实质细胞(parenchymal cell, PC)在肝纤维化形成过程中具有重要意义的理论[3], 我们对VitA原-天然β-胡萝卜素(nature beta-carotene)逆转肝纤维化的作用进行了研究.
63例受试者, 男40例, 女23例, 年龄23-61(平均43.52±17.47)岁. 其中慢性肝炎肝纤维化[4]患者28例, 酒精性肝病肝纤维化[5]16例, 非酒精性肝纤维化[6]19例. 另选健康体检60例正常者, 男39例, 女21例, 年龄25-58(平均44.12±16.73)岁. 63例病理检查纤维化分期, S0-S1期31例, S2-S4期32例. 血清结缔组织生长因子(connective tissue growth factor, CTGF)、血小板衍生生长因子-BB(platelet-derived growth factor-BB, PDGF-BB)、生物素-亲合素ELISA测定试剂盒购自Rapidbio Lab; 金属蛋白酶抑制剂-1(tissue inhibitors of metalloproteinase, TIMP-1)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)ELISA试剂盒购自Invitrogen公司. Bio-RadModel680酶联仪, 购自美国Bio-Rad公司. 天然β-胡萝卜素由广州佛山海力土药业公司生产.
1.2.1 入选标准: (1)HBV、HCV感染、过量饮酒、营养不良、慢性缺氧、胆汁淤积等; (2)年龄18-65岁, 性别不限; (3)病程在6 mo以上; (4)肝纤维化[血清透明质酸(hyalaronic acid, HA)、层粘蛋白(laminin, LN)、Ⅳ型前胶原(type Ⅳ collagen, Ⅳ-C)、III型前胶原肽(type Ⅲ procollagen, PCⅢ)]指标异常或任意一项指标高于正常值的2倍以上者; (5)知情同意, 志愿受试, 获得知情同意书过程应符合国家有关规定.
1.2.2 排除标准: (1)合并HAV, HDV, HEV感染者; (2)HBV所致的重型肝炎、失代偿期肝硬化和肝癌患者; (3)长期酗酒者、精神病患者及孕妇; (4)合并有心脑血管、呼吸、泌尿和造血系统等严重原发病者; (5)凝血机制异常者; (6)18岁以下或65岁以上的患者.
1.2.3 组织样本取材: 外科医生腹腔镜下, 使用电刀取得肝组织(直径1-2 cm), 由病理医师作出肝组织病理学诊断. 纤维化分期按文献[7]报道分为纤维化程度高(S2-S4)和纤维化程度低(S0-S1).
1.2.4 血清肝纤维化指标检测: 肝取组织后第2天, 受试者空腹从肘静脉采血5 mL, 1 500 r/min, 离心15 min, 取血清置40℃冰箱保存. 血清HA、LN、Ⅳ-C、PCⅢ采用放射免疫分析仪(西安FJ-2008P型)测定.
1.2.5 肝组织免疫组织化学法检测: 所有标本均经40 g/L的中性甲醛固定, 常规脱水、石蜡切片, 4 µm厚连续切片, 依次进行HE、Masson三色染色及网状纤维染色、免疫组织化学染色及原位杂交, 保证实验在同等条件下进行, 以减少实验的误差. 每个标本各选5张片子做图像分析.
1.2.6 治疗: 所有患者给予天然β-胡萝卜素每粒10 mg, 每日2次, 每次1粒, 空腹口服. 每3 mo 1疗程, 1疗程后停服7 d, 再服1疗程, 共计6 mo.
统计学处理 数据用mean±SD表示, 采用同体及配对对照t检验方法.
β-胡萝卜素治疗前后, 肝纤维化S0-S1、S2-S4期患者HA、LN、Ⅳ-C、PCⅢ有统计学差异(均P<0.05或0.01), 治疗后肝纤维化S0-S1期患者与正常人比较HA、LN、Ⅳ-C、PCⅢ没有统计学差异, S2-S4期患者与正常人比较HA、Ⅳ-C有统计学差异(P<0.01), LN、PCⅢ没有统计学差异(表1).
| 分组 | n | HA(µg/L) | LN(kU/L) | Ⅳ-C(µg/L) | PCⅢ(ng/L) | |
| 正常组 | 60 | 20.79±10.26 | 0.91±0.28 | 84.05±24.16 | 0.47±0.29 | |
| S0-S1 | 31 | 治疗前 | 38.14±15.02 | 1.08±0.33 | 138.82±89.78 | 0.78±0.38 |
| 治疗后 | 21.47±11.43 | 0.92±0.26 | 86.24±25.34 | 0.48±0.27 | ||
| t值 | 4.917 | 2.120 | 3.138 | 3.583 | ||
| P值 | <0.01 | <0.05 | <0.01 | <0.01 | ||
| S2-S4 | 32 | 治疗前 | 53.54±22.14 | 1.43±0.39 | 155.29±22.04 | 1.08±0.58 |
| 治疗后 | 27.54±10.87b | 0.94±0.31 | 98.45±27.31b | 0.51±0.29 | ||
| t值 | 5.963 | 5.563 | 9.162 | 4.972 | ||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 |
β-胡萝卜素治疗前后, 肝纤维化S0-S1、S2-S4期患者CTGF、PDGF-BB、TIMP-1、TGF-β1均有统计学差异(均P<0.05或0.01). 治疗后肝纤维化S0-S1期患者与正常人比较CTGF、PDGF-BB、TIMP-1、TGF-β1没有统计学差异, S2-S4期患者与正常人比较CTGF、PDGF-BB有统计学差异(P<0.01), TIMP-1、TGF-β1没有统计学差异(表2).
| 分组 | n | CTGF(µg/L) | PDGF-BB(µg/L) | TIMP-1(µg/L) | TGF-β1(ng/L) | |
| 正常组 | 60 | 4.53±1.21 | 2.81±0.57 | 136.86±56.24 | 15.40±5.22 | |
| S0-S1 | 31 | 治疗前 | 6.14±1.85 | 3.34±0.91 | 164.34±46.23 | 19.02±8.16 |
| 治疗后 | 4.49±1.19 | 2.83±0.54 | 136.92±56.21 | 15.46±5.23 | ||
| t值 | 4.176 | 2.683 | 2.098 | 2.045 | ||
| P值 | <0.01 | <0.01 | <0.05 | <0.05 | ||
| S2-S4 | 32 | 治疗前 | 12.87±6.18 | 7.34±2.72 | 203.56±92.84 | 21.43±9.96 |
| 治疗后 | 7.52±1.30b | 3.42±1.14b | 149.03±53.62 | 16.78±5.57 | ||
| t值 | 4.792 | 7.519 | 2.877 | 2.305 | ||
| P值 | <0.01 | <0.01 | <0.01 | <0.05 |
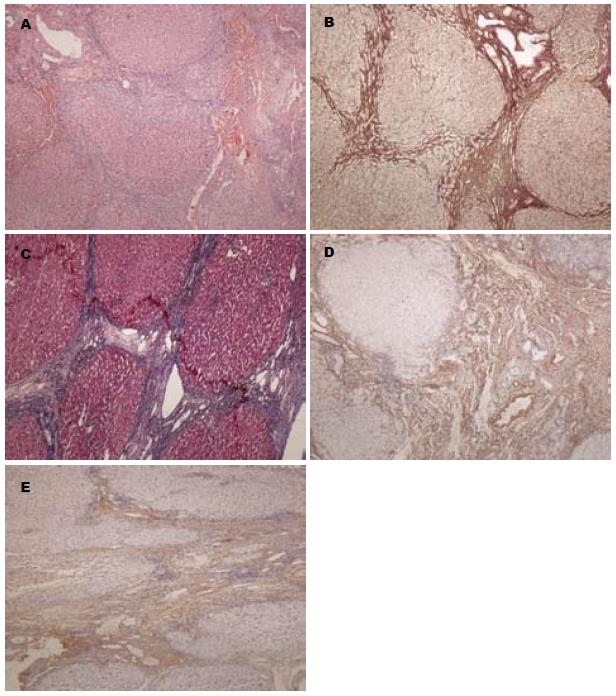
β胡萝卜素治疗前镜下示, 肝实质广泛破坏, 弥漫性纤维增生, 被分隔的肝细胞团呈不同程度的再生及假小叶形成; 纤维间隔宽大疏松, 纤维间隔内胆小管增生, 大量炎症细胞浸润, 界面明显(图1A); 网染显示宽窄不一的纤维间隔包绕大小不等的肝细胞结节(图1B); Masson显示宽窄不一的纤维间隔包绕大小不等的肝细胞结节(图1C); Ⅳ型胶原密集分布于纤维间隔中(图1D); Ⅱ型胶原较稀疏分布于纤维间隔中(图1E).
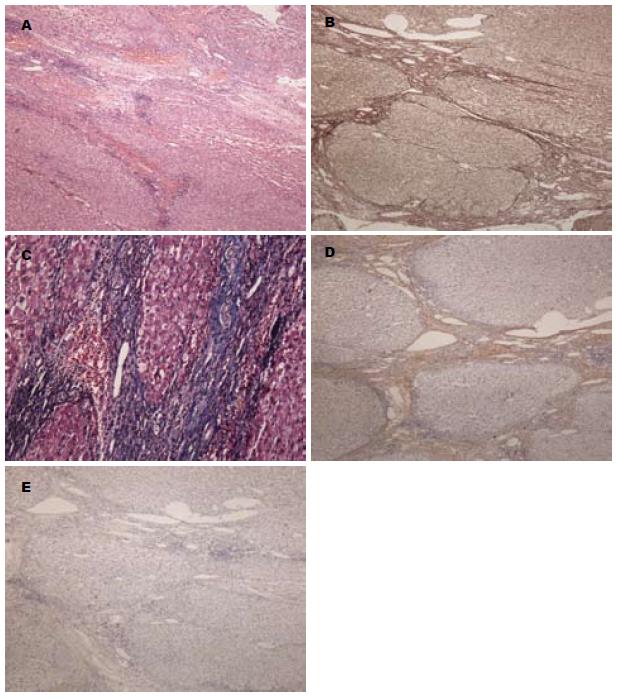
β-胡萝卜素治疗后镜下示肝实质较广泛破坏, 弥漫性纤维增生, 被分隔的肝细胞团呈不同程度的再生及假小叶形成; 纤维间隔宽大疏松, 纤维间隔内胆小管增生, 大量炎症细胞浸润, 界面明显(图2A); 网染显示宽窄不一的纤维间隔包绕大小不等的肝细胞结节(图2B); Masson显示宽窄不一的纤维间隔包绕大小不等的肝细胞结节(图2C); Ⅳ型胶原较稀疏分布于纤维间隔中(图2D); Ⅱ型胶原稀疏分布于纤维间隔中(图2E).
肝纤维化是对慢性刺激的创伤愈合反应, 具有ECM蛋白(Ⅰ型胶原聚多)过度沉淀的特征, 这改变肝脏的结构导致肝脏功能障碍. HSC激活在肝纤维化期间是引起胶原过度沉淀的主要原因. 在纤维化形成过程中有两个重要方面: 其一、由合成的EMC蛋白将HSC直接使纤维生成; 其次、被激活的HSC增生, 进一步促进了纤维生成反应. 虽然HSC被激活的确切机制还不完全清楚, 实际上在HSC中, 已获得了ECM产生和细胞增生的分子机制. 激活的HSC引起两种因子增生, 即血小板衍化生成因子和纤维生成TGF-β1. 很显然这些细胞因子激活细胞分裂活化蛋白激酶(mitogen-activated protein kinase, MAPK)发信号, 包括P38、局部黏附磷脂酰肌醇3-激酶-AKt-P70S6激酶[FAK-P13K-AKt-P70(S6K)]发级联信号, 他们共同调节增生反应, 促进细胞分裂周期的过程以及胶原的表达. 此外, 由Smad蛋白介导的TGF-β1发送信号和P38 MAPK影响胶原的表达. 已发现Smad和P38 MAPK在P38 MAPK时由转录激活单独地和累积地调节胶原基因(molecular mechanisms of hepatic fibrogenesis)的表达, 引起Ⅰ型胶原合成增加和沉淀[8], 这预示了HSC增生和ECM过度产生的分子机制, 并可确定肝纤维化新的治疗目标.
肝纤维化是急性损伤中肝脏没有发生任何疤痕变化和合并症, 在慢性损伤过程由于ECM过度沉积造成肝脏大部组织形成纤维化状态, ECM过度沉积造成肝纤维化, 从而肝纤维化发展成肝硬化的过程. 肝硬化是一个不可逆和慢性肝病的最后阶段, 为了阻断肝硬化的发展, 在病毒和免疫学领域开始了各种形式的研究. 目前, 肝纤维化的研究已深入到分子生物学领域, HSC在由ECM积累引起的肝纤维化过程起了关键性的作用. 肝纤维化的级别依据HSC的增殖、激活和胶原产物增加的程度. 因此, 抑制HSC的活性是阻止肝纤维化形成的主要途径, 许多因素, 如氧化应激、乙醛、维生素C、TGF-β1和四氯化碳(CCl4)有激活HSC和刺激胶原表达的作用[9-11], 虽然没有确切有效的抗纤维化剂, 但可能的候选者有抗氧化剂、干扰素、类视黄醇、象β-胡萝卜素黄酮类[12]、肾素血管紧张素抑制剂, 氧化物酶增殖激活γ-受体(peroxidase proliferator activated receptor γ, PPARγ)拮抗剂.
肝纤维化是常见的肝脏病, 主要表现为肝内ECM的产生和降解之间失去平衡引起ECM过度增生和异常积聚. 肝纤维化时, 肝内及HSC内vitA的含量及视黄酸受体(retinoic acid receptor, RAR)一类维生素AX受体(βRXR)-amRNA水平降低, 缺乏vitA可促进肝纤维化, 同时vitA可阻止肝纤维化的形成[13-16]. 其阻止肝纤维化形成的机制可能有: (1)调节HSC的增殖和分化[17]; (2)影响胶原等ECM的合成; (3)影响ECM的降解[18]. 由此可以推断, vitA阻止肝纤维化的作用是通过调节ECM而产生的. ECM一项重要的生理作用是贮存vitA脂滴, ECM在向肌成纤维细胞转化的过程中, 脂质中的vitA脂滴逐渐丢失, 可见vitA对ECM的转化有抑制作用[19]. 采用vitA逆转肝纤维化国外已有大量的报道, 但由于vitA中起主要作用的物质是视黄醇[20], 这种物质过量会产生毒性, 因此我们采用vitA前体物质β-胡萝卜素逆转肝纤维化.
本研究采用β-胡萝卜素胶囊治疗不同分期的肝纤维化患者, 通过血清HA[21]、LN、Ⅳ-C、PCⅢ、CTGF、PDGF-BB、TIMP-1、TGF-β1的免疫组织化学检查来判断β-胡萝卜素逆转肝纤维化的效果. HA、LN、Ⅳ-C、PCⅢ为肝纤维化诊断指标已被国内外许多学者的研究结果证实[22-25], 由于他的非创伤性特点, 现已广泛用于临床. 我们的研究结果表明, β-胡萝卜素治疗前后, 肝纤维化S0-S1、S2-S4期患者HA、LN、Ⅳ-C、PCⅢ有统计学差异, 治疗后肝纤维化S0-S1期患者与正常人比较HA、LN、Ⅳ-C、PCⅢ没有统计学差异, S2-S4期患者与正常人比较HA、Ⅳ-C有统计学差异, LN、PCⅢ没有统计学差异, 血清HA、LN、Ⅳ-C、PCⅢ水平可从不同侧面反映慢性肝炎与肝硬化患者肝细胞炎症和坏死程度, 间接地反映肝纤维化的程度. 我们研究的病例虽然是在肝活检病理检查的基础上再行4项指标的放射免疫检测, 但诊断结果和病理结果相一致.
研究显示, 某些细胞因子在HSC活化以及ECM生成中起着非常关键的作用, 其中TGF-β1是肝纤维化进展中重要的细胞因子, 在肝纤维化组织中TGF-β1明显增加[26], TGF-β1诱导细胞外基质的产生等功能是通过下游效应元件CTGF基因起作用的[27]. 使用免疫组织化学和Northern blot以及分子探针技术已证实肝纤维化组织中CTGF表达水平明显高于正常肝组织[28]. 王念跃等[29]用ELISA法检测慢性肝炎患者血清中的CTGF, 发现其和肝纤维化程度明显相关. 本项研究进一步印证了这一点.
PDGF-BB由Kupffer细胞和活化的HSC产生, 是强有力的HSC有丝分裂原, 在HSC活化和肝纤维化形成中均发挥重要作用. 阻止PDGF-BB与其受体结合可以明显减少HSC的增殖和抑制肝纤维化的发展[30]. 本项研究中, 血清PDGF-BB和肝纤维化程度明显相关, 诊断肝纤维化的准确性也比较高, 是一种有价值的肝纤维化的标志物. 血清TIMP-1虽然和肝纤维化分期有一定的相关性, 但我们的研究显示重症肝纤维化患者肝纤维化水平, β-胡萝卜素胶囊治疗后, 只能适当改善, 但血清TIMP-1水平难以恢复正常水平.
本研究从血清HA、LN、Ⅳ-C、PCⅢ、CTGF、PDGF-BB、TIMP-1、TGF-β1与免疫组织化学检测结果证明了β-胡萝卜素对S0-S1、S2-S4期患者均有逆转肝纤维化的作用. β-胡萝卜素是vitA前体, 他不仅具有vitA逆转肝纤维化的作用, 而且我们的临床观察证实长时间使用β-胡萝卜素无任何不良反应, 他是一种很有前景的抗肝纤维化药物.
肝纤维化的病理改变是以胶原为主的细胞外基质(ECM)过量增生与异常沉积. 在肝纤维化期间肝星状细胞(HSC)激活是引起胶原过度沉积的主要原因, 他具有贮存维生素A脂滴的生理作用. HSC在向肌成纤维细胞转化的过程中, 胞质中的维生素A脂滴逐渐丢失, 由此推断维生素A类可抑制HSC的活化. β-胡萝卜素作为维生素A前体, 除具有维生素A应有的活性外, 尚具有其独特的生物特征, 且大剂量应用不会产生对机体有害的不良反应.
吴俊华, 副主任医师, 南京大学医学院功能评价中心
一些研究表明, 肝纤维化在去除损伤因素后尚有逆转的可能, 这大大激发了人们对肝纤维化诊治的研究. 目前, 肝纤维化的研究已深入到分子生物学领域.
研究显示, 某些细胞因子在HSC活化以及ECM生成中起着非常关键的作用, 其中TGF-β1是肝纤维化进展中重要的细胞因子, 在肝纤维化组织中TGF-β1明显增加.
抑制肝星状细胞活化是防治肝纤维化的关键途径, 而许多基础医学研究表明作为维生素A前体, 可抑制肝星状细胞活化, 从而起到抗肝纤维化的作用. 本文将β-胡萝卜素用于临床抗慢性肝炎、酒精性肝病、非酒精性肝病引起的肝纤维化, 并采用肝纤维化4项指标、生化指标、免疫组织化学检测验证了β-胡萝卜素抗肝纤维化的有效作用.
本研究从血清HA、LN、Ⅳ-C、PCⅢ、CTGF、PDGF-BB、TIMP-1、TGF-β1与免疫组织化学检测结果证明了β-胡萝卜素对S0-S1、S2-S4期患者均有逆转肝纤维化的作用. β-胡萝卜素是vitA的前体, 他不仅具有vitA逆转肝纤维化的作用, 而且临床观察证实了长时间使用β-胡萝卜素无任何不良反应, 他是一种很有前景的抗肝纤维化药物.
本文选题尚可, 具有较高的学术价值和临床应用价值.
编辑: 李军亮 电编:吴鹏朕
| 2. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 3. | 黄 光存. 肝内维生素A类信号转导与肝纤维化. 国外医学•生理病理科学临床分册. 2000;20:109-111. |
| 5. | 中华医学会肝病学分会. 脂肪肝和酒精性肝病学组酒精性肝病诊疗指南. 2008年消化及内镜学术交流大会论文汇编. 2008;12-14. |
| 7. | Afdhal NH, Curry M. Technology evaluation: a critical step in the clinical utilization of novel diagnostic tests for liver fibrosis. J Hepatol. 2007;46:543-545. [PubMed] [DOI] |
| 8. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 9. | Lee KS. [Hepatic fibrogenesis]. Korean J Gastroenterol. 2006;48:297-305. [PubMed] |
| 10. | Wardi J, Reifen R, Aeed H, Zadel L, Avni Y, Bruck R. Beta-carotene attenuates experimentally induced liver cirrhosis in rats. Isr Med Assoc J. 2001;3:151-154. [PubMed] |
| 11. | Yadav D, Hertan HI, Schweitzer P, Norkus EP, Pitchumoni CS. Serum and liver micronutrient antioxidants and serum oxidative stress in patients with chronic hepatitis C. Am J Gastroenterol. 2002;97:2634-2639. [PubMed] [DOI] |
| 12. | Siems W, Salerno C, Crifò C, Sommerburg O, Wiswedel I. Beta-carotene degradation products - formation, toxicity and prevention of toxicity. Forum Nutr. 2009;61:75-86. [PubMed] [DOI] |
| 13. | Floreani A, Baragiotta A, Martines D, Naccarato R, D'odorico A. Plasma antioxidant levels in chronic cholestatic liver diseases. Aliment Pharmacol Ther. 2000;14:353-358. [PubMed] [DOI] |
| 15. | Vitaglione P, Morisco F, Caporaso N, Fogliano V. Dietary antioxidant compounds and liver health. Crit Rev Food Sci Nutr. 2004;44:575-586. [PubMed] [DOI] |
| 17. | Naves MM, Silveira ER, Dagli ML, Moreno FS. Effects of beta-carotene and vitamin A on oval cell proliferation and connexin 43 expression during hepatic differentiation in the rat(1). J Nutr Biochem. 2001;12:685-692. [PubMed] [DOI] |
| 19. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor betar response and signaling during trandifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1049-1102. [PubMed] [DOI] |
| 20. | Knook DL, Bosma A, Seifert WF. Role of vitamin A in liver fibrosis. J Gastroenterol Hepatol. 1995;10 Suppl 1:S47-S49. [PubMed] [DOI] |
| 21. | Eboumbou C, Steghens JP, Abdallahi OM, Mirghani A, Gallian P, van Kappel A, Qurashi A, Gharib B, De Reggi M. Circulating markers of oxidative stress and liver fibrosis in Sudanese subjects at risk of schistosomiasis and hepatitis. Acta Trop. 2005;94:99-106. [PubMed] [DOI] |
| 22. | 李 保森, 辛 绍杰, 张 双福, 邹 正升, 毛 远丽. 对几种肝纤维化诊断指标的评价. 中华实验和临床病毒学杂志. 2000;14:289. |
| 28. | Paradis V, Dargere D, Vidaud M, De Gouville AC, Huet S, Martinez V, Gauthier JM, Ba N, Sobesky R, Ratziu V. Expression of connective tissue growth factor in experimental rat and human liver fibrosis. Hepatology. 1999;30:968-976. [PubMed] [DOI] |