修回日期: 2008-02-26
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 系统评价MUC1对胰腺导管腺癌的诊断价值.
方法: 通过检索获得公开发表的研究免疫组化技术检测MUC1诊断胰腺导管腺癌的文献, 筛选文献, 评价文献质量并提取纳入文献中有关准确度的数据, 采用MetaDiSc1.4软件检验研究间的异质性、对诊断准确度指标进行Meta分析并进行综合受试者工作特征分析.
结果: 17篇文献符合纳入标准, 涉及研究对象1363例. 异质性检验无阈值效应, 但存在其它异质性. Meta分析的结果显示MUC1诊断胰腺癌的总敏感度0.83(95% CI 0.81-0.86)、总特异度0.63(95% CI 0.59-0.66)、总诊断优势比20.44(95% CI 9.53-43.85). 综合受试者工作特征曲线下面积0.8879, Q*指数为0.8185.
结论: MUC1检测对胰腺癌的诊断准确度中等, 可作为胰腺癌筛查的检查方法.
引文著录: 江志敏, 杨琼, 陈邓林, 毕卓菲, 林显敢, 刘天浩, 李志花, 谢德荣. MUC1对胰腺导管腺癌诊断效能的Meta分析. 世界华人消化杂志 2008; 16(11): 1248-1253
Revised: February 26, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To systematically assess the diagnostic performance of MUC1 for pancreatic ductal adenocarcinoma.
METHODS: A comprehensive search was performed to retrieve relevant studies on detecting immunohistochemical expression of MUC1 in the diagnosis of pancreatic ductal adenocarcinoma. Data on accuracy of included studies were extracted for further heterogeneity exploring, statistical pooling and SROC (summary receiver operating characteristics) analyzing using the MetaDiSc1.4 software.
RESULTS: Seventeen studies were selected, with 1363 patients involved. The heterogeneity (except for threshold effect) was found in these studies. The pooled accuracy indicators like sensitivity, specificity, and diagnostic odds ratio (DOR) were 0.83 (95% CI: 0.81-0.86), 0.63 (95% CI: 0.59-0.66), and 20.44 (95% CI: 9.53-43.85), respectively. The area under of SROC curve was 0.8879 and the Q index was 0.8185.
CONCLUSION: The meta-analysis indicates a moderate diagnostic accuracy of MUC1 for pancreatic ductal adenocarcinoma. It can be an optional method in the examination of pancreatic cancer.
- Citation: Jiang ZM, Yang Q, Chen DL, Bi ZF, Lin XG, Liu TH, Li ZH, Xie DR. Diagnostic performance of MUC1 for pancreatic ductal adenocarcinoma: a meta-analysis. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1248-1253
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1248.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1248
胰腺癌的发病率呈逐年升高的趋势且预后极差, 早期难以诊断, 确诊时约80%以上的患者属于晚期, 总体5年生存率不足10%[1]. 在胰腺恶性肿瘤中, 90%以上为导管腺癌. 尽管影像诊断技术日益进步, 如何早期确诊胰腺癌仍是一个难题. 研究显示黏液素-1(MUC1)与胰腺癌密切相关, 但各家报道不一, 并且样本量较少其结果难以完全信服. 因此, 本文通过Meta分析, 探讨MUC1对胰腺癌的诊断价值.
以MEDLINE数据库、EMBASE数据库、中国生物医学文献数据库(CBMdisc)、中国期刊网全文数据库(CNKI)等为主要来源进行检索, 并对纳入研究的参考文献进行二次检索. 文献截止时间为2007-11-31. 中文检索词为"胰腺肿瘤"、"胰腺癌"和"黏液素-1"等; 英文检索词为"pancreatic cancer", "pancreatic neoplasms", "pancreatic carcinoma", "pancreatic adenocarcinoma", "pancreas", "MUC1"和"mucin 1"等.
1.2.1 纳入与排除标准: 纳入标准: (1)研究类型为公开发表的应用免疫组化技术检测胰腺癌MUC1的诊断试验研究; (2)研究对象为经病理组织学证实的胰腺导管腺癌患者; (3)必须能从文献全文或摘要中获得完整的四格表数据以计算敏感性、特异性. 排除标准: (1)金标准不是病理组织学证据; (2)研究对象为导管腺癌以外的恶性胰腺肿瘤或转移性胰腺癌; (3)检测MUC1方法不是应用免疫组化技术; (4)无法获得诊断四格表数据; (5)综述类文章.
1.2.2 研究的筛选和质量评价: 因诊断试验大多是非随机临床试验, 本文参照STARD(standards for reporting studies of diagnostic accuracy)声明[2], 及Devillé et al[3]关于诊断试验Mata分析的指南, 同时结合本研究自身特点制作量表, 对MUC1在胰腺癌的诊断试验的质量进行评价, 见表1. 量表分为内部质量标准及外部质量标准两部分. 内部标准主要是分析是否设立金标准(病理学证据)、诊断试验与金标准的结果判读是否互相独立解释、是否由两个或多个病理科医生独立阅片、文献的设计类型、样本量的大小, 外部参照标准则针对原发疾病(胰腺导管腺癌)的临床分期分级、选择偏倚、诊断试验的实施过程、阈值的具体描述. 就每个条目给予评分(0.5/1是; 0否或未知). 由2位研究者独立进行方法学质量评价, 交叉核对, 共同讨论及取得共识.
| 标准 | 评分 |
| 内部 | |
| 金标准 | |
| 病理标准 | 1/0 |
| 金标准未参考MUC1结果的判读 | 1/0 |
| MUC1结果的判读未参考金标准 | 1/0 |
| ≥2人阅片对MUC1进行评价 | 1/0 |
| 设计类型 | |
| 前瞻性 | 1 |
| 回顾性/不确定 | 0.5 |
| 样本量 | |
| ≥40 | 1 |
| <40 | 0.5 |
| 外部 | |
| 肿瘤分期分级 | |
| 分期 | 0.5/0 |
| 分级 | 0.5/0 |
| 选择偏倚 | |
| 连续性 | 1/0 |
| MUC1免疫组化技术 | |
| 具体描述方法过程 | 1/0 |
| 阈值的解释 | |
| 具体描述MUC1阈值的界定 | 1/0 |
1.2.3 诊断效能评价指标: 诊断效能(准确度)评价指标包括: 敏感度、特异度、诊断优势比(diagnostic odds ratio, DOR)以及综合受试者工作特征(summary receiver operating characteristics, SROC)曲线下面积(area under curve, AUC)和Q*指数. 其中Q*指数为SROC曲线与直线(TPR+FPR = 1, 即敏感度 = 特异度)相交处的敏感度, Q*指数越大, 表示诊断试验的准确度越大.
统计学处理 提取纳入研究的诊断四格表和临界值等数据, 将其录入到MetaDiSc1.4软件, 然后进行统计学处理. Spearman相关分析检查有无阈值效应(threshold effect)引起的异质性; 对其他异质性、敏感度和特异度采用卡方检验, 如P>0.05, 且I2≤50%时无异质性, 采用固定效应模型, 反之存在异质性, 则采用随机效应模型对准确性指标进行汇总处理. 检验水准为α = 0.05. 汇总处理Meta分析获取上述准确性指标的汇总值及其95%可信区间.
最初检索得相关文献211篇, 经筛选、补充和二次检索, 18篇文献符合纳入标准, 其中1篇文献[4]因其灵敏度 = 1-特异度, 理论上属于完全无价值的诊断[5], 统计软件自动删除不纳入统计分析, 最后共17篇文献纳入研究, 其中中文3篇, 英文14篇[6-22], 包括病例组和对照组病例1363例. 各研究的基本特征见表2.
| 第一作者 | 发表年份 | 国家TP | 阳性性FP | 假阳性FN | 假阴TN | 阴性值 | 临界 |
| 王义[6] | 2007 | China | 31 | 4 | 7 | 12 | 5% |
| 高志强[7] | 2006 | China | 29 | 3 | 14 | 12 | 10% |
| 张海生[8] | 2005 | China | 40 | 10 | 12 | 20 | 10% |
| Giorgadze[9] | 2006 | USA | 25 | 7 | 5 | 6 | |
| Okada[10] | 2006 | Japan | 9 | 3 | 5 | 30 | 10% |
| Ohuchida[11] | 2006 | Japan | 23 | 18 | 0 | 21 | |
| Tajiri[12] | 2005 | Japan | 10 | 0 | 0 | 8 | 30% |
| Ueda[13] | 2005 | Japan | 21 | 6 | 0 | 18 | |
| Chhieng[14] | 2003 | USA | 23 | 1 | 1 | 10 | |
| Terris[15] | 2002 | France | 79 | 11 | 11 | 46 | |
| Kim[16] | 2002 | USA | 51 | 94 | 13 | 37 | 10% |
| Adsay[17] | 2002 | USA | 86 | 23 | 50 | 92 | 10% |
| Yonezawa[18] | 2002 | Japan | 44 | 4 | 2 | 29 | 5% |
| Lüttges[19] | 2001 | Germany | 35 | 20 | 0 | 29 | 10% |
| Masaki[20] | 1999 | Japan | 55 | 3 | 0 | 6 | |
| Terada[21] | 1996 | Japan | 25 | 25 | 0 | 2 | 33% |
| Osako[22] | 1993 | Japan | 33 | 0 | 3 | 11 | 5% |
共17篇文献纳入研究, 按文献质量评估量表(表1)评估标准, 具体评分见表3. 从内部标准看, 所有研究均设立金标准(病理学证据). 所有研究的金标准的诊断未参考MUC1结果的判读, 但MUC1结果的判读未能提示是在没有参考临床资料或病理诊断的情况下作出诊断的. 仅有4个研究明确是两位阅片人, 余研究均未提及. 所有研究均为回顾性研究. 其中2个研究的样本量偏少(<40). 从外部资料看, 大多数研究均未报道胰腺癌的分期、分级. 所有研究均未能显示是连续选择病例. 仅3个研究未详细描述免疫组化技术方法, 但研究间采用的试剂和仪器不尽相同. 3个研究未详细报道阈值的界定, 但研究间阈值设定的数值或方法不完全相同. 内外质量评分汇总分数在3.5-6.5之间, 平均5.4分.
| 第一作者 | 内部IV | 外部EV | 总分 | ||||||||||
| IV1 | IV2 | IV3 | IV4 | IV5 | IV6 | EV1 | EV2 | EV3 | EV4 | IV | EV | ||
| 王义[6] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 0 | 1 | 3.5 | 1 | 4.5 |
| 高志强[7] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0.5 | 0 | 1 | 1 | 3.5 | 2.5 | 6 |
| 张海生[8] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0.5 | 0 | 1 | 1 | 3.5 | 2.5 | 6 |
| Giorgadze[9] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Okada[10] | 1 | 1 | 0 | 1 | 0.5 | 1 | 0 | 0 | 1 | 1 | 4.5 | 2 | 6.5 |
| Ohuchida[11] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Tajiri[12] | 1 | 1 | 0 | 0 | 0.5 | 0.5 | 0 | 0 | 1 | 1 | 3 | 2 | 5 |
| Ueda[13] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Chhieng[14] | 1 | 1 | 0 | 1 | 0.5 | 0.5 | 0 | 0 | 1 | 0 | 4 | 1 | 5 |
| Terris[15] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 0 | 0 | 3.5 | 0 | 3.5 |
| Kim[16] | 1 | 1 | 0 | 1 | 0.5 | 1 | 0 | 0 | 1 | 1 | 4.5 | 2 | 6.5 |
| Adsay[17] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Yonezawa[18] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Lüttges[19] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 0 | 1 | 3.5 | 1 | 4.5 |
| Masaki[20] | 1 | 1 | 0 | 1 | 0.5 | 1 | 1 | 0 | 1 | 0 | 4.5 | 2 | 6.5 |
| Terada[21] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
| Osako[22] | 1 | 1 | 0 | 0 | 0.5 | 1 | 0 | 0 | 1 | 1 | 3.5 | 2 | 5.5 |
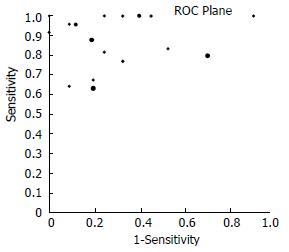
由于临界值不同导致敏感度、特异度、诊断优势比等的差异而产生阈值效应, 因此首先检验是否存在阈值效应. 当存在阈值效应时, 敏感度与特异度呈阴性关联(与1-特异度呈阳性关联), 从而ROC平面散点分布呈典型的"肩臂形"样式(shoulder arm); Spearman相关分析提示强阳性关联. 本研究中, 可见MetaDiSc1.4软件输出的ROC平面散点图不是典型的"肩臂形"外观(图1), 同时Spearman相关系数rs = 0.270, P = 0.295, 提示敏感度与1-特异度呈阴性关联, 不存在阈值效应. 然后对其他来源的异质性进行检验, 结果提示各研究之间敏感度(χ2 = 118.69, P = 0.000, I2 = 86.5%)、特异度(χ2 = 180.66, P = 0.000, I2 = 91.1%)、DOR(Cochran-Q = 67.92, P = 0.000, I2 = 76.4%)均存在异质性.
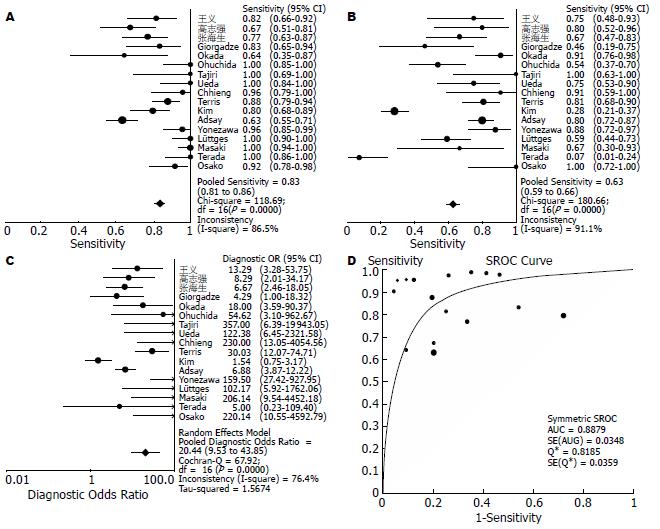
由于异质性检验提示各研究之间敏感度、特异度和DOR结果之间均存在异质性, 故Meta分析合并效应量时采用随机效应模型. 最后得到的敏感度、特异度、和DOR等汇总值分别为0.83(95% CI: 0.81-0.86)、0.63(95% CI: 0.59-0.66)、20.44(95% CI: 9.53-43.85). SROC AUC为0.8879, Q*指数为0.8185(图2).
胰腺癌是相对高发且预后极差的肿瘤, 确诊时多属晚期, 如何早期确诊胰腺癌是临床医生的一道难题. B超、CT和MRI等对小于1.0 cm的病灶显示较差; 最常用的临床检查是血清肿瘤标志物的免疫分析, 如CA199、CEA、CA125和CA153等糖蛋白, 这些抗原属肿瘤相关抗原, 在消化道、呼吸道和泌尿-生殖道上皮细胞中广泛合成、分泌和表达, 在胰腺炎、胰腺良性病变及其他肿瘤性病变中均有不同程度的表达, 缺乏特异性[23]. 因此有必要探索更敏感而特异的胰腺癌标志物.
MUC1是一种高糖基化、高分子量的糖蛋白, 起润滑和保护上皮组织的作用, 并且参与上皮细胞的更新、细胞黏着的调节和细胞信号的传导[24]. 正常腺上皮细胞有较低水平的MUC1表达,但在肿瘤细胞可存在MUC1异常表达和糖基化的异常, 从而成为一种潜在的肿瘤生物学标志物[25]. 目前有关MUC1在不同胰腺癌组织分型、胰腺炎、胰腺上皮内瘤变等胰腺疾病的表达有不同报道, 因为导管腺癌占胰腺恶性肿瘤的90%以上, 本文希望通过Meta分析定量描述MUC1在胰腺导管腺癌诊断中的应用价值.
本研究经文献检索共17篇文献纳入研究, 经质量评分平均分为5.4分, 属于中等质量.经异质性检验提示各研究之间敏感度、特异度、DOR均存在异质性. 采用随机效应模型统计得到的敏感度为0.83(95% CI: 0.81-0.86), 特异度为0.63(95% CI: 0.59-0.66), DOR为20.44(95% CI: 9.53-43.85); SROC曲线下面积(AUC)为0.8879, Q*指数为0.8185. 敏感性较高, 但特异性中等, Q*指数在0.7-0.9之间表示诊断价值为中等. 但本文的分析仍存在以下问题: (1)所有研究的MUC1结果的判读未能独立于金标准, 即缺乏盲法, 且存在选择偏倚, 这些都可能会导致诊断偏倚从而过高估计了诊断效能. (2)研究的临界值设定不尽相同. 虽然不存在阈值效应, 纳入的研究临界值从5%-33%不等, 有少数研究只要有散在细胞着色即判断为阳性或未提及具体临界值. (3)各个研究结果判断的标准不一. 研究间免疫组化结果的判定有联合着色细胞百分比及着色强度分级综合进行评价的, 也有仅凭着色细胞百分比数值进行评价的. 部分研究强调MUC1着色部位位于胞质才能判断为阳性, 其他研究则着色胞膜和/或胞质即为阳性. (4)研究间对照组病例设定不均质, 疾病类型包括正常胰腺组织、慢性胰腺炎、胰腺上皮内瘤变(PanN)、胰腺导管内乳头状黏液肿瘤(IPMN)、胰腺黏液性囊性肿瘤(MCN)等. (5)各研究的设计和试验方法不同, 研究间采用的诊断试剂和检测仪器来源不同. (6)研究间采用的金标准准确度不一, 3个研究[6,9,14]采用胰腺穿刺组织, 其结果可能受到穿刺操作者和病理医师水平、经验的影响. 另MUC1结果的判定采用目视法易受观察者主观因素的影响. (7)少数研究的样本量偏少. (8)部分研究采用的组织蜡块跨越时间较长, 可能存在抗原丢失难以修复从而影响试验结果的诊断.
本文定量综合分析MUC1对胰腺导管腺癌的诊断研究结果, 系统评估MUC1的诊断价值, 结果提示MUC1诊断胰腺导管腺癌效能属于中等, 可作为胰腺导管腺癌筛查的可选检查之一, 以提高胰腺癌的早期诊断.但MUC1免疫组化检测须要获得脏器组织, 带有创伤性, 有必要进一步研究非创伤性检查手段, 如设计靶向载体介导MUC1特异性表达于胰腺脏器等, 以便广泛推广临床应用.
胰腺癌的早期确诊率低, 现有影像学检查难以早期发现病灶, 而血清肿瘤标志物缺乏特异性, 有必要探索更敏感而特异的胰腺癌标志物. 研究显示在肿瘤细胞可存在MUC1异常表达, 而正常腺上皮细胞仅有较低水平的MUC1表达, 其可成为一种潜在的肿瘤生物学标志物.
施瑞华, 教授, 南京医科大学第一附属医院消化科
胰腺癌确诊时多属晚期, 如何提高胰腺癌早期确诊率是一道难题. 研究提示黏液素-1(MUC1)与胰腺癌密切相关, 但各家报道不一, 并且样本量较少其结果难以完全信服.
目前有关MUC1在不同胰腺癌组织分型、胰腺炎、胰腺上皮内瘤变等胰腺疾病的表达有不同报道, 因为导管腺癌占胰腺恶性肿瘤的90%以上.
本文通过Meta分析, 定量描述MUC1在胰腺导管胰腺癌诊断中的应用价值.
本文显示MUC1诊断胰腺导管腺癌效能属于中等, 可作为胰腺癌筛查检查.
本文采用Meta分析研究MUC1对胰腺导管腺癌的诊断效能, 方法合理, 数据真实可信, 具有较好的科学性.
编辑: 李军亮 电编:吴鹏朕
| 2. | Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig LM, Lijmer JG, Moher D, Rennie D, de Vet HC. Towards complete and accurate reporting of studies of diagnostic accuracy: the STARD initiative. Clin Chem Lab Med. 2003;41:68-73. [PubMed] |
| 3. | Devillé WL, Buntinx F, Bouter LM, Montori VM, de Vet HC, van der Windt DA, Bezemer PD. Conducting systematic reviews of diagnostic studies: didactic guidelines. BMC Med Res Methodol. 2002;2:9. [PubMed] |
| 4. | 袁 玫, 金 永轼. Tn, 涎酸Tn抗原及其核心多肽在胰腺癌的表达. 细胞与分子免疫学杂志. 1991;3:43. |
| 9. | Giorgadze TA, Peterman H, Baloch ZW, Furth EE, Pasha T, Shiina N, Zhang PJ, Gupta PK. Diagnostic utility of mucin profile in fine-needle aspiration specimens of the pancreas: an immunohistochemical study with surgical pathology correlation. Cancer. 2006;108:186-197. [PubMed] |
| 10. | Okada T, Masuda N, Fukai Y, Shimura T, Nishida Y, Hosouchi Y, Kashiwabara K, Nakajima T, Kuwano H. Immunohistochemical expression of 14-3-3 sigma protein in intraductal papillary-mucinous tumor and invasive ductal carcinoma of the pancreas. Anticancer Res. 2006;26:3105-3110. [PubMed] |
| 11. | Ohuchida K, Mizumoto K, Yamada D, Fujii K, Ishikawa N, Konomi H, Nagai E, Yamaguchi K, Tsuneyoshi M, Tanaka M. Quantitative analysis of MUC1 and MUC5AC mRNA in pancreatic juice for preoperative diagnosis of pancreatic cancer. Int J. Cancer. 2006;118:405-411. [PubMed] |
| 12. | Tajiri T, Tate G, Inagaki T, Kunimura T, Inoue K, Mitsuya T, Yoshiba M, Morohoshi T. Intraductal tubular neoplasms of the pancreas: histogenesis and differentiation. Pancreas. 2005;30:115-121. [PubMed] |
| 13. | Ueda M, Miura Y, Kunihiro O, Ishikawa T, Ichikawa Y, Endo I, Sekido H, Togo S, Shimada H. MUC1 overexpression is the most reliable marker of invasive carcinoma in intraductal papillary-mucinous tumor (IPMT). Hepatogastroenterology. 2005;52:398-403. [PubMed] |
| 14. | Chhieng DC, Benson E, Eltoum I, Eloubeidi MA, Jhala N, Jhala D, Siegal GP, Grizzle WE, Manne U. MUC1 and MUC2 expression in pancreatic ductal carcinoma obtained by fine-needle aspiration. Cancer. 2003;99:365-371. [PubMed] |
| 15. | Terris B, Dubois S, Buisine MP, Sauvanet A, Ruszniewski P, Aubert JP, Porchet N, Couvelard A, Degott C, Fléjou JF. Mucin gene expression in intraductal papillary-mucinous pancreatic tumours and related lesions. J Pathol. 2002;197:632-637. [PubMed] |
| 16. | Kim GE, Bae HI, Park HU, Kuan SF, Crawley SC, Ho JJ, Kim YS. Aberrant expression of MUC5AC and MUC6 gastric mucins and sialyl Tn antigen in intraepithelial neoplasms of the pancreas. Gastroenterology. 2002;123:1052-1060. [PubMed] |
| 17. | Adsay NV, Merati K, Andea A, Sarkar F, Hruban RH, Wilentz RE, Goggins M, Iocobuzio-Donahue C, Longnecker DS, Klimstra DS. The dichotomy in the preinvasive neoplasia to invasive carcinoma sequence in the pancreas: differential expression of MUC1 and MUC2 supports the existence of two separate pathways of carcinogenesis. Mod Pathol. 2002;15:1087-1095. [PubMed] |
| 18. | Yonezawa S, Nakamura A, Horinouchi M, Sato E. The expression of several types of mucin is related to the biological behavior of pancreatic neoplasms. J Hepatobiliary Pancreat Surg. 2002;9:328-341. [PubMed] |
| 19. | Lüttges J, Zamboni G, Longnecker D, Klöppel G. The immunohistochemical mucin expression pattern distinguishes different types of intraductal papillary mucinous neoplasms of the pancreas and determines their relationship to mucinous noncystic carcinoma and ductal adenocarcinoma. Am J Surg Pathol. 2001;25:942-948. [PubMed] |
| 20. | Masaki Y, Oka M, Ogura Y, Ueno T, Nishihara K, Tangoku A, Takahashi M, Yamamoto M, Irimura T. Sialylated MUC1 mucin expression in normal pancreas, benign pancreatic lesions, and pancreatic ductal adenocarcinoma. Hepatogastroenterology. 1999;46:2240-2245. [PubMed] |
| 21. | Terada T, Ohta T, Sasaki M, Nakanuma Y, Kim YS. Expression of MUC apomucins in normal pancreas and pancreatic tumours. J Pathol. 1996;180:160-165. [PubMed] |
| 22. | Osako M, Yonezawa S, Siddiki B, Huang J, Ho JJ, Kim YS, Sato E. Immunohistochemical study of mucin carbohydrates and core proteins in human pancreatic tumors. Cancer. 1993;71:2191-2199. [PubMed] |
| 23. | Bassi C, Salvia R, Gumbs AA, Butturini G, Falconi M, Pederzoli P. The value of standard serum tumor markers in differentiating mucinous from serous cystic tumors of the pancreas: CEA, Ca 19-9, Ca 125, Ca 15-3. Langenbecks Arch Surg. 2002;387:281-285. [PubMed] |
| 24. | Lan MS, Batra SK, Qi WN, Metzgar RS, Holling-sworth MA. Cloning and sequencing of a human pancreatic tumor mucin cDNA. J Biol Chem. 1990;265:15294-15299. [PubMed] |
| 25. | von Mensdorff-Pouilly S, Snijdewint FG, Verstraeten AA, Verheijen RH, Kenemans P. Human MUC1 mucin: a multifaceted glycoprotein. Int J Biol Markers. 2000;15:343-356. [PubMed] |