修回日期: 2008-03-08
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 研究DLC-1基因甲基化检测与肝细胞癌(hepatocellular carcinoma, HCC)复发转移的关系.
方法: 73例HCC标本依据临床以及病理学特征被分为高侵袭组和低侵袭组; 采用甲基化特异性PCR对不同侵袭组HCC之间DLC-1基因甲基化表达进行分析.
结果: DLC-1甲基化表达率高侵袭组明显高于低侵袭组, 二者之间有明显差异(χ2 = 4.3567, P<0.05). DLC-1甲基化阳性与阴性患者之间AFP、HBV双阳性率有明显差异(χ2 = 4.4224, P<0.05); TNM分期越后DLC-1甲基化程度越高(χ2 = 10.8478, P<0.05); 短期随访发现DLC-1甲基化的HCC患者中位生存期低于非甲基化患者(9.45 mo vs 36 mo, P<0.05).
结论: DLC-1基因甲基化可作为HCC复发转移监测指标, 并可作为靶向治疗HCC复发转移的新靶点.
引文著录: 刘继斌, 张素青, 施民新, 邵冰锋, 张一心. DLC-1基因甲基化检测与肝细胞癌复发转移的关系. 世界华人消化杂志 2008; 16(11): 1237-1240
Revised: March 8, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the relationship between the methylation status of DLC-1 gene and metastasis of hepatocellular carcinoma (HCC).
METHODS: Seventy-three surgical specimens of human HCC were divided into high- and low-invasion groups according to their clinicopathological features. The methylation status of DLC-1 gene was detected in both groups by methylation-specific polymerase chain reaction (MSP).
RESULTS: The methylation level of DLC-1 gene in HCC specimens with high invasion was significantly higher than that in specimens with low invasion (χ2 = 4.3567, P < 0. 05). The double-positive rate of alpha-fetoprotein (AFP) and hepatitis B virus (HBV) was significantly different between methylation-positive and -negative specimens (χ2 = 4.4224, P < 0.05). The methylation status of DLC-1 gene was also related to TNM stages (χ2 = 10.8478, P < 0.05). After short-term following-up, the median survival time was significantly different between HCC patients with positive- and negative methylation of DLC-1 gene (9.45 mo vs 36 mo, P < 0.05).
CONCLUSION: The aberrant methylation of DLC-1 gene may not only offer an effective method for the early auxiliary diagnosis of invasion and metastasis, but also serve as an new target for HCC therapies.
- Citation: Liu JB, Zhang SQ, Shi MX, Shao BF, Zhang YX. Relationship between methylation status of DLC-1 gene and metastasis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1237-1240
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1237
肝癌是严重危害人类生命健康的重大疾病, 肝癌手术切除后, 生存率约40%左右, 但仍然有50%左右的患者手术后出现转移复发. DLC-1基因定位于人类染色体8p21.3-22[1]. 研究发现DLC-1基因在肝癌、乳腺癌、结直肠癌中常低表达或表达缺失[2]. 而DNA启动子甲基化的改变通常是作为肿瘤抑制基因未被激活的机制[3-4]. 研究显示甲基化是在肝癌, 乳腺癌, 肠癌和前列腺癌中DLC-1表达低下的原因[5]. DLC-1基因甲基化在HCC复发转移的作用未见有报道. 通过甲基化特异性PCR技术检测分析DLC-1基因甲基化在不同转移潜能临床手术标本中的表达, 为进一步研究DLC-1基因甲基化在肝细胞癌复发转移中的作用奠定基础.
收集2005-03/2006-10南通大学附属肿瘤医院73例肝细胞癌(hepatocellular carcinoma, HCC及癌旁正常组织(其中12例含癌栓)手术切除标本, 标本均经过病理证实. 标本离体10 min内取材, 液氮速冻5 min后放置-80℃保存. HCC依据临床以及病理学特征被分为高侵袭组和低侵袭组, 肿瘤病灶局限、肉眼以及镜下均无肝内播散和门静脉浸润为低侵袭组, 共32例; 肿瘤组织伴有多发性肝内播散和(或)门静脉主干癌栓者为高侵袭组, 共41例. 德国Biometra温度梯度PCR扩增仪; ECPS3000/150电泳仪; 美国Beckman AllegraTM RA 64R高速低温离心机; 美国BIO-RAD公司凝胶图像分析仪. 参考Wong et al[7]根据GenBank的DLC-1甲基化引物由上海生工公司设计合成, DLC-1甲基化引物为(从-31到+147 bp): 5'-TTTAAAGAT CGAAACGAGGGAGCG-3'(forward)和5'-CCCAACGAAAAAACCCGACTAACG-3'(reverse). 非甲基化引物为(从-28到+144 bp): 5'-TTTTTTAAAGATTGAAATGAGGGAGTG-3'(forward)和5'-AAACCCAACAAAAAAACCCAACTA ACA-3'(reverse).
1.2.1 DNA提取: DNA提取试剂盒采用上海闪晶生物公司临床标本基因组DNA抽提试剂盒. 严格按照操作说明, 具体如下: (1)用手术剪将标本剪成小块, 用液氮将50 mg左右样品碾碎转移, 加入200 mL LB, 电动匀浆, 然后将样品转移到1.5 mL离心管中, 彻底混匀室温10 min. (2)加入200 mL氯仿, 剧烈振动20 s, 然后15 000 r/min离心5 min, 取上清液转入吸附柱, 9000 r/min离心1 min, 弃滤液. (3)在吸附柱内加500 mL清洗液, 9000 r/min离心1 min, 弃滤液. (4)再15 000 r/min离心2 min, 以彻底去除残余. (5)将吸附柱重新放在一新离心管中, 加入50 mL洗脱液EB. (6)10 000 r/min离心1 min, 收集到管内的溶液即为核酸溶液, 紫外分光光度计测定DNA含量, 吸光度A260/A280≥1.8, 4℃保存备用.
1.2.2 DNA甲基化处理: DNA甲基化处理采用美国Zymo Research公司的EZ DNA Methylation-Gold KitTM试剂盒. 严格按照操作说明, 实验前混匀CT保存试剂, 即加900 mL水M-Dissolving缓冲液和300 mL M-Dilution缓冲液到一个试管. 加130 mL CT保存试剂和20 mL DNA样品混合. 按照以下温度程序步骤操作, 98℃ 10 min, 64℃ 2.5 h, 最后放置4℃备用. 加660 mL M-Binding缓冲液到Zymo-spin IC吸附柱中, 再加样品盖紧盖子, 颠倒混合几分钟. 全速10 000 r/min离心1 min, 倒掉离心液. 加20 mL M-Desulphonation缓冲液到吸附柱中, 放置15-20 min. 全速10 000 r/min离心1 min. 加200 mL M-Wash缓冲液到吸附柱中, 重复这种步骤多次. 加10 mL M-Elution缓冲液直接到吸附柱基质, 放置到1.5 mL试管全速10 000 r/min离心2 min, 直至分离出所需处理DNA.
1.2.3 MSP反应: 甲基化PCR反应体系为10×PCR缓冲液2.5 mL, 2.0 mmol/L 4×dNTP混合物0.5 mL, 引物3 mL, TaKaRaTM热启动Taq酶0.5 mL, 25 mmol/L MgCl2 2 mL, 模板3 mL, 总体积25 mL, 甲基化扩增体系为预变性95℃ 12 min, 随后94℃ 30 s, 55℃ 30 s, 72℃ 30 s, 35个循环, 最后延伸72℃ 10 min, 非甲基化扩增体系除了退火温度提高到58℃外其他均相同. 扩增产物1%琼脂糖凝胶电泳, 紫外光照显带.
对进行MSP反应的全部HCC患者进行随访, 生存期计算从治疗开始日起到死亡或2006-03末次随访结束.
统计学处理 采用SPSS10.0统计软件分析, 卡方检验, P<0.05有统计学意义.
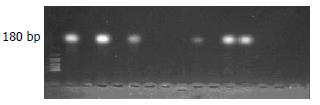
73例HCC临床标本中, 41例高侵袭组中12例DLC-1甲基化表达阳性, 阳性率为29.3%, 32例低侵袭组中3例DLC-1甲基化表达阳性, 阳性率为9.375%; 二者之间有明显的差异(χ2 = 4.3567, P<0.05, 图1).
73例HCC患者中, 17例DLC-1甲基化阳性占23.3%; 癌旁正常组织组均无1例甲基化阳性. 17例DLC-1甲基化阳性患者中AFP, HBV双阳性者为16例占94.11%; 56例DLC-1甲基化阴性患者中AFP, HBV双阳性者为42例占73.0%; 二者之间有明显的差异(χ2 = 4.4224, P<0.05).
73例HCC患者中, Ⅰ期14例, 甲基化阳性1例(7.14%); Ⅱ期18例, 甲基化阳性2例(11.1%); Ⅲ期20例, 甲基化阳性5例(20.0%); Ⅳ期21例, 甲基化阳性7例(33.3%). 因Ⅰ期, Ⅱ期甲基化阳性太少需要合并统计处理, 合并后三者之间有明显的差异(χ2 = 10.8478, P<0.05).
17例甲基化阳性的HCC患者中, 12例复发或转移, 占70.6%; 56例非甲基化阳性者中, 21例复发或转移, 占37.5%, 二者之间有明显的差异(χ2 = 5.7641, P<0.05). HCC患者生存期1-20(中位生存期11.52) mo, 其中甲基化患者中位生存期9.45 mo, 非甲基化患者中位生存期14.36 mo, DLC-1甲基化的HCC患者中位生存期低于非甲基化患者(P<0.05).
DLC-1全称为肝癌缺失基因1, 是一种肿瘤抑制基因; 位于人类染色体8p21.3-22位置, 在人类许多肿瘤中发现在这个位置上是缺失的. DLC-1 cDNA全长为7.5 kb编码1083个氨基酸的分子量122 kDa的一种蛋白, 与大鼠p122 RhoGAP基因有86%的同源, 后者是GTP酶的激动蛋白, 通过刺激GTP酶的活性调控Rho蛋白[7]. Durkin et al[12]研究认为DLC-1与小鼠p122同源, 与调控细胞增殖和黏附的信号传导通路关系密切. Ng et al[6]在 DLC-1缺失的肝癌细胞系中转染DLC-1 cDNA后发现其明显的抑制了肿瘤细胞的生长并且降低了克隆信息. DLC-1在原发性HCC中发挥抑制癌细胞增殖的功能. Wong et al[7]研究显示Rho GTP酶信号传导通路在HCC的侵袭转移中有重要作用. 现已发现DLC-1基因表达产物为RhoA和Cdc42特异性的GTP酶激活蛋白, 与调控细胞增殖和黏附的信号传导通路关系密切, 主要通过下调Rho的活性而抑制肿瘤. 研究发现DLC-1基因在肝癌、乳腺癌、结直肠癌中常低表达或表达缺失. 而DNA启动子甲基化的改变通常是作为肿瘤抑制基因未被激活的机制. Esteller et al[13]在多种类型的肿瘤中发现了其基因的过甲基化. Kim et al[14]运用Northern和Southern blot研究发现在9例人类消化系肿瘤细胞系中有7例没有表达DLC-1 mRNA而不是DLC-1基因. 为此该学者使用甲基化特异性PCR(MSP)和Southern blot研究DLC-1的甲基化, 发现在7例中有5例没有表达DLC-1 mRNA的消化系肿瘤细胞系中DLC-1 CpG岛发生了甲基化. 研究发现甲基化是在肝癌, 乳腺癌, 肠癌, 和前列腺癌中DLC-1表达低下的原因. Goodison et al[8]研究发现DLC作为转移抑制基因, 通过GTP酶活性抑制肿瘤的转移. Ueki et al[15]研究发现在细胞系中抑癌基因DNA发生甲基化的, 其来源的原代细胞中也同样发生了甲基化. Yuan et al[5]认为DNA甲基化改变是癌变早期发现, 早期预测和癌症风险预后的最可能的指标之一, 大范围硬癌和血液恶性病变DLC-1甲基化的检测是有警示意义的. 结合众多学者的研究, 我们推测DLC-1基因甲基化在肝细胞癌侵袭转移中发挥着重要的作用. 目前有关DNA甲基化与肿瘤之间的关系已成为近年来肿瘤学研究的热点. 启动子区CPG岛甲基化可影响基因表达, 对于肿瘤细胞, 甲基化异常可通过多种途径影响基因转录与表达, 导致细胞分化与增殖异常. CpG位点甲基化异常可作为恶变的生物学指标, MPCR为肿瘤研究提供了一种快速、简便、灵敏的方法.
影响肝癌侵袭转移的因素有很多, 目前仍未有较为客观的标准. 本研究采用宋丽洁 et al[9]采取的比较公认的影响肝癌侵袭转移的主要因素门静脉癌栓的有无(或)肝内有无播散结节作为划分标准, 将临床标本划分为高低侵袭组. 本研究发现肝癌组织甲基化的DLC-1大约为180 bp, 且DLC-1甲基化表达率高侵袭组明显高于低侵袭组, 二者之间有明显的差异(P<0.05). 此结果提示DLC-1甲基化可能是肝癌侵袭转移的机制之一. 采用陈龙邦 et al[10]研究方法研究与AFP(+), HBV(+)的关系分析发现: DLC-1甲基化阳性与DLC-1甲基化阴性患者二者之间有明显的差异(P<0.05); 说明DLC-1甲基化与AFP(+), HBV(+)有关. 研究DLC-1甲基化与HCC TNM分期的关系发现分期越后DLC-1甲基化程度越高. 由于随访时间短只能简单说明DLC-1甲基化的HCC 患者中位生存期低于非甲基化患者(P<0.05). 但长期随访是否支持此结论有待长期观察.
早期发现, 早期预测可能出现的转移复发, 并且给予及时的预防与治疗, 对于肝癌患者至关重要. 通过以上研究本文作者认为DLC-1基因甲基化检可作为肝细胞癌复发转移监测指标, 并可作为靶向治疗肝细胞癌复发转移的新的靶点.
目前随着治疗手段的提高, 肝癌患者的生存期明显延长, 肝癌的转移复发, 对于肝癌患者和医务工作者是个迫切需要解决的问题.
高润平, 教授, 吉林大学第一医院肝病科
DLC-1基因是一个与肝癌发生, 转移乃至复发关系密切的肿瘤抑制基因. 目前有关DNA甲基化与肿瘤之间的关系已成为近年来肿瘤学研究的热点.
Yuan et al学者认为DNA甲基化改变是癌变早期发现, 早期预测和癌症风险预后的最可能的指标之一, 大范围硬癌和血液恶性病变DLC-1甲基化的检测是有警示意义的.
检测肝癌患者DLC-1基因甲基化可以预测可能的转移、复发. 技术成熟推广容易, 不需要特殊仪器, 只要开展临床PCR工作的医院均可以使用.
本文提出HCC患者DLC-1基因甲基化可能成为靶向控制肝细胞癌转移和复发的靶点, 研究内容具有临床实用意义.
编辑:李军亮 电编:何基才
| 1. | Yuan BZ, Zhou X, Durkin ME, Zimonjic DB, Gumundsdottir K, Eyfjord JE, Thorgeirsson SS, Popescu NC. DLC-1 gene inhibits human breast cancer cell growth and in vivo tumorigenicity. Oncogene. 2003;22:445-450. [PubMed] |
| 2. | Yuan BZ, Miller MJ, Keck CL, Zimonjic DB, Thorgeirsson SS, Popescu NC. Cloning, characte-rization, and chromosomal localization of a gene frequently deleted in human liver cancer (DLC-1) homologous to rat RhoGAP. Cancer Res. 1998;58:2196-2199. [PubMed] |
| 3. | Herman JG. Hypermethylation of tumor suppressor genes in cancer. Semin Cancer Biol. 1999;9:359-367. [PubMed] |
| 4. | Jones PL, Wolffe AP. Relationships between chromatin organization and DNA methylation in determining gene expression. Semin Cancer Biol. 1999;9:339-347. [PubMed] |
| 5. | Yuan BZ, Durkin ME, Popescu NC. Promoter hypermethylation of DLC-1, a candidate tumor suppressor gene, in several common human cancers. Cancer Genet Cytogenet. 2003;140:113-117. [PubMed] |
| 6. | Ng IO, Liang ZD, Cao L, Lee TK. DLC-1 is deleted in primary hepatocellular carcinoma and exerts inhibitory effects on the proliferation of hepatoma cell lines with deleted DLC-1. Cancer Res. 2000;60:6581-6584. [PubMed] |
| 7. | Wong CM, Lee JM, Ching YP, Jin DY, Ng IO. Genetic and epigenetic alterations of DLC-1 gene in hepatocellular carcinoma. Cancer Res. 2003;63:7646-7651. [PubMed] |
| 8. | Goodison S, Yuan J, Sloan D, Kim R, Li C, Popescu NC, Urquidi V. The RhoGAP protein DLC-1 functions as a metastasis suppressor in breast cancer cells. Cancer Res. 2005;65:6042-6053. [PubMed] |
| 9. | 宋 丽杰, 叶 胜龙, 王 凯峰, 翁 永强, 梁 春敏, 孙 瑞霞, 赵 燕, 刘 银坤, 汤 钊猷. DLC-1基因表达与肝细胞癌复发转移的关系. 中华肝脏病杂志. 2005;13:428-431. |
| 11. | Homma Y, Emori Y. A dual functional signal mediator showing RhoGAP and phospholipase C-delta stimulating activities. EMBO J. 1995;14:286-291. [PubMed] |
| 12. | Durkin ME, Yuan BZ, Thorgeirsson SS, Popescu NC. Gene structure, tissue expression, and linkage mapping of the mouse DLC-1 gene (Arhgap7). Gene. 2002;288:119-127. [PubMed] |
| 13. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |