修回日期: 2008-03-04
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 探讨褪黑素对大鼠溃疡性结肠炎(ulcerative colitis, UC)炎性损伤的保护作用及对肠组织趋化因子的影响.
方法: 采用三硝基苯磺酸(TNBS)制备大鼠UC模型, 将动物随机分为正常对照组、模型组及褪黑素治疗组(2.5, 5.0, 10.0 mg/kg)5组. 采用Western blot法及免疫组织化学法检测肠组织IL-8和MCP-1蛋白表达, 生化方法检测MPO含量, 并观察肠道大体形态和和组织学改变.
结果: UC模型组IL-8、MCP-1蛋白表达及MPO含量较正常组显著增高(80.3±13.6 vs 12.2±5.4, 87.2±7.4 vs 17.3±4.6, 3450.7±135.0 nkat/g vs 416.8±73.0 nkat/g, 均P<0.01), 褪黑素治疗组IL-8、MCP-1蛋白表达, MPO含量(33.5±9.3, 37.7±7.2, 2150.4±129.0 nkat/g)均明显低于UC模型组(均P<0.01), 褪黑素治疗组形态和组织损伤评分指数明显降低(1.6±0.7 vs 6.3±1.4, 1.4±0.5 vs 6.24±1.04, 均P<0.01).
结论: 褪黑素对UC具有良好的保护作用, 抑制趋化因子表达可能是其主要的作用机制之一.
引文著录: 刘坤, 周薇, 李军华. 褪黑素对实验性溃疡性结肠炎大鼠肠组织趋化因子IL-8和MCP-1的影响. 世界华人消化杂志 2008; 16(11): 1168-1172
Revised: March 4, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the effects of melatonin on the colon inflammatory injury of rats with TNBS-induced colitis and determine whether this effect is associated with chemoattractant molecules interleukin-8 (IL-8) and monocyte chemoattractant protein-1 (MCP-1).
METHODS: Rat colitis models were established by 2, 4, 6-trinitrobenzene sulfonic acid (TNBS) enema. The animals were randomized into 5 groups: normal group, model group and three melatonin groups (2.5, 5.0, and 10.0 mg/kg), intrarectally treated with saline, TNBS, and TNBS plus melatonin, respectively. At the end of the 4th wk, macroscopic and histological changes of the colon were examined and mucosal myeloperoxidase (MPO) activities were assayed. IL-8 and MCP-1 protein expression in colon tissues were examined by Western blot and immunohistochemistry.
RESULTS: The levels of IL-8, MCP-1 expression and MPO activity were significantly higher in model group than those in normal group (80.3 ± 13.6 vs 12.2 ± 5.4; 87.2 ± 7.4 vs 17.3 ± 4.6; 3450.7 ± 135.0 nkat/g vs 416.8 ± 73.0 nkat/g; all P < 0.01), but they were significantly lower in melatonin treatment groups (33.5 ± 9.3, 37.7 ± 7.2, 2150.4 ± 129.0 nkat/g, P < 0.01). Melatonin reduced colonic lesions (macroscopical and histological damage indices: 1.6 ± 0.7 vs 6.3 ± 1.4; 1.4 ± 0.5 vs 6.24 ± 1.04; P < 0.01) and improved colitis symptoms.
CONCLUSION: Melatonin reduces colonic inflammatory injury of rats with ulcerative colitis through down-regulating the expression of IL-8 and MCP-1.
- Citation: Liu K, Zhou W, Li JH. Effects of melatonin on the expression of interleukin-8 and monocyte chemoattractant protein-1 in rats with TNBS-induced colitis. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1168-1172
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1168.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1168
炎症性肠病(inflammatory bowel disease, IBD)是肠道的慢性非特异性的炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). IBD病因及发病机制尚未完全明了, 可能与多种因素相关, 包括遗传、免疫、感染、精神心理等, 但肠道持续炎症损伤是其主要特征[1]. 近年研究发现趋化因子, 前炎症细胞因子及黏附分子等表达异常与UC的发病关系密切[2-3], 许多资料表明趋化因子IL-8和单核细胞趋化蛋白-1(MCP-1)在UC患者发病中起重要作用[4-6]. 褪黑素(melatonin)在人体主要由松果腺分泌, 具有广泛的生物学功能, 包括抗氧化、抗炎及免疫调节等作用[7-9], 可能对UC具有保护作用. 我们观察褪黑素对实验性大鼠UC肠组织病理改变, 炎性损伤及结肠组织中IL-8和MCP-1的影响, 探讨褪黑素对UC的保护作用及可能的机制, 为UC的临床治疗探寻新的途径.
健康SD大鼠50只由湖北省医学科学院实验动物中心提供, 雌雄不限, 体质量200±30 g, 正常喂养; 三硝基苯磺酸(TNBS), 褪黑素(Sigma USA); IL-1和MCP-1 mAb(Santa Cruz Biotechnology公司); Western blot显色试剂盒为Cell Signal公司产品; SP试剂盒为北京中山公司产品; 髓过氧化物酶(MPO)检测试剂盒为南京建成生物工程研究所产品; 其他试剂为进口或国产分析纯.
将50只大鼠随机分为正常对照组(Control group), 模型组(Model group)及褪黑素组(MT group, 2.5, 5.0及10.0 mg/kg)5组, 正常对照组不作任何处理; 模型组以TNBS灌肠, MT组造模后给予褪黑素ig. 以TNBS诱导UC形成[10]. SD大鼠术前禁食24 h, 自由饮水, 实验时乙醚麻醉, 用一直径2.0 mm长约12 cm的硅胶管由肛门轻缓插入深约8 cm, 除正常对照组外, 各组以含150 mg/kg TNBS的500 mL/L乙醇溶液缓慢推入结肠, 让动物保持平躺自然清醒, 5-ASA组、MT组造模后分别以2.5, 5.0及10.0 mg/kg剂量褪黑素ig, 1次/d, 4 wk后分别随机处死3只模型组及正常对照组大鼠, 取结肠标本作病理检查, 以确定造模成功, 处死所有大鼠. 取肛门至回盲部结肠(约8 cm), 沿肠系膜纵轴剪开, 用冷生理盐水冲洗干净后40 g/L多聚甲醛固定, 进行肉眼大体形态和组织学形态评分, 肠组织一部分以40 g/L多聚甲醛固定, 石蜡包埋, 4 μm连续切片, HE染色镜下评价炎症和溃疡, 相同部位的另一部分组织-70℃冻存, 用以MPO检测及蛋白检测. 结肠组织损伤大体形态损伤评分指标包括粘连、局部充血、溃疡及炎症. 粘连及充血按有无及轻重分别计0、1、2分, 出现炎症、溃疡数目增加1个、溃疡面积>2 cm时范围每增加1 cm计分均加1; 组织学指标包括溃疡、炎症、肉芽肿、纤维化及病变深度, 按有无及轻重分别计0、1、2分, 病变深度达黏膜下层、肌层、浆膜层分别计1、2、3分, 各项相加得总分[11-12].
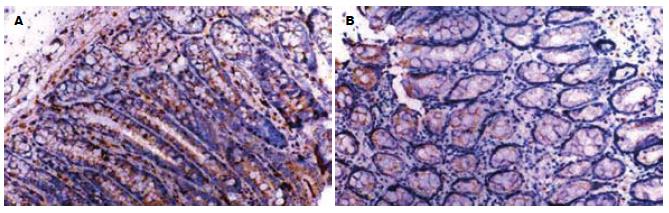
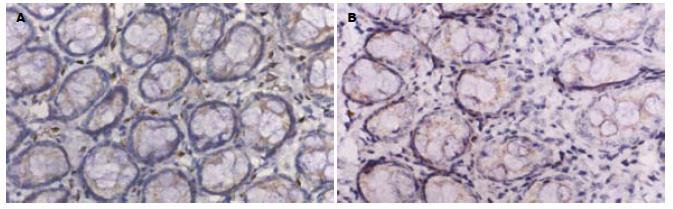
1.2.1 IL-8和MCP-1表达的检测: 取石蜡切片(4 μm)常规脱蜡、水化, 置0.05 mol/L柠檬酸缓冲液中进行微波抗原修复, 凉至室温; 30 g/L H2O2孵育10 min以消除内源性过氧化物酶活性, 滴加100 mL/L正常血清封闭非特异性抗原; 倾去血清, 滴加1:100稀释的IL-8和MCP-1抗体, 4℃放置过夜, PBS冲洗3×5 min, 滴加生物素化二抗, 37℃孵育10 min, PBS冲洗3×5 min; 滴加辣根过氧化物酶标记的卵白素工作液, 37℃孵育15 min; DAB显色, 苏木素复染, 中性树脂封片. 阳性对照为已知的IL-8和MCP-1蛋白, 以PBS代替一抗作阴性对照. 以16D目镜测微网(面积为0.1024 mm2)在400倍放大下计数阳性细胞数, 每张切片计算10个网格取平均值为阳性细胞密度.
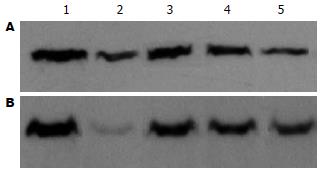
1.2.2 肠组织IL-8和MCP-1蛋白表达的检测: 组织匀浆后加入裂解液(含1 mg/L Leupetin、Aprotinin、Pepstalin, 17.42 mL/L PMSF), 冰上孵育10 min, 移入微量离心管中并置于冰上孵育1 h; 4℃, 12 000 r/min离心裂解产物5 min, 将上清转移至一个新的微离心管中于-70℃保存备用. 蛋白浓度采用Bradford法测定. 将细胞蛋白20 μg和上样缓冲液混合后, 上样在100 g/L分离胶50 g/L积层胶上进行SDS-PAGE. 应用电转移将电泳分离后的蛋白转移至硝酸纤维素滤膜上. 滤膜经50 g/L脱脂奶粉, TBS溶液于室温封闭1小时后, 分别加入IL-8和MCP-1一抗(1:1000)4℃孵育过夜. 滤膜经TBST缓冲液清洗3次后, 再与HRP(horseradish peroxidase)交联的二抗(1: 2000)于室温孵育1 h. TBST缓冲液清洗3次后, 应用增强的化学发光法显影, 暗室爆光于X线片上, 显影定影. 图像采用美国Image PC alpha 9图像分析系统分析.
1.2.3 结肠组织MPO含量测定: 采用生化方法测定MPO含量, 具体操作按试剂盒说明书(南京建成生物工程研究所提供)进行.
统计学处理 实验数据以mean±SD表示, 采用单因素方差分析, 组间差异采用q检验, 以P<0.01为有统计学意义.
所有造模大鼠在TNBS灌肠12 h后出现腹泻, 呈黄色稀便和/或肛周体毛被稀便沾染, 6-7 d体质量明显下降, 毛色失去光泽, 精神倦怠, 活动及进食明显减少; 褪黑素ig后大鼠一般状况及消化道症状逐渐好转, 用药1 wk后大便基本成形, 情况明显好于模型组. 模型组大鼠结肠标本表现为黏膜充血水肿、溃疡形成, 结肠组织与周围组织粘连, 可见近端肠腔扩张. 溃疡呈线状和灶状, 周围可见黏膜增厚. 光镜下可见溃疡及炎性渗出物, 炎症累及肠壁全层, 可见上皮细胞坏死、脱落, 有淋巴组织增生, 大量中性粒细胞浸润, 可见数量不等的单个核细胞和嗜酸性粒细胞, 也可见增生的纤维母细胞, 褪黑素组黏膜水肿少见, 无溃疡和炎性渗出物, 光镜下腺体排列整齐, 仅见少量淋巴细胞和中性粒细胞浸润, 损伤指数明显低于模型组(P<0.01); 模型组大鼠结肠组织MPO含量较正常组明显增高(P<0.01), 给予褪黑素保护后MPO含量明显下降(P<0.01, 表1).
IL-8和MCP-1阳性表达细胞表现以胞质呈棕褐色为主, 胞核也有少量着色. 阳性表达细胞有中性粒细胞、单个核细胞等, 多集中于靠近肌层的黏膜固有层内, 肠上皮细胞仅有少量阳性表达. 模型组结肠组织阳性染色的阳性细胞密度明显高于正常组(P<0.01); 褪黑素组的阳性细胞密度明显低于模型组(P<0.01, 表2, 图1-2.)
2.2 Western blot蛋白印迹结果 与正常组相比, IL-8和MCP-1蛋白表达在大鼠模型组中明显升高(P<0.01), 褪黑素可剂量依赖性地降低IL-8和MCP-1表达, 10 mg/kg效果最明显(P<0.01, 图3, 表2).
TNBS诱导的UC模型具有类似人类IBD的大体病理及组织学改变, 并由免疫系统所介导; 此外, 该模型体现了急性炎症向慢性转化的动态过程, 且能对肠道炎症损伤进行定量评分, 有利于评价药物疗效, 因此TNBS诱导的结肠炎仍是研究IBD最常用的模型. 在本实验中, 褪黑素能剂量依赖性的减轻TNBS诱导的大鼠UC的肠道炎症损伤, 抑制肠道炎症细胞浸润. UC是肠道非特异性炎性疾病, 肠道局部炎性损伤是其重要病理改变, 以大量炎性细胞浸润肠壁和持续活化为特征[13-17]. 肠道炎性细胞的募集和活化是一复杂的过程, 研究表明趋化因子及其他前炎性细胞因子在此过程中起着重要的作用[2-3], 趋化因子能快速诱导炎性细胞应答和介导免疫细胞募集和活化, 与IBD的发病及发展关系密切[18-20]. 多种细胞均能产生趋化因子, 如组织巨噬细胞, 肥大细胞, 纤维母细胞, 内皮细胞及上皮细胞等, 浸润的炎性细胞也能产生大量的趋化因子. 在静息状态下, 细胞分泌的趋化因子水平很低或者无趋化因子分泌, 但在炎症过程中其分泌能快速上调. IL-8主要介导中性粒细胞的活化而MCP-1主要诱导单核细胞活化[6,21-23], 大量的研究结果表明在IBD患者病变组织中存在高表达的IL-8和MCP-1[25-28]. 本实验结果证实在TNBS诱导的UC大鼠肠组织中IL-8和MCP-1表达水平明显高于正常对照组, 支持了趋化因子参与UC发生、发展的观点.
褪黑素主要由人松果体分泌, 胃肠道亦含有丰富的褪黑素[7], 发挥着抗炎, 抗氧化及调节免疫应答等多种作用[7-9]. 先前的研究表明褪黑素能减轻实验性大鼠UC肠道炎性损伤程度, 可能与其清除氧自由基, 抗氧化、抗炎等能力有关, 但具体的机制尚不十分确定[24-25]. 本实验结果发现, 褪黑素能明显改善TNBS诱导的大鼠UC的肠道损伤的病理及大体形态评分, 同时明显降低MPO的含量, 并呈剂量依赖关系. MPO是中性粒细胞中含量较高的一种酶, 其含量的增高可以反映中性粒细胞在某一组织中的增高, 间接反映炎症在组织的存在, 因此MPO活性可以提示组织炎性细胞的浸润程度, 被认为衡量炎症程度最敏感和可靠的指标[26], 实验结果证明褪黑素对大鼠UC具有明显的保护作用.
为了进一步观察褪黑素对UC大鼠的作用机制, 我们观察了褪黑素对肠道IL-8和MCP-1表达的影响. IL-8和MCP-1在UC的炎症发生发展过程中起重要作用. 免疫组织化学和Western blot结果均表明, 褪黑素能明显降低UC炎症局部IL-8和MCP-1蛋白表达. 提示褪黑素能通过抑制趋化因子的表达减轻UC的肠道炎症损伤, 从而发挥对UC的保护作用. 其他资料表明, 褪黑素尚能减轻其他炎性因子及其上游的调控基因核因子-κB[27-28], 核因子-κB同样能调控IL-8和MCP-1的基因转录及蛋白表达[29], 褪黑素是否通过这一途径调节UC的炎症过程, 还有待进一步的研究.
炎症性肠病是肠道的慢性非特异性炎症性疾病, 包括溃疡性结肠炎和克罗恩病. 其病因及发病机制尚未完全明了, 可能与多种因素相关, 包括遗传、免疫、感染、精神心理等, 其病程常反复迁延, 在我国的发生率呈上升趋势, 严重危害人们健康. 其治疗也是临床难题之一. 近年来, 研究者在不断探求溃疡性结肠炎新的治疗方法及药物, 但其疗效及具体作用机制多不十分明确.
白爱平, 主治医师, 南昌大学第一附属医院消化内科; 张锦生, 教授, 复旦大学上海医学院病理学系
溃疡性结肠炎目前尚无特异性治疗药物, 内科常用治疗药物主要包括5-ASA类, 激素及免疫抑制剂, 其疗效并不十分理想且毒副作用明显, 患者病情常反复迁延加重. 因此, 寻找高效低毒副作用的治疗药物已成为目前研究的重点和热点.
Bubenik的研究表明褪黑素具有显著的抗炎, 抗氧化损伤等作用; Dong et al的研究表明褪黑素可抑制实验性结肠炎中炎症因子iNOS及COX-2的表达从而减轻肠道炎症损伤.
本文通过研究CXC和CC趋化因子的代表IL-8及MCP-1在褪黑素治疗溃疡性结肠炎中的作用, 深入探讨了褪黑素对溃疡性结肠炎治疗作用的具体机制.
本研究探讨了褪黑素对大鼠结肠炎的治疗作用及机制, 为褪黑素临床治疗溃疡性结肠炎提供了理论基础.
本文选题准确, 国内外均未见报道, 结果有新意, 具有一定的参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | MacDonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol. 2000;51:2-9. [PubMed] |
| 2. | Lakatos L. Immunology of inflammatory bowel diseases. Acta Physiol Hung. 2000;87:355-372. [PubMed] |
| 3. | Ogata H, Hibi T. Cytokine and anti-cytokine therapies for inflammatory bowel disease. Curr Pharm Des. 2003;9:1107-1113. [PubMed] |
| 4. | Banks C, Bateman A, Payne R, Johnson P, Sheron N. Chemokine expression in IBD. Mucosal chemokine expression is unselectively increased in both ulcerative colitis and Crohn's disease. J Pathol. 2003;199:28-35. [PubMed] |
| 5. | MacDermott RP, Sanderson IR, Reinecker HC. The central role of chemokines (chemotactic cytokines) in the immunopathogenesis of ulcerative colitis and Crohn's disease. Inflamm Bowel Dis. 1998;4:54-67. [PubMed] |
| 6. | Reinecker HC, Loh EY, Ringler DJ, Mehta A, Rombeau JL, MacDermott RP. Monocyte-chemoa-ttractant protein 1 gene expression in intestinal epithelial cells and inflammatory bowel disease mucosa. Gastroenterology. 1995;108:40-50. [PubMed] |
| 7. | Bubenik GA. Gastrointestinal melatonin: localization, function, and clinical relevance. Dig Dis Sci. 2002;47:2336-2348. [PubMed] |
| 8. | Maestroni GJ. The immunotherapeutic potential of melatonin. Expert Opin Investig Drugs. 2001;10:467-476. [PubMed] |
| 9. | Sjoblom M, Jedstedt G, Flemstrom G. Peripheral melatonin mediates neural stimulation of duodenal mucosal bicarbonate secretion. J Clin Invest. 2001;108:625-633. [PubMed] |
| 10. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 11. | Mei Q, Yu JP, Xu JM, Wei W, Xiang L, Yue L. Melatonin reduces colon immunological injury in rats by regulating activity of macrophages. Acta Pharmacol Sin. 2002;23:882-886. [PubMed] |
| 12. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Pena AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] |
| 13. | Johansson M, Norrgard O, Forsgren S. Study of expression patterns and levels of neurotrophins and neurotrophin receptors in ulcerative colitis. Inflamm Bowel Dis. 2007;13:398-409. [PubMed] |
| 14. | Forbes E, Murase T, Yang M, Matthaei KI, Lee JJ, Lee NA, Foster PS, Hogan SP. Immunopathogenesis of experimental ulcerative colitis is mediated by eosinophil peroxidase. J Immunol. 2004;172:5664-5675. [PubMed] |
| 15. | Loftus EV. Microscopic colitis: epidemiology and treatment. Am J Gastroenterol. 2003;98:S31-S36. [PubMed] |
| 16. | Rodrigues M, Zerbini MC, Barbieri D. Immunohis-tochemical study of colonic mucosa macrophages in children with Crohn's disease and ulcerative colitis. Arq Gastroenterol. 1998;35:283-291. [PubMed] |
| 17. | Nishida Y, Murase K, Isomoto H, Furusu H, Mizuta Y, Riddell RH, Kohno S. Different distribution of mast cells and macrophages in colonic mucosa of patients with collagenous colitis and inflammatory bowel disease. Hepatogastroenterology. 2002;49:678-682. [PubMed] |
| 18. | Yang SK, Choi MS, Kim OH, Myung SJ, Jung HY, Hong WS, Kim JH, Min YI. The increased expression of an array of C-X-C and C-C chemokines in the colonic mucosa of patients with ulcerative colitis: regulation by corticosteroids. Am J Gastroenterol. 2002;97:126-132. [PubMed] |
| 19. | Melgar S, Drmotova M, Rehnstrom E, Jansson L, Michaelsson E. Local production of chemokines and prostaglandin E2 in the acute, chronic and recovery phase of murine experimental colitis. Cytokine. 2006;35:275-283. [PubMed] |
| 20. | Autschbach F, Giese T, Gassler N, Sido B, Heuschen G, Heuschen U, Zuna I, Schulz P, Weckauf H, Berger I. Cytokine/chemokine messenger-RNA expression profiles in ulcerative colitis and Crohn's disease. Virchows Arch. 2002;441:500-513. [PubMed] |
| 21. | Ina K, Kusugami K, Yamaguchi T, Imada A, Hosokawa T, Ohsuga M, Shinoda M, Ando T, Ito K, Yokoyama Y. Mucosal interleukin-8 is involved in neutrophil migration and binding to extracellular matrix in inflammatory bowel disease. Am J Gastroenterol. 1997;92:1342-1346. [PubMed] |
| 22. | Mazzucchelli L, Hauser C, Zgraggen K, Wagner HE, Hess MW, Laissue JA, Mueller C. Differential in situ expression of the genes encoding the chemokines MCP-1 and RANTES in human inflammatory bowel disease. J Pathol. 1996;178:201-206. [PubMed] |
| 23. | Uguccioni M, D'Apuzzo M, Loetscher M, Dewald B, Baggiolini M. Actions of the chemotactic cytokines MCP-1, MCP-2, MCP-3, RANTES, MIP-1 alpha and MIP-1 beta on human monocytes. Eur J Immunol. 1995;25:64-68. [PubMed] |
| 25. | Cuzzocrea S, Mazzon E, Serraino I, Lepore V, Terranova ML, Ciccolo A, Caputi AP. Melatonin reduces dinitrobenzene sulfonic acid-induced colitis. J Pineal Res. 2001;30:1-12. [PubMed] |
| 27. | Dong WG, Mei Q, Yu JP, Xu JM, Xiang L, Xu Y. Effects of melatonin on the expression of iNOS and COX-2 in rat models of colitis. World J Gastroenterol. 2003;9:1307-1311. [PubMed] |