修回日期: 2007-02-26
接受日期: 2007-03-06
在线出版日期: 2007-04-18
目的: 检测血红素氧合酶-1(HO-1)在反流性食管炎(RE)患者食管黏膜中的表达, 以探讨气体信使分子一氧化碳(CO)在RE发病机制中的作用.
方法: 采用免疫组化SP法结合血红素氧合酶(HO-1)的免疫反应阳性产物的平均光密度图像分析法检测77例RE患者(分4级组)及20例对照组的食管黏膜HO-1蛋白的表达强度.
结果: HO-1主要在食管黏膜上皮细胞中表达, RE患者食管黏膜中表达明显强于对照组(0.2334±0.0511 vs 0.1776±0.0164, P<0.01).
结论: HO-1在RE患者中的食管黏膜中的表达异常, 表明CO在胃肠动力性疾病如RE的发病机制中可能起重要作用.
引文著录: 李军杰, 郑勇, 孙侃, 常向云, 陈卫刚, 赵瑾. 血红素氧合酶-1在反流性食管炎患者食管黏膜中的表达. 世界华人消化杂志 2007; 15(11): 1310-1313
Revised: February 26, 2007
Accepted: March 6, 2007
Published online: April 18, 2007
AIM: To detect the expression of heme oxygenase-1 (HO-1) in human esophageal mucosa with reflux esophagitis (RE), and to find out the role of gas messenger molecule carbon monoxide (CO) in the pathogenesis of RE.
METHODS: The distributions of HO-1 protein in the esophageal tissues of 77 RE cases and 20 normal controls were detected by immunohistochemistry (SP method).
RESULTS: HO-1 was expressed mainly in the esophageal mucosal epithelium. The expression of HO-1 in RE patients was significantly higher than that in the normal controls (0.2334 ± 0.0511 vs 0.1776 ± 0.0164, P < 0.01).
CONCLUSION: Abnormal expression of HO-1 exists in RE, suggesting that CO may play an important role in the pathogenesis of gastrointestinal motility disorders such as RE.
- Citation: Li JJ, Zheng Y, Sun K, Chang XY, Chen WG, Zhao J. Expression of inducible heme oxygenase-1 in the patiant's mucous membrane of esophagus of reflux esophagitis. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1310-1313
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1310
反流性食管炎(reflux esophagitis, RE)是指由于胃与食管交界处抗反流屏障功能障碍而导致的胃或十二指肠内容物反流入食管, 引起食管组织黏膜损害, 是临床常见病, 其发病机制尚未完全清楚. 其中胃食管交界异常引发反流的机制中一过性食管下段括约肌松弛(TLESR)是反流性食管炎的最主要发病机制[1-6], 一些胃肠激素和气体信号分子对食管下括约肌运动有调节作用, 一氧化碳(carbon monoxide, CO)作为一种新的胃肠道抑制性神经递质可介导平滑肌的松弛效应, 我们试图通过对RE患者及对照组的食管黏膜活检标本的血红素氧合酶1(HO-1)表达的免疫组织化学研究, 探讨CO在RE发病机制中的可能作用.
(1)RE组实验对象来自2006-01/10就诊于石河子大学医学院一附院门诊和住院患者, 所有研究对象均行胃镜检查后诊断为RE的患者共77例, 其中男55例, 女22例, 年龄22-72(平均52.08±12.61)岁. RE的诊断按照洛杉矶分类标准(世界胃肠病大会, 1994)共分4级, A级: 黏膜破损局限于黏膜皱襞上, 且长度<5 mm; B级: 黏膜破损局限于黏膜皱襞上, 其中至少一个黏膜破损长度>5 mm; C级: 黏膜破损相互融合, 但小于食管周径75%; D级: 黏膜破损相互融合, 至少侵犯食管周径75%以上, 食管下端溃疡也列入D级. 77例RE者中, A, B, C, D级分别为21, 25, 18和13例. 将A和B级定为轻度RE, C级为中度, D级为重度RE. RE患者均有一种或以上不同程度的反流症状, 如反酸、烧心、反食、胸骨后疼痛, 部分患者还伴有腹胀、嗳气、吞咽困难等, 既往有糖尿病、神经性病变、硬皮病、恶性肿瘤、上消化道手术史等病史者除外; (2)对照组标本20例取自正常志愿者, 其中男13例, 女7例, 年龄23-66(平均47.75±12.79)岁. 本组无临床上无反酸、烧心、反食、胸骨后疼痛等反流的症状与体征, 无免疫疾病、感染病史, 无近期服用药物史, 内镜下无食管黏膜破损, 食管黏膜病理检查证实, 食管黏膜组织无器质性病变. 以上5组受检者, 均在电子胃镜(Olympus)直视下, 于食管下括约肌处活检取黏膜, 立即以40 g/L多聚甲醛溶液固定, 常规石蜡包埋, 3 μm连续切片, 进行免疫组织化学染色. 正常对照组同部位取材, 做相同处理. RE各组患者的年龄与对照组年龄比较无显著性差异, 用LSD对各组年龄进行两两比较, 结果均无统计学意义(P>0.05). 用SPSS软件对所有入选者的性别进行χ2检验, 检验结果表明, χ2 = 1.391, P = 0.846, 可以认为入选的A, B, C, D及对照组在性别方面无统计学差异, 所有实验数据无性别偏差; (3)实验试剂: 羊抗人HO-1多克隆抗体IgG(Santa Cruz公司产品, 福州迈新生物技术开发公司提供), 二抗工作液(Santa Cruz公司产品, 北京中杉金桥生物科技有限公司提供). DAB显色液(DAKO公司产品, 福州迈新生物技术开发公司提供).
1.2.1 免疫组织化学染色: 石蜡组织切片3 μm厚, 经脱蜡、脱二甲苯和水化后, 30 mL/L H2O2溶液孵育10 min, 以阻断内源性过氧化物酶, 置0.01 moL/L枸橼酸缓冲液中微波95 ℃ 15 min修复抗原, 滴加封闭用正常兔血清工作液(A液)孵育10 min, 滴加1:100稀释的一抗(羊抗人多克隆抗体HO-1), 4 ℃过夜; 加生物素化兔抗山羊二抗工作液(B液)和辣根过氧化物酶标记链霉卵白素工作液(C液)各孵育15 min; 滴加新鲜配制的DAB液显色, 苏木精复染, 然后脱水、透明、中性树脂封片, 光镜下观察并摄片. 上述抗体稀释和组织切片漂洗均用0.01 moL/L, pH7.4的磷酸盐缓冲溶液(TBS), 同时用TBS代替一抗作阴性对照.
1.2.2 免疫组织化学结果判断: 光镜下观察, HO-1免疫阳性产物呈棕黄色颗粒为强阳性, 黄色颗粒为阳性, 浅黄色颗粒为弱阳性, 与背景同色呈蓝紫色为阴性. 同时用计算机图像分析技术半定量监测其蛋白表达的强弱. 应用Image-Pro® Plus5.0彩色病理图文分析系统(美国Media Cybernetics公司)随机选取5个视野, 测定食管黏膜HO-1免疫反应阳性产物平均光密度值. 平均光密度越高说明表达越强, 反映细胞内蛋白表达量越多. 以平均光密度值来进行量化后的统计学分析.
统计学处理 所有参数均采用SPSS11.0统计软件分析处理, 测量指标以均值±标准差(mean±SD)表示, 确定方差齐性后, 方差分析用于分析组间均数差别, P<0.05表示两组差别具有显著性意义.
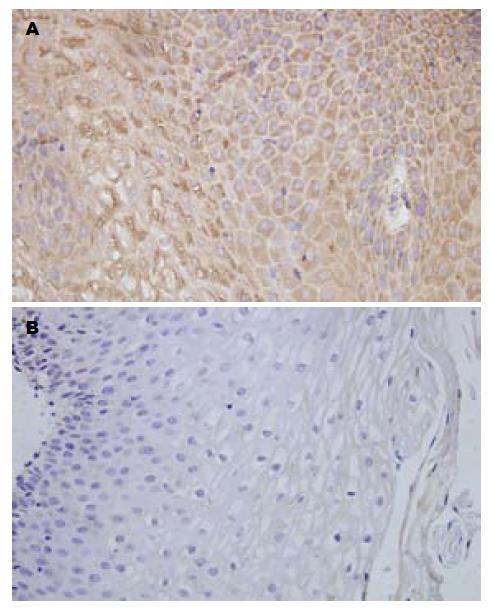
RE组HO-1蛋白主要在食管黏膜上皮细胞中表达, 胞质呈黄色至棕黄颗粒. 正常对照组, 大多样本没有HO-1阳性细胞的表达, 少数病例在食管黏膜上皮细胞中表达, 胞质呈浅黄色(图1).
HO-1平均光密度值: RE各组中A组与B组的平均光密度值比值无差异(P = 0.867), 但A, B组与对照组比值均有差异(P<0.01), C, D及对照组和A, B组比值均有差异(P<0.01), C, D组之间平均光密度值比值均有差异(P<0.01), 随着RE炎症程度的加重, HO-1平均光密度值越高, 蛋白表达越高. 我们还发现, 总RE组患者HO-1平均光密度值(0.2334±0.0511)明显高于对照组(0.1776±0.0164)(P<0.01, 表1).
| 分组 | HO-1平均光密度值 | P值 |
| A级组 | 0.2085±0.0307 | 0.003 |
| B级组 | 0.2101±0.0320 | 0.001 |
| C级组 | 0.2380±0.0322 | 0.000 |
| D级组 | 0.3123±0.0500 | 0.000 |
| 总RE组 | 0.2334±0.0511 | 0.000 |
| 对照组 | 0.1776±0.0164 | - |
RE在西方国家是一种常见病和多发病, 约25%的成年人有烧心症状[7]. 1999年潘国宗et al[8]流行病学调查显示, 北京、上海的流行病学调查推测RE患病率为1.92%; 2005年李兆申et al[9]对RE的调查显示, 1990-1999 RE占内镜检查总数的2.02%, 而2000-2004 RE的比率上升至5.11%. 国内外学者对其日益关注, 研究不断深入, 但其确切的病因及发病机制仍不十分清楚. 目前已公认一过性食管括约肌松弛(TLESR)是导致RE的最重要因素. 已有研究显示, 食管下括约肌(LES)组织内的NO对维持其一定的张力起着重要作用. 张力下降可导致TLESR频繁发生.
内源性一氧化碳(carbon monoxide, CO)和一氧化氮类似, 是近年研究证实的重要的生物调节物质, 具有传递细胞间信息、调节细胞功能的作用, 因而作为体内合成内源性CO的唯一酶系统--血红素加氧酶(hemeoxygenase, HO)也日益受到关注[10-16]. 血红素氧合酶是内源性CO生成的限速酶, 目前已证实HO有3种同工酶: HO-1, HO-2, HO-3. HO-1为诱导型, 又被称为热休克蛋白(HSP32), 主要分布于单核-吞噬细胞系统及网状内皮细胞内, 参与血红素代谢, 在多种诱导因素(如应激或损伤等)下均可表达并产生CO. HO-2和HO-3为结构型, 在细胞处于生理状态即有表达. 正常生理状态下除脾脏外, 健康胃肠道极少表达HO-l[15], 当胃肠病变/损伤时, HO-1大量诱导产生, 有利于病变/损伤的修复. 有研究发现, HO-1对动物结肠黏膜上皮细胞具有保护作用[17-18], 然而, HO-1在人类食管组织中的分布和作用尚不清楚, 在RE患者食管组织中的表达还未见相关报道. HO-1具有抗炎症、抗凋亡、抗增生作用, 可在应激或损伤条件下诱导产生CO, CO是一种弥散的气体信使分子, 可以传递生理学信息, 在HO-1的保护作用中可能起重要作用[19]. 新近研究发现, CO可以调节胃肠道平滑肌的电活动, 给于外源性的CO能刺激犬空肠环行平滑肌细胞内cGMP生成, 激活平滑肌细胞的K+通道, 增加整个细胞的外向电流, 引起膜电位超极化, 舒张平滑肌[20-21]. HO基因缺失可引起平滑肌持续痉挛, 外源性CO则能恢复平滑肌的正常反应. 在本实验中我们发现, RE患者食管组织中HO-1分布异常, 较正常对照组阳性单位增高, 他的表达主要定位在食管黏膜上皮细胞, 这提示RE患者食管HO-1的分布和表达异常可能引起食管黏膜组织内、细胞内分布和量的改变, 影响食管黏膜的生理信息传递, 出现异常的平滑肌细胞膜电位, 引起食管平滑肌的收缩、舒张障碍. 目前的研究表明, CO也是胃肠道的信使, 可通过可溶性鸟苷酸环化酶-环磷酸鸟苷(sGC-cGMP)通过胞内肌浆网钙离子的释放, 使平滑肌细胞舒张, 肌肉松弛, 可以调节食管功能. 我们的研究显示, 随着食管炎症程度的加重, HO-1阳性细胞及其蛋白表达呈一致性增强, 从而发挥自身保护效应, 推测HO-1在食管损伤发生时作为一种代偿性机制具有一定保护作用. 我们应用免疫组织化学方法检测了HO-1在RE患者和正常食管组织中的表达, 结果显示, RE组HO-1的表达主要集中在食管黏膜上皮细胞, 正常对照组则少见HO-1的阳性细胞, 我们的研究结果表明, HO-1在RE食管组织的异常表达可能与食管下括约肌的功能失调有关, 他产生的CO可能与食管疾病的发生和进程有关.
总之, 本实验检测了HO-1在RE患者食管黏膜中的分布和表达, 他异常表达与食管的功能失调有关, 并初步探讨了CO在RE发病机制中的可能作用. 但限于取材条件, 无法进深一步对人食管黏膜下层、肌层、浆膜层HO-1分布和表达作更深的研究. CO是消化道重要的信使分子, 在食管的调节中起着重要作用, 对RE的病理生理可能有重要影响. 但食管运动功能受许多因素调节如胃肠道的神经体液支配、胃肠肽类激素和气体信使分子(如一氧化氮)等的调节, 这些因素之间的相互调控也错综复杂, 仅从HO-1分布和表达变化来解释RE的发病机制很不全面, 有关HO-1与RE的生理及病理生理关系, CO在消化道疾病中所发挥的作用还有待于进一步深入研究, 这必将为RE的诊治和预防提供新思路、新方法.
反流性食管炎是消化道常见的胃肠动力性疾病, 随着生活条件的提高及生活方式的改变, 我国反流性食管炎的发病率近年有增高的趋势, 临床表现为反酸、烧心、胸骨后疼痛、嗳气等, 因其反复发作, 严重影响患者的生活质量, 目前反流性食管炎确切的发病机制尚不明确, 研究表明胃肠激素及气体信号分子(如一氧化氮)在反流性食管炎的发病中起重要作用.
目前, 反流性食管炎的发病机制中, 食管动力、肥胖等与反流性食管炎的关系, 血管紧张素Ⅱ与食管的收缩运动, 促肾上腺皮质激素释放因子受体在食管的分布等等均与反流性食管炎的发病有关. 研究热点是食管下括约肌松弛尤其是一过性食管下括约肌松弛的发生机制, 导致食管下括约肌松弛的离子通道的研究; 一氧化氮、一氧化碳导致食管下括约肌松弛的神经肌肉传道通路及他们的相互关系等.
目前, 血红素氧合酶在食管黏膜中的分布及作用的研究较为少见, 且大多在动物模型上, 本文对血红素氧合酶-1在反流性食管炎患者及对照组食管黏膜上皮细胞中表达的差异进行了分析, 探讨了气体信使分子如一氧化碳在反流性食管炎发病机制中的可能作用.
一过性食管下括约肌松弛是公认的反流性食管炎的最重要的发病机制, 本研究显示一些气体信使分子如一氧化碳可能在反流性食管炎发病机制中起重要作用, 通过对其进一步的深入研究将有助于阐明反流性食管炎的病理生理机制, 为反流性食管炎的的诊疗提供新方案.
血红素氧合酶: 作为体内合成内源性CO的唯一酶系统-血红素加氧酶(hemeoxygenase, HO), 血红素氧合酶是内源性CO生成的限速酶, 目前已证实HO有3种同工酶: HO-1, O-2, HO-3. O-1为诱导型, 又被称为热休克蛋白(HSP32), 主要分布于单核-吞噬细胞系统及网状内皮细胞内, 参与血红素代谢, 在多种诱导因素(如应激或损伤等)下均可表达并产生CO; HO-2为非诱导型, 也称原生型HO, 是生理状态下HO的主要存在形式; HO-3也为非诱导型, 催化血红素的能力很低, 主要可能介导HO与血红素结合.
本文研究了血红素氧合酶-1在反流性食管炎患者食管黏膜中的表达, 立题新颖, 方法可靠, 结果可信, 有一定意义.
编辑: 王晓瑜 电编:张敏
| 1. | Scheffer RC, Wassenaar EB, Herwaarden MA, Holloway RH, Samsom M, Smout AJ, Akkermans LM. Relationship between the mechanism of gastro-oesophageal reflux and oesophageal acid exposure in patients with reflux disease. Neurogastroenterol Motil. 2005;17:654-662. [PubMed] [DOI] |
| 2. | Boeckxstaens GE, Hirsch DP, Verkleij CB, Lei A, Holman R, Lehmann A, Rydholm H. Reproducibility of meal-induced transient lower oesophageal sphincter relaxations in patients with gastro-oesophageal reflux disease. Neurogastroenterol Motil. 2005;17:23-28. [PubMed] [DOI] |
| 3. | Piche T, Galmiche JP. Pharmacological targets in gastro-oesophageal reflux disease. Basic Clin Pharmacol Toxicol. 2005;97:333-341. [PubMed] [DOI] |
| 4. | Frisby CL, Mattsson JP, Jensen JM, Lehmann A, Dent J, Blackshaw LA. Inhibition of transient lower esophageal sphincter relaxation and gastroesophageal reflux by metabotropic glutamate receptor ligands. Gastroenterology. 2005;129:995-1004. [PubMed] [DOI] |
| 5. | Boeckxstaens GE. The lower oesophageal sphincter. Neurogastroenterol Motil. 2005;17 Suppl 1:13-21. [PubMed] [DOI] |
| 6. | Zou D, Chen WH, Iwakiri K, Rigda R, Tippett M, Holloway RH. Inhibition of transient lower esophageal sphincter relaxations by electrical acupoint stimulation. Am J Physiol Gastrointest Liver Physiol. 2005;289:G197-G201. [PubMed] [DOI] |
| 7. | Louis E, DeLooze D, Deprez P, Hiele M, Urbain D, Pelckmans P, Devière J, Deltenre M. Heartburn in Belgium: prevalence, impact on daily life, and utilization of medical resources. Eur J Gastroenterol Hepatol. 2002;14:279-284. [PubMed] [DOI] |
| 8. | 潘 国宗, 许 国铭, 郭 慧平, 柯 美云, 韩 少梅, 李 兆申, 方 秀才, 邹 多武, 鲁 素彩, 刘 婧. 北京上海胃食管反流症状的流行病学调查. 中华消化杂志. 1999;19:223-226. |
| 14. | Kim HP, Ryter SW, Choi AM. CO as a cellular signaling molecule. Annu Rev Pharmacol Toxicol. 2006;46:411-449. [PubMed] [DOI] |
| 15. | Gibbons SJ, Farrugia G. The role of carbon monoxide in the gastrointestinal tract. J Physiol. 2004;556:325-336. [PubMed] [DOI] |
| 16. | Miller SM, Reed D, Sarr MG, Farrugia G, Szurszewski JH. Haem oxygenase in enteric nervous system of human stomach and jejunum and co-localization with nitric oxide synthase. Neurogastroenterol Motil. 2001;13:121-131. [PubMed] [DOI] |
| 17. | Murthy S, Flanigan A, Coppola D, Buelow R. RDP58, a locally active TNF inhibitor, is effective in the dextran sulphate mouse model of chronic colitis. Inflamm Res. 2002;51:522-531. [PubMed] [DOI] |
| 18. | Berberat PO, A-Rahim YI, Yamashita K, Warny MM, Csizmadia E, Robson SC, Bach FH. Heme oxygenase-1-generated biliverdin ameliorates experimental murine colitis. Inflamm Bowel Dis. 2005;11:350-359. [PubMed] [DOI] |
| 19. | Fujii H, Takahashi T, Nakahira K, Uehara K, Shimizu H, Matsumi M, Morita K, Hirakawa M, Akagi R, Sassa S. Protective role of heme oxygenase-1 in the intestinal tissue injury in an experimental model of sepsis. Crit Care Med. 2003;31:893-902. [PubMed] [DOI] |
| 20. | Farrugia G, Miller SM, Rich A, Liu X, Maines MD, Rae JL, Szurszewski JH. Distribution of heme oxygenase and effects of exogenous carbon monoxide in canine jejunum. Am J Physiol. 1998;274:G350-G358. [PubMed] |
| 21. | Xue L, Farrugia G, Miller SM, Ferris CD, Snyder SH, Szurszewski JH. Carbon monoxide and nitric oxide as coneurotransmitters in the enteric nervous system: evidence from genomic deletion of biosynthetic enzymes. Proc Natl Acad Sci USA. 2000;97:1851-1855. [PubMed] [DOI] |