修回日期: 2007-02-26
接受日期: 2007-03-06
在线出版日期: 2007-04-18
目的: 研究IFN-α对活化的大鼠肝星状细胞(HSC)凋亡的影响, 进一步探讨IFN-α抗肝纤维化的机制.
方法: 将体外培养大鼠HSC分别给予不同浓度的IFN-α作用24 h后, 采用四甲基偶氮唑蓝实验(MTT)测定活细胞数及应用流式细胞仪(flow cytometry)AnnexinV和PI双染方法将早期凋亡与中晚期凋亡和死细胞区分开, 从而测定HSC的早期凋亡情况.
结果: MTT实验观察到IFN-α作用于大鼠活化的HSC后, 作用组活细胞数目减少, 1×107及1×108 U/L两个作用浓度组与对照组的A值比较有显著性差异(t = 2.82, 5.44, 均P<0.05). 流式细胞仪结果示HSC的早期凋亡率随干扰素浓度的增加而提高, 1×107及1×108 U/L两个作用浓度组与对照组比较早期凋亡率有显著性差异(t = 4.31, 5.07, 均P<0.05).
结论: 诱导肝星状细胞早期凋亡可能是IFN-α抗肝纤维化的机制之一.
引文著录: 车雷, 马力, 吴丹, 李智伟. α-干扰素对活化的肝星状细胞早期凋亡的影响. 世界华人消化杂志 2007; 15(11): 1276-1279
Revised: February 26, 2007
Accepted: March 6, 2007
Published online: April 18, 2007
AIM: To investigate the effects of interferon-α on the early apoptosis of activated hepatic stellate cells (HSCs), and to further explore the anti-fibrosis mechanism of interferon-α (IFN-α).
METHODS: Rat HSCs were cultured in vitro, and then treated with different concentrations of IFN-α for 24 h. The viable cell count was measured by MTT assay, and the early apoptosis of HSCs was detected by flow cytometry using AnnexinV/PI-staining.
RESULTS: MTT assay showed a decrease of HSCs after IFN-α treatment, and the absorbency was significantly different from that of the control cells when 1 × 107 and 1 × 108 U/L IFN-α was used (t = 2.82, 5.44, both P < 0.05). Flow cytometry demonstrated that the early apoptosis rate of HSCs was increased with the elevation of IFN-α concentration, and the apoptosis rate was markedly different from that of the control cells when IFN-α was adopted at the concentrations of 1 × 107 and 1 × 108 U/L (t = 4.31, 5.07, both P < 0.05).
CONCLUSION: IFN-α can induce the early apoptosis of HSCs, which is probably one of the anti-fibrosis mechanism of interferon-α.
- Citation: Che L, Ma L, Wu D, Li ZW. Effects of interferon-α on the early apoptosis of activated hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1276-1279
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1276.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1276
肝纤维化(hepatic fibrosis)是大多数慢性肝病共有的病理改变, 涉及到组织病理学, 细胞生物学的多个环节, 并与细胞因子及分子水平的调节有密切关系[1], 是影响慢性肝炎预后的重要环节. 在目前尚无有效病因治疗方法的情况下, 减缓或阻止肝纤维化进程是一相当重要的治疗对策. 近年来通过研究发现α-干扰素(interferon-α, IFN-α)除抗病毒作用外还具有独立的抗肝纤维化的作用[2], 但目前尚未能完全阐明其作用机制. 肝星状细胞(hepatic stellate cells, HSC)是产生细胞外基质、参与肝纤维化形成的主要细胞. 既往已有实验表明α-干扰素存在促进活化的HSC凋亡的作用[3], 但对其作用于凋亡的哪个阶段未见明确报道. 我们旨在通过体外条件下观察α-干扰素在不同作用浓度对活化的HSC早期凋亡率的影响, 进一步探讨α-干扰素在抗肝纤维化中的作用机制.
r-HSC99细胞系, 中国医科大学附属盛京医院感染科实验室提供. IFN-α(500 MU/支)购自天津华立达生物公司; MTT购自武汉博士德生物公司; AnnexinV-FITC/PI凋亡检测试剂盒购自北京宝赛生物公司; 酶标仪为Labsystems Dragon公司产品; 流式细胞仪为美国BD公司产品.
复苏冻存细胞株, 用含有100 mL/L胎牛血清的DMEM常规培养, 倒置显微镜下观察细胞, 待细胞生长状态良好, 并且细胞数目在1×109/L以上时, 将细胞传代.
1.2.1 MTT检测活的HSC数目: 将细胞生长状态良好, 并且细胞数目在1×109/L以上的培养瓶中的细胞接种在96孔板中, 在加入含IFN-α 1×105, 1×106, 1×107, 1×108 U/L的DMEM培养液中培养24 h后的各组HSC细胞(每组设有3个复孔)中加入MTT液50 mL继续培养4 h后, 弃上清液, 加入二甲基亚砜(DMSO) 100 mL, 震荡10 min, 上酶标仪于492 nm波长处测吸光度值, 代表各孔的细胞数.
1.2.2 流式细胞仪测HSC凋亡: 将细胞生长状态良好, 并且细胞数目在1×109/L以上的培养瓶中加入含IFN-α 1×107, 1×108 U/L的DMEM培养液中培养24 h后, 调整待测细胞的浓度为1×109/L, 取1 mL细胞, 1000 r/min 4 ℃离心10 min, 弃上清. 加入1 mL冷的PBS, 轻轻震荡使细胞悬浮, 1000 r/min, 4 ℃离心10 min, 弃上清. 将细胞悬于200 mL Binding Buffer, 加入10 mL AnnexinV-FITC和5 mL PI, 轻轻混匀, 避光室温反应15 min, 加入300 mL Binding Buffer, 在1 h内上机检测.
统计学处理 所得结果采取均数±标准差(mean±SD), 应用SPSS11.0统计软件对数据进行t检验.
分别应用IFN-α浓度为IFN-α 1×105, 1×106, 1×107, 1×108 U/L作用于活化的大鼠HSC, 应用MTT方法检测到的A值如表1. 给予不同浓度组IFN-α作用于活化的HSC后, A值逐渐降低, 经统计学分析结果表明, 1×107及1×108 U/L两个作用浓度组与对照组的A值比较有显著性差异, 分别为t = 2.82和t = 5.44>t0.05/2(4) = 2.132, P<0.05有统计学意义, 其他浓度组无显著性差异. 说明IFN-α在1×107及1×108 U/L两个浓度组有明显的促进活化的HSC凋亡的作用, 而且此作用随浓度的增加而增强.
| 分组 | A值 |
| 对照组 | 0.493±0.0518 |
| IFN-α 1×105 U/L | 0.4497±0.0338 |
| IFN-α 1×106 U/L | 0.4273±0.0566 |
| IFN-α 1×107 U/L | 0.3657±0.0581 |
| IFN-α 1×108 U/L | 0.2707±0.0387 |
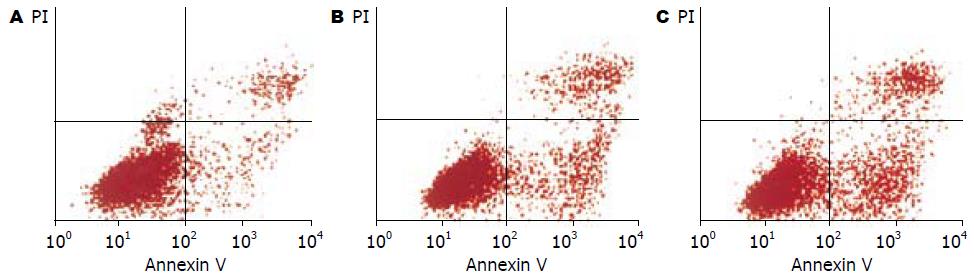
应用1×107及1×108 U/L两个作用浓度组的IFN-α作用于体外培养的活化的HSC后, 经Annexin V和PI双染上流式细胞仪检测结果(表2, 图1)IFN-α作用组的右下象限中的红色标记点比对照组的右下象限中红色标记点明显增多, 表明早期凋亡的细胞增多, 说明IFN-α有促进活化的HSC早期凋亡的作用. 正如表2显示, IFN-α作用活化的HSC后凋亡率及早期凋亡率都随着浓度的增大而增加, 经统计学分析表明, 1×107及1×108 U/L两个作用浓度组与对照组比较早期凋亡率有显著性差异, 分别t = 4.31和t = 5.07>t0.05/2(4), P<0.05有统计学意义. 说明IFN-α有诱导活化的HSC凋亡的作用, 并且还表明主要促进活化的HSC的早期凋亡.
| 分组 | 早期凋亡率 | 凋亡率 |
| 对照组 | 0.0327±0.001652 | 0.0653±0.0108 |
| IFN-α 1×107 U/L | 0.0553±0.008921 | 0.0995±0.0093 |
| IFN-α 1×108 U/L | 0.0915±0.0200 | 0.1513±0.2396 |
目前认为肝细胞外基质(extracellular matric, ECM)的过度增多和异常沉积是肝纤维化的主要发生机制[4-6]. 当肝脏发生纤维化时有3个基本现象值得重视: (1)肝细胞外基质的增加; (2)肝星状细胞转变为肌纤维母细胞; (3)肝星状细胞胞质内视黄醇减少. 这3个现象都与肝星状细胞有关[7], HSC的活化被认为是肝纤维化形成的中心环节. 因此清除活化的HSC成为抗肝纤维化的研究热点. 凋亡不引起溶酶体等细胞器的破坏, 凋亡细胞在数小时内被周围的细胞吞噬, 很少引起微环境的炎症反应, 是一种理想的清除活化HSC的方式[8]. 目前, IFN-α作为抗病毒的药物已应用于肝炎的临床治疗中. 既往认为IFN-α的抗病毒作用是因为能减轻肝细胞的炎症、坏死, 改善肝脏所处的微环境, 减少对肝细胞和肝脏非实质细胞(FSCs、Kupffer细胞和肝窦状内皮细胞)的刺激, 使得胶原合成减少, 从而发挥抗纤维化的作用[9]. van Zonneveld et al[10]通过对1978-2002年165名应用α-干扰素平均治疗16 wk的患者进行血清学和病理学的研究发现, 随着病毒的抑制血清中谷丙转氨酶逐渐恢复正常, 并且肝脏病理提示炎症及纤维化程度得到改善. 随着对IFN-α研究的深入发现其具有不依赖抗病毒作用而独立的抗肝纤维化作用. Guerret et al[11]对用IFN-α短期治疗后无明显病毒应答的24例CHC患者继续应用IFN-α治疗, 以观察其对肝纤维化病变的影响. 将24例患者随机分为2组: 甲组13例, 用IFN-α治疗不足1 a(平均疗程7.5 mo, 剂量313 MU); 乙组11例, IFN-α治疗不少于1 a(平均疗程21.8 mo, 剂量791 MU). 于治疗前和治疗后1、5年分别作3次肝组织活检. 应用HAI评分法和比色法评价检测结果发现, 在IFN-α治疗开始后5年, 2组肝组织纤维化均有轻度好转, 而与治疗剂量和疗程并无显著相关性. 由此表明, IFN-α可能存在直接的抗肝纤维化作用, 而并非是仅仅通过抗病毒所引起的间接作用抗纤维化. 但对于IFN-α的抗肝纤维化的机制尚不完全清楚.
我们应用IFN-α作用于体外培养的活化的大鼠肝星状细胞, 结果发现IFN-α作用组MTT及流式细胞仪检测结果均发现HSC的凋亡率增加, 并随浓度的增加而增加, 流式细胞仪检测结果的散点图在右下象限增加比较明显, 即早期凋亡率增加, 且具有统计学意义. 说明IFN-α对HSC的凋亡有促进作用, 而且主要促进HSC的早期凋亡, 即凋亡的启始阶段, 并具有浓度依赖性. Annexin V是一种Ca2+依赖性磷脂结合蛋白, 能与细胞凋亡过程中翻转到膜外的磷脂酰丝氨酸高亲和力特异性结合. 以标记了FITC的Annexin V作为荧光探针, 利用流式细胞仪可检测细胞凋亡的发生. Propidium iodide(PI)是一种核酸染料, 他不能透过完整的细胞膜, 但在凋亡中晚期的细胞和死细胞, PI能够透过细胞膜而使细胞核红染. Annexin V与PI匹配使用, 可将凋亡早期的细胞和晚期的细胞以及死细胞区分开来[12]. 本实验利用Annexin V与PI双染, 明确了IFN-α主要对HSC的早期凋亡有促进作用.
HSC位于Disse间隙, 胞质富含类维生素A脂滴, 肝受损时被激活, 转化为肌成纤维细胞, 脂滴丢失, 形态改变, 表达多种细胞因子及受体大量增殖, 大量合成ECM, 表达平滑肌α-肌动蛋白(α-smooth muscle atine, α-SMA), 并具有收缩功能[13-14], 近年来研究表明, HSC还能生成少量基质金属蛋白酶及其抑制剂参与ECM的产生和降解[15-16]. 故HSC的激活是肝纤维化的关键细胞. 所以促进HSC的凋亡具有重要意义, 一方面HSC数量的减少使ECM分泌减少, 另一方面使活化的HSC分泌的金属蛋白酶抑制剂减少, 促进ECM的降解[17]. 因此, HSC的凋亡在肝纤维化的治疗中具有重要的作用. 通过基因芯片技术以及其他技术筛选IFN调节基因的表达, 发现有多种基因与凋亡有关, 除了IRF-1, STAT1, PKR, 还有促凋亡家族成员BCL-2, 几种caspase酶, 肿瘤坏死因子家族的受体以及受体的配体等, 这些基因中有的含有IFN刺激反应元件(ISRE), IFN-α可以通过依赖或非依赖于P53的途径, 抑制细胞周期进程, 促进细胞凋亡[18]. 从本实验的研究中发现, IFN-α对HSC的凋亡有着促进的作用, 进一步证实了IFN-α具有独立的抗肝纤维化的作用, 这与汪谦et al[19]所报道的在电镜下观察到IFN-α作用于活化的HSC后, 可使HSC发生凋亡的早期形态学改变相符合. 并且本实验通过IFN-α作用于体外培养的活化的HSC, 进一步阐明了IFN-α主要促进HSC的早期凋亡. 说明IFN-α对HSC凋亡的促进作用主要是在凋亡的启始阶段.
总之, IFN-α所存在的促进HSC早期凋亡的作用可能是其所具有抗肝纤维化的机制之一. 我们从对HSC凋亡的影响角度出发, 揭示了IFN-α抗肝纤维化的作用机制, 为临床上的应用提供了可靠的理论依据.
目前, IFN-α已广泛应用于慢性肝炎的抗病毒治疗中, 人们发现IFN-α具有不依赖于抗病毒作用的独立的抗肝纤维化作用, 但其作用机制尚不清楚. 最近研究表明, 对作为肝纤维化中心环节的活化的HSC的影响可能是IFN-α抗肝纤维化的主要机制之一.
HSC是肝脏中ECM主要的产生细胞. IFN-α对活化的HSC的影响被认为是其抗肝纤维化作用的重要机制. 因此, 是目前抗肝纤维化研究的热点之一.
慢性肝炎是我国引起肝纤维化及肝硬化的主要原因, IFN-α是目前慢性肝炎抗病毒治疗的主要药物, 已证实IFN-α具有抗肝纤维化的作用, 但作用机制尚不清楚. 本研究通过IFN-α对活化的HSC早期调亡的影响, 为IFN-α的临床应用提供理论依据.
本文从实验中观察到, IFN-α作用于大鼠活化的HSC后, 作用组活细胞数目减少, 流式细胞仪结果示HSC的早期凋亡率随干扰素浓度的增加而提高, 说明诱导肝星状细胞早期凋亡是IFN-α抗肝纤维化的机制之一. 文章有一定的科学性、创新性和可读性.
编辑:张焕兰 电编:张敏
| 2. | Papatheodoridis GV, Petraki K, Cholongitas E, Kanta E, Ketikoglou I, Manesis EK. Impact of interferon-alpha therapy on liver fibrosis progression in patients with HBeAg-negative chronic hepatitis B. J Viral Hepat. 2005;12:199-206. [PubMed] [DOI] |
| 4. | Giannelli G, Antonaci S. Immunological and molecular aspects of liver fibrosis in chronic hepatitis C virus infection. Histol Histopathol. 2005;20:939-944. [PubMed] |
| 5. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 6. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 8. | Rippe RA. Life or death: the fate of the hepatic stellate cell following hepatic injury. Hepatology. 1998;27:1447-1448. [PubMed] [DOI] |
| 9. | Ishibashi K, Kashiwagi T, Ito A, Tanaka Y, Nagasawa M, Toyama T, Ozaki S, Naito M, Azuma M. Changes in serum fibrogenesis markers during interferon therapy for chronic hepatitis type C. Hepatology. 1996;24:27-31. [PubMed] [DOI] |
| 10. | van Zonneveld M, Honkoop P, Hansen BE, Niesters HG, Darwish Murad S, de Man RA, Schalm SW, Janssen HL. Long-term follow-up of alpha-interferon treatment of patients with chronic hepatitis B. Hepatology. 2004;39:804-810. [PubMed] [DOI] |
| 11. | Guerret S, Desmoulière A, Chossegros P, Costa AM, Badid C, Trépo C, Grimaud JA, Chevallier M. Long-term administration of interferon-alpha in non-responder patients with chronic hepatitis C: follow-up of liver fibrosis over 5 years. J Viral Hepat. 1999;6:125-133. [PubMed] [DOI] |
| 13. | Brenner DA, Waterboer T, Choi SK, Lindquist JN, Stefanovic B, Burchardt E, Yamauchi M, Gillan A, Rippe RA. New aspects of hepatic fibrosis. J Hepatol. 2000;32:32-38. [PubMed] [DOI] |
| 14. | Lee KS, Lee SJ, Park HJ, Chung JP, Han KH, Chon CY, Lee SI, Moon YM. Oxidative stress effect on the activation of hepatic stellate cells. Yonsei Med J. 2001;42:1-8. [PubMed] [DOI] |
| 15. | Schlaf G, Schmitz M, Heine I, Demberg T, Schieferdecker HL, Götze O. Upregulation of fibronectin but not of entactin, collagen IV and smooth muscle actin by anaphylatoxin C5a in rat hepatic stellate cells. Histol Histopathol. 2004;19:1165-1174. [PubMed] |
| 16. | Galli A, Svegliati-Baroni G, Ceni E, Milani S, Ridolfi F, Salzano R, Tarocchi M, Grappone C, Pellegrini G, Benedetti A. Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism. Hepatology. 2005;41:1074-1084. [PubMed] [DOI] |
| 17. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] [DOI] |
| 18. | de Veer MJ, Holko M, Frevel M, Walker E, Der S, Paranjape JM, Silverman RH, Williams BR. Functional classification of interferon-stimulated genes identified using microarrays. J Leukoc Biol. 2001;69:912-920. [PubMed] |