修回日期: 2006-07-29
接受日期: 2006-08-23
在线出版日期: 2006-10-08
目的: 探讨阿斯匹林和选择性COX-2抑制剂塞莱昔布对体外培养的幽门螺杆菌(Helicobacter pylori, H. pylori)生长、毒力因子及外膜蛋白的影响.
方法: 不同浓度的阿司匹林及塞莱昔布与H. pylori共同培养, 以活菌计数、分光光度计法检测H. pylori的生长状态, 分光光度计检测A560nm值判断尿素酶活性, Hela细胞空泡变性实验和中性红吸收试验检测空泡毒素的活性, 以SDS-PAGE电泳检测H. pylori外膜蛋白的变化.
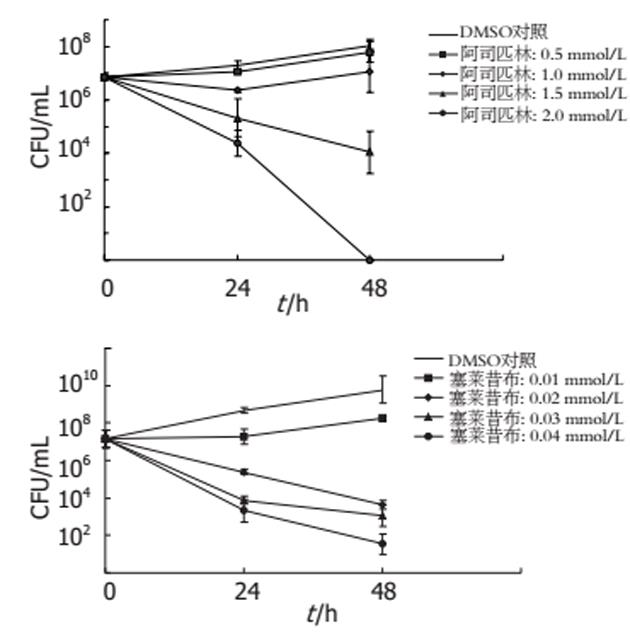
结果: 阿司匹林及塞莱昔布可以抑制H. pylori的生长, 此过程为剂量依赖性效应. 阿司匹林0.5 mmol/L及塞莱昔布0.01 mmol/L时与DMSO对照相比H. pylori 24 h和48 h的菌落计数开始降低, 随着两药剂量的加大菌落计数降低得更加明显, 阿司匹林2.0 mmol/L和塞莱昔布0.04 mmol/L时H. pylori被完全杀灭. 阿司匹林及塞莱昔布可剂量依赖性的抑制H. pylori的尿素酶活性及空泡毒素的活性. 在对H. pylori外膜蛋白的研究中发现, NSAIDs可能对H. pylori的某种外膜蛋白表达有影响.
结论: 阿司匹林和塞莱昔布可抑制H. pylori的生长、毒力因子的活性, 并可能改变H. pylori外膜蛋白的表达.
引文著录: 马慧霞, 王蔚虹, 胡伏莲, 李江. 阿司匹林和塞莱昔布对幽门螺杆菌的体外影响. 世界华人消化杂志 2006; 14(28): 2747-2752
Revised: July 29, 2006
Accepted: August 23, 2006
Published online: October 8, 2006
AIM: To investigate the possible effects of aspirin and celecoxib on the growth, virulence factors and outer membrane protein of Helicobacter pylori (H. pylori).
METHODS: Two standard strains of H. pylori were treated with a series concentration of aspirin or celecoxib (a specific inhibitor of cyclooxygenase 2) and were incubated in brucella broth under microaerobic condition for 24 and 48 h. The growth and urease activity were assessed by viable colony counting and spectrophotometry. After 48-hour treatment, the supernatants were incubated with Hela cells to estimate vacuolating cytotoxin activity. The outer membrane protein of H. pylori was analyzed by SDS-PAGE.
RESULTS: Aspirin or celecoxib inhibited the growth of H. pylori in a dose-dependent manner with the lowest inhibitory concentrations of 0.5 or 0.01 mmol/L, and the lethal concentrations of 2.0 and 0.04 mmol/L, respectively. Aspirin and celecoxib inhibited the urease activity and vacuolating cytotoxin activity of H. pylori. The inhibitory effect of celecoxib on H. pylori was superior to that of aspirin. Both aspirin and celecoxib had some effects on the expression of the outer membrane protein.
CONCLUSION: Aspirin or celecoxib can inhibit the growth, urease activity and vacuolating cytotoxin activity of H. pylori in vitro significantly. Both aspirin and celecoxib may have some effects on the outer membrane protein expression of H. pylori.
- Citation: Ma HX, Wang WH, Hu FL, Li J. Effect of aspirin and celecoxib on Helicobacter pylori in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(28): 2747-2752
- URL: https://www.wjgnet.com/1009-3079/full/v14/i28/2747.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i28.2747
幽门螺杆菌(Helicobacter pylori, H. pylori)和非甾体类消炎药(non-steroidal anti-inflammatory drugs, NSAIDs)被认为是导致胃黏膜损伤及溃疡形成的两个主要因素, 两者同时存在而致病的情形并不少见. H. pylori和NSAIDs作为两个独立的致病因素, 在多数情况下具有相同或相似的胃黏膜损害作用, 而在某些情况下的作用却是相反或拮抗的. NSAIDs抑制胃黏膜环氧化物酶(COX)的表达和前列腺素(PG)合成, 而H. pylori感染则可以上调COX-2 mRNA的表达, 增加PG合成[1-3]. Huang et al[4]荟萃分析研究显示, H. pylori感染和NSAIDs均可以增加消化性溃疡和出血的发生, 二者同时存在时发生消化性溃疡和溃疡出血的风险进一步增加, 提示二者有Ð同作用. 然而有临床研究观察了NSAIDs服用者6 wk内胃肠道症状的发生率, 结果显示, H. pylori阳性者与阴性者相比无显著性差异[5]. 因此, H. pylori感染和NSAIDs同时存在时, 胃黏膜的损伤并不是两种损害因素的简单相加. 我们推测在NSAIDs和H. pylori之间可能存在某种相互作用, 从而干扰对方在胃肠道的致病性. 有研究发现, NSAIDs甚至可以提高H. pylori对几种常用的抗生素如甲硝唑、克拉霉素等的敏感性[6-7]. 而革兰氏阴性细菌的外膜蛋白可能与细菌抗生素的敏感性密切相关[8-9]. 因此我们推测, NSAIDs可能通过影响H. pylori的某些外膜蛋白的表达, 使得H. pylori的细胞膜对某些抗生素的通透性增加, 从而提高H. pylori对这些抗生素的敏感性. 我们探讨了临床上广泛应用的阿司匹林和倍受人们关注的选择性COX-2抑制剂塞莱昔布在体外培养条件下, 对H. pylori生长、尿素酶活性及空泡毒素活性的影响, 为进一步解释H. pylori和NSAIDs共同存在时对胃黏膜的致病性提供依据. 通过SDS-PAGE电泳方法研究NSAIDs对H. pylori外膜蛋白的影响, 初步探讨NSAIDs提高H. pylori对抗生素敏感性的作用机制.
两株毒素阳性的H. pylori标准菌株: H. pylori NCTC11637来自英国伦敦国家标准培养物收藏中心(National Collection of Type Culture), 由北京大学第一医院消化实验室保存. H. pylori 26695由北京疾病预防控制中心流行病研究所惠赠. Hela细胞由北京大学肿瘤医院试验中心提供. 阿司匹林购自美国Sigma公司, 塞莱昔布由北京医药研究开发中心惠赠, 二者分别溶于二甲基亚砜(DMSO)中备用.
1.2.1 H. pylori液体培养体系的建立及相关指标的检测: 收集新鲜培养的H. pylori NCTC11637或26695于100 mL/L的胎牛血清/布氏肉汤培养液中, 调整菌液浓度(1×107-1×108)CFU/mL. 20 mL菌液加入灭菌10 cm的培养皿中, 分别加入阿司匹林或塞莱昔布药液100 μL, 药物的终浓度为: 阿司匹林0.5, 1.0, 1.5及2.0 mmol/L, 塞莱昔布0.01, 0.02, 0.03及0.04 mmol/L, 对照组加入100 μL DMSO. 培养皿置微需氧条件下, 空气摇床60 r/min, 37℃培养48 h后, 6000 r/min, 4℃离心. 上清以超滤离心管(30 k)浓缩20倍, 浓缩上清0.22 μm滤膜过滤后备用, 保留细菌沉淀. 于培养0, 24, 48 h分别取菌液2 mL. 1 mL菌液用于分光光度计测量A600nm值. 100 μL菌液加入1 mL尿素酶试剂20 min后, 分光光度计测A560nm值, 未加入菌液的尿素酶试剂作为空白对照. 计算每数量级活菌的尿素酶活性, 以评价药物对H. pylori尿素酶的抑制作用与其对H. pylori生长抑制作用的关系, 即A560nm值/Log10(活菌计数). 剩余菌液用培养液分别10倍比稀释, 稀释后的菌液各取100 μL接种于哥伦比亚琼脂平板培养基上, 于37℃, 微需氧环境下培养3 d后, 选择菌落数量在30-300范围内的培养皿行菌落计数.
1.2.2 空泡变性实验[10-11]: 取对数生长期的Hela细胞4×105/孔接种于96孔细胞培养板中, 培养24 h. 加入不同稀释倍数的H. pylori浓缩上清, 共同孵育12 h, 倒置显微镜观察细胞形成空泡的情况. 每孔计数100个细胞, 超过50%细胞形成空泡为空泡毒素活性阳性.
1.2.3 中性红吸收实验[12]: Hela细胞与H. pylori浓缩上清液共同孵育后, 加入0.5 g/L中性红/生理盐水液, 室温下放置5 min. 以2 g/L牛血清白蛋白/生理盐水液轻洗3次, 加入盐酸酒精液裂解细胞. 酶标仪上测定A540nm值. 以未接种H. pylori的空白培养上清作为阴性对照, 每种浓缩上清作3孔, 取平均值作为最终结果.
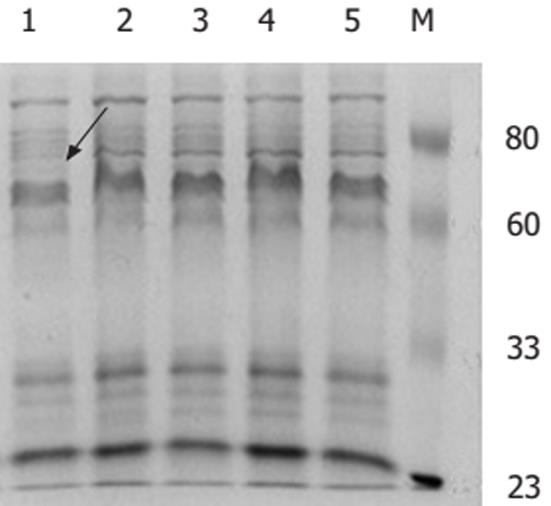
1.2.4 外膜蛋白分析[13]: 收集培养48 h的H. pylori, 悬于20 mmol/L pH 7.5的Tris液中, 超声破菌至镜下细颗粒状, 6000 r/min, 4℃离心, 保留上清. 离心40 000 g, 4℃, 30 min, 保留沉淀. 重悬于20 g/L十二烷基肌氨酸钠(SLS)/20 mmol/L pH 7.5的Tris液中, 室温孵育30 min. 再以40 000 g, 4℃, 30 min离心, 保留沉淀即为外膜蛋白. 测定蛋白浓度. 取各组外膜蛋白10 μg, 100 g/L的SDS-PAGE凝胶电泳, 调整电压120 伏(8伏/cm)直至溴酚兰到达分离胶底部时停止电泳, 凝胶以考马斯亮兰染色.
统计学处理 实验结果取mean±SD, 并行t检验, 以SPSS软件进行处理.
H. pylori培养菌液A600nm值和菌落计数结果显示, 阿司匹林和塞莱昔布对H. pylori生长有抑制作用, 这种作用是剂量依赖性的. 菌落计数结果(图1)显示, 阿司匹林0.5 mmol/L组与DMSO对照组相比差异无统计学意义, 阿司匹林其他剂量和塞莱昔布各剂量组与DMSO组相比在24 h和48 h差异均有统计学意义(P<0.05).
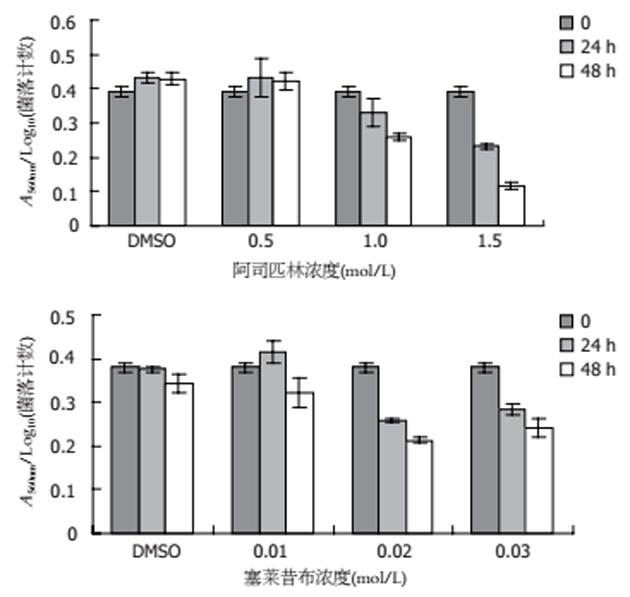
阿司匹林和塞莱昔布均能明显抑制H. pylori尿素酶活性, 且呈剂量依赖性. 24 h和48 h阿司匹林和塞莱昔布各组A560nm结果与DMSO对照组相比差异有统计学意义(P<0.05). 为评价药物对H. pylori尿素酶的抑制作用与其对H. pylori生长抑制作用的关系, 计算每数量级活菌的尿素酶活性. 阿司匹林0.5 mmol/L与DMSO对照组每数量级活菌尿素酶的活性相比差异无统计学意义, 塞莱昔布0.01 mmol/L与DMSO对照组相比差异无统计学意义. 阿司匹林剂量大于1.0 mmol/L时和塞莱昔布剂量大于0.02 mmol/L时, H. pylori每数量级活菌尿素酶的活性与DMSO对照组相比有降低, 且差异有统计学意义(P均<0.05). 且阿斯匹林组随着药物剂量的增大每数量级活菌尿素酶活性的下降更为明显(图2).
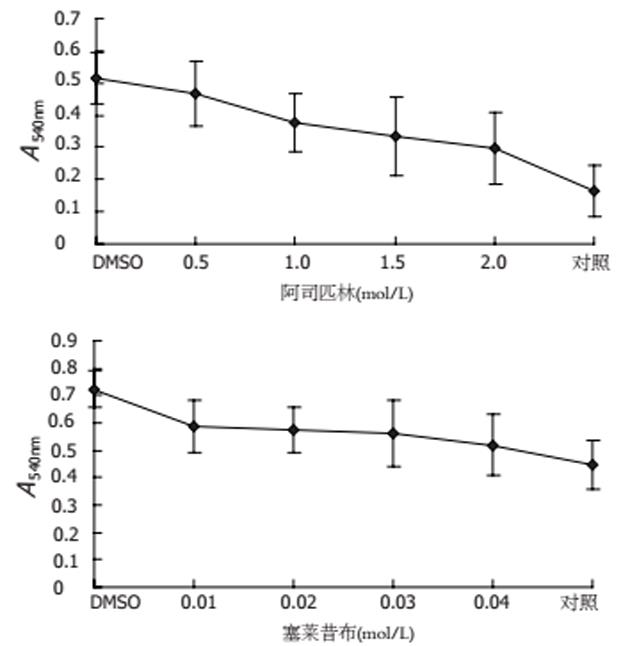
空泡变性实验结果显示, DMSO对照组浓缩上清1∶16倍稀释空泡毒素为阳性. 0.5 mmol/L阿司匹林处理的H. pylori菌株浓缩上清1∶2倍稀释时空泡毒素为阳性. 阿司匹林浓度为1.0, 1.5, 2.0 mmol/L时培养上清空泡毒素活性均为阴性. 塞莱昔布处理后的H. pylori浓缩上清空泡毒素活性均为阴性. 中性红吸收实验结果显示, 随着两种药物浓度的增加A540nm值逐渐减低(图3). 以上结果均提示, 两种药物对H. pylori空泡毒素活性有抑制作用, 表现为剂量依赖性.
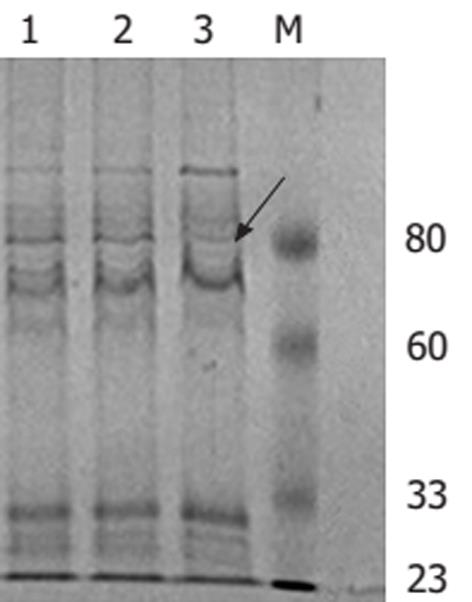
H. pylori感染和NSAIDs被认为是胃黏膜损伤及溃疡形成的两个重要的独立危险因素, 由于H. pylori感染在世界范围内人群中的广泛存在以及NSAIDs越来越广泛的应用, 临床上二者合并存在的机会并不少见. 由于两者致病的机制不同, 两个危险因素同时存在时, 其相互作用就比较复杂. 我们的动物实验曾显示H. pylori与NSAIDs共同作用可以造成比H. pylori或NSAIDs单独作用更加严重的胃黏膜损伤[14], 但这种损害程度并不是两个单因素的简单相加. 有临床研究发现, 在NSAIDs服用者中, H. pylori感染可以增加NSAIDs相关性溃疡的发生[15], 并成倍的增加上消化道出血的危险[16]. Huang et al[4]对有关NSAIDs和H. pylori对消化性溃疡危险性的研究进行了荟萃分析. 单纯H. pylori感染和服用NSAIDs分别可以使消化性溃疡病的危险增加18.1倍和19.4倍, 二者同时存在时发生消化性溃疡病的危险增加了61.1倍. H. pylori感染和服用NSAIDs分别可以使溃疡出血的风险增加1.79倍和4.85倍, 而二者同时存在时溃疡出血的风险增加了6.13倍. 提示在消化性溃疡和溃疡出血中, 二者之间存在协同作用. 然而, 近期法国的一项研究对于NSAIDs服用者进行观察, 发现6 wk内胃肠道症状的发生率H. pylori阳性者与阴性者相比无显著性差异[5]. 有些研究发现, 对于NSAIDs相关性溃疡H. pylori阳性者治疗和预防复发的成功率较阴性者明显提高[17-18], 根除H. pylori可以降低NSAIDs服用者消化性溃疡的发生, 但其作用似乎不如维持质子泵抑制剂治疗更为有效[19]. 导致上述研究结果不一致除了可能存在观察时间不同、病例选择有差异等原因, 推测可能在H. pylori感染和NSAIDs同时存在时, 胃黏膜的损伤不是两种损害因素的简单相加, 二者之间很可能存在某些相互作用, 从而互相干扰对方在胃肠道中的致病性. 近期Wang et al[20]的研究也发现, 阿司匹林可以剂量依赖性抑制H. pylori的生长. Gu et al[6]的研究发现, 吲哚美辛及COX抑制剂SC-236不仅可以抑制H. pylori的生长, 还对H. pylori尿素酶活性有抑制作用. 我们的研究显示, 阿司匹林和选择性COX-2抑制剂塞莱昔布不仅可以剂量依赖性抑制H. pylori的生长, 还可以抑制H. pylori的尿素酶活性及空泡毒素的活性, 与上述的结果一致. 新近Shirin et al[21]的研究也显示布洛芬、吲哚美辛、选择性COX-2抑制剂NS-398和两种舒林酸亚砜的衍生物可以抑制H. pylori的生长. 尿素酶活性和空泡毒素均为与H. pylori致病有关的主要毒力因子, 尿素酶除了对H. pylori本身起保护作用外[22], 还能造成胃黏膜屏障的损害[23-24]. 随着患者胃黏膜损伤程度的加重, 分离出的产毒H. pylori菌株的百分比也在增加[25-26], babA2, cagA和vacA阳性的菌株可以加重胃黏膜的损害并使发生肠化生的危险增加[27], 提示细胞空泡毒素与临床疾病的严重程度密切相关. 阿司匹林和塞莱昔布不仅抑制H. pylori生长, 更进一步抑制了尿素酶及空泡毒素的产生及其活性, 从而有可能减弱H. pylori的致病性. 本研究显示, 阿司匹林2.0 mmol/L和塞莱昔布0.04 mmol/L培养48 h可完全杀灭H. pylori. 阿司匹林用于解热、止痛和抗炎作用时, 其血浆浓度通常为150-300 mg/L(0.8-1.6 mmol/L), 而口服后, 胃黏膜局部的浓度可以达到更高水平, 因此在体内完全有可能达到其抑菌浓度. 近期的一项随机对照临床研究[28]显示, 应用标准奥美啦唑-阿莫西林-克拉霉素(OAC)三联疗法及OAC三连疗法+大剂量阿司匹林(2000 mg, bid)治疗H. pylori阳性的消化性溃疡和慢性胃炎患者, H. pylori根治率分别为80.3%(49/61)及86.7%(52/60). OAC+阿司匹林组对H. pylori的根治率稍高于OAC组, 但两组在统计学上并无显著性差异. 两组中所有恶性事件包括消化道出血的发生率也无统计学差异. 在临床观察期间, 消化性溃疡及慢性胃炎患者均可以很好的耐受服用较大剂量阿司匹林. 然而阿司匹林特别是选择性的COX-2抑制剂是否可以用于临床上H. pylori的根除治疗及其安全性还有待于更多的动物及临床研究证实. 阿司匹林和塞莱昔布能够抑制H. pylori尿素酶活性, 且药物处理后每数量级H. pylori活菌的尿素酶活性较对照相比明显下降, 提示这两种药物对H. pylori尿素酶的抑制可能不是完全由于其对生长的抑制造成的, 他们有可能直接抑制H. pylori尿素酶的产生或其活性. 目前, NSAIDs在人群中广泛应用, 基于尿素酶的H. pylori感染检测方法如快速尿素酶实验, 13C及14C尿素呼气实验也广泛应用于临床. 由于NSAIDs可能对H. pylori尿素酶有抑制作用, 对NSAIDs服用者采用基于尿素酶的实验来诊断H. pylori感染, 其敏感性及特异性是否受到影响应引起人们的关注. 对NSAIDs服用者以何种方式检测H. pylori感染具有更好的准确性也需要更多的临床实验来证实. 不同的H. pylori菌株致病性不同, 毒素阳性的菌株致病性较强. 阿司匹林和塞莱昔布与H. pylori共同培养可明显降低H. pylori空泡毒素的活性, 表现为剂量依赖性. NSAIDs对H. pylori空泡毒素抑制作用的机制尚不明了, 有可能是通过药物的抑菌作用实现的. NSAIDs是否同时抑制H. pylori空泡毒素的活性尚有待研究. 近年有研究发现, 在阿司匹林存在的条件下, 临床上最常用于H. pylori根除治疗的抗生素如甲硝唑、克拉霉素和羟氨苄青霉素对H. pylori的MIC值降低, 说明阿司匹林提高了细菌对这些抗生素的敏感性[7]. 进一步的研究发现, 消炎痛和选择性COX-2抑制剂SC-236也可以提高H. pylori对甲硝唑和克拉霉素的敏感性[6]. 革兰氏阴性细菌的外膜蛋白具有选择性屏障作用, 小分子的亲水性物质凭借亲水性的微孔蛋白(Porin)构成的孔道穿透疏水性的外膜蛋白进入菌体. 目前发现了至少5种微孔蛋白, 命名为HopA至HopE[29-30], 并认为可能与H. pylori的耐药性有关[29], 进一步的研究证实H. pylori对抗生素的耐药性与青霉素结合蛋白(PBP)的改变及膜通透性的减低有关[31]. 在体外培养条件下, 阿司匹林和塞莱昔布对H. pylori NCTC11637外膜蛋白有影响, 两种药物均可以使分子量80 kDa左右的一个蛋白表达增多, 因此推测NSAIDs有可能通过改变H. pylori的某些外膜蛋白, 使得H. pylori的细胞膜对某些抗生素的通透性增加, 从而提高H. pylori对抗生素的敏感性. 但具体受影响的外膜蛋白及作用机制还需进一步研究.
阿司匹林和塞莱昔布可以抑制H. pylori生长、尿素酶活性和空泡毒素活性, 这可以部分解释NSAIDs和H. pylori共同存在时的致病性并不是两种因素的简单相加这一事实. 本研究还发现, 阿司匹林和塞莱昔布可能对H. pylori的外膜蛋白有影响, 提示NSAIDs可能通过对H. pylori外膜蛋白的作用来影响H. pylori对抗生素的敏感性. 然而, 由于NSAIDs对H. pylori生长及尿素酶的抑制作用, 临床上对NSAIDs服用者采用基于尿素酶的实验诊断H. pylori感染的敏感性和特异性是否受到影响, 以及NSAIDs在体内H. pylori根除治疗中所起的作用, 还有待进一步的研究.
幽门螺杆菌(H. pylori)和非甾体类消炎药(NSAIDs)被认为是导致胃黏膜损伤及溃疡形成的两个主要因素, H. pylori感染和NSAIDs同时存在时, 胃黏膜的损伤并不是两种损害因素的简单相加. NSAIDs和H. pylori之间可能存在某种相互作用, 从而干扰对方在胃肠道的致病性.
H. pylori感染在世界范围内广泛存在, 而NSAIDs是世界范围内应用最广泛的药物之一, 二者同时存在而致病的情形并不少见. 对二者共同致病及二者间相互作用的研究引起人们的重视. 近年研究发现, NSAIDs可以提高H. pylori对一些常用抗生素的敏感性, 其具体作用机制及在临床上H. pylori根除治疗中的作用还有待进一步的研究明确.
Wang et al的研究发现阿司匹林可以剂量依赖性抑制H. pylori的生长. Wangetal进一步研究发现在阿司匹林存在的条件下, 临床上最常用于H. pylori根除治疗的抗生素如甲硝唑、克拉霉素和羟氨苄青霉素对H. pylori的MIC值降低, 说明阿司匹林提高了细菌对这些抗生素的敏感性. Guetal的研究发现吲哚美辛及COX抑制剂SC-236不仅可以抑制H. pylori的生长, 还对H. pylori尿素酶活性有抑制作用, 吲哚美辛和选择性COX-2抑制剂SC-236也可以提高H. pylori对甲硝唑和克拉霉素的敏感性. Shirinetal的研究显示布洛芬、吲哚美辛、选择性COX-2抑制剂NS-398和两种舒林酸亚砜的衍生物可以抑制H. pylori的生长.
阿司匹林和塞莱昔布可以抑制H. pylori生长、尿素酶活性和空泡毒素活性, 这可以部分解释NSAIDs和H. pylori共同存在时的致病性并不是两种因素的简单相加这一事实. 本研究还发现, 阿司匹林和塞莱昔布可能对H. pylori的外膜蛋白有影响, 提示NSAIDs可能通过对H. pylori外膜蛋白的作用来影响H. pylori对抗生素的敏感性.
由于NSAIDs对H. pylori生长及尿素酶的抑制作用, 提示目前在临床上广泛应用的基于尿素酶的诊断性实验对NSAIDs服用者的敏感性和特异性可能受到影响. NSAIDs可能通过对H. pylori外膜蛋白的作用来影响H. pylori对抗生素的敏感性. 提示在体内H. pylori根除治疗中NSAIDs可能存在积极作用.
本文探讨阿斯匹林和选择性COX-2抑制剂塞来昔布对体外培养的幽门螺杆菌(H. pylori)生长、毒力因子及外膜蛋白的影响, 论文选题准确, 研究方法科学性强, 结论可靠, 具有较高的理论水平及临床意义.
电编:张敏 编辑:王晓瑜
| 1. | Romano M, Ricci V, Memoli A, Tuccillo C, Di Popolo A, Sommi P, Acquaviva AM, Del Vecchio Blanco C, Bruni CB, Zarrilli R. Helicobacter pylori up-regulates cyclooxygenase-2 mRNA expression and prostaglandin E2 synthesis in MKN 28 gastric mucosal cells in vitro. J Biol Chem. 1998;273:28560-28563. [PubMed] [DOI] |
| 2. | Kim JM, Kim JS, Jung HC, Song IS, Kim CY. Upregulated cyclooxygenase-2 inhibits apoptosis of human gastric epithelial cells infected with Helicobacter pylori. Dig Dis Sci. 2000;45:2436-2443. [PubMed] [DOI] |
| 3. | Bhang CS, Lee HS, Kim SS, Song HJ, Sung YJ, Kim JI, Chung IS, Sun HS, Park DH, Lee YS. Effects of selec-tive cyclooxygenase-2 inhibitor and non-selective NSAIDs on Helicobacter pylori-induced gastritis in Mongolian gerbils. Helicobacter. 2002;7:14-21. [PubMed] [DOI] |
| 4. | Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet. 2002;359:14-22. [PubMed] [DOI] |
| 5. | Schaeverbeke T, Broutet N, Zerbib F, Combe B, Bertin P, Lamouliatte H, Perie F, Joubert-Collin M, Megraud F. Should we eradicate Helicobacter pylori before prescribing an NSAID? Result of a placebo-controlled study. Am J Gastroenterol. 2005;100:2637-2643. [PubMed] [DOI] |
| 6. | Gu Q, Xia HH, Wang WH, Wang JD, Wong WM, Chan AO, Yuen MF, Lam SK, Cheung HK, Liu XG. Effect of cyclo-oxygenase inhibitors on Helicobacter pylori susceptibility to metronidazole and clarithromycin. Aliment Pharmacol Ther. 2004;20:675-681. [PubMed] [DOI] |
| 7. | Wang WH, Wong WM, Dailidiene D, Berg DE, Gu Q, Lai KC, Lam SK, Wong BC. Aspirin inhibits the growth of Helicobacter pylori and enhances its susceptibility to antimicrobial agents. Gut. 2003;52:490-495. [PubMed] [DOI] |
| 8. | Nikaido H. Prevention of drug access to bacterial targets: permeability barriers and active efflux. Science. 1994;264:382-388. [PubMed] [DOI] |
| 9. | Putman M, van Veen HW, Konings WN. Molecular properties of bacterial multidrug transporters. Microbiol Mol Biol Rev. 2000;64:672-693. [PubMed] [DOI] |
| 10. | Cover TL, Dooley CP, Blaser MJ. Characterization of and human serologic response to proteins in Helicobacter pylori broth culture supernatants with vacuolizing cytotoxin activity. Infect Immun. 1990;58:603-610. [PubMed] |
| 12. | Cover TL, Cao P, Murthy UK, Sipple MS, Blaser MJ. Serum neutralizing antibody response to the vacuolating cytotoxin of Helicobacter pylori. J Clin Invest. 1992;90:913-918. [PubMed] [DOI] |
| 13. | Doig P, Trust TJ. Identification of surface-exposed outer membrane antigens of Helicobacter pylori. Infect Immun. 1994;62:4526-4533. [PubMed] |
| 15. | Grigoriadou S, Quraishi A, Saravanna J, Saravanan V, Heycock C, Kelly C. What effect does Helicobacter pylori infection have on the risk of peptic ulceration in patients receiving NSAIDs for rheumatoid arthritis? Eur J Intern Med. 2002;13:269-273. [PubMed] [DOI] |
| 16. | Papatheodoridis GV, Papadelli D, Cholongitas E, Vassilopoulos D, Mentis A, Hadziyannis SJ. Effect of helicobacter pylori infection on the risk of upper gastrointestinal bleeding in users of nonsteroidal anti-inflammatory drugs. Am J Med. 2004;116:601-605. [PubMed] [DOI] |
| 17. | Hawkey CJ, Karrasch JA, Szczepanski L, Walker DG, Barkun A, Swannell AJ, Yeomans ND. Omeprazole compared with misoprostol for ulcers associated with nonsteroidal antiinflammatory drugs. Omeprazole versus Misoprostol for NSAID-induced Ulcer Management (OMNIUM) Study Group. N Engl J Med. 1998;338:727-734. [PubMed] [DOI] |
| 18. | Yeomans ND, Tulassay Z, Juhasz L, Racz I, Howard JM, van Rensburg CJ, Swannell AJ, Hawkey CJ. A comparison of omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory drugs. Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID-associated Ulcer Treatment (ASTRONAUT) Study Group. N Engl J Med. 1998;338:719-726. [PubMed] [DOI] |
| 19. | Vergara M, Catalan M, Gisbert JP, Calvet X. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ulcer in NSAID users. Aliment Pharmacol Ther. 2005;21:1411-1418. [PubMed] [DOI] |
| 20. | Wang WH, Hu FL, WONG BCY, BERG DE, LAM SK. Inhibitory effects of aspirin and indometacin on the growth of Helicobacter pylori in vitro. Chinese J Dig Dis. 2002;3:172-177. [DOI] |
| 21. | Shirin H, Moss SF, Kancherla S, Kancherla K, Holt PR, Weinstein IB, Sordillo EM. Non-steroidal anti-inflammatory drugs have bacteriostatic and bactericidal activity against Helicobacter pylori. J Gastroenterol Hepatol. 2006;21:1388-1393. [PubMed] [DOI] |
| 22. | Windsor HM, O'Rourke J. Bacteriology and taxonomy of Helicobacter pylori. Gastroenterol Clin North Am. 2000;29:633-648. [PubMed] [DOI] |
| 23. | Hazell SL, Lee A. Campylobacter pyloridis, urease, hydrogen ion back diffusion, and gastric ulcers. Lancet. 1986;2:15-17. [PubMed] [DOI] |
| 24. | Marshall BJ. Helicobacter pylori. Am J Gastroenterol. 1994;89:S116-128. [PubMed] |
| 25. | Tee W, Lambert JR, Dwyer B. Cytotoxin production by Helicobacter pylori from patients with upper gastrointestinal tract diseases. J Clin Microbiol. 1995;33:1203-1205. [PubMed] |
| 26. | Qiao W, Hu JL, Xiao B, Wu KC, Peng DR, Atherton JC, Xue H. cagA and vacA genotype of Helicobacter pylori associated with gastric diseases in Xi'an area. World J Gastroenterol. 2003;9:1762-1766. [PubMed] [DOI] |
| 27. | Hocker M, Hohenberger P. Helicobacter pylori virulence factors-one part of a big picture. Lancet. 2003;362:1231-1233. [PubMed] [DOI] |
| 28. | Park SH, Park DI, Kim SH, Kim HJ, Cho YK, Sung IK, Sohn CI, Jeon WK, Kim BI, Keum DK. Effect of high-dose aspirin on Helicobacter pylori eradication. Dig Dis Sci. 2005;50:626-629. [PubMed] [DOI] |
| 29. | Doig P, Exner MM, Hancock RE, Trust TJ. Isolation and characterization of a conserved porin protein from Helicobacter pylori. J Bacteriol. 1995;177:5447-5452. [PubMed] [DOI] |
| 30. | Exner MM, Doig P, Trust TJ, Hancock RE. Isolation and characterization of a family of porin proteins from Helicobacter pylori. Infect Immun. 1995;63:1567-1572. [PubMed] |
| 31. | Kwon DH, Dore MP, Kim JJ, Kato M, Lee M, Wu JY, Graham DY. High-level beta-lactam resistance associated with acquired multidrug resistance in Helicobacter pylori. Antimicrob Agents Chemother. 2003;47:2169-2178. [PubMed] [DOI] |