修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-05-01
目的: 探讨胆管癌组织中CD44v6和nm23-H1的表达及临床意义.
方法: 采用免疫组织化学方法检测49例胆管癌及16例胆管良性病变组织中CD44v6和nm23-H1的表达. 分析与临床病理学特征的相关性.
结果: CD44v6阳性表达率在胆管癌组明显高于胆管良性病变组69.40% vs 18.75%, P<0.01; CD44v6表达与胆管癌的临床分期、转移及预后有关. nm23-H1在胆管癌组织中的阳性表达率明显低于胆管良性病变组53.1% vs 87.50%, P<0.05; nm23-H1的表达与胆管癌的组织学分级、临床分期、转移及预后密切相关. CD44v6和nm23-H1在胆管癌组织中表达呈负相关(r = -0.359, P<0.05).
结论: CD44v6的表达与胆管癌的临床分期、转移及预后有关, nm23-H1的表达与胆管癌的组织学分级、临床分期、转移及预后有关; 二者可能在胆管癌细胞的侵袭和转移中起重要作用. 联合检测二者有利于评估胆管癌的生物学行为和判断预后.
引文著录: 张炳远, 闫尚伦, 李玉军, 吴力群. 胆管癌组织中CD44v6和nm23-H1的表达及其临床意义. 世界华人消化杂志 2005; 13(9): 1127-1130
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: May 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1127-1130
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1127.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1127
恶性肿瘤的侵袭和转移是受多因素调控的复杂过程, 涉及肿瘤细胞恶性增殖、肿瘤组织新生血管形成、肿瘤细胞黏附、分泌蛋白降解基质及肿瘤细胞迁移运动等一系过程. 已有研究表明, CD44v6和nm23-H1在肿瘤的侵袭和转移中起着十分重要的作用. 我们联合检测CD44v6和nm23-H1在胆管癌中的表达, 并结合临床和随访资料分析, 旨在探讨他们的表达特征和临床意义.
选取青岛大学医学院1999-01/2001-01间49例手术切除的肝外胆管癌患者的存档组织蜡块, 每例均有详细的临床资料、手术记录及18 mo以上的随访结果, 全部病例均经病理证实. 其中男26例, 女23例, 年龄38-77(平均54.3±7.4)岁. 按CT显示肿瘤大小0.8-6.0 cm, 其中≤2.0 cm者15例, >2.0 cm者34例. 按部位分肝门部胆管癌(上段癌)27例, 中段癌8例, 下段癌14例. 临床PTNM分期I期4例, II期9例, III期15例, IV期21例. 组织学分级包括I级(高分化)10例, II 级(中分化)21例, III级(低分化)18例. 临床和病理证实伴有转移者27例(包括淋巴结、肝、胆囊、肠系膜和胰腺等), 无转移者22例.49例胆管癌患者生存时间>18 mo者17例, ≤18 mo者32例. 同时取16例经手术及病理学检查证实的胆管良性病变(9例胆总管囊肿, 7例胆管黏膜慢性炎症)蜡块标本做对照. 用已知阳性组织切片做对照片. CD44v6(工作浓度1: 100)和nm23-H1(工作浓度1: 50)单克隆抗体(鼠抗人)和SP试剂盒均购自福州迈新生物技术公司.
采用SP免疫组织化学法, 所有标本均经40 g/L甲醛固定, 石蜡包埋, 每例4 μm连续切片, 分别作HE染色及SP免疫组化染色, SP染色法按照SP试剂盒说明书进行. 结果判断标准: CD44v6和nm23-H1阳性信号为细胞膜和(或)细胞质内出现棕黄色或棕褐色染色. 根据染色强度及显色癌细胞比例将染色分为"-, +, ++"三级. (1)按切片细胞显色有无及深浅评分: 无显色为0分, 浅黄色为1分; 棕黄色为2分, 棕褐色为3分. (2)按显色细胞比例记分: 显色细胞<10%为0分; 10%-30%显色为1分; 31%-60%显色为2分; 60%以上显色为3分. 每例积分 = (1)×(2). 按积分高低分为: 阴性(-), 积分为0分; 阳性(+), 积分1-4分; 强阳性(++), 积分>4分.
统计学处理 根据资料性质CD44v6在胆管癌及正常胆管中的表达差异、及其表达与胆管癌患者性别、组织学分级、是否伴发转移、存活时间关系, nm23-H1在胆管癌及正常胆管中的表达差异、及其表达与胆管癌患者性别、年龄、肿瘤大小、组织学分级、临床分期、是否伴发转移、存活时间关系应用χ2检验; CD44v6与胆管癌患者年龄、肿瘤大小、临床分期、应用χ2校正检验; CD44v6、nm23-H1与胆管癌部位关系应用精确检验法; CD44v6与nm23-H1胆管癌组织中的表达相关性应用Spearman等级相关分析.
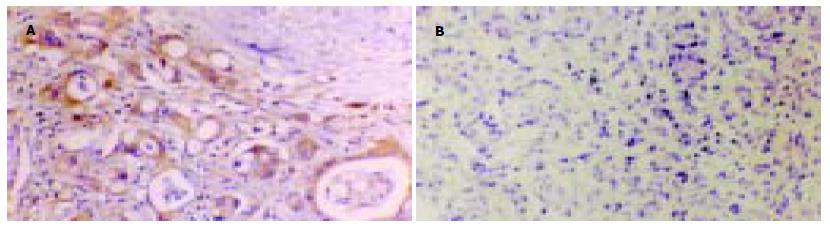
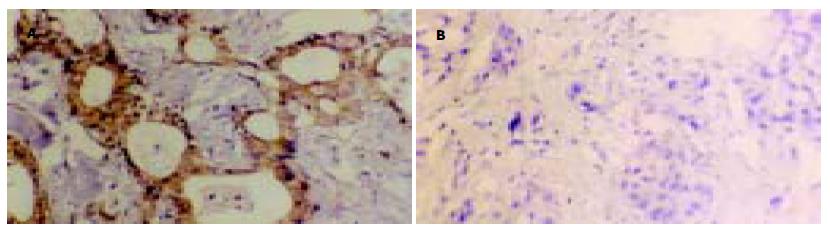
CD44V6阳性表达产物呈棕黄色或棕褐色, 主要定位于细胞膜(图1), nm23-H1阳性表达产物呈棕黄色或棕褐色颗粒状或团块状, 主要定位于细胞质(图2).16例胆管良性病变组织中, CD44v6阳性表达3例, 阳性率为18.75%(3/16), nm23-H1阳性表达14例, 阳性率为87.50%.49例胆管癌中, CD44v6和nm23-H1的阳性表达率分别为69.40%(34/49)和53.1%(26/49). CD44v6在胆管癌中的阳性表达率显著高于良性病变组织(χ2 = 12.61, P<0.01), nm23-H1在胆管癌中的阳性表达率显著低于良性病变组织(χ2 = 6.04, P<0.05).
CD44v6在胆管癌中的表达与患者性别(χ2 = 0.36, P>0.05)、年龄(χ2 = 0.01, P>0.05)、肿瘤大小(χ2 = 0.004, P>0.05)、肿瘤部位(P = 0.87, P>0.05)及组织学分级(χ2 = 0.14, P>0.05)、TNM(χ2 = 3.13, P>0.05)分期无关, 与转移状况(χ2 = 7.07, P<0.01)及预后(χ2 = 6.11, P<0.05)密切相关; nm23-H1在胆管癌中的表达与患者年龄(χ2 = 0.01, P>0.05)、性别(χ2 = 0.01, P>0.05)、肿瘤大小(χ2 = 0.0 006, P>0.05)、肿瘤部位(P = 0.99, P>0.05)、组织学分级(χ2 = 4.57, P>0.05)无关, 与TNM分期(χ2 = 4.05, P<0.05)、转移状况(χ2 = 6.20, P<0.05)及预后(χ2 = 4.79, P<0.05)密切相关(表1).
| 病理特征 | n | CD44v6 | nm23-H1 | ||||||
| - | + | ++ | R | - | + | ++ | R | ||
| 性别 | |||||||||
| 男 | 26 | 7 | 10 | 9 | 73.1 | 12 | 8 | 6 | 53.8 |
| 女 | 23 | 8 | 6 | 9 | 65.2 | 11 | 8 | 4 | 52.2 |
| 年龄 | |||||||||
| >50岁 | 38 | 12 | 11 | 15 | 68.4 | 18 | 13 | 7 | 52.6 |
| ≤50岁 | 11 | 3 | 5 | 3 | 72.7 | 5 | 3 | 3 | 54.5 |
| 肿瘤大小 | |||||||||
| >2.0 cm | 34 | 10 | 13 | 11 | 70.6 | 16 | 13 | 5 | 52.9 |
| ≤2.0 cm | 15 | 5 | 3 | 7 | 66.7 | 7 | 3 | 5 | 53.3 |
| 部位 | |||||||||
| 上段 | 27 | 9 | 10 | 8 | 66.7 | 13 | 9 | 5 | 51.9 |
| 中段 | 8 | 2 | 2 | 4 | 75 | 4 | 3 | 1 | 50.0 |
| 下段 | 14 | 4 | 4 | 6 | 71.4 | 6 | 4 | 4 | 57.1 |
| 组织学分级 | |||||||||
| I | 10 | 3 | 3 | 4 | 70.0 | 4 | 4 | 2 | 60.0 |
| II | 21 | 7 | 6 | 8 | 66.7 | 7 | 9 | 5 | 66.7 |
| III | 18 | 5 | 7 | 6 | 72.2 | 12 | 3 | 3 | 33.3 |
| 临床分期 | |||||||||
| I-II | 13 | 7 | 3 | 3 | 46.1 | 3 | 5 | 5 | 76.9a |
| III-IV | 36 | 8 | 13 | 15 | 77.8 | 20 | 11 | 5 | 44.4 |
| 伴转移 | |||||||||
| 无 | 22 | 11 | 5 | 6 | 50.0b | 6 | 10 | 6 | 72.7a |
| 有 | 27 | 4 | 11 | 12 | 85.2 | 17 | 6 | 4 | 37.0 |
| 存活时间 | |||||||||
| ≤18 mo | 32 | 6 | 11 | 15 | 81.3a | 19 | 7 | 6 | 40.6a |
| >18 mo | 17 | 9 | 5 | 3 | 47.1 | 4 | 9 | 4 | 70.6 |
在CD44v6表达阳性的34例胆管癌组织中, nm23-H1阳性者14例(41.2%), 在CD44v6阴性的15例中, nm23-H1阳性者12例(80.0%). 经统计学处理, CD44v6表达与nm23-H1表达呈负相关(r = -0.359, P<0.05).
CD44是一种广泛分布于细胞表面的跨膜糖蛋白, 属细胞黏附分子(CAM)家族成员. 细胞黏附分子(CAM)所介导的细胞或细胞外基质(EAM)的相互作用, 是恶性肿瘤形成、侵袭和转移的生物学基础. 人类CD44基因定位于11号染色体短臂上, CD44外显子有两种, 一种是组成型外显子, 另一种是V区变异性拼接外显子, 其产生的亚型主要有标准型CD44(CD44s)和变异型CD44(CD44v), CD44v6是CD44的一种拼接变异体, 他的出现可改变肿瘤细胞表面CAM的结构和功能, 使肿瘤细胞侵袭和转移的能力增强[1-2]. 近年来研究发现, CD44v6的过量表达与多种人体恶性肿瘤, 如结肠癌、胃癌、原发性肝癌、前列腺癌等许多肿瘤的发生发展、侵袭和转移密切相关[3-12]. 我们采用免疫组化方法检测CD44v6在49例胆管癌组织和16例胆管良性病变组织中的表达, 并结合资料分析. 结果显示, CD44v6阳性表达率在胆管癌中显著高于胆管癌良性病变(P<0.01), 与Mikami et al研究结果相似[13], CD44v6表达阳性与胆管癌的转移及预后呈正相关, CD44v6表达阳性的患者术后18 mo内复发和转移的机会显著增高, 存活率明显降低. 结果表明, CD44v6参与胆管癌的发生和细胞恶性转化过程, 在肿瘤临床进展和转移过程中起着重要作用, 是胆管癌转移潜能的重要标志. 因此, CD44v6可作为检测胆管癌和判断预后的可靠病理生理学指标.
Steeg et al于1988年利用差式筛选方法, 发现一种cDNA克隆的表达与鼠K-1735黑色素瘤的转移能力有关, 此即nm23基因. 人类nm23基因主要有两个亚型即nm23-H1和nm23-H2. 临床研究最多的是nm23-H1, 人nm23-H1基因定位于17号染色体着丝点附近, 即17q21.3-22, 其所编码的蛋白质为核苷二磷酸激酶(NDPK), NDPK被认为至少参与两个在肿瘤发育上起重要作用的功能[14-15]: 微管的聚合和解聚以及G蛋白介导的细胞信号传导. 微管的聚合和解聚需要由NDPK介导的转磷酸作用所提供的GTP, 因此nm23-H1蛋白的改变, 一方面可能使微管聚合异常而引起减数分裂时纺锤体的异常, 从而导致肿瘤细胞染色体非整倍体的形成, 促进肿瘤的发展, 另一方面, 他可能通过影响细胞骨架而引起细胞运动, 从而参与浸润转移过程. NDPK的第二个功能是在信号传导过程中使GDP还原为GTP, 从而使G蛋白激活, 可以设想以这种方式能调节大量的蛋白介导的细胞信号传导的反应, 进而参与肿瘤的发生和发展. 在人类多种肿瘤如大肠癌、乳腺癌、肝癌、肺癌等中, nm23-H1的表达与肿瘤的转移及临术预后不良呈负相关[16-17]. 我们的研究结果显示, nm23-H1表达阳性率在胆管癌中显著低于胆管良性病变组织. nm23-H1表达阳性与胆管癌的临床分期和转移呈显著负相关. nm23-H1表达阴性的患者术后18 mo复发和转移的机会显著增高, 存活率明显降低.
我们的研究还发现, nm23-H1表达阳性的肿瘤组织中存在着染色强度不同的细胞群, 尤其是在肿瘤边缘向邻近正常组织浸润的细胞多为阴性表达. 这表明在同一肿瘤内存在着侵袭力不同的多个细胞亚群, nm23-H1阴性的细胞系是参与浸润和转移的具有高侵袭潜能的细胞, 对肿瘤的发展及预后起重要作用. 同时, 也反映了nm23-H1基因对胆管癌浸润的抑制作用.
总之, nm23-H1表达的缺失或失活与胆管癌的组织分化、临床分期及转移密切相关, 尤其在反映肿瘤向邻近器官侵犯和转移方面有重要意义, 通过检测nm23-H1基因的表达可指导临床准确估计肿瘤的侵袭性和转移趋势, 选择适宜的治疗方案以及评估预后.
在恶性肿瘤发生的癌基因研究中, 许多学者提出了基因协同作用假说, 认为在恶性肿瘤发生、发展和转移的各阶段, 至少有两个或两个以上功能不同的异常激活的基因各自发挥不同作用, 并在时间和空间上相互配合, 协同促进了细胞的癌变. 目前, 有关CD44v6和nm23-H1相关性的报道甚少, 结果也不一致[18-19]. 我们的研究结果表明, 在胆管癌组织中CD44v6和nm23-H1表达呈负相关(r = -0.359, P<0.05, ), 说明CD44v6和nm23-H1具有肿瘤转移过程中存在协同作用. 其中CD44v6阳性表达伴nm23-H1阴性表达的患者发生淋巴结转移和肝转移的可能性大. 本研究显示5例同时有淋巴结和肝转移的胆管癌CD44v6均为阳性表达, 而nm23-H1均为阴性表达. 有资料表明, CD44v6也具有GTP连接蛋白和G蛋白的特性[2], 而CD44v6作为黏附分子参与细胞骨架蛋白形成伪足, 促进转移. 所以, nm23-H1和CD44v6可能共同通过G蛋白及细胞骨架蛋白的调节来影响转移的发生, 但确切的机制, 仍有待进一步研究.
编辑: 张海宁
| 1. | Thorne RF, Legg JW, Isacke CM. The role of the CD44 transmembrane and cytoplasmic domains in co-ordinating adhesive and signalling events. J Cell Sci. 2004;117:373-380. [PubMed] |
| 2. | Martin TA, Harrison G, Mansel RE, Jiang WG. The role of the CD44/ezrin complex in cancer metastasis. Crit Rev Oncol Hematol. 2003;46:165-186. [PubMed] |
| 3. | Bhatavdekar JM, Patel DD, Chikhlikar PR, Shah NG, Vora HH, Ghosh N, Trivedi TI. Molecular markers are predictors of recurrence and survival in patients with Dukes B and Dukes C colorectal adenocarcinoma. Dis Colon Rectum. 2001;44:523-533. [PubMed] |
| 4. | Gu HP, Shang PZ, Zhou CL. Expression of CD44v6 and E-cadherin in prostate carcinoma and metastasis of prostate carcinoma. Zhonghua Nan Kexue. 2004;10:32-38. [PubMed] |
| 5. | Xin Y, Grace A, Gallagher MM, Curran BT, Leader MB, Kay EW. CD44V6 in gastric carcinoma: a marker of tumor progression. Appl Immunohistochem Mol Morphol. 2001;9:138-142. [PubMed] |
| 6. | Endo K, Terada T. Protein expression of CD44 (standard and variant isoforms) in hepatocellular carcinoma: relationships with tumor grade, clinicopathologic parameters, p53 expression, and patient survival. J Hepatol. 2000;32:78-84. [PubMed] |
| 7. | Yue SQ, Yang YL, Dou KF, Li KZ. Expression of PCNA and CD44mRNA in colorectal cancer with venous invasion and its relationship to liver metastasis. World J Gastroenterol. 2003;9:2863-2865. [PubMed] |
| 8. | Joo M, Lee HK, Kang YK. Expression of E-cadherin, beta-catenin, CD44s and CD44v6 in gastric adenocarcinoma: relationship with lymph node metastasis. Anticancer Res. 2003;23:1581-1588. [PubMed] |
| 9. | Chun SY, Bae OS, Kim JB. The significance of CD44 variants expression in colorectal cancer and its regional lymph nodes. J Korean Med Sci. 2000;15:696-700. [PubMed] |
| 10. | Aaltomaa S, Lipponen P, Ala-Opas M, Kosma VM. Expression and prognostic value of CD44 standard and variant v3 and v6 isoforms in prostate cancer. Eur Urol. 2001;39:138-144. [PubMed] |
| 11. | Zhang JC, Wang ZR, Cheng YJ, Yang DZ, Shi JS, Liang AL, Liu NN, Wang XM. Expression of proliferating cell nuclear antigen and CD44 variant exon 6 in primary tumors and corresponding lymph node metastases of colorectal carcinoma with Dukes stage C or D. World J Gastroenterol. 2003;9:1482-1486. [PubMed] |
| 12. | Bendardaf R, Lamlum H, Ristamaki R, Pyrhonen S. CD44 variant 6 expression predicts response to treatment in advanced colorectal cancer. Oncol Rep. 2004;11:41-45. [PubMed] |
| 13. | Mikami T, Saegusa M, Mitomi H, Yanagisawa N, Ichinoe M, Okayasu I. Significant correlations of E-cadherin, catenin, and CD44 variant form expression with carcinoma cell differentiation and prognosis of extrahepatic bile duct carcinomas. Am J Clin Pathol. 2001;116:369-376. [PubMed] |
| 14. | Hartsough MT, Morrison DK, Salerno M, Palmieri D, Ouatas T, Mair M, Patrick J, Steeg PS. Nm23-H1 metastasis suppressor phosphorylation of kinase suppressor of Ras via a histidine protein kinase pathway. J Biol Chem. 2002;277:32389-32399. [PubMed] |
| 15. | Roymans D, Willems R, Van Blockstaele DR, Slegers H. Nucleoside diphosphate kinase(NDPK/NM23)and the waltz with multiple partners: possible consequences in tumor metastasis. Clin Exp Metastasis. 2002;19:465-476. [PubMed] |
| 16. | Hartsough MT, Steeg PS. Nm23/nucleoside diphosphate kinase in human cancers. J Bioenerg Biomembr. 2000;32:301-308. [PubMed] |
| 17. | Otero AS. NM23/nucleoside diphosphate kinase and signal transduction. J Bioenerg Biomembr. 2000;32:269-275. [PubMed] |
| 18. | Chen JQ, Zhan WH, He YL, Peng JS, Wang JP, Cai SR, Ma JP. Expression of heparanase gene, CD44v6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas. World J Gastroenterol. 2004;10:776-782. [PubMed] |
| 19. | Messinetti S, Giacomelli L, Fabrizio G, Giarnieri E, Gabatel R, Manno A, Feroci D, Guerriero G, Masci E, Vecchione A. CD44v6 and Nm23-H1 protein expression related to clinico pathological parameters in colorectal cancer. Ann Ital Chir. 2003;74:45-51. [PubMed] |