修回日期: 2002-11-01
接受日期: 2002-11-16
在线出版日期: 2003-02-15
目的: 从病理组织学方面验证DNA疫苗对小鼠 HCV-C皮下移植瘤的预防及治疗作用, 为将来的临床应用提供动物实验依据.
方法: 利用脂质体转染技术将pcDNA HCV-C质粒转染SP2/0细胞并将稳定表达HCV C抗原的SP2/0细胞皮下接种于Balb/c小鼠, 成瘤后取小鼠瘤组织, 用病理组织学方法验证DNA疫苗对HCV-C皮下移植瘤的预防及治疗作用.
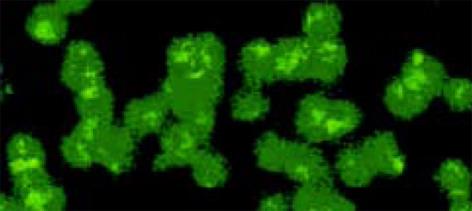
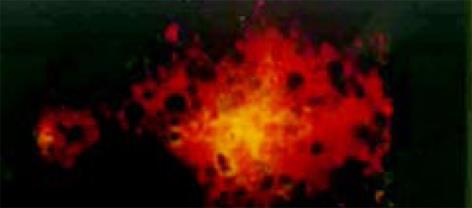
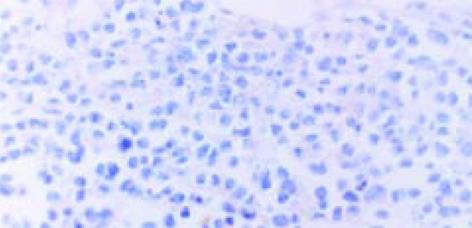
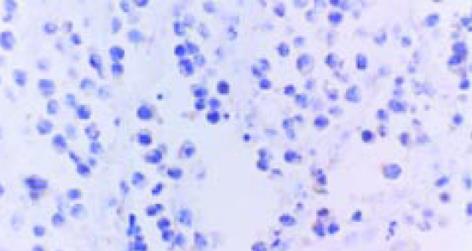
结果: 肿瘤组织中以T淋巴细胞浸润为主; HCV-C抗原表达主要在SP2/0细胞的细胞质和胞膜上, 少数位于胞核中; 对照组HCV-C抗原表达明显强于实验组.
结论: HCV-C DNA疫苗对HCV的感染有预防和治疗作用.
引文著录: 孙利, 周永兴, 郝春秋, 冯志华, 赵君, 胡沛臻, 付勇, 马福成, 常吉庆, 王九平, 聂青和. DNA疫苗对小鼠HCV-C皮下移植瘤的防治. 世界华人消化杂志 2003; 11(2): 165-168
Revised: November 1, 2002
Accepted: November 16, 2002
Published online: February 15, 2003
AIM: To investigate the effect of DNA vaccine on infection of hepatitis C virus (HCV) in mice model of subcutaneous inoculating tumour of HCV -C.
METHODS: SP2/0 cell was transfected with pcDNAHCV-C with the lipofectamine and confirmed the ability to express the HCV-C antigen steadily, and then inoculated subcutaneously into Balb/c mice. The formed nodules were removed surgically and examined pathologically.
RESULTS: T lymphocytes infiltrated dominately in inoculated tumour; HCV-C antigin was mainly expressed in cytoplasm and membrane of Sp2/0 cell, and scarcely in nucleolus; The level of expression of HCV-C antigin in experimental group was significantly lower than that in control group.
CONCLUSION: HCV-C DNA vaccine has the effect against HCV infection.
- Citation: Sun L, Zhou YX, Hao CQ, Feng ZH, Zhao J, Hu PZ, Fu Y, Ma FC, Chang JQ, Wang JP, Nie QH. Effect of DNA vaccine on anti-HCV infection in mice with subcutaneous inoculating tumor. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 165-168
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/165.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.165
丙型肝炎呈世界性, 常呈持续感染, 是-严重危害人类身心健康的传染性疾病. 目前除了部分患者对于 干扰素α(IFNα)有部分应答之外[1-4], 至今尚无特异性的预防和治疗措施. 因此寻求免疫预防及治疗措施以防止这种致死性疾病的发生至关重要. DNA免疫能诱导细胞免疫及体液免疫, 从而使其成为免疫治疗的策略之一[5,6].
5-8周龄♂Balb/c小鼠由本校动物中心提供, 小鼠骨髓瘤SP2/0细胞由本校免疫学教研室惠赠, 重组真核表达质粒pcDNA HCV-C 基因和CMV启动子由本室构建. 胰蛋白胨、酵母提取物为Oxford公司产品; 氨苄青霉素为齐鲁制药厂产品; 琼脂糖为BRL产品; 溴化乙锭(EB)为华美公司产品; 质粒提取及纯化试剂盒(大量)为上海华舜生物工程公司产品; 质粒超大量提取试剂盒为Sigma公司产品; 脂质体lipofectamine 2 000和DMEM均为Gibco公司产品; 国产小牛血清为杭州四季青公司产品; 核酸内切酶HindIII, XholI, λDNA/HindIII, λDNA/EcoRI+HindIII, G418, 荧光标记的羊抗人IgG和过氧化物酶标记的羊抗小鼠IgG均购自华美生物工程公司; 小鼠抗HCV-C单克隆抗体由南京军区总医院检验科李保仝主任惠赠.
用含100 mL/L小牛血清的DMEN培养基, 于50 mL/L CO2孵箱中培养. 取重组质粒DNA20 mg, 加1/10体积3 molNaAc及3倍体积的无水乙醇, 混匀后置-20℃过夜, 1 000 g离心10 min, 弃上清, 加700 mL/L乙醇1 mL轻轻冲洗管壁, 弃上清后倒置无菌超净台约1 h, 吹干备用. 收获SP2/0细胞, 将2×105细胞重悬于完全培养基2 mL中. 转种于35 mm培养瓶, 37℃ 50 mL/L CO2孵箱中培养18-24 h, 使细胞达50-80%汇合, 于无菌Ep管中制备溶液A: 质粒DNA20 mg溶于无血清培养基100 μL中, 溶液B: lipofectamine 15 μL加无血清培养基85 μL, 溶液A和溶液B轻轻混合, 置室温15 min; 弃取细胞培养基, 用无血清培养基洗涤细胞1次, 将lipofectamine-DNA混合物200 μL加无血清培养基800 mL, 轻轻混匀, 小心滴加至细胞上, 置37℃ 50 mL/L CO2孵箱中培养15-18 h, 弃取培养基, 加完全培养基2 mL继续培养. 转染72 h后, 取少量细胞滴加在微孔玻片上, 晾干, 冰丙酮固定15 min, PBS洗涤3次, 每次3 min, 滴加HCV阳性患者血清(1:20稀释), 5% CO2孵箱中湿育1 h, PBS液洗涤3次, 加荧光标记羊抗人IgG(1:200稀释), 50 mL/L CO2孵箱中湿育1 h后, 置荧光显微镜下观察转染细胞瞬时表达情况. 同时, 细胞按1: 4传代, 继续培养, 细胞达50%-80%汇合后, 更换浓度为400 mg/L的G418培养基进行筛选, 约96 h后, 对照细胞大部分死亡时, 筛选液G418浓度降至为150 mg/L, 维持筛选约3 wk, 待被转染细胞HCV-C抗原荧光染色均阳性后, 将其做为靶细胞备用. 将pcDNA HCV-C质粒转染并稳定表达HCV-C抗原的SP2/0细胞(SP2/0-HCV-C)以每只Balb/c小鼠5×109/L右肋皮下接种观察肿瘤形成情况. 将16只小鼠随机分为预防组和治疗组(记为A组和B组), A组又随机分为对照组和实验组(记为A1组和A2组), 分别注射空载体pcDNA3和重组体pcDNA HCV-C质粒, 2 wk后与B组同时接种SP2/0-HCV-C, B组又随机分为对照组和实验组(记为B1组和B2组), 于接种后3 d开始治疗, 每次股四头肌肌肉注射1 g/L质粒100 mL, 1次/wk, 共4次, 每次注射质粒前24 h于小鼠股四头肌注射2.5 mL/L布比卡因100 mL. 观察成瘤时间、肿瘤大小及小鼠存活情况. 治疗4 wk后, 拉颈处死各组小鼠, 取出瘤体, 直接做冰冻切片, 其余用40 g/L甲醛固定, 做成石蜡切片, 用免疫组化的方法观察瘤组织内HCV-C抗原表达情况. -抗用小鼠HCV-C单克隆抗体, 二抗用过氧化物酶标记的羊抗小鼠IgG, 最后DAB显色. 另外做特异性T淋巴细胞标记, 看肿瘤组织中T、B淋巴细胞浸润情况. 由本校病理学教研室 协作完成.
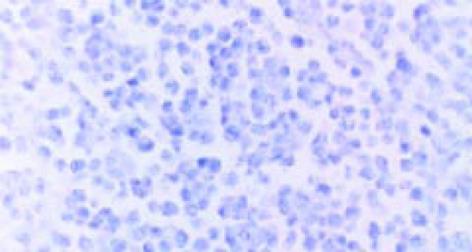
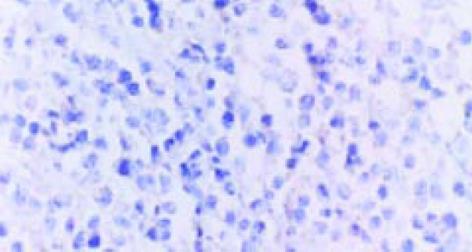
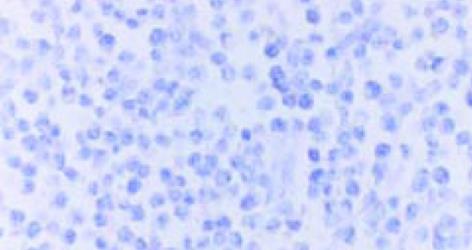
用免疫荧光法检测表明, SP2/0细胞内的表达产物, 可与HCV-C单抗发生特异性结合(图1, 2). pcDNA HCV-C对SP2/0-HCV-C细胞在小鼠体内成瘤时间延长, B2组尤为明显(图3, 4). 肿瘤组织中以T淋巴细胞浸润为主(图5); HCV-C抗原表达主要在SP2/0细胞的细胞质和胞膜上, 少数位于胞核中, 对照组HCV-C抗原表达明显强于实验组(图6-9).
丙型肝炎是一种严重的进展性肝病, 急性丙型肝炎患者中有50%-60%转为慢性, 其中5年内20%发展为肝硬化, 且与肝细胞癌(HCC)的发生密切相关[5,7-12]. 我国输血后HCV感染率为34.8%左右, 献血人群中HCV感染率达40%[13], 是流行范围仅次于乙型肝炎的第二大传染性肝病. HCV为单股正链RNA病毒, HCV-RNA全长9 600 bp, 含有一个大的单-开放阅读框(ORF), 编码约3 010个氨基酸的病毒前体蛋白. 在HCV的编码基因中, 核心区(C区)序列具有高度遗传保守性, 核心蛋白定位于胞核中[14], C基因表达产物具有良好的抗原稳定性. 人肝细胞[15]和黑猩猩对HCV很敏感, 但HCV体外培养尚未找到敏感有效的细胞培养系统. 有报道HCV核心蛋白在酵母中表达成功[16]; 以非融合蛋白的方式, 在大肠杆菌中高效表达了完整的HCV核心蛋白, 具有较高生物活性[17,18]. Hao et al[19]构建了HCV C基因腺病毒表达载体的骨架质粒, 并证实其可以在7721细胞中瞬时表达HCV C基因. 应用PCR方法获取完整的HCV核心区cDNA片段, 克隆到真核表达载体PBK-CMV上, 可在HepG2中稳定表达C蛋白, 提供了理想的实验用细胞株[20].
丙型肝炎发病机制仍未明. 体液免疫应答总的效应很弱, 不能有效地中和病毒. 多数学者认为细胞免疫病理反应可能起重要作用, 其组织浸润细胞以CD3+为主, 细胞毒T细胞(TC)特异攻击HCV感染的靶细胞, 可引起肝细胞损伤.
DNA疫苗是一种新的征对靶抗原诱导产生免疫的方法. 他直接使识别基因编码的抗原和包含基因片段的抗原成为疫苗传播媒介, 识别侯选基因可快速进入感染机体和肿瘤细胞. DNA一项优点是在免疫的所有路径均显示了活性, 特别是细胞毒T细胞反应, 而在蛋白疫苗中很难产生. 对于各种病毒包括那些血液传播的病毒, DNA疫苗均可被用于预防措施中. 对于慢性感染和肿瘤患者, DNA疫苗则可作为一种治疗措施. 在这种情况下, 可把具有免疫活性的基因片段引入疫苗中, 对基因片段进行合适处理以及联合增加免疫的操作识别系统[21]. 丙肝DNA疫苗含有编码病毒蛋白(如核心蛋白、包膜蛋白)的基因, 宿主细胞摄取外源性DNA并表达病毒基因、产生相应的病毒蛋白, 后者通过宿主细胞的主要组织相容性复合体Ⅰ类(MHC-Ⅰ)途径被运载到细胞表面, 通过刺激细胞表面的CD8及细胞毒性T细胞启动细胞介导的免疫反应, 从而发挥抗病毒作用[22].
本实验中SP2/0-HCV-C细胞形成的肿瘤组织中以T淋巴细胞浸润为主, 说明HCV核心基因疫苗能诱导Balb/c小鼠产生良好的细胞免疫应答, 与相关报道-致[23-27]. 并发现HCV-C抗原表达主要在SP2/0细胞的细胞质和胞膜上, 少数位于胞核中. 实验组HCV-C抗原表达明显弱于对照组, 说明HCV-C DNA疫苗对HCV感染有预防及治疗作用.
表达HCV结构蛋白(C, E1, E2) 的FVB/n转基因小鼠及野生型(WT)FVB/n小鼠经肌肉注射免疫表达核心(pHCVC)质粒或C/E1/E2(pHCVSt)质粒. WT和转基因小鼠经结构蛋白或包膜蛋白免疫后均可产生抗C抗体和显示T细胞增生反应. WT小鼠免疫pHCVSt后, 只产生抗E2的CTL活性, 非征对抗C或抗E1, 而当WT小鼠免疫pHCVC时可产生强烈的抗C的CTL活性. 经pHCVSt免疫的转基因小鼠未测出抗C或抗包膜蛋白的CTL活性, 但免疫pHCVC的转基因小鼠产生了独特型抗C的CTL活性[28]. Balb/c(H-2d)和C57bl/6小鼠接受联接多顺反子C/E1/E2/NS2/NS3(pRC/C-NS3)的黄痘病毒增强了对HCV蛋白的抗体和细胞反应, CD8(+)T细胞反应增强[29]. 重组质粒pcDNA HCV-C治疗组, 使SP2/0-HCV-C细胞成瘤性显著降低, 对HCV皮下移植瘤有-定的治疗作用; 与表达IL-12质粒联合接种后, 治疗作用加强[30]. 脂质转染剂[31]或联合注射GM-CSF细胞因子[26]可以促进基因疫苗的 摄取并增强其诱导的抗病毒免疫应答的效力. pRSC-HBV/HCV可分别表达HBcAg及HCV核蛋白, 免疫Balb/c小鼠后可诱导其体液免疫应答[32,33]. 双表达载体pcDNA3.0 BA同时输送GM-CSF与pc154基因能增强Balb/c小鼠对HCV C蛋白基因的体液免疫应答及免疫鼠脾淋巴细胞对特异性抗原刺激的增生能力[34]. 重组的HCV结构区DNA疫苗(pBK-CMV)能诱导小鼠体内特异性T淋巴细胞反应[35]. rhIL-12可在体外显著增加慢性HCV感染者淋巴细胞的增生反应[36]. HCV多表位抗原基因 PCX克隆到真核表达载体 pREP9(RSV启动子)及 pcDNA3 (CMV启动子)中, 构建真核表达载体 pREP9/PCX及 pcDNA3/PCX, 将其肌肉注射免疫小鼠及家兔, 可诱发特异性免疫应答且安全性好[37]. HCV不同区段的基因重组抗原或人工合成多肽可诱导HLA-II类分子限制CD4+ T细胞增生, 这种增生反应的强弱可能反映不同人群对HCV免疫应答的不同, 并与HCV感染的预后有关.
编辑: N/A
| 1. | Yu SK, Yi DY. Response of Patients with HCV Genotype Ⅱ Infection to IFN a. J Jiangxi Med. 2000;40:1. |
| 2. | Zhou GP, Bai JY, Huang YQ, Wang YZ, Deng WQ, Chen M. The levels of Hepatitis C virus RNA of sera in patients with Chronic hepatitis C during alfa in terferon treatment. J Ningxia Med. 2000;22:7. |
| 3. | Yao ZB, Fu XX, Tian GS, Xu DZ, Hao LJ, Huang PY. Clinical trial of consensus interferon for chronic hepatitis C. Chinese J Epidemiol. 2000;18:2. |
| 4. | Zhao GZ, An P, Li Y. The relationship between HCV genotypes, HCV RNA quantities, and IFN therapeutic effectiveness. J Chinese Med Univers. 2000;29:6. |
| 5. | Prince AM. Perspectives on prophylactic and therapeutic immunization against hepatitis B and C viruses. Transfus Clin Biol. 2001;8:467-470. [DOI] |
| 6. | Brinster C, Inchauspé G. DNA vaccines for hepatitis C virus. Intervirology. 2001;44:143-153. [PubMed] [DOI] |
| 7. | Li J, Wang WL. Detection of hepatitis C virus RNA in the tissue of hepatocellular carcinoma by multiple detection system. Chin J Experimental Clinical Virol. 2000;14:1. |
| 8. | Liu RH. Chronic liver disease and hepatitis B and hepatitis C virus infection. J Ningxia Med. 2000;22:4. |
| 9. | Wang RQ, Zhou ZC, Yang JM, Fang DC. Expression of oncogenes and tumor-suppressor gene in the tissues of hepatocellular carcinoma with different types of HBV HCV infection. Chongqing Med. 2000;29:2. |
| 10. | Yang JM, Wang RQ, Pu B, Zhou ZC, Fang DC, Luo YH. The effect of hepatitis C virus infection on expression of several cancer-associated gene products in hepatocellular carcinoma. Tumour. 2000;20:1. |
| 11. | Zhang WJ, Yu XL, Du CX, Yin Q, Du SC. The infections of HBV HCV HGV TTV in patients with hepatocellular carcinoma (HCC) and the possibility and prevention in interventional treatment. Shaanxi Tumour Med. 2002;10:1. |
| 12. | Prince AM, Shata MT. Immunoprophylaxis of hepatitis C virus infection. Clin Liver Dis. 2001;5:91-103. [DOI] |
| 13. | Han DL, Liu W, Ou ZY, Liang M, Hu Q. A survey on HCV infection among blood donors. Contem Precaut med. 2001;28:4. |
| 14. | Chen LB, Chen PL, Fan GR, Li L, Liu CY. Localization of hepatitis C virus core protein in the nucleus of peripheral blood mononuclear cells of hepatitis C patients. Chin J Exper Clin Virol. 2002;16:1. |
| 15. | Ma QY, Hao F, Wang YM. Study on the intection of nomal adult hepatocytes with HCV in vitro. J Third Milit Med Univer. 2001;23:10. |
| 16. | Li K, Wang L, Cheng J, Zhang LX, Lu MY, Li L. Cloning and expression of the gene of hepatitis C virus core in yeast. J Surg Advan Coll. 2002;23:1. |
| 18. | Zhao W, Liao GY, Li WD, Chen JY, Zhang XW, Sun MB, Jiang SD. Expression of hepatitis C virus core protein in E. coli and its immunological characteristics. Immunol J. 2001;17:06. |
| 19. | Hao CQ, Zhou YX, Feng ZH, Li JG, Jia ZS, Wang PZ. Construction, identification and expression of framework plasmid pAd. HCV-C of adenovirus expression vector of HCV C. Shijie Huaren Xiaohua Zazhi. 2001;9:635-639. |
| 21. | Stevenson FK, Rosenberg W. DNA vaccination: a potential weapon against infection and cancer. Vox Sang. 2001;80:12-18. [PubMed] [DOI] |
| 22. | Tang XP, Xu YL, Yuan XZ, Zhang FC. Activity of HCV-specific cytotoxic T lymphocytes in chronic hepatitis C. Chin J Epidemiol. 2001;19:4. |
| 23. | Tan DM, Liu SH, Li CZ, Fan XG, Yan MY, Sun KZ. V specific cellular and humoral immune responses induced by intramuscular injection of DNA vaccine containing HCV core gene in mice. Fund Med Clin. 2000;20:5. |
| 24. | Feng ZH, Zhou YX, Jia ZS, Lian JQ, Jiao CS, Li JG. Construction and gene immunization of recombinant expression plasmid of Hepatitis C virus core gene. Chin J Immnol. 2000;16:4. |
| 25. | Ceng XW, Du Y, Wang QC. Research on DNA vaccines of hepabitis C virus. J Sich Univer. 2000;37:04. |
| 26. | Ou-Yang P, Hwang LH, Tao MH, Chiang BL, Chen DS. Co-delivery of GM-CSF gene enhances the immune responses of hepatitis C viral core protein-expressing DNA vaccine: role of dendritic cells. J Med Virol. 2002;66:320-328. [PubMed] [DOI] |
| 27. | Dueñas-Carrera S, Alvarez-Lajonchere L, Alvarez-Obregón JC, Herrera A, Lorenzo LJ, Pichardo D, Morales J. A truncated variant of the hepatitis C virus core induces a slow but potent immune response in mice following DNA immunization. Vaccine. 2000;19:992-997. [PubMed] |
| 28. | Satoi J, Murata K, Lechmann M, Manickan E, Zhang Z, Wedemeyer H, Rehermann B, Liang TJ. Genetic immunization of wild-type and hepatitis C virus transgenic mice reveals a hierarchy of cellular immune response and tolerance induction against hepatitis C virus structural proteins. J Virol. 2001;75:12121-12127. [PubMed] [DOI] |
| 29. | Pancholi P, Liu Q, Tricoche N, Zhang P, Perkus ME, Prince AM. DNA prime-canarypox boost with polycistronic hepatitis C virus (HCV) genes generates potent immune responses to HCV structural and nonstructural proteins. J Infect Dis. 2000;182:18-27. [PubMed] [DOI] |
| 30. | Du DW, Zhou YX, Feng ZH, Jia ZS, Jiao CS, Wang QC, Li JG. Enhancing therapeutic effect of DNA vaccine against hepatitis C virus infection by interleukin-12. Chin J Epidemiol. 2001;19:1. |
| 31. | Feng ZH, Zhou YX, Wang QC, Du DW, Jiao CS, Li JG. Lipofectamine coated hepatitis C virus core gene vaccine promotes the efficacy of immune responses. J Fourth Mil Med Univer. 2000;21:7. |
| 32. | Deng T, Fan GR, Chen TB, Chen NL, Hu DR, Li L, Huang SL, Jia KP. Constructs and expression of hepatitis C virus core gene combined hepatitis B virus core gene with two multiple cloning sites vector. Chin J Immnol. 2002;18:3. |
| 33. | Deng T, Fan G, Chen T, Chen N, Hu D, Wang M, Jia K. [Expression and immune response to hepatitis C virus core gene combined hepatitis B virus core gene with two multiple cloning sites vector]. Zhonghua Yixue Zazhi. 2002;82:77-80. [PubMed] |
| 34. | Liao GY, Zhang XW, Sun MB, Cheng JY, Yang HJ, Jiang D. Enhancement of immune response to HCV core gene by GM-CSF gene with bicistronic vector. Immunol J. 2001;17:4. |
| 35. | Li B, Yin PQ, Wang J, Dou J, Lin L, Wang LX, Shi ZY. DNA immunization of mice with a plasmid encoding hepatitis C virus structural proteins elicits significant cell-mediated immune responses. Immunol J. 2001;17:5. |
| 36. | Fan XG, Ou ZM, Hu GL. Effect of IL-12 on lymphoproliferative response in individuals with chronic hep atitis C virus infection. Chin J Immnol. 2000;16:4. |
| 37. | Zhang LY, Ren DM, Chen LS, Guo MQ, Huang JS, ShenXR , Zhang Q, Xie YM, Chen LY, Jia FX. Immunogenicity of a multiple epitope antigen gene of hepatitis C virus in mice and rabbits. Chin J Cell Mol Immnol. 2001;17:1. |