修回日期: 2002-10-20
接受日期: 2002-10-29
在线出版日期: 2003-01-15
目的: 探讨银杏制剂对大鼠急性肝损伤的保护作用及机制.
方法: ♂Wistar大鼠, 随机分为: 对照组、模型组、银杏制剂低、中、高三个剂量治疗组及齐敦果酸阳性药对照组. D-氨基半乳糖胺(D-GalN)致大鼠急性肝损伤模型. 测定大鼠血清血小板活化因子(PAF)、丙氨酸转氨酶(ALT)、丙二醛(MDA), 并光镜下观察肝脏病理变化.
结果: 模型组血清PAF、ALT、MDA显著高于正常组(P<0.01). 光镜: 肝细胞大块或亚大块坏死, 肝小叶及肝细胞消失, 肝脏病理学分级与正常组有显著差异(P<0. 01). 银杏各剂量组血清PAF、ALT、MDA及阳性对照组ALT、MDA则均明显低于模型组(P<0.01), 肝细胞坏死明显减轻, 范围缩小, 并可见肝小叶结构, 其中尤以银杏高剂量组疗效较佳(P<0.05), 其他各治疗组效果无明显差异(P>0.05).
结论: 银杏制剂对D-GalN所致大鼠急性肝损伤具有保护作用, 其机制可能是通过清除氧自由基、拮抗PAF, 改善肝脏微循环实现的. 他有望成为临床治疗急性重型病毒性肝炎的有效药物之一.
引文著录: 杜东红, 袁凤仪, 何云, 任渝江. 银杏制剂对大鼠急性肝损伤保护的作用及机制. 世界华人消化杂志 2003; 11(1): 85-87
Revised: October 20, 2002
Accepted: October 29, 2002
Published online: January 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(1): 85-87
- URL: https://www.wjgnet.com/1009-3079/full/v11/i1/85.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i1.85
急性肝衰竭(AHF), 在我国发病率较高, 且起病急、症状重、并发症多、死亡率高. 近年发现, PAF在AHF的发病机制中具重要作用, 尤其在内毒素-细胞因子所致肝损害中可能起"中心"和"放大"致病作用[1,2]. 银杏提取物中的银杏苦内脂BN52021是强效的特异性PAF拮抗剂, 可与PAF竞争受体, 发挥保肝作用[3]. 但其价格昂贵, 临床尚难广泛应用. 银杏制剂含有BN52021(含量占6%), 其提取工艺稳定、成本低廉; 其另一种主要成分银杏总黄酮(含量占24%), 可捕获氧自由基、抗脂质过氧化, 对急性肝损伤也具保护作用[4], 故治疗AHF应具良好疗效. 而将此药用于AHF保肝治疗尚未见报道. 为此, 我们利用D-GalN致 AHF大鼠模型, 用齐敦果酸作为阳性对照, 观察银杏制剂对大鼠血清PAF、MDA、ALT的影响及肝脏病理学改变, 以明确他的保肝作用, 探讨其机制, 为应用于临床提供理论依据.
♂Wistar大鼠, 60只, 体质量300±80 g, 贵阳医学院动物中心提供, D-GalN1, 重庆医科大学化学教研室提供, 用时配成100 g/L的溶液, 并用1 mmol/L NaOH调pH为7.4. 银杏制剂, 由江苏扬子江药业有限公司提供, 为一散装粉末状中药制剂, 用时配成20 g/L的混悬液, 灌胃前摇匀. 齐敦果酸片, 重庆制药七厂, 用时配成6 g/L的混悬液, 灌胃前摇匀. TDL-80-2B型台式低速离心机和LG-3型多用冰冻干燥机, 宁波市生化仪器厂制造. TYXN-96多功能智能血液凝集仪, 上海通用机电技术研究所制造. TG328A全机械加码电光分析天平(可精确至10-4), 北京医用天平厂制造.
1.2.1动物分组及处理: 大鼠分笼饲养, 保持适宜环境(室温: 16-25 ℃), 按体质量均衡法, 将动物随机分为总体质量相近的6个实验组, 每组10只, 给予治疗性药物(银杏制剂)及阳性药对照剂(齐敦果酸), 1次/d, 共8 d, 于第7天上午, 给予D-GalN造模, 第8天, 末次给药1 h后断头取血(表1).
| 动物数只 | 用药方法、剂量(mL/100g鼠体质量)、次数 | ||
| ip D-GalN×1次 | ig 药物×8次 | ||
| 正常组 | 10 | 生理盐水(0.7 mL/100 g) | 生理盐水(0.5 mL/100 g) |
| D-GaIN组 | 10 | 100 g/L D-GaIN(0.7 mL/100 g) | 生理盐水(0.5 mL/100 g) |
| D-GaIN组+银杏低剂组 | 10 | 100 g/L D-GaIN(0.7 mL/100 g) | 20 g/L银杏制剂(0.25 mL/100 g) |
| D-GaIN组+银杏中剂组 | 10 | 100 g/L D-GaIN(0.7 mL/100 g) | 20 g/L 银杏制剂(0. 5 mL/100 g) |
| D-GaIN组+银杏高剂组 | 10 | 100 g/L D-GaIN(0.7 mL/100 g) | 20 g/L银杏制剂(1 mL/100 g) |
| D-GaIN组+齐敦果酸组 | 10 | 100 g/L D-GaIN(0.7 mL/100 g) | 6 g/L齐敦果酸(1 mL/100 g) |
1.2.2 观测指标及检测方法: 每只鼠断头取血7-10 mL, 离心(1 560 g×10 min)取血清, 置4 ℃冰箱保存, 备测. (1)PAF的检测: 血浆中PAF脂质的提取: 按Croft et al[5]报道的方法. 洗涤兔血小板的制备[6]. 血小板聚集功能测定及PAF计算: 用血小板多功能聚集仪按说明书操作步骤测试PAF标准品或样品, 得出PAF标准品致血小板聚集的量效曲线. 据此曲线, 计算出相应PAF含量(以百分比浓度表示). (2)ALT: 用Beckman全自动生化分析仪检测; (3)MDA: 采用硫代巴比妥比色法检测; (4)病理学观察: 光镜观察. 病理学判断标准: 0级: 肝细胞正常; 1级: 肝细胞仅有水肿变性或点状坏死; 2级: 肝细胞灶或片状坏死, 但坏死程度小于整个肝组织切片的25%; 3级: 肝细胞坏死量占整个切片的25%-50%; 4级: 肝细胞坏死量大于肝组织切片的50%以上.
统计学处理 实验数据, 先经方差齐性检验, 方差齐, 则用单因素方差分析进行组间比较分析, 并用q检验进行组间两两比较; 方差不齐以及等级分类资料用秩和检验. 所有数据均经SAS统计学软件包处理.
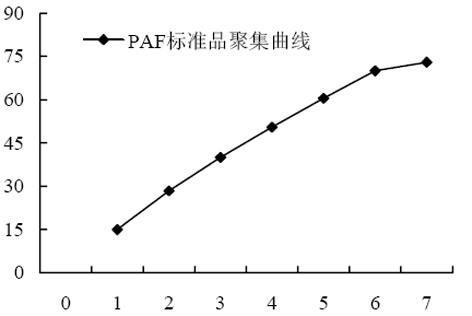
不同剂量的PAF标准品引起的血小板聚集率, 呈良好的线性量效关系(图1). 据此曲线, 计算出各组大鼠血清PAF含量(表2).
齐敦果酸实际用量为: 60 mg/kg; (相当于正常人剂量10倍); 银杏制剂低、中、高剂量组的实际用量分别为: 50、100、200 mg/kg鼠体质量(中剂量组相当于正常人剂量10倍); D-GalN的实际用量为: 700 mg/kg体质量.
| 大鼠数 | 病理改变分级(只数) | vs模型组 | vs高剂量组 | ||||
| + | ++ | +++ | ++++ | ||||
| 正常组 | 10 | 0 | 0 | 0 | 0 | ||
| 模型组 | 10 | 2 | 5 | 3 | |||
| 银杏制剂低剂量组 | 10 | 3 | 5 | 1 | P<0.01 | P<0.01 | |
| 银杏制剂中剂量组 | 10 | 7 | 3 | 0 | P<0.01 | P<0.01 | |
| 银杏制剂高剂量组 | 10 | 9 | 1 | 0 | P<0.01 | ||
| 齐敦果酸组 | 10 | 6 | 4 | 0 | P<0.01 | P<0.01 | |
造成AHF肝坏死的机制[7] :(1)原发性损伤, 包括免疫病理反应和HBV本身的作用; (2)继发性损伤, 即以TNF-α为核心的细胞因子等炎症递质对肝脏的致伤效应. 已证实, PAF在原发性和继发性损伤中均具有一定作用. 本试验中模型组PAF较正常组显著升高(P<0.01), 亦证实: PAF参与了AHF的致病过程.
3.2.1 银杏制剂对血清PAF的影响: 各银杏制剂组血清PAF含量明显低于模型组(4.6±0.33)(P<0.01), 齐敦果酸组则与模型组无显著性差异(P>0.05), 说明银杏制剂可通过其中的PAF拮抗剂拮抗PAF, 降低血清PAF水平, 发挥抗炎保肝作用; 齐敦果酸不具有拮抗PAF的作用.
3.2.2 对ALT的影响: 血清转氨酶是肝细胞损害的敏感指标, 在一定程度上反映了细胞损害和坏死程度, 而ALT活性反应肝损害更具有特异性. 本试验, 模型组血清ALT活性(1092.2±88.5) U/L明显高于正常对照组(55.8±6.58) U/L(P<0.01), 说明: D-GalN导致了大鼠大量肝细胞坏死, 血清转氨酶升高. 而各治疗组转氨酶活性明显低于模型组, 提示银杏制剂及齐敦果酸均有降酶保肝作用, 尤以银杏制剂高剂量组作用最显著ALT(350.6±66.77)U/L(P<0.01); 银杏中(501±45.04)U/L、低(498±73.03)U/L剂量组与齐敦果酸组之间, 降酶作用无显著性差异(P>0.05).
3.2.3 对MDA的影响: 导致肝细胞坏死损伤的重要因素之一是氧自由基(OFR), 氧毒性集团主要是通过氧化细胞蛋白质DNA及生物膜脂质, 导致肝细胞坏死, 并形成脂质过氧化终产物MDA, 而MDA也可使膜蛋白发生交联反应, 导致肝细胞破坏, 因此, 测定血清MDA, 可间接反应OFR对肝细胞的损害程度. 本结果显示: 各治疗组血清MDA含量明显低于模型组(16.43±3.78)nmol/L(P<0.01), 说明各银杏制剂和齐敦果酸均具有清除OFR, 减少脂质过氧化产物产生的作用, 从而防止肝细胞破坏. 疗效以银杏高剂量组效果最好(P<0.05).
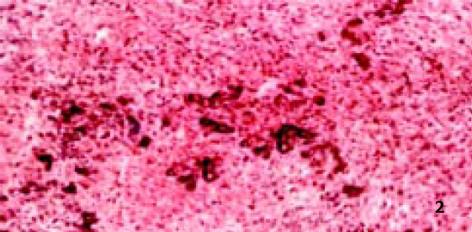
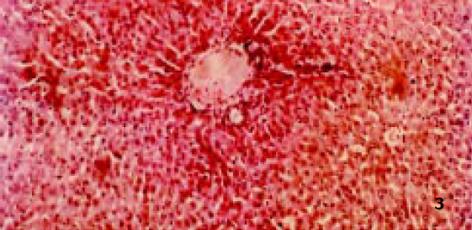
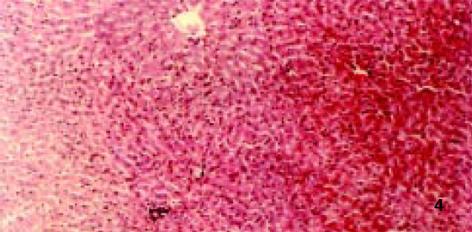
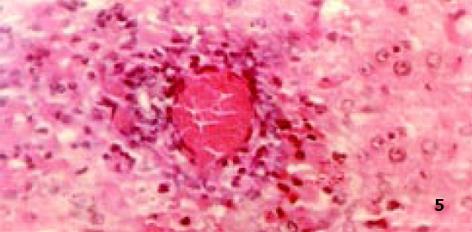
3.2.4 对病理学改变的影响: D-GalN诱发大鼠肝损伤模型, 因其病理变化与人类病毒性肝炎相似而被广泛应用[8]. 后又证实, D-GalN复制出的大鼠AHF模型, 与临床暴发性肝衰竭(FVH)患者所表现出的机体变化、病理改变及生化指标变化基本相同. 本试验病理学观察显示: 正常组肝组织正常; 而模型组可见融合成片的肝细胞坏死, 或有不同程度亚大块坏死, 肝小叶结构破坏, 肝细胞消失, 网状支架塌陷, 在门管区周围肝小叶周边偶见狭窄的肝实质和稀疏的水肿变性肝细胞, 毛细胆管中有胆汁淤积, 肝窦内普遍含有稀疏的慢性炎症细胞、肥大的Kupffer细胞和巨噬细胞, 其内常见色素沉着, 门管区有不同程度的小胆管增生(图2), 与正常组有显著性差异; 而治疗组病理学改变与模型组比较具有显著性差异(P<0.01), 表现为肝细胞点状或灶状坏死, 程度明显减轻, 甚至有的仅有肝细胞变性和点状坏死, 肝小叶结构正常. 说明: 银杏制剂和齐敦果酸, 均具有防止肝细胞坏死的作用, 但前者除清除OFR外, 还拮抗PAF, 故作用较后者好, 且以银杏高剂量组效果最好(P<0.01, 图3-5).
根据本试验结果可得出, 银杏制剂的保肝作用机制有: (1)清除氧自由基. 银杏制剂中的银杏总黄酮[4]和银杏苦内酯均具有这种作用. (2)拮抗PAF. 银杏制剂中的银杏苦内酯BN52021, 具有拮抗PAF 生物学活性, 防止单核-巨噬细胞系统激活, 从而阻止了粒细胞活化、炎症递质、溶酶体酶释放及Ca2+超载等连锁反应所致的肝细胞坏死[9-13].
银杏制剂通过上述作用机制, 发挥良好的治疗效果, 有望成为临床上治疗AHF的有效药物之一. 然而AHF的发病机制非常复杂, 银杏制剂并不能清除内毒素对肝脏的直接毒性作用, 仅能遏制内毒素-细胞因子网络的某一致病环节, 防止各种毒素通过PAF而介导肝损害的发生. 因此对于AHF的治疗, 应根据其多种发病机制, 应用多种药物综合治疗, 才能达到良好治疗效果.
编辑: N/A
| 1. | Tiegs G, Wolter M, Wendel A. Tumor necrosis factor is a terminal mediator in galactosamine/endotoxin-induced hepatitis in mice. Biochem Pharmacol. 1989;38:627-631. [PubMed] [DOI] |
| 2. | Nagakawa J, Hishinuma I, Hirota K, Miyamoto K, Yamanaka T, Tsukidate K, Katayama K, Yamatsu I. Involvement of tumor necrosis factor-alpha in the pathogenesis of activated macrophage-mediated hepatitis in mice. Gastroenterology. 1990;99:758-765. [PubMed] [DOI] |
| 5. | Croft KD, Sturm MJ, Codde JP, Vandongen R, Beilin LJ. Dietary fish oils reduce plasma levels of platelet activating factor precursor (lyso-PAF) in rats. Life Sci. 1986;38:1875-1882. [PubMed] [DOI] |
| 9. | Todoroki H, Higure A, Okamoto K, Okazaki K, Nagafuchi Y, Takeda S, Katoh H, Itoh H, Ohsato K, Nakamura S. Possible role of platelet-activating factor in the in vivo expression of tissue factor in neutrophils. J Surg Res. 1998;80:149-155. [PubMed] [DOI] |
| 10. | Kasirga E, Coker I, Aydoğdu S, Yağci RV, Taneli B, Gousseinov A. Blood levels of leukotrienes (LTC4, D4, E4, B4) and synthesis of leukotriene B4 by peripheral leukocytes in children with acute A and B hepatitis. Turk J Pediatr. 1999;41:457-465. [PubMed] |
| 11. | Ueda T, Takeyama Y, Hori Y, Takase K, Goshima M, Kuroda Y. Pancreatitis-associated ascitic fluid increases intracellular Ca(2+) concentration on hepatocytes. J Surg Res. 2000;93:171-176. [PubMed] [DOI] |
| 12. | Sakaguchi T, Nakamura S, Suzuki S, Oda T, Ichiyama A, Baba S, Okamoto T. Participation of platelet-activating factor in the lipopolysaccharide-induced liver injury in partially hepatectomized rats. Hepatology. 1999;30:959-967. [PubMed] [DOI] |
| 13. | Libert C. Acute phase proteins as protective factors against the toxicity of tumor necrosis factor. Verh K Acad Geneeskd Belg. 1997;59:515-523. [PubMed] |