修回日期: 2019-02-10
接受日期: 2019-03-10
在线出版日期: 2019-03-28
乙肝相关慢加急性肝衰竭(hepatitis-B-related acute-on-chronic liver failure, ACLF)是慢加急性肝衰竭中的常见类型, 病情进展快, 短期死亡率高. 全身炎症反应是慢加急性肝衰竭重要的机制, 而肠道通透性增加、内毒素移位增加是引起炎症反应的原因之一. 肠道短链脂肪酸(short chain fatty acids, SCFAs)可减少肠道通透性、参与肝脏能量供应, 可能在ACLF中起到一定保护作用. 因此研究ACLF患者的肠道SCFAs水平变化, 可能为该疾病的治疗提供新的方向.
探讨ACLF患者与正常人相比肠道SCFAs浓度的变化及其临床意义.
25名ACLF患者(病例组)、15名健康者(对照组). 应用高效液相色谱法检测两组粪便SCFAs(乙酸、丙酸、丁酸、异丁酸、异戊酸及总SCFAs)的水平. 根据病例组是否合并肝性脑病, Child-Pugh分级等不同病情分组, 对SCFAs水平差别进行分析.
ACLF患者肠道丙酸、异戊酸、总SCFAs水平显著低于对照组(P<0.05). 病例组伴肝性脑病患者的肠道乙酸、丙酸、总SCFAs水平显著低于不伴肝性脑病患者(P<0.05). Child-Pugh C级的患者乙酸水平低于Child-Pugh B级患者(P<0.05).
ACLF患者肠道SCFAs水平下降; 肠道乙酸、丙酸、总SCFAs水平下降, 可能参与肝性脑病的发病; 肠道乙酸水平可在一定程度上反映肝脏的储备功能.
核心提要: 本文以乙肝相关慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)患者为研究对象, 发现ACLF患者肠道丙酸、异戊酸、总短链脂肪酸谱(short chain fatty acids, SCFAs)水平下降, 而发生肝性脑病患者的肠道乙酸、丙酸、总SCFAs水平较未发生者下降, SCFAs下降可能在慢加急性肝衰竭中起到一定作用, 值得探索.
引文著录: 蒙丹丽, 梁列新, 陈建红, 宋怀宇. 乙肝相关慢加急性肝衰竭患者肠道短链脂肪酸的变化研究. 世界华人消化杂志 2019; 27(6): 408-414
Revised: February 10, 2019
Accepted: March 10, 2019
Published online: March 28, 2019
Hepatitis-B-related acute-on-chronic liver failure (ACLF) is a common type of ACLF, which has rapid progression and a high short-term mortality. Systemic inflammation is an important mechanism, and the increase of intestinal permeability and endotoxin translocation are the main causes of inflammatory reaction. Intestinal short chain fatty acids (SCFAs) can reduce intestinal permeability and participate in liver energy supply, which may play a protective role in hepatitis-B-related ACLF. Therefore, to study the changes of intestinal SCFA levels in patients with hepatitis-B-related ACLF may provide a new direction for the treatment of this disease.
To find out the difference of fecal SCFA levels between hepatitis-B-related ACLF patients and normal controls, and to explore its clinical significance.
The levels of fecal acetic acid, propionic acid, butyric acid, isobutyric acid, isovaleric acid, and total SCFAs were measured by high performance liquid chromatography (HPLC), and twenty-five ACLF patients and 15 healthy individuals were measured separately. The levels of SCFAs were compared when patients were divided into different groups by the characteristics of encephalopathy or Child-Pugh score.
The levels of propionic acid, isovaleric acid, and total SCFAs in the ACLF group were significantly lower than those in the control group. In the ACLF group, the levels of acetic acid, propionic acid, and total SCFAs of the patients with hepatic encephalopathy were significantly lower than those without (P < 0.05). The acetic acid level in the Child-Pugh C group was significantly lower than that in the Child-Pugh B group (P < 0.05).
The levels of intestinal SCFAs in ACLF patients are lower than those in normal controls, and the levels of intestinal acetic acid, propionic acid, and total SCFAs in ACLF patients with hepatic encephalopathy are lower than those without. These changes may be associated with the pathogenesis of hepatic encephalopathy. The level of intestinal acetic acid may reflect ACLF patients' liver reserve function.
- Citation: Meng DL, Liang LX, Chen JH, Song HY. Changes of intestinal short chain fatty acids in patients with hepatitis-B-related acute-on-chronic liver failure. Shijie Huaren Xiaohua Zazhi 2019; 27(6): 408-414
- URL: https://www.wjgnet.com/1009-3079/full/v27/i6/408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i6.408
慢加急性肝衰竭患者病情重, 病情变化快, 死亡率高达50%-90%[1], 虽然经过多年攻关研究, 但仍然疗效不够理想, 值得深入研究. 我们的前期研究发现, 慢性重度乙型肝炎患者肠黏膜通透性较正常人明显增高, 肠道屏障功能受损[2]. 而慢性重度乙型病毒性肝炎进展到慢性加急性肝衰竭的病人并不少见. 肠道短链脂肪酸(short chain fatty acids, SCFAs)可减少肠道通透性, 增强肠黏膜屏障, 同时还参与肝脏能量供应[3,4]. 但目前少见慢加急性肝衰竭与肠道SCFAs水平的相关研究. 本研究应用高效液相色谱法(High efficiency liquid chromatography, HPLC)检测乙肝相关慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)患者粪便SCFAs水平变化, 旨在研究其变化与正常人有无不同, 并探讨肠道SCFAs水平与肝性脑病、肝功能储备的关系.
选择2013-01/2015-12在广西壮族自治区人民医院消化内科、南宁市第四人民医院肝病科确诊的乙肝相关ACLF住院患者作为病例组, 同期体检健康者作为对照组. 研究取得广西壮族自治区人民医院医学伦理委员会的批准同意.
纳入的病例组患者满足2012年修订的《肝衰竭诊治指南》[5]中慢加急性肝衰竭的诊断标准. 合并肝性脑病者的诊断符合《中国肝性脑病诊治共识意见(2013)》[6]中肝性脑病的诊断标准. 病例组共25例, 其中男21例,女4例, 年龄范围21-65岁, 平均年龄42岁±12岁.
病例组的排除标准为: 同时患有其他型病毒性肝炎、肝癌、酒精性肝病、非酒精性脂肪性肝病或者自身免疫性肝病者; 合并高血压病、糖尿病、胃肠道肿瘤、慢性胃肠道疾病(克罗恩病、溃疡性结肠炎、肠易激综合征等); 有消化道手术史, 近1 mo内有急性胃肠道疾病症状者; 孕妇、哺乳期女性, 或患有精神疾病者; 取标本前4 wk内使用抗生素、微生态制剂; 取标本3 d前使用抗性淀粉、欧车前/卵叶车前、燕麦麸、菊粉、乳果糖等.
对照组为体检健康者, 既往无肝炎病史、无肝病症状、体征, 肝功能无异常, 肝炎病毒标记物阴性. 共15名, 其中男5例, 女10例, 年龄范围24-57岁, 平均39岁±10岁.
1.2.1 资料收集: 收集病例组及对照组的一般人口学资料、病史资料、实验室检查等. 予改良的Child-Pugh分级对肝功能储备进行评估.
1.2.2 血标本的采集、检测: 清晨时抽取空腹静脉血, 统一检测血常规、肝肾功能、病毒性肝炎(甲、乙、丙、丁、戊型)抗原抗体检测、HBV-DNA、甲胎蛋白等.
1.2.3 粪便标本的采集、保存、预处理及测定: (1)采集、保存、预处理: 取当日新鲜粪便10 g, 置于清洁粪便盒, -80 ℃冰箱中冷冻保存, 待成批检测. 取0.5 g粪便样本自然解冻, 取其中0.3 g粪便标本装到塑料管, 加入1000 ul超纯水, 涡旋振荡, 离心(4 ℃, 1900 g, 10 min), 初步去除粗颗粒, 取上清液, 再次离心(4 ℃, 10000 g , 10 min)后, 取上清液经Millex-GS 0.22 μm滤膜过滤, 留取滤过液送检. (3)测定: 用HPLC法, 采用美国Waters 2695高效液相色谱仪, 检测器为2996-紫外检测器, 检测波长为217 nm. 乙酸、丙酸、丁酸、异丁酸、异戊酸等SCFAs的标准品购自sigma公司. 色谱条件: 色谱柱: YMC-Pack ODS-AQ色谱柱(250 mm×4.6 mm), 磷酸二氢铵(pH 2.7): 甲醇 = 7: 3, 流速: 0.8 mL/min, 进样量50 μL, 柱温: 30 ℃. 以上5种SCFAs及总SCFAs水平通过色谱图峰面积计算.
统计学处理 满足正态分布数据予t检验, 不满足正态性数据, 则采用Mann-Whitney秩和检验. 数据用中位数和四分位数间距[M(QR)]或mean±SD表示, 采用SPSS 22.0进行统计分析. P<0.05为具有统计学意义.
病例组与对照组的年龄差别无统计学意义(P>0.05), 病例组及对照组基本资料如表1所示.
| 分组 | 性别/n | 年龄(岁) | TBIL(μmmol/L) | ALB(g/L) | PT(s) | 肝性脑病分级/n | CP分级/n | HBeAg/n | HBV-DNA/n |
| 病例组 | 男/21 | 42 ± 12 | 358.41 ± 156.77 | 32.41 ± 6.25 | 19.95 ± 6.27 | 1级/2 | B级/9 | 阳性/3 | 阳性/16 |
| 女/4 | 2级/4 | C级/16 | 阴性/22 | 阴性/9 | |||||
| 无/19 | |||||||||
| 对照组 | 男/10 | 39 ± 10 | 10.62 ± 2.81 | 41.25 ± 2.75 | 13.3 ± 0.74 | - | - | 阳性/0 | 阳性/0 |
| 女/5 | 阴性/15 | 阴性/15 | |||||||
| P值 | 0.853 | 0.00 | 0.000 | 0.000 | - | - | - | - |
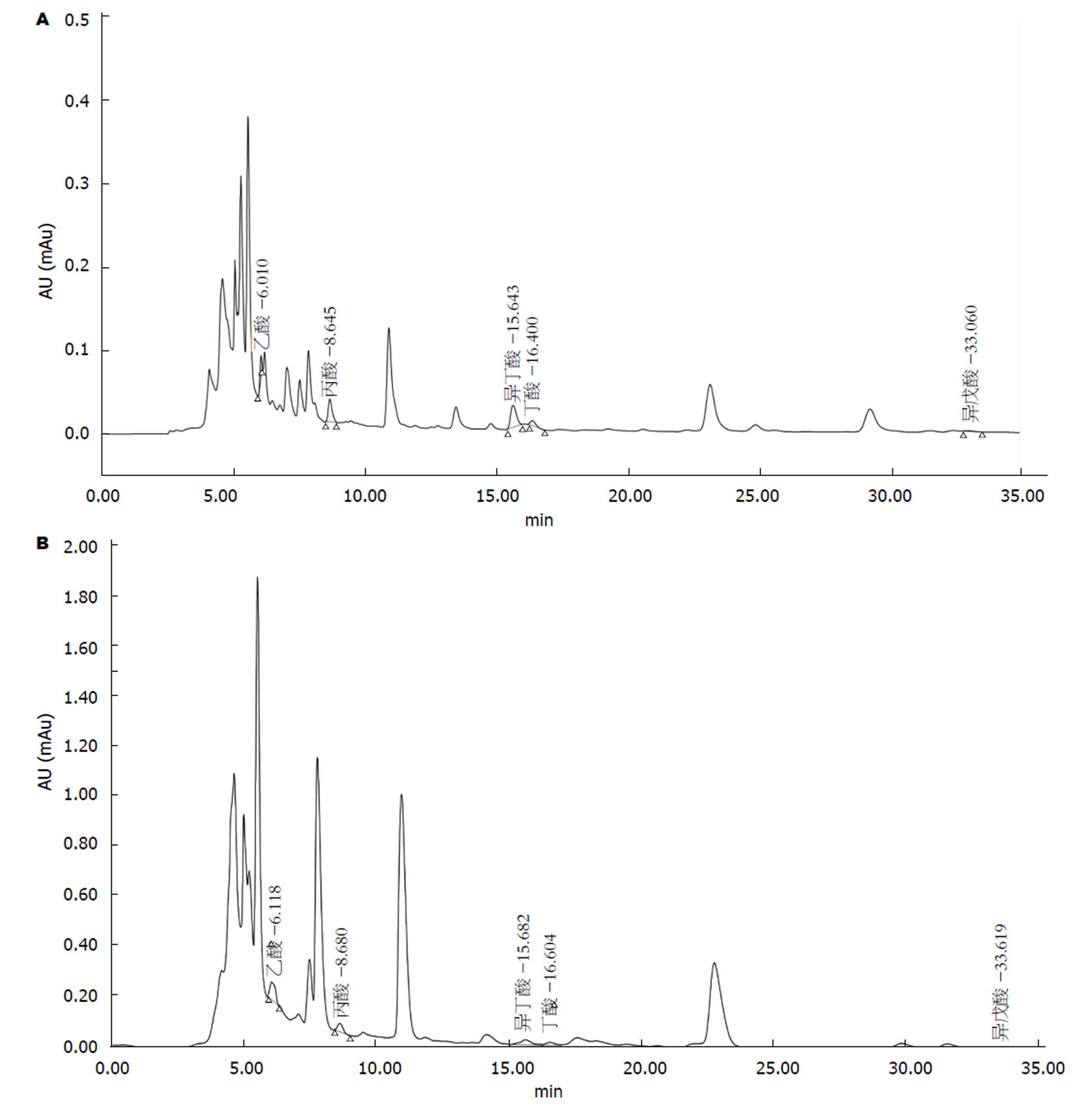
采用HPLC法, 测出病例组及对照组粪便中5种SCFAs水平图谱, 如图1所示, 从色谱图可以看出, 两组标本的谱峰分离良好, 满足测定要求.
病例组、对照组的各SCFAs及总SCFAs水平如表2所示, 其中丙酸、异戊酸、总SCFAs水平差异具有统计学意义(P<0.05).
病例组中按是否合并肝性脑病分为肝性脑病组(n = 6)、无肝性脑病组(n = 19)两组, 对比肠道SCFAs水平差异. 如表3所示, 发现合并肝性脑病的慢重肝患者肠道乙酸、丙酸、总SCFAs水平较无肝性脑病患者低, 具有统计学意义(P<0.05).
将病例组患者按肝功能储备不同可分为2组: Child-Pugh B级(n = 9)、Child-Pugh C级(n = 16), 本研究中无Child-Pugh评分为A级的病人. 如表4所示, Child-Pugh B级粪便乙酸、丙酸、丁酸、异丁酸、异戊酸、总SCFAs水平均低于Child-Pugh B级的患者. 其中, Child-Pugh C级组的乙酸水平降低有统计差异(P<0.05). 如表5所示, 病例组中, HBV阳性与阴性的患者各SCFAs及总SCFAs水平无统计学差异(P均<0.05).
| n | 乙酸 | 丙酸 | 异丁酸 | 丁酸 | 异戊酸 | 总短链脂肪酸 | |
| Child-Pugh B级 | 9 | 4.45 (3.50) | 2.62 ± 2.40 | 0.98 (4.37) | 0.11 (0.74) | 0.75 (1.03) | 9.57 (13.1) |
| Child-Pugh C级 | 16 | 1.01 (1.91) | 1.62 ± 1.99 | 0.82 (2.99) | 0.00 (0.41) | 0.00 (1.06) | 5.72 (10.08) |
| t值/Z值 | - | -1.990 | 1.122 | -0.406 | -1.649 | -1.755 | -1.645 |
| P值 | - | 0.049a | 0.273 | 0.718 | 0.136 | 0.095 | 0.108 |
| n | 乙酸 | 丙酸 | 异丁酸 | 丁酸 | 异戊酸 | 总短链脂肪酸 | |
| HBV-DNA阳性 | 8 | 5.64 ± 4.96 | 0.89 (5.57) | 2.79 (12) | 0.06 (0.23) | 0.32 (1.09) | 15.75 ± 13.06 |
| HBV-DNA阴性 | 17 | 1.54 ± 1.55 | 1.18 (3.81) | 0.07 (1.39) | 0.00 (0.72) | 0.22 (1.51) | 6.33 ± 5.57 |
| t值/Z值 | - | 2.290 | -0.471 | -1.670 | 0.000 | 0.241 | 1.956 |
| P值 | - | 0.053 | 0.669 | 0.110 | 1.000 | 0.842 | 0.085 |
SCFAs是包含1-6个碳原子的有机酸, 包括乙酸、丙酸、丁酸、异丁酸、异戊酸、乳酸等. 肠道SCFAs对肠道的能量供应、肠黏膜屏障的维持、肠道免疫调节等方面有重要作用[3]. SCFAs可通过营养肠上皮细胞、加粘液层分泌、增加紧密连接蛋白合成等增强肠道屏障、减少肠道通透性[7-9], 此外肠道SCFAs还参与肝脏能量供应[4]. 我们的前期研究发现, 慢性重度乙型肝炎患者肠黏膜通透性较正常人明显增高, 存在早期肠道屏障损害, 并对其病情发展有促进作用[2].
本研究发现, ACLF患者的肠道丙酸、异戊酸、总SCFAs水平明显低于正常人. 有报道富膳食纤维饮食、肠道产SCFAs菌多、肠道转运时间延长等均可使肠道SCFAs产生增多[10]. 慢加急性肝衰竭患者消化道症状明显, 食欲明显减退, 从而导致SCFAs饮食来源减少. Li等[11]发现, 慢性重型肝炎患者肠道拟杆菌、双歧杆菌等主要产SCFAs细菌数量明显减少, 而肠杆菌数量增加. 拟杆菌则主要产丙酸、乙酸, 双歧杆菌主要产乙酸、乳酸. 产SCFAs菌群减少可能使肠道丙酸、异戊酸、总SCFAs等水平下降. 因此, ACLF患者肠道SCFAs水平下降, 可能是食物摄入不足和肠道菌群变化共同作用的结果. 肠道SCFA的减少, 反过来加重肠道上皮细胞损害, 使得肠道通透性增加、内毒素移位增加, 促进疾病进展.
当肝功能严重受损或者存在门体分流等时, 氨、SCFAs、硫醇、酚类等产物进入脑组织增多, 协同参与肝性脑病的发生. SCFAs进入大脑后可能通过影响神经传导、干扰脑组织能量代谢, 导致动物出现意识障碍症状[12]. 在王慧[13]的研究中, 30名肝性脑病患者肠道产SCFAs菌拟杆菌、双歧杆菌较正常对照组明显减少. 我们研究发现伴肝性脑病的ACLF患者, 肠道乙酸、丙酸、总SCFAs等水平下降, 其原因我们推测一方面可能有肠道SCFAs总合成水平降低的原因, 另一方面不排除是肠道通透性增加, 由肠道进入外周血中的SCFAs相对增多, 进而中枢神经系统的SCFAs水平增高, 参与ACLF患者肝性脑病的发生.
有研究发现, 慢性乙型病毒性肝炎后肝硬化患者肠道主要产SCFAs菌--拟杆菌丰度与Child-Pugh评分呈负相关关系[14]. 肝硬化患者肠道产乙酸菌双歧杆菌减少, Child-Pugh B、C级患者菌群失调较A级严重[15]. 本研究中, Child-Pugh C级的患者乙酸水平显著低于Child-Pugh B级患者, 与上述研究有吻合之处, 但其他肠道SCFA水平未提示有统计学差异, 可能和本研究样本量偏小有关, 仍待今后进一步研究. 本文中研究对象为ACLF, 并未发现不同HBV-DNA水平的患者肠道SCFAs水平存在统计学差别, 两者关系有待研究.
总之, 我们发现ACLF患者肠道SCFAs水平明显低于正常人, 伴肝性脑病的患者肠道乙酸、丙酸、总SCFAs水平较无肝性脑病患者下降, Child-Pugh评分为C级的患者乙酸水平较Child-Pugh B级患者低, 以上发现提示肠道SCFAs的变化可能在ACLF患者的病情进展中发挥一定的作用, 针对肠道SCFAs的干预措施有可能是改善其预后是一个新的研究方向, 值得临床进一步深入研究.
乙肝相关慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)病情进展快, 预后差. 慢性重型乙肝患者肠道黏膜通透性增高短链脂肪酸(short chain fatty acids, SCFAs)在营养肠道、维持肠道屏障、肝脏能量代谢中发挥作用, 其变化可能在该病中起到一定保护作用.
通过比较ACLF与正常对照、不同病情(肝性脑病, Child-Pugh分级等)患者粪便SCFAs变化情况, 初步探究肠道SCFAs与该病的关联.
本研究结果为探索SCFAs在ACLF患者疾病治疗、病情预后评估方面提供了线索, 为未来的深入研究提供了方法参考.
通过高效液相色谱技术, 检测到患者的肠道SCFAs水平下降, 并且在合并症较多、病情较重时某些SCFAs含量下降, 并具有统计学意义, 为SCFAs在该病的进一步应用提供线索, 达到了研究目的.
研究发现ACLF患者肠道丙酸、异戊酸、总SCFAs水平下降, 而发生肝性脑病患者较未发生肝性脑病患者的肠道乙酸、丙酸、总SCFAs水平下降, 病情较重的Child-Pugh C级的患者乙酸水平低于Child-Pugh B级患者, 提示SCFAs可能在这一疾病的发生发展中有一定作用, 某些SCFAs可能与特定疾病进展有关, 未来值得进一步研究.
ACLF患者肠道SCFAs水平下降; 肠道乙酸、丙酸、总SCFAs水平下降, 可能参与肝性脑病的发病; 肠道乙酸水平可在一定程度上反映肝脏的储备功能. 本研究采用高效液相法检测SCFAs, 提示结果较稳定, 适合推广.
因本研究为初步探索性研究, 研究病例数相对偏少, 且未能纳入肝硬化等患者人群, 未来有待扩大样本量、扩大患者人群, 也有待从分子水平等进一步探究, 以期对临床有更大的指导意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Jalan R, Williams R. Acute-on-chronic liver failure: pathophysiological basis of therapeutic options. Blood Purif. 2002;20:252-261. [PubMed] [DOI] |
| 2. | 宋 怀宇, 姜 春华, 杨 建荣, 陈 秋虹, 黄 云花, 梁 列新. 重度慢性乙型病毒性肝炎患者肠黏膜通透性的变化及其机制. 世界华人消化杂志. 2008;31:3561-3565. [DOI] |
| 3. | Tan J, McKenzie C, Potamitis M, Thorburn AN, Mackay CR, Macia L. The role of short-chain fatty acids in health and disease. Adv Immunol. 2014;121:91-119. [PubMed] [DOI] |
| 4. | Leung C, Rivera L, Furness JB, Angus PW. The role of the gut microbiota in NAFLD. Nat Rev Gastroenterol Hepatol. 2016;13:412-425. [PubMed] [DOI] |
| 6. | 中国肝性脑病诊治共识意见. 中国肝性脑病诊治共识意见(2013年, 重庆). 中国医学前沿杂志(电子版). 2014;2:81-93. |
| 7. | Inagaki A, Sakata T. Dose-dependent stimulatory and inhibitory effects of luminal and serosal n-butyric acid on epithelial cell proliferation of pig distal colonic mucosa. J Nutr Sci Vitaminol (Tokyo). 2005;51:156-160. [PubMed] |
| 8. | Tong LC, Wang Y, Wang ZB, Liu WY, Sun S, Li L, Su DF, Zhang LC. Propionate Ameliorates Dextran Sodium Sulfate-Induced Colitis by Improving Intestinal Barrier Function and Reducing Inflammation and Oxidative Stress. Front Pharmacol. 2016;7:253. [PubMed] [DOI] |
| 9. | Burger-van Paassen N, Vincent A, Puiman PJ, van der Sluis M, Bouma J, Boehm G, van Goudoever JB, van Seuningen I, Renes IB. The regulation of intestinal mucin MUC2 expression by short-chain fatty acids: implications for epithelial protection. Biochemical J. 2009;420:211-219. [PubMed] [DOI] |
| 10. | Macfarlane S, Macfarlane GT. Regulation of short-chain fatty acid production. Proc Nutr Soc. 2003;62:67-72. [PubMed] [DOI] |
| 11. | Li L, Wu Z, Ma W, Yu Y, Chen Y. Changes in intestinal microflora in patients with chronic severe hepatitis. Chin Med J (Engl). 2001;114:869-872. [PubMed] |
| 13. | 王 慧, 张 艳鹤, 常 文娟, 杨 记康. 初步分析肝性脑病患者肠道菌群结构的变化. 临床医药文献电子杂志. 2016;25:4991; 4993. |
| 14. | Wei X, Yan X, Zou D, Yang Z, Wang X, Liu W, Wang S, Li X, Han J, Huang L, Yuan J. Abnormal fecal microbiota community and functions in patients with hepatitis B liver cirrhosis as revealed by a metagenomic approach. BMC Gastroenterol. 2013;13:175. [PubMed] [DOI] |